用于检测间充质干细胞的方法及其应用
文献发布时间:2024-05-31 01:29:11
技术领域
本申请涉及生物检测领域,具体涉及用于检测生物样品中间充质干细胞的方法及其应用。
背景技术
细胞疗法,又称为细胞移植或细胞移植疗法,是一种将活细胞注射、移植或植入患者体内以实现药物效果的疗法,已成为世界上最重要的新兴医学疗法之一。已有多项利用干细胞、诱导多能干细胞、体细胞和免疫细胞进行治疗的临床试验研究。然而,到目前为止,大多数研究都是评估安全性和可行性的I期和II期试验,仍然缺乏治疗效果的证据,基于干细胞的治疗产品仍然没有得到美国食品和药物管理局(USFDA)的批准。缺乏一致和标准化的方法来表征干细胞产品的安全性和有效性是一个主要的问题,而实现良好疗效的一个重要障碍是缺乏可靠的细胞体内药代动力学(PK)数据,这极大地减缓了干细胞治疗向临床应用的进程。
鉴于干细胞在治疗各种疾病方面的巨大潜力,有必要确定灵敏有效的检测手段来量化体内细胞,增加对细胞分布的了解有助于评估其PK,从而确定达到治疗效果所需的给药方案,以促进对干细胞治疗的安全性和有效性的理解。然而,干细胞的生物分布或PK受到许多不同因素的影响,如给药方式等限制。临床样本中间充质干细胞的浓度极低,这对检测方法的灵敏度需求极高。
因此,亟需开发一种用于检测间充质干细胞的方法。
发明内容
针对上述问题,经过反复摸索,本申请的发明人开发了一种用于检测间充质干细胞的方法,以及由此开发的相关产品及其应用。
具体地,本申请提供了如下技术方案:
第一方面,本申请提供了一种用于检测生物样品中间充质干细胞的方法,其包括以下步骤:基于流式细胞术,利用荧光标记的抗CD45抗体对生物样品进行绝对计数操作,以确定所述生物样品中单位体积的CD45
第二方面,本申请提供了一种用于检测间充质干细胞的试剂,其包含不同荧光标记的抗CD45抗体、抗CD73抗体、抗CD90抗体和抗CD105抗体。
第三方面,本申请提供了一种用于检测间充质干细胞的试剂盒,其包括不同荧光标记的抗CD45抗体、抗CD73抗体、抗CD90抗体和抗CD105抗体。
此外,本申请还提供了第二方面所提供的试剂或第三方面所提供的试剂盒在检测间充质干细胞中的应用。
由于临床样本中间充质干细胞的浓度极低,这需要灵敏度极高的检测方法。理想的定量技术应具有以下特征:高灵敏度和特异度,对于细胞层面对灵敏度要求为0.1~0.2个细胞/μL。
鉴于间充质干细胞表达CD90、CD105和CD73,并且不表达CD45等一些指标的特性,本申请选用抗CD45抗体、抗CD73抗体、抗CD90抗体和抗CD105抗体,以CD45
本申请所提出的检测方法的报告数值为单位体积样品中CD45
本申请建立了一种准确、可靠且灵敏的检测体内间充质干细胞的方法。该方法采用抗CD45抗体、抗CD90抗体、抗CD73抗体和抗CD105抗体组合,可准确保证特异性,同时具有较高灵敏度,对间充质干细胞可实现准确定量,并且可在普通实验室快速实施,高效便捷,可实施性强。也就是说,本申请所提出的方法可以很好地解决间充质干细胞检测中的灵敏度,特异性,操作便捷性和通用型的问题。
本申请所提供的方法适用于各种间充质干细胞的检测,例如脂肪组织、胎盘和脐带、乳牙髓、子宫内膜、肝脏等不同来源的间充质干细胞,并且特别适用于检测输注了MSC注射液的患者外周血中的间充质干细胞,以便于监测间充质干细胞治疗过程及疗效。
附图说明
图1A至图1C为实施例1中绝对计数管流式获取分析模板及示例性结果图;
图2A和图2B为实施例1中非绝对计数管流式获取分析模板及示例性结果图。
具体实施方式
本文所用的“间充质干细胞(Mesenchymal stem cell,MSC)”,意指起源于中胚层的多能干细胞,主要存在于结缔组织和器官间质中,包括骨髓、胎盘、脐带、脂肪、粘膜、骨骼、肌肉、肺、肝、胰腺等组织以及羊水、羊膜、脐带血等,在适宜条件下可分化为脂肪、骨、软骨等多种组织细胞。
本文所用的“白细胞”、“CD45+细胞”或“CD45+白细胞”可互相替换使用。
本文所用的“生物样品”,意指来自动物或人体的体液样品,包括血液、细胞/组织裂解液,脑脊液,骨髓等生物学样品。
本文所用的“荧光标记”,意指本领域已知的适合于与抗体偶联进行流式细胞术分析的任何荧光染料,可根据仪器配置的荧光进行选择,包括但不限于:FITC、APC、BV421、BV785、PerCP、BV510、BV650、BV605、APC-Cy7、PE-Cy7等。
具体而言,本申请提供了如下技术方案:
第一方面,本申请提供了一种用于检测间充质干细胞的方法,其以CD45
在具体的实施方案中,所述用于检测间充质干细胞的方法包括以下步骤:基于流式细胞术,利用荧光标记的抗CD45抗体对所述生物样品的第一部分进行绝对计数操作,以确定所述生物样品中单位体积的CD45
在具体的实施方案中,所述荧光标记选自:FITC、APC、BV421、BV785、PerCP、BV510、BV650、BV605、APC-Cy7和PE-Cy7中的一种或多种。
在具体的实施方案中,所述试剂包含FITC标记的抗CD45抗体、BV785标记的抗CD73抗体、BV421标记的抗CD90抗体和APC标记的抗CD105抗体。
在具体的实施方案中,所述方法还包括根据所确定的样品中的CD45
在具体的实施方案中,所述生物样品为动物或人体的体液样品,包括血液、细胞/组织裂解液、脑脊液、骨髓等生物学样品。
第二方面,本申请提供了一种用于检测间充质干细胞的试剂或试剂盒,其包含不同荧光标记的抗CD45抗体、抗CD73抗体、抗CD90抗体和抗CD105抗体。
在具体的实施方案中,所述荧光标记选自:FITC、APC、BV421、BV785、PerCP、BV510、BV650、BV605、APC-Cy7和PE-Cy7中的一种或多种。
在具体的实施方案中,所述试剂或试剂盒包含:FITC标记的抗CD45抗体、BV785标记的抗CD73抗体、BV421标记的抗CD90抗体和APC标记的抗CD105抗体。
此外,本申请还提供了第二方面所提供的试剂或试剂盒在检测间充质干细胞中的用途。
在具体的实施方案中,所述间充质干细胞源自骨髓、胎盘、脐带、脂肪、粘膜、骨骼、肌肉、肺、肝、胰腺、羊水、羊膜或脐带血等。
实施例
以下实施例用于说明本申请,但不用来限制本申请的范围。在不背离本申请精神和实质的情况下,对本申请方法、步骤或条件所作的修改或替换,均属于本申请的范围。
若未特别指明,实施例中所用的试剂均为常规市售试剂,实施例中所用的技术手段均为本领域技术人员所熟知的常规手段。
实施例1 建立检测间充质干细胞(MSC)的方法
在本实施例中,选用CD45、CD73、CD90和CD105,以CD45-CD73+CD90+CD105+作为检测MSC的明确标记,建立了检测生物样品中间充质干细胞的方法。
具体地,检测生物样品中间充质干细胞的方法包括以下步骤:
1. 试剂(抗体工作液)的配制
每个测试的抗体配制量:2μL APC-CD105,2μL BV421-CD90,2μL BV785-CD73, 2μLFITC-CD45,共8μL 抗体工作液。
2. 绝对计数管操作
1)样本管(临床需要检测的样本,例如全血,骨髓或脑脊液等)每个样品准备1管Trucount™管(每个梯度只做1管Trucount™管),每管加入50 μL样品及2 μL FITC-CD45(Biolegend),于2~8℃避光孵育25 ± 5 min。
MSC细胞样品管:复苏后的MSC细胞(具体操作请参见实施例2)准备1管流式管和1管Trucount
2)孵育结束后,加入450 μL的1×红细胞裂解液(氯化铵裂解液(1×)),于室温避光孵育15 ± 5 min;若样本为脑脊液,则可将1×红细胞裂解液更换为PBS或其他缓冲液,无需孵育即可进行检测。
3)孵育结束后,于2~8℃保存,待流式上机检测。
4)打开流式细胞仪(BD FACS Celesta,3激光12色)获取模板。
绝对计数管部分每个样品收集数目为CD45
完成流式细胞仪检测,并记录完成时间。处理原始数据分析报告,打印报告并上传至指定项目文件夹中。
根据绝对计数管中CD45
数据报告时可能会由于细胞群位置的不一致,存在圈门位置的微调,因此报告样本的CD45
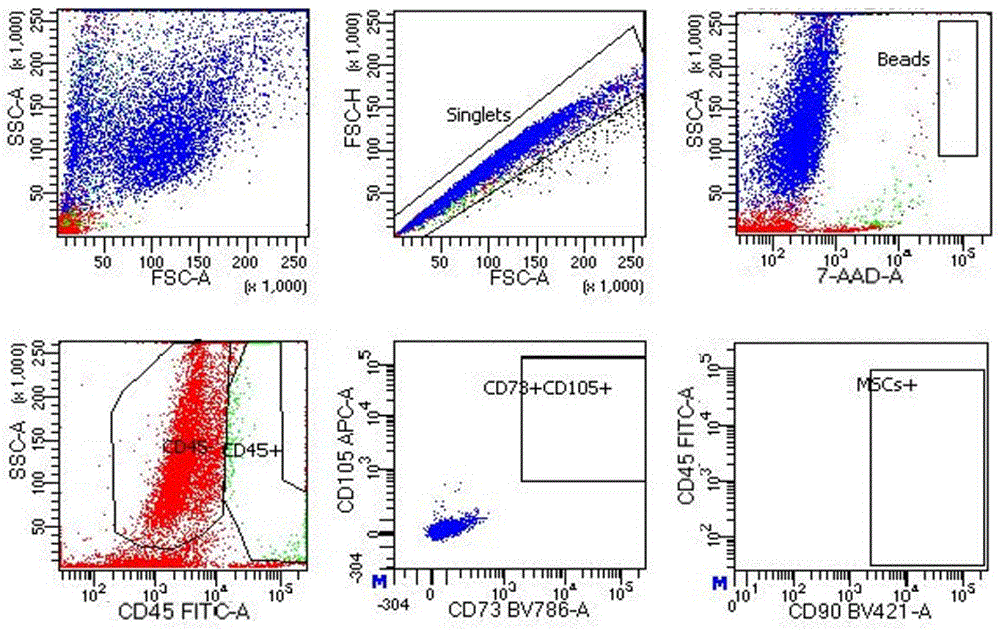
绝对计数管流式获取分析模板及示例性结果图如图1A至图1C所示。
具体地,图1A和图1B分别示出上述流式管(Cell FMT)和Trucount™管(Cell)的流式分析模板圈门逻辑策略示例图,选用FSC-A和FSC-H排除粘连体后标记圈门为Singlets,从Singlets门圈出的细胞进一步选用CD45-FITC和SSC-A圈门出CD45+细胞和CD45-细胞门分别命名为CD45+和CD45-;对CD45-细胞进一步使用CD73 BV786和CD105 APC圈门出CD73+CD105+,从CD73+CD105+细胞群中进一步使用CD90 BV421和CD45-FITC圈门出CD90+MSC+细胞群;使用7-AAD和SSC-A对所有细胞进行分析圈门出Beads门。图1C示出样本管(以全血为例)绝对计数管分析模板圈门逻辑策略示例图,选用FSC-A和FSC-H排除粘连体后标记圈门为Singlets,从Singlets门圈出的细胞进一步选用CD45-FITC和SSC-A圈门出CD45+细胞命名为CD45+;使用7-AAD和SSC-A对所有细胞进行分析圈出Beads门。
绝对计数管报告值:
CD45
3. 非绝对计数管操作
1)每个样本准备2个离心管分别标记为样本管A和样本管B,其中样本管A作为样本管B细胞群阴性细胞分界位置的对照参考。每管加入满足检测需求的样品。
2)按每100 μL样品加入3 mL的比例加入1×红细胞裂解液,于室温避光孵育15 ±5 min。
3)孵育结束后,于室温350 g离心 5 min。
4)弃去上清(直接倒掉),在吸水纸上把悬挂液滴去除,加入50 μL流式缓冲液后,样品转入流式管,A管加入2 μL FITC-CD45,B管加入8 μL抗体工作液,于2~8℃避光孵育25± 5 min。
5)每管加入2 mL流式缓冲液重悬,于室温350 g离心 5 min。
6)弃去上清(直接倒掉),在吸水纸上把悬挂液滴去除,加入200 μL流式缓冲液重悬,待流式上机检测。
7)打开流式细胞仪获取模板。非绝对计数管部分每个样品收集数目为CD45
备注:数据报告时可能会由于细胞群位置的不一致,存在圈门位置的微调,因此报告样本的CD45+细胞个数非整200,000个。MSC阳性细胞结果使用B管结果值报告,故A管CD45+细胞数收集不足200,000个对结果报告无影响。
非绝对计数管流式获取分析模板及示例如图2A和图2B所示。
具体地,图2A和图2B分别示出上述样本管A和样本管B的细胞分析模板圈门逻辑策略示例图,选用FSC-A和FSC-H排除粘连体后标记圈门为Singlets,从Singlets门圈出的细胞进一步选用CD45-FITC和SSC-A圈门出CD45+细胞和CD45-细胞门分别命名为CD45+和CD45-;对CD45-门进一步使用CD73 BV786和CD105 APC圈门出CD73+CD105+,再进一步使用CD90 BV421和CD45-FITC圈门出CD90+ MSC+细胞群。
非绝对计数管报告值:
MSC占白细胞百分比=仪器获取CD45
CD45
实施例2方法学验证
本实施例对本申请所建立的检测间充质干细胞的方法进行了方法学验证,包括批内精密度、批间精密度、灵敏度和线性、染色前后的稳定性等几方面。
1. MSC细胞的复苏
1)预热恒温水浴锅至温度稳定在37℃±0.5℃,取1支MSC细胞(Procell)快速37℃复苏,复苏后的细胞转入离心管中,加入5mL PBS(Gibco),于300 g室温离心5min,弃去上清。
2)加入10 mL PBS重悬细胞,于300 g室温离心5min,弃去上清后,加入1mL PBS(Gibco)重悬细胞备用。
2. MSC细胞及空白全血绝对计数管操作
1)全血样本管:空白全血样本细胞准备1管Trucount
MSC细胞样品管:复苏后的MSC细胞准备1管流式管和1管Trucount
单染管:首次实验多准备5管单染管,分别标记为Blank,FITC-CD45,BV421-CD90,APC-CD105,BV785-CD73;单染管每管加入50 μL全血样本和50 μL MSC细胞悬液,“FITC-CD45”加入2μL FITC-CD45抗体,“BV421-CD90” 加入2μL BV421-CD90抗体,“APC-CD105” 加入2μL APC-CD105抗体,“BV785-CD73” 加入2μL BV785-CD73抗体,混匀,于2~8℃避光孵育25 ± 5 min。
2)孵育结束后,MSC细胞样品管加入450 μL流式缓冲液(Stain Buffer(BSA),BD),全血样本管和单染管加入450 μL的1×红细胞裂解液(氯化铵裂解液(1×)),室温避光孵育15 ± 5 min。
3)孵育结束后,于2~8℃保存,待流式上机检测。
4)首次实验通过单染管(使用样本非绝对计数管的单染管样本进行检测)确定电压和荧光补偿,保存模板。打开流式细胞仪获取模板。
流式仪器参数如下表1所示。
表1
单染管收集数目为20,000个所有细胞或全部细胞悬液体积,全血样本管收集数目为30,000个CD45
完成流式细胞仪检测,并记录完成时间。原始数据分析报告由检测人员处理,并打印报告。
根据绝对计数管中CD45
MSC阳性细胞结果使用Trucount™管(Cell)结果值报告。
数据报告时可能会由于细胞群位置的不一致,存在圈门位置的微调,因此报告样本的CD45
MSC细胞复苏后绝对计数管值:
CD45
3. 方法学验证
3.1 批内精密度
批内精密度实验由3个分析员完成3个分析批,验证样品配制在健康个体的全血基质中,复苏后的人诱导多能干细胞来源间充质样细胞(MSC)原液稀释到一定体积后,与全血不同比例混合,以CD45-CD73+CD90+CD105+作为检测MSC的明确标记,使全血中CD45-CD73+CD90+CD105+ 细胞浓度分别为每200,000个白细胞约含有: 1000个MSCs(验证样品1)、500个MSCs(验证样品2)、100个MSC(验证样品3),且每个质控样品均为3个重复。检测项为CD45-CD73+CD90+CD105+细胞数(个/微升)、CD45-CD73+CD90+CD105+细胞数占CD45+细胞数的百分比(MSC占白细胞百分比)。
结果如以下表2所示。
表2
NA表示不适用。
可见,本申请所建立的检测间充质干细胞的方法中,MSC占白细胞百分比和MSC(个/微升)浓度的批内精密度范围为1.2%~8.5%;MSC占白细胞百分比和MSC(个/微升)浓度的批内准确度的相对偏差范围为:-10.1%~3.7%。
3.2 批间精密度
批间精密度实验由3名分析员在一天内以长、中、短不同时间完成3次独立的分析批,每个分析员完成至少1个分析批,验证样品配制在健康个体的全血基质中,复苏后的人诱导多能干细胞来源间充质样细胞(MSC)原液稀释到一定体积后,与全血不同比例混合(以下是比例20W白细胞中对应含有1000个,500个,100个MSC),以CD45-CD73+CD90+CD105+作为检测MSC的明确标记,使全血中CD45-CD73+CD90+CD105+细胞浓度分别为每200,000个白细胞约含有:1000个(验证样品1)、500个(验证样品2)、100个(验证样品3),且每个验证样品均为3个重复。检测项为CD45-CD73+CD90+CD105+个/微升、CD45-CD73+CD90+CD105+细胞占白细胞的百分比(MSC占白细胞百分比)。
批间样品精密度验证,结果如以下表3所示。
表3
NA表示不适用。
可见,本申请所建立的检测间充质干细胞的方法中,MSC占白细胞百分比和MSC(个/微升)浓度的批间精密度范围为0.2%~8.6%;MSC占白细胞百分比和MSC(个/微升)浓度的批间准确度的相对偏差范围为-19.8%~13.1%。
3.3 灵敏度和线性
验证样品需配制在健康个体的全血基质中,复苏后的MSC原液稀释到一定体积后,与全血不同比例混合,使每200,000个白细胞中含有CD45-CD73+CD90+CD105+细胞浓度分别约为:0个(BLK)、5个、10个、50个、100个、200个、500个、1000个,BLK样品为3个样品重复/分析批,其他浓度水平样品为单个样品/分析批,共进行3个个体独立检测,每个个体进行1个独立分析批,每次约收取200,000个活的白细胞,分析并记录数据(若收集不到200,000个白细胞,可根据收集的数量进行回算到200,000个白细胞中含有CD45-CD73+CD90+CD105+细胞数量)。检测项为CD45-CD73+CD90+CD105+个/微升、CD45-CD73+CD90+CD105+细胞占白细胞的百分比(MSC占白细胞百分比)。
灵敏度和线性结果见以下表4。
表4
NA表示不适用。
由于BLK样本中没有检出CD45-CD73+CD90+CD105+细胞,故检出下限在0.000%~0.003%范围内,报告时低于0.003%以下的值报BQL,灵敏度最低定量限(LLOQ)为5个(20万白细胞)和0.003%。
3.4. 染色前稳定性
使用验证样本考察样本在2~8℃保存的稳定性,考察时间点约为约1d、3d、7d和10d,并且使用验证样本考察样本在室温保存的稳定性,考察时间点约为:室温存放4h(RT4h)的稳定性。
验证样品需配制在健康个体的全血基质中,复苏后的MSC原液稀释到一定体积后,与全血不同比例混合,使全血中CD45-CD73+CD90+CD105+细胞浓度分别为每200,000个白细胞约含有:1000个(验证样品1)、500个(验证样品2)、100个(验证样品3),且每个验证样品均为3个重复。基线样本为配制于全血基质的验证样品,基线数据为基线样本检测结果,结果见以下表5。
表5
NA表示不适用。
可见,验证样本2~8℃保存10d稳定。
上文中已经用一般性说明及具体实施方案对本申请作了详尽的描述,且在本申请基础上在不偏离本申请精神的基础上所做的这些修改或改进,均属于本申请要求保护的范围。
- 含有脂肪间充质干细胞外泌蛋白提取物的干细胞组合物及提取物的制备方法及组合物的应用
- 一种用于直接分化多能性干细胞来源间充质干细胞的培养基、用其制备间充质干细胞的方法以及由此制备的间充质干细胞
- 评估间充质干细胞群体的伤口愈合效力的方法以及选择间充质干细胞和鉴定作为用于产生间充质干细胞群体的起始材料的组织的相关方法
