抗菌噬菌体、治疗用组合物、杀菌剂、食品、细菌鉴别试剂盒、治疗用组合物制造方法、细菌去除方法、细菌鉴别方法及动物治疗方法
文献发布时间:2023-06-19 09:33:52
技术领域
本发明特别涉及抗菌噬菌体、治疗用组合物、杀菌剂、食品、细菌鉴别试剂盒、治疗用组合物制造方法、细菌去除方法、细菌鉴别方法及动物治疗方法。
背景技术
近年来,利用位点特异性的核酸酶来改变靶标DNA的被称为基因组编辑的技术备受瞩目。
例如,在专利文献1中记载了使用CRISPR(Clustered Regularly InterspacedShort Palindromic Repeats:成簇的规律间隔的短回文重复序列)/Cas9(CrisprAssociated protein 9:CRISPR相关蛋白9)的基因组编辑的技术。在CRISPR/Cas9中,将包含与DNA的靶点互补的序列的向导RNA和Cas9核酸酶注入到细胞内。然后,使向导RNA与靶点特异性结合。然后,以覆盖向导RNA和DNA的方式使Cas9蛋白质结合,并切断DNA。
另一方面,近年来,对抗菌药无效的耐药菌的出现及其迅速蔓延成为问题。即,由于抗性菌以远远超过抗菌药的开发的速度出现,所以细菌感染症再次成为威胁人类健康的世界性问题。
在此,以往已知作为使用噬菌体(bacteriophage,以下,称为“噬菌体”)的抗菌治疗法的噬菌体疗法。噬菌体疗法是利用作为感染细菌的病毒的噬菌体的溶菌活性来进行杀菌的治疗法,由于1915年发现噬菌体而进行了尝试,现在还被某些东欧国家应用于临床。由于以往的噬菌体比抗菌药的杀菌效力低,所以作为细菌感染症的治疗产品存在限制。
现有技术文献
专利文献
专利文献1:国际公开第2014/204726号
非专利文献
非专利文献1:Shmakov S等,“Discovery and Functional Characterization ofDiverse Class 2CRISPR-Cas Systems”,Mol Cell,2015年,Nov 5,60(3),p.385-397(“不同的2类CRISPR-Cas系统的发现和功能表征”,《分子细胞》杂志,2015年,Nov 5,60(3),p.385-397)
非专利文献2:Abudayyeh OO等,“C2c2 is a single-component programmableRNA-guided RNA-targeting CRISPR effector.”,Science,2016年,Aug 5,353(6299),aaf5573(“C2c2是一种单组分可编程的RNA引导的RNA靶向CRISPR效应蛋白”,《科学》杂志,2016年,Aug 5,353(6299),aaf5573)
非专利文献3:Gootenberg JS等,“Nucleic acid detection with CRISPR-Cas13a/C2c2.”,Science,2017年,Apr 28,356(6336),p.438-442(“使用CRISPR-Cas13a/C2c2进行核酸检测”,《科学》杂志,2017年,Apr 28,356(6336),p.438-442)
发明内容
发明要解决的问题
然而,即使将现有的基因组编辑应用于噬菌体而在抗性菌的治疗中使用,也由于CRISPR/Cas9仅切断菌的基因组DNA,所以存在通过细菌自身的基因修复机制而无法获得杀菌效果的情况、或者诱发了菌的意外的遗传进化的情况。此外,菌内的耐药基因大多位于质粒上,这种情况下,以基因组DNA为靶标的CRISPR/Cas9则完全无法获得杀菌效果。
因此,一直在通过耐药菌的治疗等寻求有效的噬菌体。
本发明是鉴于这种状况而完成的,其目的在于解决上述问题。
解决问题的方案
本发明的抗菌噬菌体的特征在于,包含CRISPR-Cas13a,所述CRISPR-Cas13a具备将特定基因作为靶标进行识别的靶序列。
本发明的抗菌噬菌体的特征在于,上述靶序列被设计为14~28个碱基的crRNA的间隔序列。
本发明的抗菌噬菌体的特征在于,上述特定基因为任意的基因,以包含上述特定基因的任意的细菌作为抗菌对象。
本发明的抗菌噬菌体的特征在于,上述特定基因为耐药基因或病原基因,包含在以下细菌的基因组和/或质粒中,所述细菌包括由耐甲氧西林金黄色葡萄球菌(MRSA)、耐万古霉素金黄色葡萄球菌(VRSA)、耐万古霉素肠球菌(VRE)、耐青霉素肺炎链球菌(PRSP)、多重耐药铜绿假单胞菌(MDRP)、多重耐药鲍曼不动杆菌属(MDRA)、耐碳青霉烯铜绿假单胞菌(CRPA)、耐碳青霉烯沙雷氏菌(CRSA)、耐第三代头孢菌素肺炎克雷伯菌(3GCRKP)、耐第三代头孢菌素大肠杆菌(3GCREC)、耐氟喹诺酮大肠杆菌(FQREC)、耐多粘菌素大肠杆菌(ColR-EC)构成的群组中的一种或任意的组合。
本发明的抗菌噬菌体的特征在于,上述耐药基因或病原基因包括由mecA、vanA、vanB、vanC、vanD、vanE、vanG、vanL、vanM、vanN、pbp1a、pbp2b、pbp2x、bla
本发明的抗菌噬菌体的特征在于,上述特定基因为毒素基因或病原基因,包含在下述细菌的基因组和/或质粒中,所述细菌包括由金黄色葡萄球菌(Staphylococcusaureus)、肉毒杆菌(Clostridium botulinum)、霍乱菌(Vibrio cholerae)、大肠杆菌(Escherichia coli)、肠炎弧菌(Vibrio parahaemolyticus)、破伤风杆菌(Clostridiumtetani)、威尔士菌(Clostridium perfringens)、A群链球菌(Staphylococcus pyogenes)、艰难梭状芽胞杆菌(Clostridium difficile)、百日咳杆菌(Bordetella pertussis)、白喉杆菌(Corynebacterium diphtheriae)、痢疾杆菌(Shigella dysenteriae)、炭疽杆菌(Bacillus anthracis)、铜绿假单胞菌(Pseudomonas aeruginosa)、单核细胞增生李斯特菌(Listeria monocytogenes)、肺炎链球菌(Staphylococcus pneumoniae)构成的群组中的一种或任意的组合。
本发明的抗菌噬菌体的特征在于,上述毒素基因包含由产生肠毒素、肉毒杆菌神经毒素、霍乱毒素、耐热性肠毒素、易热性肠毒素、耐热性溶血毒、志贺毒素、破伤风毒素、α毒素、杀白细胞素、β毒素、毒素性休克综合征毒素、链球菌溶血素O、发红毒、α溶血毒素、细胞毒性坏死因子I、A毒素、B毒素、百日咳毒素、白喉毒素、粘附素、分泌(透过)结构、溶解素、超抗原的基因构成的群组中的一种或任意的组合。
本发明的抗菌噬菌体的特征在于,上述靶序列是靶标基因序列中的特定的14~28个碱基的序列。
本发明的抗菌噬菌体的特征在于,上述靶序列是序列号7、序列号17、序列号22、序列号26、序列号27、序列号28、序列号36、序列号37、序列号38、序列号39、序列号40、序列号41、序列号42、序列号43、序列号44、序列号45、序列号46、序列号47、序列号48、序列号49、序列号50、序列号51、序列号52的序列。
本发明的抗菌噬菌体的特征在于,上述特定基因是通过核酸获得和/或核酸变异而产生耐药性的基因。
本发明的抗菌噬菌体的特征在于,上述靶序列为多个,将多个上述特定基因分别作为靶标进行识别。
本发明的治疗用组合物的特征在于,包含上述抗菌噬菌体。
本发明的杀菌剂的特征在于,包含上述抗菌噬菌体。
本发明的食品的特征在于,包含上述抗菌噬菌体。
本发明的细菌鉴别试剂盒的特征在于,包含上述抗菌噬菌体。
本发明的治疗用组合物制造方法的特征在于,使包含具备将特定基因作为靶标进行识别的靶序列的CRISPR、Cas13a和包装序列的噬菌粒、以及辅助噬菌体转染和/或感染噬菌体合成细菌,并使该噬菌体合成细菌溶菌和/或向菌体外进行释放,获得构建的抗菌噬菌体。
本发明的细菌去除方法的特征在于,通过包含具备将特定基因作为靶标进行识别的靶序列的CRISPR-Cas13a的抗菌噬菌体来去除具备上述特定基因的细菌。
本发明的细菌去除方法的特征在于,上述细菌存在于人、动物和/或环境中的细菌菌群中。
本发明的细菌去除方法的特征在于,上述细菌存在于食品内。
本发明的细菌鉴别方法的特征在于,使包含具备将特定基因作为靶标进行识别的靶序列的CRISPR-Cas13a的抗菌噬菌体感染细菌,鉴别和/或检查上述细菌是否具备上述特定基因。
本发明的细菌鉴别方法的特征在于,上述细菌是存在于人、动物、食品内或环境中的细菌菌群中的细菌、和/或基因重组细菌。
本发明的动物治疗方法的特征在于,通过包含具备将特定基因作为靶标进行识别的靶序列的CRISPR-Cas13a的抗菌噬菌体,对人以外的动物中的由具备上述特定基因的细菌引起的感染症进行治疗。
发明的成效
根据本发明,通过以包含具备将特定基因作为靶标进行识别的靶序列的CRISPR-Cas13a的方式构成,从而能够实现可有效治疗耐药菌、毒素产生菌等的抗菌噬菌体。
附图说明
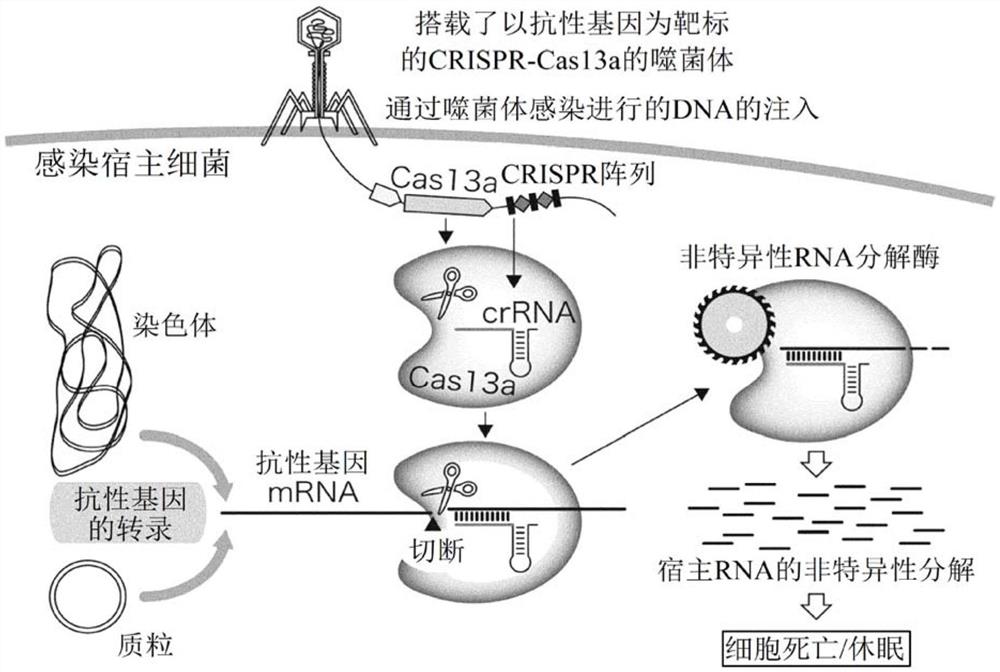
图1是利用本发明的第一实施方式的抗菌噬菌体的抗菌治疗方法的示意图。
图2是表示通过具有本发明的实施例1的特定基因的细菌的CRISPR-Cas13a得到的杀菌效果的图和照片。
图3是本发明的实施例1的抗菌噬菌体的合成和实验的示意图。
图4是表示通过本发明的实施例1的抗菌噬菌体感染得到的细菌的杀菌效果的照片。
图5是表示通过本发明的实施例1的抗菌噬菌体感染得到的携带特定基因的大肠杆菌的发育抑制的图和照片。
图6是表示本发明的实施例1的各靶序列的杀菌活性的照片。
图7是表示本发明的实施例1的确认了强杀菌活性的靶序列的基于Weblogo的信息量的图。
图8是对图6所示的照片的菌落数进行计数而得的图表。
图9是表示本发明的实施例1的碳青霉烯抗性基因的鉴别结果的照片。
图10是表示本发明的实施例1的多粘菌素抗性基因的鉴别结果的照片。
图11是表示通过本发明的实施例2的抗菌噬菌体得到的细菌菌群改变的结果的图。
图12是在通过本发明的实施例2的抗菌噬菌体得到的杀菌效果中,调查最佳的CRISPR序列的方法的示意图。
图13是表示通过本发明的实施例2的抗菌噬菌体得到的杀菌效果的图表。
图14是表示本发明的实施例2的提高了特定基因的检测灵敏度的结果的图和照片。
图15是表示使用图14所示的方法鉴别碳青霉烯抗性基因的结果的照片。
图16是表示本发明的实施例2的志贺毒素产生基因和碳青霉烯抗性基因的鉴别结果的照片。
图17是表示本发明的实施例2的临床分离大肠杆菌菌株的碳青霉烯抗性基因的鉴别结果的图和照片。
图18是表示通过本发明的实施例2的感染了临床分离大肠杆菌菌株的蛾幼虫的抗菌噬菌体得到的治疗效果的图表。
图19是表示本发明的实施例2的具有耐甲氧西林金黄色葡萄球菌菌株的抗性基因mecA的细菌的选择性杀菌和mecA阳性菌的鉴别结果的图表。
具体实施方式
<第一实施方式>
鉴于抗菌药开发和抗性菌变迁的历史,抗性菌的出现是不可避免的,此外,担心在于不存在即使出现新的抗性菌也能够应对的进化适应型药品。然而,像专利文献1中记载那样的CRISPR/Cas9无法应用于抗菌治疗。
因此,本发明人等考虑到使用非专利文献1中记载的作为以RNA为靶标的CRISPR系统的CRISPR-Cas13a。如非专利文献2所记载,Cas13a在2015年被发现,其功能在次年得到阐明。该CRISPR-Cas13a虽然以RNA为其靶标,但是Cas13a酶一旦序列特异性地识别靶标RNA,则迅速地转变为对各种RNA进行序列非特异性地分解的酶。因此,在非专利文献3中,示出了通过检测被Cas13a分解的RNA以检测传染性病原菌DNA的方法。该方法仅是从细菌/抗性菌中一次性提取核酸后进行的检测方法,与抗菌治疗无关。
这里,由于非专利文献2的Cas13a使用将质粒转染到菌内的方法,所以不能用于抗菌治疗。
对此,本发明人等考虑将该CRISPR-Cas13a导入到细菌细胞内而能够作为杀菌剂使用的可能性。具体而言,本发明人等通过设计包含识别抗性基因序列等的靶序列(靶标基因识别序列)的CRISPR-Casl3a,并在噬菌体内搭载了该编码序列的DNA,并基于想要制作人工设计和制造的合成噬菌体即抗菌噬菌体的想法,通过多次反复认真的进行了实验,进而完成了本发明。
图1表示利用包含本实施方式的CRISPR-Cas13a的抗菌噬菌体的抗菌治疗方法的概念图。
本实施方式的抗菌噬菌体利用了CRISPR的碱基序列的识别特异性以及Cas13a的碱基序列非特异性的RNA分解活性。如果使本实施方式的抗菌噬菌体感染目标细菌,则在细菌内合成的Cas13a识别并切断来自染色体或来自质粒的抗性基因mRNA。获取了靶序列的Cas13a转变为非特异性的RNA分解酶,从而诱导伴随着宿主细菌RNA的分解的细胞死亡或休眠。即,通过将包含约20个碱基靶序列DNA的CRISPR-Cas13a DNA搭载于抗菌噬菌体,从而能够进行仅选择性地杀灭具有特定基因的特定细菌的抗菌治疗。
以下,对本实施方式的抗菌噬菌体、治疗用组合物、杀菌剂、食品、细菌鉴别试剂盒、治疗用组合物制造方法、细菌去除方法、细菌鉴别方法及动物治疗方法进行具体且详细说明。
本发明的第一实施方式的抗菌噬菌体的特征在于,包含CRISPR-Cas13a,所述CRISPR-Cas13a具备将特定基因作为靶标进行识别的靶序列。
在此,本实施方式的特定基因是能够将细菌区分成特定基因型的任意的基因。作为该特定基因型,例如,即使是同种的菌,只要是能够根据基因组DNA、所含的质粒、其他核外基因等基因序列进行鉴定即可,表现型可以不同。另外,本实施方式的特定基因也可以是菌的基因本身、重组的基因、导入到基因组或质粒等中的基因。此外,该特定基因可以不必翻译成蛋白质。
更具体而言,本实施方式的特定基因例如可以是药剂的抗性菌的耐药基因、各种毒素基因、编码与弱毒化或强毒化相关的蛋白质的基因、用于生成特定的代谢产物的酶基因、用于对菌进行鉴定的基因、用于形质转换的报告基因、包含用于基因重组的限制酶或粘性末端的序列、重复序列、其他表示广义的基因型的“基因”。
即,本实施方式的抗菌噬菌体改变设计的靶序列即可,具有特定病原因子的菌等具有任意特定基因的细菌也可以作为靶标。
作为具体例,在该特定基因为耐药基因的情况下,可以包含于细菌的基因组和/或质粒中,所述细菌包括选自各种病原性的大肠杆菌菌株(Escherichia coli)、耐甲氧西林金黄色葡萄球菌(Methicillin-resistant Staphylococcus aureus,MRSA)、耐万古霉素金黄色葡萄球菌(vancomycin-resistant Staphylococcus aureus,VRSA)、耐万古霉素肠球菌(vancomycin-resistant enterococci,VRE)、耐青霉素肺炎链球菌(penicillin-resistant Streptococcus pneumoniae,PRSP)、多重耐药铜绿假单胞菌(multidrug-resistant Pseudomonas aeruginosa,MDRP)、多重耐药鲍曼不动杆菌(Multiple Drug-Resistant Acinetobacter,MDRA)、耐碳青霉烯铜绿假单胞菌(carbapenem-resistantPseudomonas aeruginosa,CRPA)、耐碳青霉烯沙雷氏菌(carbapenem-resistantSerratia,CRSA)、耐第三代头孢菌素肺炎克雷伯菌(3GCRKP)、耐第三代头孢菌素大肠杆菌(3rd generation cephalosporin-resistant E.coli,3GCREC)、耐氟喹诺酮大肠杆菌(fluoroquinolone-resistant E.coli,FQREC)、耐多粘菌素大肠杆菌(ColR-EC)中的一种或任意的组合。
此时,这些耐药基因可以包含由mecA、vanA、vanB、vanC、vanD、vanE、vanG、vanL、vanM、vanN、pbp1a、pbp2b、pbp2x、bla
对于这些耐药菌(抗性菌的种类)、耐药基因(编码靶标RNA的基因名称)和本实施方式中使用的抗菌噬菌体用的噬菌体(Bacteriophage)的例子,汇总示于下述的表1中:
【表1】
注释1.bla
注释2.bla
注释3.bla
注释4.bla
注释5.bla
注释6.bla
注释7.bla
注释8.bla
注释9.bla
注释10.bla
注释11.bla
注释12.bla
注释13.mcr:mcr
如该表所示,耐药基因包括各自的变异(variation)。
此外,这些耐药基因可以水平传播到其他种类的细菌,作为细菌的分类本身可以不同。
另外,特定基因可以通过核酸获得和/或核酸变异而产生耐药性。
具体而言,由于抗性菌有时通过外来的DNA或RNA(核酸)获得和/或核酸变异而产生,所以可以将该核酸变异作为本实施方式的抗菌噬菌体作为靶向目标的特定基因。此时,本实施方式的抗菌噬菌体通过与该变异对应地改变靶序列,从而能够对抗包含产生耐药性的核酸变异作为“特定基因”的菌。
另外,本发明的第一实施方式的抗菌噬菌体的靶序列的特征在于,是以将特定基因作为靶标进行识别的方式设计的碱基序列。在此基础上,在本实施方式的靶序列被设计为14~28个碱基的crRNA的间隔序列的情况下,在包装于抗菌噬菌体时的DNA碱基序列中,优选第10个碱基的靶标为T。具体而言,该靶序列例如可以是序列号7、序列号17、序列号22、序列号26、序列号27、序列号28、序列号36。
在此,如下述的实施例所示,在本实施方式的包含CRISPR-Cas13a的抗菌噬菌体中,即使简单地从特定基因内选择随机的位置的位点作为crRNA的序列,杀菌效果也存在差异。因此,本发明人等认真进行了实验,结果发现通过将特定基因内的DNA碱基序列中的5’侧~3’侧中第10个碱基为T(thymine:胸腺嘧啶)的序列作为14~28个碱基的crRNA的间隔序列,从而将Cas13a的非特异性地分解RNA而能够使菌达到细胞死亡的效率最佳化。作为这样的序列的例子,示出下述的序列表所示的序列号7、序列号17、序列号22、序列号26、序列号27、序列号28、序列号36的各碱基序列。此外,作为具体例,搭载于抗菌噬菌体内的crDNA的碱基序列可以如下述的实施例所示地被设计为互补的序列。另外,在crDNA以转录的RNA为靶标的情况下,该RNA内的靶标为U(Uracil:尿嘧啶)。
此外,如后述的第二实施方式所示,也允许这些以外的序列作为抗菌噬菌体的靶序列。
此外,靶序列可以为多个,以将多个特定基因分别作为靶标进行识别的方式构成。即,本实施方式的抗菌噬菌体可以在一个噬菌体内包含多个靶序列。此时,由于CRISPR的间隔序列可以包含一~十几个的程度,所以可以在能够含有于噬菌体的衣壳内的范围内包含多个靶序列。该多个靶序列可以构成为在crRNA的序列内连续地排列或者作为多个位点排列,或者可以在噬菌体内包含多个靶序列不同的crRNA本身。由此,一个抗菌噬菌体能够适用于多个抗性菌。此外,在为具有多个抗性基因的多重抗性菌的情况下,能够通过CRISPR-cas13a提高抗菌效率。
另外,本发明的第一实施方式的抗菌噬菌体还可以用于包含其的治疗用组合物的用途。
即,通过给予本实施方式的抗菌噬菌体用于治疗,从而能够用于选择性地杀灭特定基因型的细菌的抗菌治疗法。具体而言,能够实现合成特异性地识别靶标RNA的CRISPR-Cas13a DNA并将其包装于抗菌噬菌体内(包含于衣壳内),选择性地杀灭靶标(具有特定的基因)细菌的抗菌治疗法。由此,能够进行包括耐药菌的感染症在内的利用抗菌药难以治疗的感染症的抗菌治疗。
该治疗用组合物制造方法的特征在于,将包含具备将特定基因作为靶标进行识别的靶序列的CRISPR、Cas13a和包装序列的噬菌粒以及辅助噬菌体转染和/或感染噬菌体合成细菌,并使该噬菌体合成细菌溶菌和/或向菌体外进行释放,获得构建的抗菌噬菌体。
具体而言,本实施方式的治疗用组合物可以使用合成特异性识别靶标RNA的CRISPR-Cas13a DNA并搭载于抗菌噬菌体内(包装、包含于衣壳内)的治疗用组合物,以及与现有的使用抗菌噬菌体的抗菌治疗法(抗菌噬菌体疗法)相同的各种配合物。作为该噬菌体合成细菌,例如可以使用大肠杆菌等通常的细菌。
另外,本发明的第一实施方式的治疗用组合物可以与任意的制剂上能够允许的载体(可举出例如含有生理盐水、葡萄糖、其他辅助药的等渗溶液,例如D-山梨醇、D-甘露糖、D-甘露醇、氯化钠等,适当的助溶剂,例如醇,具体而言为乙醇、多元醇,例如丙二醇、聚乙二醇,非离子性表面活性剂,例如可举出聚山梨酯80(TM)、HCO-50等,但不限于这些)一起给药。另外,还可以含有适当的赋形剂等。
另外,为了制备制剂上能够允许的载体,本实施方式的治疗用组合物可以包含适当的药学上能够允许的载体。作为该载体,可以包含有机硅、胶原蛋白、明胶等生物体亲和性材料。或者也可以是各种乳浊液。此外,例如还可以含有选自稀释剂、香料、防腐剂、赋形剂、崩解剂、润滑剂、粘合剂、乳化剂、增塑剂等中的1种或2种以上的制剂用添加物。
本发明的第一实施方式的治疗用组合物可以在适合用于口服给药的给药方式中使用该领域中公知的制剂上能够允许的载体。
本发明涉及的医药组合物的给药途径没有特别限制,可以是口服给药或非口服给药。作为非口服给药,例如可以是静脉内、动脉内、皮下、真皮内、肌肉内、腹腔内的给药或者直接施用于细菌菌群、感染部位施予。该给药方法可以与现有的噬菌体疗法相同的方式进行。
另外,为了将本发明的第一实施方式的治疗用组合物用于上述治疗,给药间隔和给药量可以根据疾病的状况、甚至对象的状态等各种条件进行适当选择和改变。
本发明的第一实施方式的治疗用组合物的1次的给药量和给药次数可以根据给药目的,甚至患者的年龄和体重、症状和疾病的严重程度等各种条件进行适当选择和改变。
给药次数和期间可以仅为1次,也可以为1天1次~数次,给药数周程度,监视疾病的状态,根据其状态再次给药或反复给药。
本发明的组合物可以与其他组合物等并用。另外,可以与其他组合物同时给予本发明的组合物,另外,也可以隔开间隔进行给药,但是其给药顺序没有特别限制。
另外,在本发明的第一实施方式中,疾病改善或减轻的期间没有特别限定,但是也可以是暂时的改善或减轻,还可以是一定期间的改善或减轻。
另外,本发明的第一实施方式的治疗用组合物可以针对生物、生物体内的一部分或从生物中提取或排出的其一部分作为治疗用的对象。
该生物没有特别限制,可以是例如动物、植物和菌类等。该动物包括人、家畜动物类、野生动物等。
因此,本发明的第一实施方式的治疗用组合物也可以用于进行动物的治疗的动物治疗。即,本实施方式的抗菌噬菌体也可以用于以人以外的各种动物为对象的动物治疗方法。
具体而言,本实施方式的动物治疗方法通过包含具备将特定基因作为靶标进行识别的靶序列的CRISPR-Cas13a的抗菌噬菌体,从而能够治疗人以外的动物中的由具备特定基因的细菌引起的感染症。
该动物也没有特别限制,广泛地包括脊椎动物和无脊椎动物。作为脊椎动物,包括鱼类、两栖类、爬虫类、鸟类和哺乳类。具体而言,例如,作为哺乳类,可以是啮齿类,例如小鼠、大鼠、雪貂、仓鼠、豚鼠或兔、狗、猫、羊、猪、牛、马或非人类的重组基因灵长类。另外,作为野生动物,除了哺乳类以外,还包括鱼类、包括家禽在内的鸟类、爬虫类等。另外,还广泛地包括甲壳类动物,包括虾、昆虫等,以及其他无脊椎动物的乌贼等等。
即,本发明的第一实施方式的治疗用组合物除了可以用于人的治疗以外,还可以用于动物的治疗、促进家畜的发育等方法。
另外,本发明的第一实施方式的细菌去除方法的特征在于,通过包含具备将特定基因作为靶标进行识别的靶序列的CRISPR-Cas13a的抗菌噬菌体,从而去除具备特定基因的细菌。因此,还可以将包含本实施方式的抗菌噬菌体的组合物用于杀菌剂(增殖抑制剂)的用途。该杀菌剂也可以像上述那样被包含于适当的载体、溶液等中。另外,还可以添加去除细菌的肽聚糖、生物膜等之类的辅助剂。该杀菌剂例如可以包含在洗手液、漱口水、口罩、餐巾、空气净化器的过滤器等各种抗菌用品中。
通过将该本实施方式的杀菌剂涂布、散布等,从而能够从病灶、细菌菌群和环境中进行特定基因型的细菌的去除和增殖抑制。即,能够减少存在于人、动物和/或环境中的细菌菌群中的具备特定基因的细菌。
另外,在本发明的第一实施方式的细菌去除方法中,还能够去除存在于食品中的细菌。这是因为本实施方式的抗菌噬菌体不会感染人。即,通过本实施方式的抗菌噬菌体,能够选择性地去除食品内的具有特定基因的特定基因型的细菌。另外,还能够提供由此去除了特定基因型的细菌的食品。由此,例如能够提供可靠地去除了产生毒素的食物中毒菌的安全的食品。这里,本实施方式的抗菌噬菌体可以包含在各种蔬菜、食用肉、鱼贝类、加工食品、乳制品等的栽培、养殖、采集等的任意食品中使用。
另外,本发明的第一实施方式的细菌鉴别方法的特征在于,使包含具备将特定基因作为靶标进行识别的靶序列的CRISPR-Cas13a的抗菌噬菌体感染细菌,鉴别和/或检查细菌是否具备特定基因。具体而言,通过以特定基因为靶标来设计CRISPR-Cas13a并搭载于本实施方式的抗菌噬菌体,选择性地杀灭具有特定基因的细菌,从而能够简便地检测具有特定基因的特定基因型的细菌。即,本实施方式的抗菌噬菌体能够用于鉴别、检查的用途。
具体而言,例如通过同时添加作为对象的细菌和本实施方式的抗菌噬菌体来抑制细菌数的增加(生长),或者在平板上进行培养并涂布本实施方式的抗菌噬菌体,确认溶菌,从而能够容易地鉴别(检查)该细菌中是否有该特定基因。通过该细菌鉴别方法能够鉴别的特定基因可以是在上述的细菌去除方法中作为对象的特定基因。
通过该细菌鉴别方法鉴别和/或检查的细菌如上所述,可以是存在于人、动物、食品内或环境中的细菌菌群中的细菌和/或基因重组细菌。另外,还能够提供包含本实施方式的抗菌噬菌体的细菌鉴别试剂盒。
通过如上构成,能够得到如下效果。
一直以来,抗菌药在细菌感染症的治疗中发挥着最重要的作用。但是,由于抗菌药无效的耐药菌的出现及其迅速蔓延,导致现有的抗菌药逐渐无能为力。因此,细菌感染症再次成为威胁人类健康的世界性问题。具体而言,由于抗性菌的出现速度远远超过抗菌药的开发的速度、新型抗菌药的开发陷入困境,所以抗性菌的问题变得难以解决。
对此,本发明的第一实施方式的抗菌噬菌体通过将CRISPR-Cas13a搭载于抗菌噬菌体,从而能够在不使用抗菌药的情况下应对抗性菌等。即,由于作为CRISPR-Cas13a的靶标的特定基因能够任意确定,所以任何特定基因型的细菌均可以作为杀菌对象。
另外,在本实施方式的抗菌噬菌体中,由于CRISPR-Cas13a是以转录的RNA为靶标,所以无论作为靶标的特定基因的位置是染色体性还是质粒性,均能够有效地进行杀菌。
另外,由于本实施方式的抗菌噬菌体以RNA作为靶标,所以难以施加选择压力,原理上难以产生抗性菌。此外,对于因特定基因型不同而无法杀灭的细菌,只要设计并给予与该特定基因型的特定基因对应的抗菌噬菌体即可。因此,通过适当地选择特定基因并制作抗菌噬菌体,从而能够可靠地杀灭特定基因型的细菌。即,本发明的第一实施方式的抗菌噬菌体在产生新的抗性菌的情况时,仅通过再次设计CRISPR-Cas13a的序列识别部分就能够成为可以应对的进化适应型药品。另外,也可以使用基因工程技术改变搭载的抗菌噬菌体本身。
另外,在使用抗菌药的抗菌治疗法中,存在抗菌药的抗菌谱,即发挥杀菌效果的对象细菌的范围广而选择性低的问题。因此,对目标细菌以外的细菌也有抗菌作用,选择对抗菌药有耐性的细菌,导致诱发耐药性等。另外,由于是广谱杀灭细菌,所以对宿主的正常细菌菌群的平衡也造成了影响。
对此,在本发明的第一实施方式的抗菌噬菌体中,CRISPR-Cas13a需要能够识别20个碱基左右的靶序列,该识别需要几乎100%的序列相同性。通过该选择性,使高选择性仅杀灭对象细菌的抗菌治疗成为可能。作为结果,能够不杀灭有用的常在菌等,保持宿主的正常细菌菌群的平衡。此外,通过介由受感染的菌种被限定的抗菌噬菌体而将CRISPR-Cas13a导入到感染细菌细胞内,从而能够进一步提高对象细菌的选择性。即,由于CRISPR-Cas13a识别靶标RNA序列并使其活化,所以能够进行从细菌菌群中仅选择性地去除特定基因型的细菌的“跟踪导弹型”抗菌治疗。另外,可以确立能够应用于人、动物、环境内的所有的细菌种类的抗菌治疗法。
另外,在本实施方式中,由于使用作为不自我增殖的合成噬菌体的抗菌噬菌体,所以能够抑制由抗菌噬菌体本身的变异引起的副作用。另外,由于抗菌噬菌体不自我增殖,所以在给药的生物、环境中的细菌中保持前噬菌体的可能性也极低。此外,原理上难以产生抗性菌。由此,能够提高安全性。此外,即使靶标基因发生变异,也可以通过每次改变识别靶标RNA的探针(crRNA序列)来应对。此外,由于是不进行自我增殖的抗菌噬菌体,所以能够准确估算给药量。
另外,本发明的第一实施方式的抗菌噬菌体可以在生物体的特定细胞中控制基因表达,不仅有助于明确细胞的生理功能,甚至还可能与控制病情有关。因此,可能与新的治疗法的开发有关。
另外,本发明的第一实施方式的抗菌噬菌体仅杀灭具有特定基因的细菌,此外,由于来自自然物,所以安全且环境负荷低。因此,还能够提高安全且环境负荷低的杀菌剂、食品。
另外,本发明的第一实施方式的抗菌噬菌体除了治疗以外,还能够适用于以高灵敏度检测(鉴别)特定基因的细菌鉴别方法。由此,例如,能够可靠地鉴别在临床上分离得到的大肠杆菌等细菌中是否存在特定的抗性基因。此时,由于只是目测细菌不增殖或溶菌,所以不花费时间,另外,由于不需要核酸的扩增,所以不需要使用PCR等设备,因此能够低廉地进行鉴别。
<第二实施方式>
接下来,作为本发明的第二实施方式,对通过设计将毒素基因作为特定基因进行识别的靶序列(靶标基因识别序列)的CRISPR-Casl3a,使对其进行编码的DNA包含(搭载)于噬菌体内,从而制作人工设计、制造的合成噬菌体即抗菌噬菌体的例子进行说明。
作为具体例,在该特定基因为毒素基因的情况下,可以包含于以下细菌的基因组和/或质粒中,所述细菌包括选自金黄色葡萄球菌(Staphylococcus aureus)、肉毒杆菌(Clostridium botulinum)、霍乱菌(Vibrio cholerae)、大肠杆菌(Escherichia coli)、肠炎弧菌(Vibrio parahaemolyticus)、破伤风杆菌(Clostridium tetani)、威尔士菌(Clostridium perfringens)、A群链球菌(Staphylococcus pyogenes)、艰难梭状芽胞杆菌(Clostridium difficile)、百日咳杆菌(Bordetella pertussis)、白喉杆菌(Corynebacterium diphtheriae)、痢疾杆菌(Shigella dysenteriae)、炭疽杆菌(Bacillus anthracis)、铜绿假单胞菌(Pseudomonas aeruginosa)、单核细胞增生李斯特菌(Listeria monocytogenes)、肺炎链球菌(Staphylococcus pneumoniae)中的一种或任意的组合。
此时,这些毒素基因的特征在于,包括产生选自肠毒素、肉毒杆菌神经毒素、霍乱毒素、耐热性肠毒素、易热性肠毒素、耐热性溶血毒素、志贺毒素、破伤风毒素、α毒素、杀白细胞素、β毒素、毒素性休克综合征毒素、链球菌溶血素O、发红毒、α溶血毒素、细胞毒性坏死因子I、A毒素、B毒素、百日咳毒素、白喉毒素、粘附素、分泌(透过)结构、溶解素和超抗原的基因中的一种或任意的组合。
对于这些毒素产生菌(菌的种类)、毒素基因(编码靶标RNA的基因名称)和本实施方式中使用的抗菌噬菌体用的噬菌体(bacteriophage)的种类,汇总示于下述的表2中:
【表2】
如该表所示,这些毒素基因可以分别存在遗传性变异(variation)。
此外,这些毒素基因可以水平传播到其他种类的细菌,作为细菌的分类本身可以不同。
另外,本实施方式的特定基因可以是通过核酸获得而产生毒素那样的基因。
具体而言,由于毒素产生菌有时通过获得外来的DNA或RNA(核酸)而产生,所以可以将该核酸变异作为本实施方式的抗菌噬菌体所靶向的特定基因。此时,本实施方式的抗菌噬菌体通过与该变异对应地改变靶序列,从而能够对抗包含产生毒素的核酸变异作为“特定基因”的菌。
以该毒素基因为特定基因的抗菌噬菌体的治疗用组合物、治疗用组合物、杀菌剂、食品、细菌鉴别试剂盒、治疗用组合物制造方法、细菌去除方法、细菌鉴别方法及动物治疗方法与上述的第一实施方式同样地实现,能够得到同样的效果。
例如,本实施方式的动物治疗方法通过包含具备识别毒素基因作为特定基因的靶标的靶序列的CRISPR-Cas13a的抗菌噬菌体,从而能够治疗人以外的动物中的由具备特定基因的细菌引起的感染症。
此外,本实施方式的抗菌噬菌体可以包含抗生素的抗性基因的序列。在此基础上,还可以使用包含抗生素的抗性基因的培养基来鉴别和/或检查细菌是否具备特定基因。
具体而言,如后述的实施例2所示,通过使抗菌噬菌体含有抗生素的抗性基因,在含有和/或不含有该抗生素的平板上进行培养,从而能够鉴别和/或检查细菌是否具备特定基因。通过使抗菌噬菌体含有抗生素的抗性基因,所以如果在含有抗生素的平板上进行培养,则会感染抗菌噬菌体,只有不含有特定基因的细菌才增殖。另一方面,未感染抗菌噬菌体的细菌由于抗生素而无法增殖,并且即使感染抗菌噬菌体,含有特定基因的细菌也会溶菌。这里,作为特定基因而检测的耐药基因、毒素基因或病原基因以与抗菌噬菌体中含有的抗生素的抗性基因不同的基因为靶标。
如果这样构成,则与在不含有抗生素的培养基进行培养相比,能够将抗菌噬菌体对特定基因的检测灵敏度提高百倍程度以上。
应予说明,在上述的第一实施方式和第二实施方式中,对作为特定基因,以耐药基因或毒素基因为靶标的例子进行了说明。另外,对于细菌,还对适用于具有该耐药基因的细菌的例子进行说明。
然而,特定基因可以是任意的基因,将包含特定基因的任意的细菌作为抗菌对象。
即,能够将可区分为上述的特定基因型的任意的基因作为本实施方式的特定基因而作为靶标。此外,只要是包含该特定基因的细菌,就可以不限定该细菌地作为靶标。
具体而言,作为一个例子,具有相同的维罗毒素的特定基因的痢疾杆菌(志贺痢疾杆菌,Shigella dysenteria)、肠出血性大肠杆菌(enterohaemorrhagic E.coli,EHEC)均可以作为抗菌对象。在这种情况下,通过利用同时以多种菌为对象的噬菌体,从而能够对具有特定基因型的所有细菌进行抗菌。
此外,特定基因可以包括与耐药基因或毒素基因随带地表达,或者被表达控制,或者相关联那样的基因。此外,特定基因还可以包括与其他病原性有关的病原基因。
另外,本发明的第一实施方式和第二实施方式的识别CRISPR-Cas13a的靶标RNA的探针(crRNA序列)能够识别出碱基序列的一个碱基的差异。因此,还能够应用于癌症治疗、遗传性疾病的治疗。此时,不一定是细菌用的Cas13a,也可以使用通过非特异性的RNA分解作用在真正细菌以外的细胞中诱导细胞凋亡等那样的酶,从而引起细胞死亡。
此外,本实施方式的特定基因可以是作为癌症治疗、遗传性疾病的靶标的基因变异的序列、单碱基取代、重复序列等广义的“基因”。此时,也可以将细菌本身作为药剂的搬运者(载体)而用于治疗。即,还能够应用于使对象细菌的细胞质等中包含与该特定基因的细胞对应的药剂,并通过溶菌而散布于组织、靶标细胞周边之类的用途。此时,还能够提供包含前噬菌体的细菌本身。另外,还可以包含通过特定的免疫反应而活化的前噬菌体。
另外,在上述的第一实施方式和第二实施方式中,对使用通常的噬菌体作为抗菌噬菌体的例子进行了说明。然而,作为“抗菌噬菌体”,也可以使用与通常的噬菌体不同的、感染细菌的病毒(Virus)、RNA病毒、噬菌粒等。另外,抗菌噬菌体还可以以前噬菌体的状态整合到细菌的基因组、质粒中的状态提供。另外,例如在本实施方式的细菌鉴别方法中,可以通过使用电穿孔和纳米粒子那样的任意的方法将噬菌粒导入到细胞中。
另外,在本实施方式的细菌鉴别方法中,也可以进行不一定需要细菌的增殖抑制或完全的溶菌的检测。这种情况下,例如可以通过使CAS13a结合而产生非特异性的RNA分解活性,切断与各种荧光探针结合的RNA,从而诱导荧光等各种报告基因,检测有无特定基因、拷贝数、表达量等。即使在该情况下,在通过本实施方式的细菌鉴别方法进行检测的情况下,也能够将检测到的该细菌作为抗菌对象。即,可以将本实施方式的抗菌噬菌体用于抗菌用途。
另外,本发明的第一实施方式和第二实施方式的抗菌噬菌体也可以与其他组合物等并用。此外,还能够提供包含多种抗菌噬菌体的“鸡尾酒”。另外,可以将本发明的组合物与其他组合物同时给药、散布、涂布等。
【实施例1】
以下,基于具体的实验,作为实施例对利用本发明的第一实施方式的抗菌噬菌体的杀菌(细菌去除)和细菌鉴别方法进行具体说明。然而,该实施例只不过是一个例子,并不限于此。
〔具有CRISPR-Cas13a的特定基因的细菌的杀菌效果〕
(四环素诱导性bla
利用TetReg SalI-f、ATATGTCGACGCATGCTTAAGACCCACTTTC和TetReg BamHI-r、ATATGGATCCTTTCTCCTCTTTAGATCTTTTG的引物,将四环素依赖性表达控制区的序列从pC008(从Dr.F.Zhang得到)进行扩增,亚克隆至pSP72载体的SalI-BamHI位点(以下,称为“pSP72aTc-诱导性载体”)。其后,利用IMP-1 clo BamHI-f、ATATGGATCCATGAGCAAGTTATCTGTATTC和IMP-1 clo EcoRI-r、ATATGAATTCTTAGTTGCTTGGTTTTGATG的引物,将bla
(以bla
利用pC003 PCR-r、CCAGCTGTTAAACGAGCTTTAATGCGGTAGTTTATC、pC003 PCR-f、GAAGGGGACTAAAACGGAGACCGAGATTGGTCTCG将作为CRISPR-Cas13a表达载体的pC003(Dr.F.Zhang提供)进行扩增,利用LsCas13a clo-f、TCGTTTAACAGCTGGGAAAATG、LsCas13a clo-r、GTTTTAGTCCCCTTCGATATTGG从Leptotrichia shahii(DSM 19757)的基因组DNA扩增Cas13a、Cas1、Cas2的区域,利用In-Fusion HD克隆试剂盒将2个DNA片段结合(以下,将其称为“pKLC5载体”),再利用BsaI限制酶将pKLC5载体切断,插入以bla
(CRISPR-Cas13a质粒对具有特定基因的细菌的杀菌效果)
根据图2,对使本实施例的CRISPR-Cas13a的各质粒转染上述的大肠杆菌进行形质转换并进行培养的结果进行说明。利用四环素诱导性bla
图2(a)示出进行了实验的大肠杆菌的系列。系列1、2、4表示对照的实验例,系列3表示全部导入的实验例。在实验项目的“bla
图2(b)是表示经时地测定了OD650的结果的图表。横轴表示从加入冰四环素之后的增殖时间(h),纵轴表示OD(650nm)。
图2(c)表示对4小时后(4h)、8小时后(8h)在试管内培养的大肠杆菌进行了拍摄而得的照片。
如这些结果所示,以将bla
〔抗菌噬菌体对具有特定基因的细菌的杀菌效果〕
接下来,将设计的CRISPR-Cas13a搭载于噬菌体,验证对具有特定基因的大肠杆菌的杀菌效果。
图3表示以bla
(以bla
如下对上述的表达载体pKLC5 BsaI IMP-1_104进行改良。由于存在于载体上的Cas1/2与Cas13a的杀菌活性无关,所以将其删除。该删除通过Cas1Cas2 del SacI-f、ATATGAGCTCATGGGAGAAAAAATTTCACAAAAC和Cas1Cas2 del SacI-r、ATATGAGCTCTCATTCTTATAACGTATCATTCG进行载体的PCR,利用SalI限制酶切断后,通过Ligation high ver.2(TOYOBO制)进行连接后完成。然后,对该载体进行赋予f1 ori和卡那霉素抗性的操作。具体而言,将本载体作为模板,利用InF13 PCR SalI-f、tcttcaccctgtcgatgggaaaatgtggaatttg和InF13PCR SmaI-r、caggatcttctgcccaattaggctctagttagcct的引物进行PCR,另外,利用InF13pRC319-f、gggcagaagatcctgcagg和InF13 pRC319-r、tcgacagggtgaagacgaaag对pRC319(从Dr.Timothy Lu得到)的f1 ori和卡那霉素抗性基因进行扩增,利用In-FusionHD克隆试剂盒将2个DNA片段结合(以下,将其称为“pKLC21 BsaI IMP-1_104载体”)。
另外,作为对照,还制作了同样改良了表达载体pKLC5的对照载体。
(M13辅助噬菌体质粒的制作)
使辅助噬菌体M13KO7(NEB biolab制)感染大肠杆菌NEB5αF'l
(bla
为了删除pBAD33载体的多余的序列(f1 ori),利用2个引物、pBAD33 PCR XhoI-f、tcaCTCGAGcgaatttgctttcgaatttc和pBAD33 PCR XhoI-r、tcaCTCGAGcaaaagagtttgtagaaacgc对pBAD33载体进行扩增,用限制酶XhoI切断后利用Ligation high ver.2结合(以下,称为“pKLC23载体”)。利用pKLC23 PCR In-Fusion-f2、GAATTCgatcctctagagtc和pKLC23 PCR In-Fusion-r2、tgcttcgtccatttgacag这2个引物对pKLC23进行扩增。另外,利用Intl1 pro In-Fusion-f、caaatggacgaagcaTGACGCACACCGTGGAAAC和Intl1 pro In-Fusion-r、tagaggatcGAATTCGAGAATGGATTTTGTGATGC从native的bla
准备利用该pKLC26 IMP-1载体进行了形质转换的大肠杆菌NEB5αF'l
(bla
制作搭载以bla
另外,也同样地使对照载体转染,制作bla
(TFU(转化菌落形成单位)的测定)
用SM缓冲液将这些抗菌噬菌体(搭载了Cas13a的M13噬菌体)稀释1000倍。对1ml的大肠杆菌NEB5αF'l
(噬菌粒诱导试验)
将测定了TFU的噬菌粒(搭载了Cas13a的M13噬菌体)逐次稀释10倍。如果预先培养的大肠杆菌NEB5αF'l
图4分别表示针对bla
〔使用搭载CRISPR-Cas13a的噬菌体进行的细菌鉴别〕
接下来,对制作以特定基因为靶标而设计CRISPR-Cas13a并搭载于M13噬菌体的抗菌噬菌体,通过选择性地杀灭具有特定基因的细菌,来简便地检测该细菌的细菌鉴别方法进行实验。以下是其实验例。在本例中,以抗性基因为靶标。
(Cas13a对携带特定基因的大肠杆菌的生长抑制)
在图5中示出携带特定基因的大肠杆菌的生长抑制的例子。同时将i)表达Cas13a和crRNA的质粒以及ii)表达crRNA的特定基因的质粒(靶标基因的表达质粒)与大肠杆菌菌株MC1061(Lucigen公司制)进行形质转换。i)的质粒携带卡那霉素抗性基因,ii)的质粒携带氯霉素抗性基因。将经形质转换的MC1061在LB平板(含有卡那霉素和氯霉素)上进行培养,在12小时后拍摄平板的照片。
如果在表达IMP-1的大肠杆菌中表达Cas13a和识别IMP-1的第339个碱基的crRNA,则抑制大肠杆菌的生长。
通过预实验,可知CRISPR-Cas13a的杀菌效果很大程度上受到特定基因的序列结构的影响。因此,对CRISPR-Cas13a的特定基因序列的特殊性(规律性)进行了研究,提取了最佳序列。即,在本实施例中,进行CRISPR-Cas13a的特定基因序列的最佳化。
在本实施例中,参考非专利文献1的CRISPR-Cas的论文,分别针对特定基因,将3~8个序列作为靶点的碱基序列进行了研究。
具体而言,针对10种耐药基因设计了CRISPR-Cas13a的靶序列。该10种基因使用IMP-1(GenBank ID:S71932)、KPC-2(AY034847)、NDM-1(FN396876)、OXA-48(AY236073)、VIM-2(AF191564)、mcr-1(KP347127)、mcr-2(LT598652)、mcr-3(KY924928)、mcr-4(MF543359)、mcr-5(KY807921)。另外,作为对照,使用RFP(红色荧光蛋白,GenBank ID:KJ021042)的序列。
在下述的表3中示出序列表的序列号(No.),主要以耐药基因为对象的序列名称(Spacer name)以及选定的靶点碱基序列(靶序列,Spacer Sequence)的关系。
【表3】
设计针对这些靶点碱基序列的crRNA,对CRISPR-Cas13a的杀菌效果进行了评价。
图6的照片表示针对表3的各靶序列来设计crRNA,使用其评价CRISPR-Cas13a的杀菌效果的结果。具体而言,同时将i)表达Cas13a和与各靶点碱基序列对应的crRNA的质粒以及ii)表达crRNA的特定基因的质粒(有靶标)与大肠杆菌MC1061进行形质转换。i)的质粒携带卡那霉素抗性基因,ii)的质粒携带氯霉素抗性基因。图6表示将经形质转换的MC1061在37℃下培养的LB平板(含有卡那霉素和氯霉素)中培养12小时后,对平板进行拍摄而得的照片。对于各序列号,对于没有针对靶序列的crDNA(无靶标),从左起示出未进行形质转换的(无耐药基因)菌、经形质转换的(有耐药基因)菌的平板。另外,对于有crDNA(有靶标),也是从左起示出无耐药基因的菌、有耐药基因的菌的平板。在用黑框包围的序列号的平板中,在有靶标、有耐药基因的大肠杆菌的平板中,几乎未出现菌落,确认了Cas13a的强杀菌活性(增殖抑制活性)。这样,根据靶序列不同,杀菌效果也不同。另外,确认了强杀菌活性(增殖抑制活性)的是导入了以序列号7、序列号17、序列号22、序列号26、序列号27、序列号28、序列号36为靶序列的crDNA的试样。
图7是在图6中,用Weblogo(URL<https://weblogo.berkeley.edu/>)对由黑框表示的平板的序列号的靶序列进行了比对的图。如第10个T所代表的那样,发现了偏差。即,研究的结果是,在设计为14~28个碱基的crRNA的间隔序列的靶序列中,在第10个碱基的靶标为T的情况下,CRISPR-Cas13a的杀菌活性最佳。
图8是表示通过目视对图6中进行的实验的平板上的菌落进行计数的数量的图表。但是,小的菌落从计数中去除。这里,对于各耐药基因的平板,示出将有耐药基因(携带抗性基因)的大肠杆菌的平板上的菌落数除以无耐药基因(无抗性基因)的大肠杆菌的平板上的菌落数而得的相对菌落计数。mcr-3_997以外的crRNA均阻碍携带作为靶标的耐药基因的大肠杆菌的生长。在此基础上,圆所示的位置表示上述的强杀菌活性被识别到的位置和对照的RFP(RFP_100)。这样,显示能够有效杀灭携带抗性基因的菌。
(通过抗菌噬菌体进行的大肠杆菌的碳青霉烯抗性基因的鉴别)
图9表示利用搭载了Cas13a的抗菌噬菌体来识别大肠杆菌的碳青霉烯抗性基因的结果。在该实验中,在M13噬菌体搭载了针对上述的确认过强杀菌活性的靶序列的crRNA和Cas13a。使用IMP-1、OXA-48、VIM-2、NDM-1、KPC-2的质粒作为碳青霉烯抗性基因,分别与大肠杆菌NEB5αF'l
(通过抗菌噬菌体进行的大肠杆菌的多粘菌素抗性基因的鉴别)
图10表示利用搭载了Cas13a的抗菌噬菌体来识别大肠杆菌的多粘菌素抗性基因的结果。在该实验中,在M13噬菌体搭载了针对上述的确认过强杀菌活性的靶序列的crRNA和Cas13a。使用MCR-1、MCR-2的质粒作为多粘菌素抗性基因,与NEB 5αF'll
【实施例2】
(由抗菌噬菌体引起的大肠杆菌的细菌菌群的改变)
图11表示利用搭载了Cas13a的抗菌噬菌体,选择性地去除大肠杆菌中携带碳青霉烯抗性基因bla
在本实施例中,在M13噬菌体搭载了针对上述的实施例1中确认过强杀菌活性的靶序列的crRNA和Cas13a。使用碳青霉烯抗性基因bla
以bla
(以bla
图12是在具有bla
制作将以bla
在下述的表4中示出序列表的序列号(No.)、以bla
【表4】
通过将上述的121种质粒载体按等量混合来制作质粒。将这些质粒文库转化大肠杆菌MC1061 pKLC26或MC1061 pKLC26 bla
图13是表示对具有bla
(提高抗菌噬菌体的基因检测灵敏度的方法)
接下来,为了提高抗菌噬菌体的基因检测灵敏度,本发明人等进行了使抗菌噬菌体含有抗生素的抗性基因,并检测基因的实验。
图14(a)表示提高抗菌噬菌体的基因检测灵敏度的示意图。合成了携带CRISPR-Cas13a序列和卡那霉素抗性基因序列的基于M13的抗菌噬菌体。使用不含有卡那霉素的琼脂平板(Agar plate)和含有卡那霉素的琼脂平板(Agar plate(Kanamycin))进行检测实验。注入将作为目标细菌的(NEB5αF'l
图14(b)表示不含有卡那霉素的琼脂平板中的实验结果,图14(c)表示含有卡那霉素的琼脂平板中的实验结果。分别针对对照(未携带bla
在本实验中,如实施例1所示,在未加入针对噬菌体所携带的抗性基因的抗生素(不含有抗生素的琼脂平板)进行培养的情况下,为了进行检测,需要使用10
与此相对的是,如果使抗菌噬菌体含有抗生素的抗性基因,则能够确认即使10
(通过抗菌噬菌体进行的碳青霉烯抗性基因的鉴别)
图15是使用图14的方法进行对碳青霉烯抗性基因bla
作为结果,可知具有各基因的菌被选择性地溶菌。
使大肠杆菌NEB5αF'l
(通过抗菌噬菌体进行的毒素基因的鉴别)
图16是使用抗菌噬菌体进行对毒素基因stx1、stx2的鉴别的照片。具体而言,针对对照、各毒素基因(toxin)stx1、stx2和抗性基因(AMR),能够利用抗菌噬菌体进行检测。
应予说明,stx1、stx2不使用全长,而是使用一部分序列。使用pKLC26 stx1partial PCR SacI-r、GTGGAGCTCGGTCATGGCATTTCCACTAAACTCCATTAAGAGAATGGATTTTGTGATGC和pKLC26 stx1 partial PCR SacI–f、ACCGAGCTCCACCGGAAGAAGTGGAACTCACACTGAACGAATTCGATCCTCTAGAGTC、pKLC26 stx2 partial PCR SacI–r、GCGGAGCTCGGTCATTGTATTACCACTGAACTCCATTAAGAGAATGGATTTTGTGATGC和pKLC26 stx2 partial PCR SacI–f、ACCGAGCTCCGCCGGGAGACGTGGACCTCACTCTGAACGAATTCGATCCTCTAGAGTC的引物从pKLC26质粒进行扩增,利用SacI(TaKaRa Bio制)进行处理后,用Ligation High Ver.2(TOYOBO制)结合。(以下,分别称为“pKLC26 stx1载体”和“pKLC26 stx2载体”)。另外,向pKLC21的BsaI位点插入将stx1488-as、TATCCTAATGGAGTTTAGTGGAAATGCCATGAC和stx1 488-s、AAACGTCATGGCATTTCCACTAAACTCCATTAG退火而得的双链DNA或者将stx2 488-as、TATCCTAATGGAGTTCAGTGGTAATACAATGAC和stx2 488-s、AAACGTCATTGTATTACCACTGAACTCCATTAG退火而得的双链DNA,制作“pKLC21BsaI stx1_488载体”和“pKLC21 BsaI stx2_488载体”。使用这些,通过与图14所示的相同的方法,进行毒素基因stx1、stx2的检测。
(通过临床分离株中的抗菌噬菌体进行的碳青霉烯抗性基因的鉴别)
图17是针对抗菌噬菌体所感染的临床分离株(E.coli1、E.coli2)进行了碳青霉烯抗性基因bla
临床分离株(E.coli1、E.coli2)的bla
(感染了临床分离大肠杆菌菌株的蛾幼虫的抗菌噬菌体的治疗效果)
图18是对感染了临床分离大肠杆菌菌株的蛾幼虫的抗菌噬菌体的治疗效果进行了调查的图表。
从活饵工厂购入Galleria mellonella的M尺寸的幼虫,用于生存分析。接收后,24小时在暗处适应研究室的环境,在其后48小时以内用于分析。另外,实验中没有使用动作弱、颜色深、形状不常见、尺寸与其他幼虫明显不同的幼虫。注射器使用在Hamiltonsyringe、leur tip(701LT,Hamilton)中组合了KF731的针(Hamilton)的注射器。将一晩上在LB培养基中且在37℃下培养的大肠杆菌放入LB培养基中1/100的量,在37℃下进行振荡培养,直到OD600成为0.5左右。其后,用PBS清洗2次,制作~1×10
根据图18的图表,给予了表达bla
(通过抗菌噬菌体进行的金黄色葡萄球菌的甲氧西林抗性基因的鉴别)
图19显示针对金黄色葡萄球菌制备的抗菌噬菌体针对金黄色葡萄球菌的甲氧西林抗性基因mecA也具有选择性的杀菌效果的实验结果的图表。合成以mecA为靶标的mecAcrRNA-446-as,TATCCCAAAGCATACATATTGAAAATTTAAAAT和mecA crRNA-446-s,AAACATTTTAAATTTTCAATATGTATGCTTTGG,退火后将其插入到pKLC21的BsaI位点中。为了使pKLC21 BsaImecA的Cas13a crRNA区域包装到噬菌体NM1中,将包装序列连接,并转化到包装序列缺失的NM1噬菌体溶原化的金黄色葡萄球菌RN4220中。其后,将经形质转换的RN4220株在TSB培养基中且37℃下进行培养,在OD600达到0.2时,加入丝裂霉素C(2μg/ml)。其后在30度下以80rpm的条件振荡一晚,通过0.22μm的过滤器而得到抗菌噬菌体。对于未携带mecA的RN4220、携带mecA的临床分离株USA300、缺失了mecA的临床分离株USA300ΔmecA,分别以与图14相同的方式添加以mecA为靶标的抗菌噬菌体,在37℃下培养12小时后,进行抗性基因mecA的鉴别。
根据图19的结果,确认了携带mecA的USA300因为抗菌噬菌体而没有形成菌落,与此相对,从未携带mecA的金黄色葡萄球菌菌株(RN4220和USA300ΔmecA)中确认了菌落形成。根据以上的结果,确认了不仅在革兰氏阴性的大肠杆菌中,在革兰氏阳性的金黄色葡萄球菌中也可以通过抗菌噬菌体进行特定基因的检查。
需要说明的是,上述实施方式的构成和动作为例子,在不脱离本发明的主旨的范围内当然可以进行适当改变来执行。
工业实用性
鉴于本发明,使提供能够将选择性地杀灭具有耐药基因的细菌,或者能够简易地鉴别的抗菌噬菌体作为治疗用组合物、杀菌剂、食品、细菌鉴别试剂盒等便成了可能,并且基于这些方法的可行性,其在工业上的利用也成为了可能。
序列表
<110> 学校法人自治医科大学(Jichi Medical University)
<120> 用于治疗耐多药细菌的噬菌体及其
<130> YU2068178JPP
<160> 36
<170> PatentIn version 3.5
<210> 1
<211> 31
<212> DNA
<213> 大肠杆菌(Escherichia coli)
<400> 1
cggtctgggt accttcgtac ggacgacctt c 31
<210> 2
<211> 28
<212> DNA
<213> 大肠杆菌(Escherichia coli)
<400> 2
aaaacggcaa cactcgccac aagaacaa 28
<210> 3
<211> 28
<212> DNA
<213> 大肠杆菌(Escherichia coli)
<400> 3
cggatttata atcggcaaat tgcgcttt 28
<210> 4
<211> 28
<212> DNA
<213> 大肠杆菌(Escherichia coli)
<400> 4
ccattggcgt gatgccagtt tgcttatc 28
<210> 5
<211> 28
<212> DNA
<213> 大肠杆菌(Escherichia coli)
<400> 5
ccaccaaacc catcagcaca aaaggatt 28
<210> 6
<211> 28
<212> DNA
<213> 大肠杆菌(Escherichia coli)
<400> 6
ctgatttata atcaaaatac tgcgtggc 28
<210> 7
<211> 28
<212> DNA
<213> 大肠杆菌(Escherichia coli)
<400> 7
gcagttggct tgaatgtcgt attatttg 28
<210> 8
<211> 28
<212> DNA
<213> 大肠杆菌(Escherichia coli)
<400> 8
caaaatacag tgccaaaaag aacataag 28
<210> 9
<211> 28
<212> DNA
<213> 大肠杆菌(Escherichia coli)
<400> 9
ggtgatcctt tggttcgatt tcgatgtt 28
<210> 10
<211> 28
<212> DNA
<213> 大肠杆菌(Escherichia coli)
<400> 10
gtaaatccag gtgacatcca cacctgca 28
<210> 11
<211> 28
<212> DNA
<213> 大肠杆菌(Escherichia coli)
<400> 11
gcaacataaa acaacgcagt gatgaaag 28
<210> 12
<211> 28
<212> DNA
<213> 大肠杆菌(Escherichia coli)
<400> 12
gatcactctt caaatctatc gtgagatt 28
<210> 13
<211> 28
<212> DNA
<213> 大肠杆菌(Escherichia coli)
<400> 13
ctaaagtcat tagataccca agccagca 28
<210> 14
<211> 28
<212> DNA
<213> 大肠杆菌(Escherichia coli)
<400> 14
ctgatgaaca gagtcaaaaa ttcagtgc 28
<210> 15
<211> 28
<212> DNA
<213> 大肠杆菌(Escherichia coli)
<400> 15
gatggcctgc cgaagacagg ttttcaaa 28
<210> 16
<211> 28
<212> DNA
<213> 大肠杆菌(Escherichia coli)
<400> 16
cataaacctg actcgactgc caccagat 28
<210> 17
<211> 28
<212> DNA
<213> 大肠杆菌(Escherichia coli)
<400> 17
ttaacttctt caaacgaagt atgaacat 28
<210> 18
<211> 28
<212> DNA
<213> 大肠杆菌(Escherichia coli)
<400> 18
ccactctatt ccgcccgtgc tgtcgcta 28
<210> 19
<211> 28
<212> DNA
<213> 大肠杆菌(Escherichia coli)
<400> 19
aattaagcca ctctattccg cccgtgct 28
<210> 20
<211> 28
<212> DNA
<213> 大肠杆菌(Escherichia coli)
<400> 20
agaattaagc cactctattc cgcccgtg 28
<210> 21
<211> 28
<212> DNA
<213> 大肠杆菌(Escherichia coli)
<400> 21
ttaattcaga tgcatacgtg gggataga 28
<210> 22
<211> 28
<212> DNA
<213> 大肠杆菌(Escherichia coli)
<400> 22
ttcatttgtt aattcagatg catacgtg 28
<210> 23
<211> 28
<212> DNA
<213> 大肠杆菌(Escherichia coli)
<400> 23
ggcctggata aaaaacttca attttatt 28
<210> 24
<211> 28
<212> DNA
<213> 大肠杆菌(Escherichia coli)
<400> 24
acttggaaca accagttttg ccttacca 28
<210> 25
<211> 28
<212> DNA
<213> 大肠杆菌(Escherichia coli)
<400> 25
atcgccaaac cgttggtcgc cagtttcc 28
<210> 26
<211> 28
<212> DNA
<213> 大肠杆菌(Escherichia coli)
<400> 26
acaacgcatt ggcataagtc gcaatccc 28
<210> 27
<211> 28
<212> DNA
<213> 大肠杆菌(Escherichia coli)
<400> 27
aatggctcat cacgatcatg ctggcctt 28
<210> 28
<211> 28
<212> DNA
<213> 大肠杆菌(Escherichia coli)
<400> 28
attgggaatt ttaaaggtag atgcgggt 28
<210> 29
<211> 28
<212> DNA
<213> 大肠杆菌(Escherichia coli)
<400> 29
caatttggcg ggcaaattct tgataaac 28
<210> 30
<211> 28
<212> DNA
<213> 大肠杆菌(Escherichia coli)
<400> 30
gccgaaattc gaataccacc gtcgagcc 28
<210> 31
<211> 28
<212> DNA
<213> 大肠杆菌(Escherichia coli)
<400> 31
gtcagcgcgg tggcagaaaa gccagcca 28
<210> 32
<211> 28
<212> DNA
<213> 大肠杆菌(Escherichia coli)
<400> 32
cctgctgctg gctgcgagcc agcacagc 28
<210> 33
<211> 28
<212> DNA
<213> 大肠杆菌(Escherichia coli)
<400> 33
cccagtgggc cagacgacgg catagtca 28
<210> 34
<211> 28
<212> DNA
<213> 大肠杆菌(Escherichia coli)
<400> 34
ctgtatcaat caaaagcaac tcatcacc 28
<210> 35
<211> 28
<212> DNA
<213> 大肠杆菌(Escherichia coli)
<400> 35
ccgacgcggt cgtcatgaaa gtgcgtgg 28
<210> 36
<211> 28
<212> DNA
<213> 大肠杆菌(Escherichia coli)
<400> 36
tcggtcgaat gcgcagcacc aggataga 28
<210> 37
<211> 28
<212> DNA
<213> 大肠杆菌(Escherichia coli)
<400> 37
gactttggcc aagcttctat atttgcgt 28
<210> 38
<211> 28
<212> DNA
<213> 大肠杆菌(Escherichia coli)
<400> 38
gcggactttg gccaagcttc tatatttg 28
<210> 39
<211> 28
<212> DNA
<213> 大肠杆菌(Escherichia coli)
<400> 39
ttttgatggt tttttacttt cgtttaac 28
<210> 40
<211> 28
<212> DNA
<213> 大肠杆菌(Escherichia coli)
<400> 40
actttggcca agcttctata tttgcgtc 28
<210> 41
<211> 28
<212> DNA
<213> 大肠杆菌(Escherichia coli)
<400> 41
tggcttgaac cttaccgtct tttttaag 28
<210> 42
<211> 28
<212> DNA
<213> 大肠杆菌(Escherichia coli)
<400> 42
cggactttgg ccaagcttct atatttgc 28
<210> 43
<211> 28
<212> DNA
<213> 大肠杆菌(Escherichia coli)
<400> 43
tatctttagc cgtaaatgga gtgtcaat 28
<210> 44
<211> 28
<212> DNA
<213> 大肠杆菌(Escherichia coli)
<400> 44
tgctgtcgct atgaaaatga gaggaaat 28
<210> 45
<211> 28
<212> DNA
<213> 大肠杆菌(Escherichia coli)
<400> 45
tttcaagagt gatgcgtctc caacttca 28
<210> 46
<211> 28
<212> DNA
<213> 大肠杆菌(Escherichia coli)
<400> 46
caaaacaaaa atataaagaa tacagata 28
<210> 47
<211> 28
<212> DNA
<213> 大肠杆菌(Escherichia coli)
<400> 47
aacaaccagt tttgccttac catatttg 28
<210> 48
<211> 28
<212> DNA
<213> 大肠杆菌(Escherichia coli)
<400> 48
gttttgatgg ttttttactt tcgtttaa 28
<210> 49
<211> 28
<212> DNA
<213> 大肠杆菌(Escherichia coli)
<400> 49
tgactaactt ttcagtatct ttagccgt 28
<210> 50
<211> 28
<212> DNA
<213> 大肠杆菌(Escherichia coli)
<400> 50
gtcatggcat ttccactaaa ctccatta 28
<210> 51
<211> 28
<212> DNA
<213> 大肠杆菌(Escherichia coli)
<400> 51
gtcattgtat taccactgaa ctccatta 28
<210> 52
<211> 28
<212> DNA
<213> 大肠杆菌(Escherichia coli)
<400> 52
attttaaatt ttcaatatgt atgctttg 28
- 抗菌噬菌体、治疗用组合物、杀菌剂、食品、细菌鉴别试剂盒、治疗用组合物制造方法、细菌去除方法、细菌鉴别方法及动物治疗方法
- 用于治疗细菌感染的包含抗细菌噬菌体的混合物的组合物及其使用方法
