一种2型糖尿病的生物标志物和治疗靶点及浒苔寡糖的应用方法
文献发布时间:2024-04-18 19:52:40
技术领域
本发明涉及生物医药技术领域,尤其涉及2型糖尿病的生物标志物和治疗靶点及浒苔寡糖的应用方法。
背景技术
2型糖尿病(Type 2diabetes)是一种以高血糖和胰岛素抵抗为特征的异质性、激素性和代谢性疾病,当前正以一定的发病率在人群中蔓延;随着近几十年来医疗及卫生技术手段的快速发展,以及各种药物治疗检测手段的不断完善,针对糖尿病的治疗取得很大进展,但糖尿病及其并发症仍旧威胁着人们的身体健康。
高糖高脂饮食是肥胖和2型糖尿病发病的重要风险因素之一,同时易诱发糖脂代谢紊乱、粥样动脉粥样硬化、心脏病及心血管疾病等其他严重并发症。随着代谢组、蛋白质组、转录组学研究的不断深入以及高通量测序技术的应用,人们发现了许多糖尿病相关的生物标志物。但2型糖尿病的发病原因复杂且在治疗过程中生理指标及反应多变,我们需要更多针对性治疗各种不同因素诱发的2型糖尿病的生物标记物。
2′,5′-寡腺苷酸合成酶L(OASL)是抗病毒酶,它通过降解病毒和宿主RNA来抵消病毒攻击。该酶在2'-特异性核苷酸转移反应中使用ATP来合成2'-5'-寡腺苷酸,寡腺苷酸可以与核糖核酸酶L结合使之被激活,降解RNA,从而抑制蛋白质的合成。该酶在干扰素诱导下形成,因而是干扰素抗病毒和抗肿瘤过程中的一个关键酶。
中国专利CN201510122371.1公开了一种沉默DF-1细胞系中OASL基因的方法,用于提高禽流感病毒在该细胞系中的增殖滴度,属于生物技术领域;美国专利US20090611746公开了一种使用先天免疫基因OASL预防或治疗负链RNA病毒感染的方法,即在有需要的个体中治疗由负义单链RNA病毒引起的疾病、病症或病症的方法,包括至少向所述有需要的个体使用分离的2',5'-寡腺苷酸合成酶的步骤样蛋白或编码所述2'-5'-寡腺苷酸合成酶样蛋白的分离的多核苷酸。以上专利是OASL与病毒相关疾病的发现与运用,尚未见OASL与肠道及2型糖尿病之间相关的报道。
发明内容
有鉴于此,本发明的目的在于提出一种实施可靠、高效且无毒副作用的2型糖尿病的生物标志物和治疗靶点及浒苔寡糖的应用方法。
为了实现上述的技术目的,本发明所采用的技术方案为:
OASL基因或其转录产物或OASL蛋白在制备2型糖尿病的生物标志物和治疗靶点试剂中的应用,其中,以OASL基因或其转录产物或OASL蛋白作为2型糖尿病的生物标志物和治疗靶点,所述OASL基因的核苷酸序列如SEQ ID NO.1所示,所述OASL蛋白的氨基酸序列如SEQ ID NO.2所示。
作为一种可能的实施方式,进一步本方案应用通过RT-qPCR技术特异性扩增OASL基因转录的RNA进行检测;
其中,扩增引物序列包括:
前引物序列,SEQ ID NO.3:5'-AGAGTCAAGAGATAGGCAGGACAGTA-3',
后引物序列,SEQ ID NO.4:3'-CTACACAGCAAGGATGGTCAGAACT-5';
另外,RT-qPCR扩增程序如下:
(1)95℃维持60s,一个循环;
(2)95℃和60℃分别设定运行20s及60s,运行40个循环;
(3)熔解曲线分析,95℃,15s;60℃,30s;95℃,15s;一个循环。
作为一种可能的实施方式,进一步本方案还提出浒苔寡糖在制备2型糖尿病药物中的应用,其中,所述药物用于提高OASL蛋白的表达量,并改善空腹血糖、胰岛素和糖化血红蛋白水平。
作为一种较优的实施选择,优选的,本方案所述浒苔寡糖的制备方法包括:
将80目的浒苔粉与纯水以1:30-1:50g/mL的比例混合,然后超声波辅助提取1-2h,再以4000 -5000rpm速度离心处理8-12min后,进行真空抽滤取上清液,继而在50-75℃的温度下进行旋蒸浓缩,再加入3.5-4.5倍体积的90%-100%乙醇醇沉处理8h以上;然后在4000-5000rpm的离心转速下处理8-12min后,取沉淀置于50-70℃环境下干燥,再以1:80-120(g:mL)的比例将产物溶于纯水,然后在溶液中加入蛋白酶使酶活350-450U/mL,继而在45-50℃温度条件下酶解1.5-2.5h,随后在80-100℃下水浴10-30min以灭酶活,然后在4000-5000rpm离心转速下处理8-12min,再取上清液,然后以分子量大小为15kDa的透析袋透析36-60h后收集袋内液体浓缩冻干得浒苔多糖;在0.8%-1.2%浒苔多糖水溶解液中加入浓硫酸,其中,每升溶液加入2.5-3ml浓硫酸,于90-100℃水浴酸解1-2h,冷却至室温后加0.5-2mol/L NaOH将溶液调至中性,然后按1:1的体积比加入90%-100%乙醇溶液醇沉8-12h后,取上清液于3kDa透析袋进行透析,收集袋外溶液浓缩冻干,获得浒苔寡糖。
采用上述的技术方案,本发明与现有技术相比,其具有的有益效果为:本发明方案所提供的2型糖尿病生物标志物OASL蛋白及基因和转录产物,可用于2型糖尿病的快速诊断的生物标志物和临床治疗新的靶点。相比于传统的血糖及糖化血红蛋白检测手段,本方案对该生物标志物的检测能够提供更为精确而直接的参考数据,有助于提高临床诊断的准确度;除此之外,本发明方案提供的治疗靶点为2型糖尿病的医治开辟了新的道路,以此为靶点可以推动一系列2型糖尿病新型药物的开发和应用。同时,本发明提供的浒苔寡糖作为2型糖尿病的治疗药物,是从天然海藻中提取制备的绿色生物活性物质,具有快速、高效、无毒副作用等优势。原料来源于海洋常见生物污染物浒苔,其开发利用对于维护海洋生态平衡具有重要意义。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
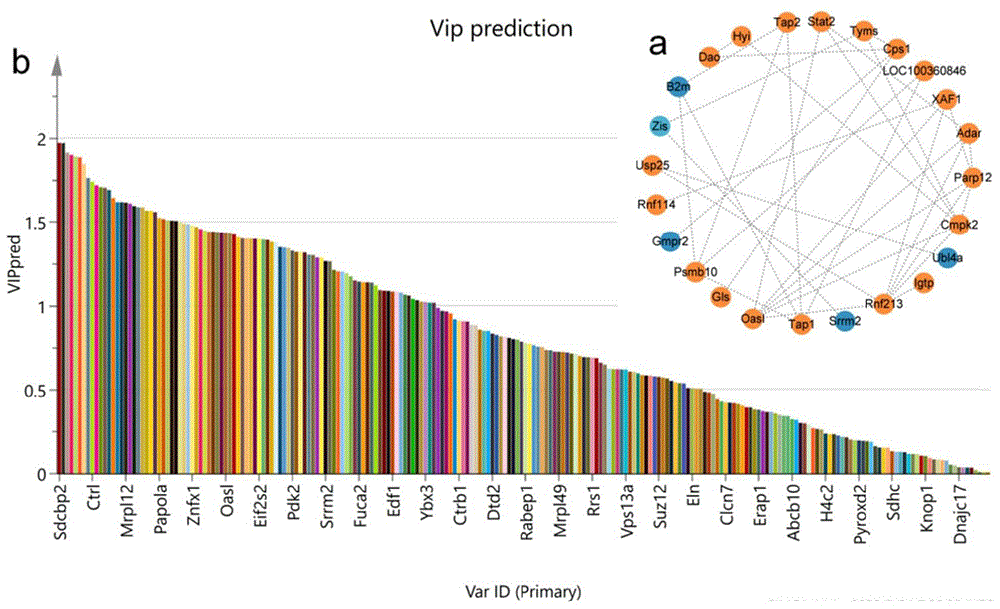
图1为本发明实施例1所述模型组与浒苔寡糖给药组大鼠的OASL蛋白在蛋白质组学及生信技术分析下发现的差异表达:通过String网站构建空肠组织差异表达蛋白相互作用网络关联图,其中,黄色节点和蓝色节点分别表示上下显著调节(E/M)。
图2为本发明实施例3浒苔寡糖的工艺流程图。
图3为本发明实施例4浒苔寡糖提高糖尿病大鼠OASL的mRNA表达。
图4为本发明实施例4所述浒苔寡糖给药后的模型组与给药组OASL蛋白表达的变化、空腹血糖、胰岛素及糖化血红蛋白的变化情况;其中a为大鼠空腹血糖变化情况;b为大鼠口服糖耐量变化情况;c为大鼠C-肽变化情况;d为大鼠血清胰岛素变化情况;e为大鼠糖化血红蛋白变化情况。
图5为本发明实施例5所述OASL的mRNA表达情况、IR-HepG2细胞OASL受干扰后表达情况的变化及细胞葡萄糖消耗量的变化(与正常组进行对比,p<0.05:
具体实施方式
下面结合附图和实施例,对本发明作进一步的详细描述。特别指出的是,以下实施例仅用于说明本发明,但不对本发明的范围进行限定。同样的,以下实施例仅为本发明的部分实施例而非全部实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其它实施例,都属于本发明保护的范围。
实施例1
OASL作为2型糖尿病生物标志物的依据
模型组大鼠(高糖高脂饮食诱发2型糖尿病)与正常大鼠的OASL在蛋白质组学及生信技术分析下发现的差异表达。
通过4D Laber free蛋白质组学分析,检测了全部6810个蛋白质,结合生信分析手段,将P值低于0.05设定为阈值判断显著性差异。其中在模型组与正常组的比较中,265个蛋白质呈现差异表达。进一步地,通过差异蛋白网络互作图发现OASL在蛋白质的相互作用网络中处于功能网络节点数目较多的核心位置,VIP预测中排名靠前,且其差异倍数较大同时差异显著,说明该蛋白在2型糖尿病中扮演着极其重要的角色,参与了维持正常糖代谢功能的过程(参考图1)。
实施例2
OASL基因的检测方法
(1)提取RNA
根据总RNA抽提试剂盒说明书分别提取空肠组织中的总RNA,于微量紫外分光光度计测完浓度后置于-80℃冰箱保存备用。
(2)反转录
根据带有gDNA Eraser的反转录试剂盒说明书对提取成功的空肠总RNA进行逆转录,得到cDNA,测定浓度后根据实验需求适当稀释3-5倍,-□80℃保存备用。
(3)RT-qPCR
将RNA反转录后得到的cDNA第一链作为模板,设计引物(引物见下表1)。利用苏州近岸蛋白质科技股份有限公司的
表1用于检测基因的引物
备注:OASL的前引序列如SEQ ID NO.3所示,后引序列如SEQ ID NO.4所示,Gapdh的前引序列如SEQ ID NO.5所示,后引序列如SEQ ID NO.6所示。
实施例3
针对OASL靶点的浒苔寡糖药物的制备
称取100g浒苔粉(80目),按照1:40的料液比将其溶解。在60℃、45kHZ、200W功率条件下超声波辅助提取2h,4500rpm离心10min后弃沉淀去上清。将上清液进行真空抽滤,得到滤液后,再将其旋转蒸发浓缩至500mL,按照1:4的比例加入2000mL 95%乙醇醇沉过夜(8h以上)。而后将其以4500rpm转速离心10min后得到沉淀物并将沉淀物置于50℃烘箱烘干。烘干后的沉淀物按照1:100的比例加入纯水并以电动搅拌机助溶,直至完全溶解后。随后,在溶液中加入中性蛋白酶使酶活400U/mL,在最适温度中酶解2h。酶解结束后,将溶液放置于100℃水浴锅中,灭活20min后,4500rpm离心10min后去沉淀取上清液。将取得液体以分子量为15kDa的透析袋透析48h,收集袋内溶液并浓缩至10-20mL,冻干得到绿藻浒苔多糖。准确称取15g绿藻浒苔多糖用纯水溶解成1%多糖溶液,加入浓硫酸,直至溶液浓度为0.05mol/L,放入100℃水浴锅中酸解1.5h后,静置冷却。冷却后加1.0mol/L NaOH将溶液调至中性,再浓缩溶液,按1:1的比例加入95%乙醇溶液醇沉8h以上,取上清液浓缩冻干,最终得浒苔寡糖(EPO)(参考图2)。
实施例4
针对OASL靶点的浒苔寡糖药物的效果
本发明通过对模型组、给药组的空腹胰岛素和糖化血红蛋白来具体验证OASL下调对于这两者的影响,发现模型组因为OASL的下调导致空腹血糖、胰岛素和糖化血红蛋白含水平均极显著偏移,而在恢复OASL表达后,二者恢复了正常的水平值,说明OASL的抑制恶化了机体对于糖代谢的调节能力(参考图4),具体操作步骤如下:
(1)OASL蛋白表达的变化
蛋白质提取和酶解:空肠组织置于预冷的研钵中,加入液氮磨成粉末后,加入4倍体积的裂解缓冲液(1%蛋白酶抑制剂、1% SDS、1%磷酸酶抑制剂、50mM NAM、3μM TSA)进行裂解。4℃下,12000r,离心10min,弃沉淀,测定上清液蛋白浓度。将每个样品的蛋白质进行等量的胰酶促水解,调整体积使之与裂解液一致。缓慢加入终浓度为20%的TCA,涡旋混合,在4℃下沉淀2h,4500r,离心5min,弃去上清液,用预冷丙酮洗涤沉淀物2-3次。干燥沉淀后,加入终浓度为200mM的TEAB,用超声波打碎沉淀,并按1:50(蛋白酶:蛋白质,m/m)的比例加入胰蛋白酶,酶解过夜。然后加入DTT使终浓度为5mM,并在56℃下还原30min。最后加入IAA,使其最终浓度为11mM,在室温下避光培养15min。
液相色谱-质谱联用分析:肽段用液相色谱流动相A相溶解后使用NanoElute超高效液相系统进行分离。流动相A为含0.1%甲酸和2%乙腈的水溶液;流动相B为含0.1%甲酸和100%乙腈溶液。液相梯度设置:0-70min,6%~24%B;70-84min,24%~35%B;84-87min,35%~80%B;87-90min,80%B,流速维持在450nL/min。肽段经由超高效液相系统分离后被注入Capillary离子源中进行电离然后进入timsTOF Pro质谱进行分析。离子源电压设置为1.75kV,肽段母离子及其二级碎片都使用高分辨的TOF进行检测和分析。二级质谱扫描范围设置为100-1700。数据采集模式使用平行累积串行碎裂(PASEF)模式。一张一级质谱采集后进行10次PASEF模式采集母离子电荷数在0-5范围内的二级谱图,串联质谱扫描的动态排除时间设置为30s秒避免母离子的重复扫描。
对于蛋白质差异分析,选择比较样本对中每种蛋白质的所有生物重复定量值的平均值的比率作为差异倍数(Fold Change,FC),其中EPL/Mod Ratio为2.93,显著性p<0.05(p=0.0476),浒苔寡糖治疗组OASL蛋白表达呈显著上调趋势(见表2)。
表2
(2)OASL基因表达的变化
基于实施例2中的方法,提取空肠组织RNA进行反转录,将RNA反转录后得到的cDNA作为模板进行PCR扩增,具体参数和引物序列如实例2。
如图3检测结果显示,浒苔寡糖低剂量(EPL)组大鼠空肠组织中OASL的mRNA表达量显著高于模型组(p<0.05)。
(3)空腹血糖和口服糖耐量的变化
28天连续灌胃结束后,所有大鼠禁食12h(期间保持饮水自由),通过OMRON血糖仪检测空腹血糖值(FBG)和糖耐量(OGTT),其中,试验大鼠处理血液葡萄糖的能力可以直接通过OGTT的结果衡量。0h时取大鼠尾部静脉血测空腹血糖值,测定完毕后对所有大鼠进行葡萄糖(2g/kg)灌胃后,在0.5、1和2小时于尾巴静脉取血测血糖。
检测结果显示,Model组中试验大鼠对血液中高含量的葡萄糖摄取处理能力极显著下降,无法正常调控血液中的高糖环境。浒苔低剂量(EPL)和浒苔高剂量(EPH)干预处理4周后,与模型组相比,浒苔寡糖治疗后大鼠的FBG和口服糖耐量(OGTT)水平显著降低(p<0.5),且浒苔低剂量处理对模型组大鼠的OGTT水平具有更佳改善效果(p<0.1),综上所示,说明浒苔寡糖高低剂量组都能缓解模型大鼠体内高糖环境所导致的糖耐受损伤。
(4)血清中C-肽、胰岛素及糖化血红蛋白的变化
采集大鼠部分全血,按照南京建成生物工程研究所的糖化血红蛋白试剂盒操作说明,对各组大鼠糖化血红蛋白含量进行测定和分析。另外收集一份大鼠的血液,室温静置1h后,4℃,3000r/min,离心10min,取上层血清于-20℃下保存,用于其他指标测定。通过C-肽(C-P)和胰岛素(INS)大鼠ELISA试剂盒测定大鼠血清中C-P及INS含量。
检测结果显示,由STZ诱导的糖尿病大鼠模型,空腹血糖FBG值显著升高,而血清胰岛素、C-P水平呈下降趋势。浒苔寡糖给药治疗4周后,试验大鼠的FBG显著下降,血清胰岛素含量和C-P水平得到改善。浒苔寡糖维持血液中葡萄糖稳定的能力,可以通过检测大鼠全血中的糖化血红蛋白(Ghb)来判断。根据4-2c&d图所示,给药治疗28天后,浒苔寡糖给药治疗组均取得较好成效:浒苔低剂量组大鼠的Chb含量显著低于模型组(p<0.01)。综上所示,摄入浒苔寡糖对衰老糖尿病大鼠起到较好的稳定血糖及改善胰岛β细胞功能的作用。
实施例5
通过转染实验干扰IR-HepG2细胞中OASL的表达,验证OASL作为治疗靶点的效果
本实施例方案以IR-HepG2细胞为转染对象,实验设阳性及阴性对照,以一段无意义的空白序列干扰作为空白对照,设为NC组,以经典的GAPDH干扰序列为阳性对照,设为GAPDH组,配备好转染复合物后,在其静置过程中,给12孔板进行换液,每孔换上0.8ml预热好的无血清培养基。静置时间结束后,立即将转染复合物加入孔中,每孔添加200μL。加完后将板轻轻晃动以使复合物均匀分布,然后置于37℃,5% CO
如图5所示,浓度为2μM的地塞米松作用72h对胰岛素抵抗HepG2细胞模型(IR-HepG2)的诱导是成功的,模型组细胞葡萄糖的消耗量明显低于空白对照组(p<0.01),抑制率达到23.6%。siRNA干扰序列对模型组的IR-HepG2细胞中的OASL基因进行干扰后,各组葡萄糖消耗量降低了28.11%(参考图5),与NC组接近。将干扰后各组葡萄糖消耗量的变化情况与mRNA表达情况进行比对,发现对于OASL基因mRNA表达抑制率高的组葡萄糖消耗量相应地降低,说明OASL基因的表达会影响IR-HepG2细胞消耗葡萄糖的能力,判断其具有调节糖代谢作用。
以上所述仅为本发明的部分实施例,并非因此限制本发明的保护范围,凡是利用本发明说明书及附图内容所作的等效装置或等效流程变换,或直接或间接运用在其他相关的技术领域,均同理包括在本发明的专利保护范围内。
- 自由曲面双层网格结构参数化建模方法、系统、设备
- 一种双层网格结构参数化建模方法、设备及可读存储介质
