一种大鼠被动型海曼肾炎模型的构建方法
文献发布时间:2024-04-18 19:58:53
技术领域
本发明属于生物医药技术领域,具体涉及一种大鼠被动型海曼肾炎模型的构建方法。
背景技术
临床上原发性膜性肾病是成人肾病综合征的主要病理类型,然而关于其组织损伤及进展机制目前仍未了解清楚。海曼(Heymann)肾炎模型作为研究人类模型肾病的经典动物模型,可用于原发性膜性肾病的研究,应用较为广泛。
海曼肾炎模型属于异种免疫性抗肾小球基膜肾炎,其造模机制是用于甲种动物的肾皮质匀浆免疫乙种动物,使乙种动物产生抗甲种动物的抗肾血清(抗肾抗体),然后再将抗肾血清注入健康的甲种动物体内,诱发其产生肾炎。由于这种肾炎模型的建立是通过被动地注射抗体形成的,所以又被成为被动型海曼肾炎(Passive Heymann Nephritis,PHN)。
PHN是研究产生蛋白尿肾脏损害较理想的动物模型,这是因为肾脏是模型动物损害的唯一靶器官,所用的抗体很少,且病变出现较快,病理改变特征与人类膜性肾病相似。据以往的研究报道称,目前通常采用一次性静脉注入抗beta 2Microglobulin抗血清的方法建立PHN模型,虽然模型发病迅速,但由于其病程短、病情易缓解,不能满足长期观察的需要。因此需要构建一种病程更长的PHN模型,以满足长期观察的需要。
发明内容
本发明的目的在于提供一种大鼠被动型海曼肾炎模型的构建方法,以解决背景技术中存在的问题。
为了实现上述目的,本发明设计了一种大鼠被动型海曼肾炎模型的构建方法,包括如下步骤:间隔24h对大鼠进行多次尾静脉注射Sheep Anti-Rat Fx1A Serum。
进一步的,所述大鼠为雄性,种属品系为Lewis,等级为SPF,体重为200-220g。
进一步的,间隔24h对大鼠进行2次尾静脉注射,其中在0-1min注射第一针,在24h后的0-1min注射第二针。
进一步的,所述尾静脉注射的注射量为3-8mL/kg,优选为5mL/kg。
进一步的,在进行尾静脉注射时,大鼠为趴卧位,以酒精擦拭鼠尾,使血管清晰,在远心端1/3处进针,观察回血确认针头进入血管,在1min内注射完毕。
与现有技术相比,本发明的大鼠被动型海曼肾炎模型的构建方法具有如下优点:
本发明中,通过对大鼠进行两次尾静脉注射Sheep Anti-Rat Fx1A Serum,成功构建了大鼠PHN模型,模型大鼠表现出大量蛋白尿为特征的肾病综合征,病程长、病情不易缓解,能够满足长期观察的需求。本发明的建模方法简单,易于实现,可为动态观察模型动物的肾损害、探讨PHN的发病机制及研发人类模型肾病的药物治疗方面等提供研究帮助。
附图说明
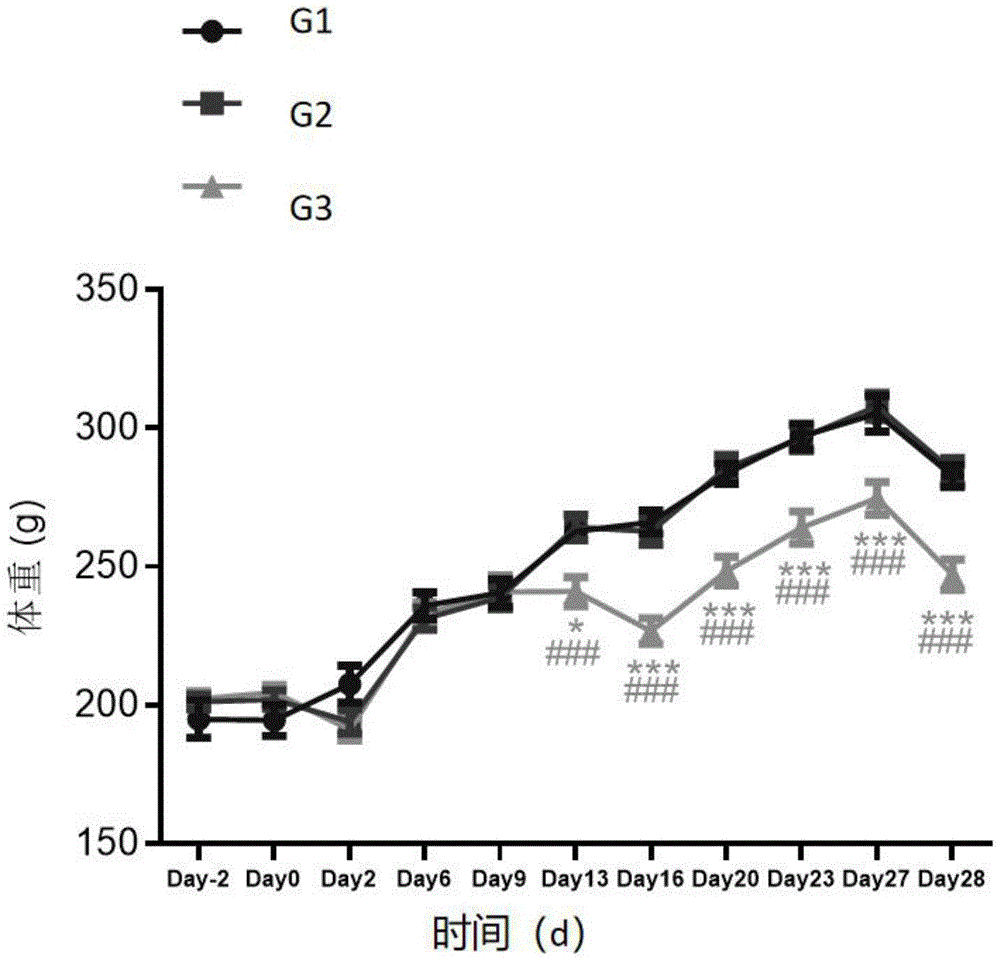
图1:G1、G2和G3组大鼠的体重变化曲线图。
其中,Two-way ANOVA:*P<0.05,***P<0.001vs.Control serum(G1);###P<0.001vs.Fx1A Serum(5mL/kg)(G2)。
图2:G1、G2和G3组大鼠的24h尿白蛋白含量变化曲线图。
其中,Two-way ANOVA:*P<0.01,***P<0.001vs.Control serum(G1);###P<0.001vs.Fx1A Serum(5mL/kg)(G2)。
图3:G1、G2和G3组大鼠的24h尿总蛋白含量变化曲线图。
其中,Two-way ANOVA:*P<0.01,***P<0.001vs.Control serum(G1);###P<0.001vs.Fx1A Serum(5mL/kg)(G2)。
图4:G1、G2和G3组大鼠的24h尿白蛋白肌酐比含量变化曲线图。
其中,Two-way ANOVA:***P<0.001vs.Control serum(G1);###P<0.001vs.Fx1ASerum(5mL/kg)(G2)。
图5:G1、G2和G3组大鼠的肾脏PAS染色示意图。
图6:G1、G2和G3组大鼠的肾小球PAS染色阳性面积占比柱状图。
其中,One-way ANOVA:*p<0.05vs.Control serum(G1)。
图7:G1、G2和G3组大鼠的肾小球C3d免疫组化染色图。
图8:G1、G2和G3组大鼠的肾小球C3d免疫组化染色强度评分柱状图。
其中,One-way ANOVA:***P<0.001vs.Control serum(G1);##P<0.01vs.Fx1ASerum(5mL/kg)(G2)。
具体实施方式
下面将结合具体实施例对本发明的实施方案进行详细描述,下列实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。
一、大鼠购买及饲养
购买的大鼠信息如表1所示。
表1大鼠信息
二、大鼠的饲养
大鼠购买后,兽医对大鼠进行体检,然后对大鼠进行实验前期的检疫和适应。实验前期是从大鼠到达日开始至模型诱导开始的当日,实验前期至少为3天。
饲养时,将大鼠饲养于屏障系统中,动物房的环境条件控制为20-26℃,湿度40-70%,饲养人员每天上午和下午各记录一次,动物房内每小时空气更换10-20次,动物房内的照明按照12/12小时明暗循环交替进行,实验活动中必须进行的中断除外,但需对中断进行记录。入组实验后,大鼠进行合笼饲养,每笼3-4只,动物笼具采用聚砜材质的塑料笼具,带有玉米芯垫料,动物笼具中设有供大鼠啃咬或遮蔽的玩具,为动物提供丰富的生活环境。笼具内设有笼卡,笼卡上记载有试验号、组别、性别、动物名称和数量,大鼠按照组别依次排列。
由北京科奥协力饲料有限公司的饲料对大鼠进行正常饲料喂养,动物自由采食。添加任何额外的实物都需经过专题负责人的许可并记录。由自动饮水装置提供二级反渗透水为大鼠供水。
三、主要仪器和试剂
试验过程中用到的仪器和试剂如表2和表3所示。
表2主要仪器
表3主要试剂
实施例1大鼠分组及模型建立
大鼠经过检疫期后,将大鼠分为三组。分组前,首先对大鼠进行尿液生化指标测试,计算白蛋白/肌酐的值,并对大鼠进行称重;确保各组间,任意两组大鼠的白蛋白/肌酐的值以及体重,统计学t-test,p>0.05,即确保分组后,各组间大鼠的体重差异最小,白蛋白/肌酐的值差异也最小。
分别为:
G1组:记为control serum,n=3;
G2组:记为Fx1A Serum(5mL/kg),n=7,对G2组大鼠通过尾静脉注射Sheep Anti-Rat Fx1A Serum建立PHN模型,以注射当天为Day0计,G2组大鼠在Day0静脉注射抗血清;注射时,大鼠为趴卧位,以酒精擦拭鼠尾,使血管清晰,在远心端1/3处进针,观察回血确认针头进入血管,在1min内注射完毕。
G3组:记为Fx1A Serum(5mL/kg*2),n=7,对G3组大鼠通过尾静脉注射SheepAnti-Rat Fx1A Serum建立PHN模型,以注射当天为Day0计,G3组大鼠分别在Day0和Day1静脉注射抗血清。注射时,大鼠为趴卧位,以酒精擦拭鼠尾,使血管清晰,在远心端1/3处进针,观察回血确认针头进入血管,在1min内注射完毕;其中在0-1min注射第一针,在24h后的0-1min注射第二针。间隔24h注射是因为在尾静脉注射首针Sheep Anti-Rat Fx1ASerum后,动物会出现精神萎靡、行动迟缓的症状,在注射1h左右后恢复,为了减少注射SheepAnti-RatFx1A Serum对大鼠造成的不良反应对检测结果造成影响,所以间隔24h后再进行第二针注射。
实施例2模型指标检测
2.1体重
对G1组大鼠,自试验开始当日起,每周测定2次体重。
对G2组和G3组大鼠,自注射首针Sheep Anti-Rat Fx1A Serum的当天开始,每周测定2次体重。
2.2尿液生化指标检测
以注射当天为Day0计,对G1组、G2组和G3组大鼠,分别在Day2、Day7、Day14和Day28,进行尿液生化指标检测。
检测指标有:白蛋白、总蛋白和白蛋白肌酐比。
2.3大鼠肾脏病理组织检测
试验动物经异氟烷深度麻醉后,安乐死动物,动物进行在体生理盐水灌流;肾脏固定于10%福尔马林中,石蜡包埋,切成片厚3μm切片,PAS(Periodic Acid-Schiff,高碘酸—希夫)染色、或使用C3d抗体进行免疫组织化学染色,染色的切片经Hamamatsu NanozoomerS210切片扫描仪进行全片扫描。
实施例3试验检测结果
如图1所示,给出了各组大鼠的体重变化曲线图,可看出,G2组经Fx1A Serum单次注射的大鼠和G1组Control serum的大鼠体重增长相近,G3组经Fx1A Serum两次注射的大鼠体重增长速度更慢,且在Day13之后体重显著低于G1组和G2组。
如图2、3和4所示,分别给出了各组大鼠的尿液白蛋白、尿液总蛋白、以及尿液白蛋白肌酐的变化曲线图。可看出,上述三项检测指标均具有相同的变化趋势,即:G2组大鼠的三项检测数值在Day7日略微升高,在Day14日达到顶峰,在Day28日略有回落;而G3组大鼠的上述三项检测数值的水平始终高于G2组大鼠,且在检测期间,三项检测数值水平始终处于增长状态,无明显回落,且高数值水平维持的时间更长,说明G3组大鼠的模型可维持时间更长;同时,G1组大鼠的三项检测数值始终处于较低水平。
如图5所示,给出了各组大鼠的肾脏PAS染色示例图,着色阴影区越多,说明肾小球系膜增厚越显著。可见,进行两次尾静脉注射的G3组大鼠的肾小球系膜增厚严重,肾炎症状更明显。
如图6所示,给出了各组大鼠的肾小球PAS染色阳性面积占比变化,可看出,G2组大鼠的肾小球染色阳性面积高于G1组,但无统计学差异,而G3组大鼠的肾小球染色阳性面积显著高于G2组。
如图7所示,给出了各组大鼠的肾小球C3d免疫组化染色图,着色表示染色阳性,着色越多、颜色越深,说明C3d表达越多,可看出,G3组大鼠的肾小球C3d免疫组化染色阳性最显著。
如图8所示,给出了各组大鼠的肾小球C3d免疫组化染色强度评分,可看出,G2组大鼠的肾小球C3d免疫组化染色强度评分高于G1组大鼠,但无统计学差异;而G3组大鼠的肾小球C3d免疫组化染色强度评分分别显著高于G1组大鼠和G2组大鼠。
本发明在一次性尾静脉注射抗血清的基础上,在24h后再进行一次尾静脉注射抗血清,成功建立了大鼠PHN模型,模型动物表现出大量蛋白尿为特征的肾病综合征,病理表现为肾小球肾小球基底膜弥漫性增厚,肾小球基底膜外侧免疫复合物沉积和足突融合。本模型可用于动态观察模型动物的肾损害、PHN的发病机制及人类膜性肾病的药物治疗方面的研究。
以上所述仅为本发明的较佳实施例,并不用于限制发明,凡在本发明的设计构思之内所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
