一种基于RPA检测肠炎沙门氏菌的侧流层析试剂盒
文献发布时间:2024-04-18 19:59:31
技术领域
本发明属于食品微生物检测技术领域,具体涉及一种等温扩增法快速检测沙门氏菌的试纸。
背景技术
沙门氏菌是造成食物中毒的主要原因之一,且沙门氏菌感染渠道众多,可通过食物和粪便传播,造成人畜共患病。沙门氏菌产生的内毒素和肠毒素,可以引发多种疾病,如伤寒、胃肠炎等,还会伴随呕吐腹泻、发热畏寒、腹绞痛等症状,严重者甚至会引发脱水导致死亡。特别是在一些经济不发达地区,感染沙门氏菌后由于医疗条件差会造成严重后果。因此,需要对食物和水进行沙门氏菌检测来确保食品安全问题。
传统的检测方法为生物培养法,此方法主要分为4个不同阶段,全程需要4-7天。这种方法虽然比较成熟,但周期长,同时在增菌过程中会受许多不确定性因素影响,灵敏性差。抗原-抗体法检测沙门氏菌大大提高了检测的灵敏度,但这些方法往往检测限比较高,而且费时费力。基于荧光检测技术的rRNA检测法、聚合酶链式反应法、环介导等温扩增法等核酸检测方法简化了操作步骤,但这些方法对设备要求高,需要受过专业培训的操作人员。
重组聚合酶扩增 (Recom binase Polymerase Amplification, RPA)技术是由英国公司TwistDxInc开发的一种可以替代传统PCR的新型核酸检测技术。其可在25-43℃的恒温下实现特定核酸序列的扩增,并在5-20min内观察结果。而且,RPA技术设备要求低,扩增过程不仅可采用传统的反应管,还可在纸片等反应载体上进行。RPA作为一种操作简便、反应快速、灵敏度高、特异性强、无需精密仪器的检测技术,是目前最有潜力成为快速分子诊断的工具,其在疾病诊断、食品安全检测、转基因作物检测、病原学检测及防疫现场检测等多个领域中都具有良好的应用前景,而且RPA技术对实验设备的要求非常低,使得该技术在经济条件差,资源不足的区域具有广阔的应用前景。RPA技术在病原学检测领域的研究已经逐渐成为热门。然而,适用于PCR方法的引物还不适用于RPA,目前没有专门的软件或网站用于RPA引物的设计,也没有明确的数据显示引物中哪些序列会影响扩增效率,只能通过设计多个候选引物进行筛选,通过实验者摸索和实验验证确定适合RPA检测的引物和探针。
发明内容
针对现有技术中的问题,本发明提供一种基于RPA的检测肠炎沙门氏菌的侧流层析试剂盒,包括用于RPA的上、下游引物和探针,探针通过巯基与金纳米连接并结合在测流层析试纸条的释放垫上,在整个检测过程中不需要使用大型实验设备和分析仪器,检测准确度高、特异性好。
为实现上述目的,本发明采用如下技术方案。
一种用于RPA检测肠炎沙门氏菌的引物探针组,包括核苷酸序列如SEQ ID NO:1-4所示的上、下游引物,报告探针和捕获探针;
其中,上游引物的5’端修饰生物素;
报告探针的3’端依次修饰C6-Spacer和巯基;
捕获探针的3’端修饰TEG-biotin。
一种基于RPA检测肠炎沙门氏菌的侧流层析试剂盒,包括上述引物探针组、侧流层析试纸条;所述侧流层析试纸条上包被连接金纳米的报告探针和偶联链霉亲和素的捕获探针,所述报告探针通过巯基与金纳米连接。
所述连接金纳米的报告探针(AuNP-DNA)的制备方法如下:通过柠檬酸还原方法合成金纳米;然后将合成的报告探针与金纳米共孵育进行偶联。
所述偶联链霉亲和素的捕获探针的制备方法如下:将捕获探针和链霉亲和素共孵育。
所述侧流层析试纸条上包括:
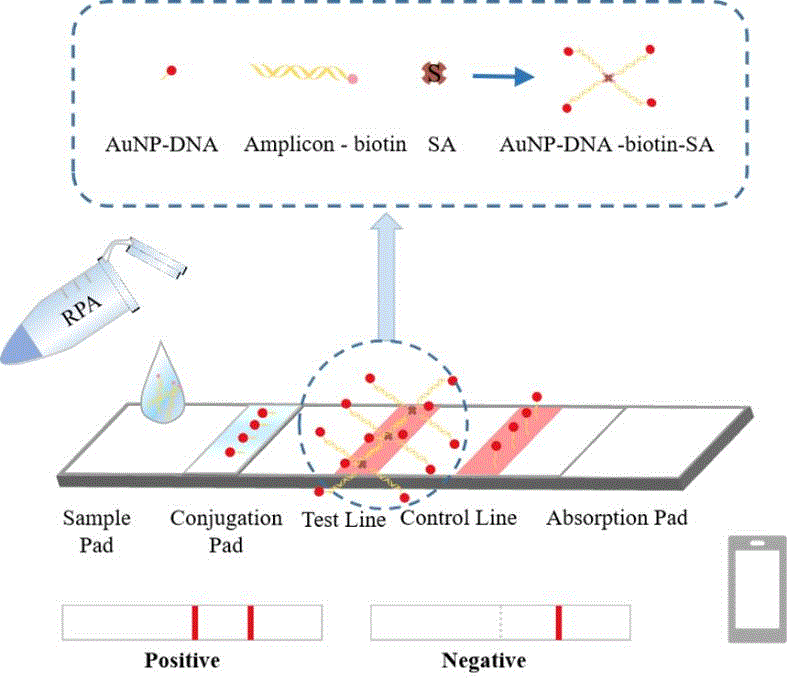
背板和在背板上依次粘贴的样品垫、结合物释放垫、硝化纤维素膜(NC膜)和吸收垫;所述结合物释放垫包被连接金纳米的报告探针(AuNP-DNA);所述硝化纤维素膜(NC膜)上包括检测线(T线)和质控线(C线);T线和C线分别释放链霉亲和素和偶联链霉亲和素的捕获探针。
所述试剂盒还包括RPA反应试剂,如,冻干酶试剂、再水化缓冲液、醋酸镁溶液。
一种检测食品和环境中肠炎沙门氏菌的方法,包括以下步骤:
(1)提取待测样品基因组DNA;
(2)以步骤(1)得到的基因组DNA为模板,以上述RPA检测肠炎沙门氏菌的引物进行RPA反应获得扩增产物;
(3)以扩增产物为待测液以上述试剂盒进行侧流层析;
(4)获取测流层析结果图片,通过目视定性检测或将结果图片以ImageJ软件分析侧流试纸条检测线处的灰度值对样品中的目标物进行定量。
本发明的检测流程和原理如图1所示:在结合物释放垫上,位于扩增子上端的DNA探针与AuNP-DNA进行碱基互补配对。当携带AuNP的扩增子经过T线时,生物素标记的扩增子尾部被T线上的链霉亲和素捕获,这是由于链霉亲和素和生物素之间具有强大的亲和力。逐渐地,AuNP沿着T线积累,形成一个肉眼可见的红色条带。剩余的AuNP在C线被捕获探针捕获。如果T线和C线都出现红色条带,则表示信号为阳性,如果只有C线出现红色带,则认为信号为阴性。通过图像采集终端和相应软件,可以将侧流层析试纸条的视觉信号转换为相应的灰度值,通过灰度值分析软件可以精确定量,方便远程和现场定量分析。
本发明具有以下优点:
金纳米颗粒作为侧流试纸中常用的信号分子,通常只能通过比色法检测目标物的有无,并不能实现目标物的定量检测。本发明通过探针设计和ImageJ软件的应用,使金纳米颗粒可以在侧流试纸中实现定量检测,实验室条件下,测定到牛奶样品中肠炎沙门氏菌(血清型)的LOD为19.41CFU/mL。在整个检测过程中没有使用任何大型实验设备和分析仪器,且该试纸条保质期长,而且储存时不需要制冷,非常适用于医疗条件简陋地区、小型流动医疗机构使用。此外,在侧流试纸制备过程中不使用抗体,有效降低了试纸成本。
附图说明
图1为试剂盒原理图;
图2为RPA条件优化图;
图3为灰度值与目标物浓度的拟合图;
图4为侧流试纸的特异性检测结果和琼脂糖凝胶电泳验证。
具体实施方式
下面结合实施例和附图对本发明做进一步说明,但本发明不受下述实施例的限制。
实施例1 RPA检测肠炎沙门氏菌引物的筛选
将培养的肠炎沙门氏菌稀释后提取DNA,对提取的DNA采用TwistAmp Basic试剂盒进行重组酶聚合酶扩增:在含有冻干酶的反应管中加入1×再水合缓冲液29.5μL,500nM沙门氏菌特异性引物2.4μL,模板DNA2μL和水11.2μL。短暂振荡后加入280mM醋酸镁溶液2.5μL,充分混合。快速将试管置于37℃恒温器中孵育20分钟。
按照表1中的引物对合成引物:
表1 RPA检测检测肠炎沙门氏菌的引物对
将扩增产物进行1%琼脂糖电泳,筛选合适引物,结果如图2B所示:引物2、4、5的扩增效果较1、3更为明显;引物2、3和4在扩增过程中产生了150-200bp的额外条带,说明产生了非特异性扩增。综上所述,引物5具有较高的特异性和扩增效率,具有最佳的扩增效果。
将肠炎沙门氏菌、单核增生李斯特菌、大肠杆菌O157:H7、金黄色葡萄球菌和产气肠杆菌DNA作为模板进行扩增,验证扩增的特异性,结果如图2A所示,仅1的扩增效果明显,2、3、4、5没有发生扩增,扩增具有特异性。
以引物对5为引物对,分别在33℃、35℃、37℃、39℃和41℃进行扩增,筛选最优的RPA反应温度,结果如图2C所示:在35℃-39℃范围内RPA反应较有效,最佳反应温度为37℃。
以引物对5为引物对,在37℃分别扩增5分钟、10分钟、15分钟、20分钟、25分钟以筛选优化反应时间,结果如图2D所示:扩增产物的浓度随时间增大,在25分钟时达到饱和;与25分钟相比,20分钟时的扩增效果没有明显的差异,并且提供了节省时间和成本的机会。因此,确定20分钟为最佳反应时间。
实施例2 基于RPA检测肠炎沙门氏菌的试剂盒的制备
1. 金纳米报告探针(AuNP-DNA)的制备
通过柠檬酸还原方法合成AuNPs:在250mL三颈烧瓶中加入300μL 1% (w/v)的HAuCl
合成报告探针:CGAACGTATCACCGCGATTTTTTTTTTTTTTTTT-C6-thiol;按照探针和AuNPs的摩尔比为1.5:1混合,然后将溶液在室温下震荡96h;将得到的溶液在5000rmp下离心20min,去除上清液,获得AuNP-DNA。
2. 侧流层析试纸条制备
合成捕获探针:ATCGCGGTGATACGTTCGTTTTTTTTTTT TTTTT-TEG-biotin。为了便于其固定在硝化纤维素膜(NC膜)上,使用链霉亲和素与捕获探针反应形成偶联物:将60µL 1mM捕获探针和140µL PBS加入300µL 1.67 mg/mL链霉亲和素溶液中,在室温下孵育1h。用离心过滤器(6000r/min)离心20 min,去除多余的DNA探针,然后在同一离心过滤器中分别用1mL PBS洗涤离心三次;最后,沉淀中加入500µL的PBS得到捕获探针的溶液。
在NC膜的T线和C线分别释放0.025mg/cm链霉亲和素和0.025mg/cm上述偶联链霉亲和素的捕获探针。将合成的AuNP-DNA探针释放到结合物释放垫上,并在22℃下干燥一夜。将侧流试纸的所有组件都组装在一个附胶的聚氯乙烯材质背板上,其上依次贴附样品垫、结合物释放垫、硝化纤维素膜和吸收垫,将制备好的试纸条在37℃下干燥一夜,于4℃避光保存备用。
3. 组装检测肠炎沙门氏菌的试剂盒
根据实施例1中引物对5合成上下游引物;
购买TwistAmp Basic试剂盒;
上述材料与侧流层析试纸条组合后获得基于RPA检测肠炎沙门氏菌的试剂盒。
实施例3 试剂盒的检测限
按照实施例1的方法提取肠炎沙门氏菌DNA,并稀释为1 × 10
结果如图3A所示,T线红色条带颜色随着DNA浓度的增加而增强。一旦DNA浓度达到10
选取10
实施例4 试剂盒的实用性
为了验证该方法的实用性,将培养的肠炎沙门氏菌样品通过连续稀释引入牛奶样品中。对牛奶样品进行检测,按照实施例3中的方法进行。该方法在4℃时的目视检出限为2.0×10
实施例5 试剂盒的特异性
将培养的肠炎沙门氏菌、单核增生李斯特菌、大肠杆菌O157:H7、金黄色葡萄球菌和产气肠杆菌样品通过连续稀释引入牛奶样品中,再从牛奶中提取各病原的DNA,对提取的DNA采用实施例2中制备的试剂盒先进行重组酶聚合酶扩增:在含有冻干酶的反应管中加入1×再水合缓冲液,沙门氏菌特异性引物500nM,模板DNA和水共13.2μL。用超纯水调节反应体积至47.5μL。短暂振荡后加入280mM醋酸镁溶液,充分混合。快速将试管置于37℃恒温器中孵育20分钟;产物分别进行琼脂糖凝胶电泳和测流层析:在0.01M PBS缓冲液(pH7.4)中添加以下成分配制成运行缓冲液:3%BSA,5%蔗糖,1% Tween-20,1%氯化钠。将90μL的运行缓冲液和10μL的RPA产物组成的混合物释放到样品垫上。用智能手机采集试纸条T线的图像信息。
结果如图4所示:电泳图只有肠炎沙门氏菌表现出特定的条带。相应地,测流层析表明只有肠炎沙门氏菌显示阳性信号,其他四种病原体显示阴性结果。这说明,本发明的试剂盒的特异性良好。
