细胞移植物的方法和组成
文献发布时间:2023-06-19 12:16:29
交叉引用相关应用
本申请要求获得美国临时申请的利益。于2018年8月2日提交的第62/713,732文件,其中全部内容均以参考方式纳入。
技术领域
本发明涉及将目标细胞移植到需要的主体中的组合物和方法。这些方法通常包括通过将脱细胞膜附加到被试内脏器官或组织的表面,从而在内脏器官或组织的表面和膜之间创造一个密封的空间,并将支持细胞和靶细胞的混合物植入密封的移植空间。
背景技术
现有细胞植入技术的重点是,例如,用人羊膜上皮细胞(hAECs)诱导胰岛素产生细胞,或者只使用未经处理的羊膜进行生物载体应用。使用目前的标准程序,当胰岛通过门静脉注入胰岛移植时,超过50%的人胰岛移植在3天内丢失,至少部分原因是瞬间血液介导的炎症反应(IBMIR)。将胰岛放置在血流之外可以避免IBMIR导致的胰岛细胞丢失。然而,没有理想的胰岛细胞移植位点,尽管努力积极寻找替代位点,如骨髓、网膜、胃粘膜下层和/或皮下位点。
在临床上,肝脏一直是胰岛移植的首选部位。近年来,越来越多的人认识到,门静脉内输注分离的胰岛细胞可能不能为胰岛提供理想的微环境,因为各种因素导致胰岛质量在输注后早期丢失。胰岛输注后的几小时和几天内发生的关键事件影响着移植的成功。最值得注意的是,在胰岛输注过程中,当胰岛暴露于血液中时,会产生IBMIR,包括凝血级联补体激活。这些炎症过程是由内分泌细胞分泌的组织因子触发的,从而导致凝血酶的产生。凝血酶激活的血小板与胰岛表面结合,然后涉及因子XI和激活的血小板的正向回路在胰岛周围产生纤维蛋白包裹。门静脉内胰岛输注也与肝窦内胰岛包封引起的血栓形成和肝组织缺血有关,导致窦内皮细胞活化和功能损害。最后,IBMIR最终通过浸润白细胞破坏胰岛形态。多形核细胞(PMNs)是浸润胰岛的主要细胞类型,受缺血诱导分子的上调和释放所吸引,即组织因子、IL-1β、肿瘤坏死因子α(TNF-alpha)、一氧化氮、高迁移率族蛋白1(HMGB1);以及由胰岛释放的促炎信号,即单核细胞趋化蛋白(MCP-1)、IL-8、IL-6。活化后,PMNs分泌活性氧,导致胰岛的快速且直接的损伤。
目前解决植入不良的方法包括通过生物和/或生物工程方法应用抗炎剂和/或抗凋亡剂。在生物方法中,该解决方案依赖于使用抗炎/抗凝剂或增加移植胰岛的数量。
有必要提高细胞移植的效率,以恢复或增加正常功能,如通过分泌胰岛素产生糖耐量。
发明内容
本发明涉及将目标细胞移植到需要的主体中的方法。这些方法通常包括通过将脱细胞膜附加到被试内的内脏器官或组织的表面,从而在内脏器官或组织的表面和膜之间创建一个密封的空间,并将支持细胞和靶细胞的混合物植入密封的移植空间。
本发明还涉及包括完整内脏器官外表面、脱细胞膜和至少一种支持细胞和至少一种目标细胞组成群体的组合物。该组合物配置为包括在脱细胞膜和完整内脏器官的外表面之间形成的密封空间,细胞的混合物在密封空间中的分配。
附图说明
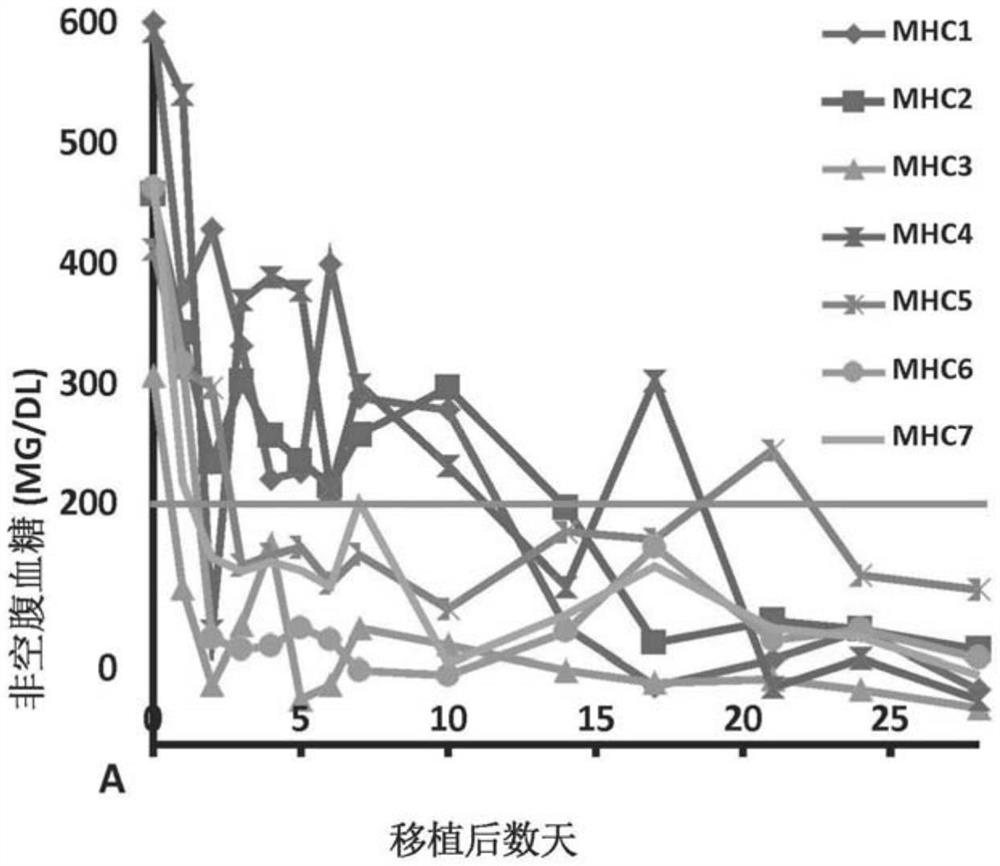
图1A和1B显示了七只化学诱导糖尿病小鼠的非空腹血糖水平(图1A)和体重(图IB),本发明的方法是在此基础上进行的。
图2A-2C显示了手术过程的图像(图2A)和组织学检查图像,4倍放大(图2B)和20倍放大(图2C),这证实了在最初手术后28天后,移植部位存在人胰岛(HI)细胞。
图3A-3D显示了组织学检查图像,显示了28天收获的羊膜的血管生成,包括没有嵌入在小鼠腹壁部位的hAECs(图3A和3B),和嵌入在小鼠腹壁部位的hAECs(图3C和3D)。图3A和3C是l0倍放大的图像,图3B和3D是20倍放大的图像。HAM:脱细胞人羊膜;BV:血管;HAEC:人羊膜上皮细胞。
具体实施方式
本发明涉及将目标细胞移植到需要的主体中的方法。这些方法通常包括通过将脱细胞膜附加到被试内脏器官或组织的表面,从而在内脏器官或组织的表面和膜之间创造一个密封的空间,并将支持细胞和靶细胞的混合物植入密封的移植空间。
这里交替使用“主体”和“病人”。在一些实施例中,执行本发明方法的主体是哺乳动物。在某些实施例中,实施本发明方法的主体是狗、猫、老鼠、老鼠、牛、马、猪或人类或非人类灵长类动物。
这里描述的方法依赖于脱细胞膜。在此使用的术语是“脱细胞膜,,是一种组织或其部分,已经历脱细胞过程,使通常存在于组织中的驻留细胞或其部分被移除、破坏和/或使代谢不活跃。由此产生的组织或其部分包含细胞外基质(ECM),其中完整性或生物活性几乎或根本没有丧失。组织脱细胞的方法在本领域技术中是众所周知的,本发明的方法不一定依赖于对组织或其部分进行脱细胞的特定方法。例如,在Crapo,P.,等人,Biomaterials,32(12):3233-3243(2011)中披露了脱细胞方法,该方法在这里全文参考。
在一个实施例中,脱细胞膜是脱细胞的羊膜。在另一实施例中,脱细胞膜为脱细胞膀胱组织。在另一实施例中,脱细胞膜是脱细胞的小肠组织。在另一实施例中,脱细胞膜为脱细胞系膜。在另一实施例中,脱细胞膜为脱细胞心包。
脱细胞膜可以是异种移植、同种异体移植或自体移植。这些术语在该领域中是众所周知的。自体移植物是一种组织的移植物,其中同一个体既是组织的供体,也是组织的接受者。在一些实施例中,包括为脱细胞膜使用自体移植,主体可以提供经受脱细胞过程的组织,并在本发明方法的性能下随后接收脱细胞膜。自体移植的脱细胞膜可以在本发明方法实施之前的任何一段时间内储存。或者,自体移植物可以从供体中获得,并经过脱细胞程序以产生脱细胞膜,然后脱细胞膜可以附着在受体的器官或组织上,而不需要将脱细胞膜储存一段时间。
同种异体移植是指组织的供体和接受者来自同一物种,但不一定是同一个体的组织移植物。在包括对脱细胞膜使用同种异体移植的一些实施例中,供体可以在本发明方法实施之前的任何时间提供脱细胞过程的组织。同种异体脱细胞膜可在本发明方法实施之前储存任何一段时间。或者,同种异体移植可以从供体中获得,并经过脱细胞程序以产生脱细胞膜,然后脱细胞膜可以附着在受体的器官或组织上,而不需要将脱细胞膜储存一段时间。
异种移植是指组织的供体和受体不来自同一物种的组织移植物。在包括对脱细胞膜使用异种移植的一些实施例中,供体可以在本发明方法实施之前的任何时间提供脱细胞过程的组织。异种移植的脱细胞膜可以在本发明方法实施之前储存任何一段时间。或者,异种移植可以从供体中获得,并经过脱细胞程序以产生脱细胞膜,然后脱细胞膜可以附着在受体的器官或组织上,而不需要将脱细胞膜储存一段时间。在包括使用异种移植的选择实施例中,脱细胞膜的供体是非人类哺乳动物,脱细胞膜的受体(主体)是人类。在包括使用异种移植的某些实施例中,脱细胞膜的供体是猪或非人类灵长类动物,脱细胞膜的受体(主体)是人类。
在执行本发明的方法时,脱细胞膜可以附着在内脏器官或组织的表面。脱细胞膜可以通过任何创造密封空间的方法附着在器官或组织上。在一些实施例中,脱细胞膜可以附着在内脏器官或组织的表面,包括将膜放置在器官或组织表面,并允许膜与器官或组织表面形成非特异性的结合来创建密封。在一些实施例中,脱细胞膜可以附着在内脏器官或组织的表面,包括使用组织胶或粘合剂,方法是用胶水或粘合剂涂覆膜的外缘,并将涂覆膜放置在器官或组织表面,并允许膜与器官或组织表面结合以创建密封。在替代实施例中,脱细胞膜可以放置在器官或组织表面,胶水或粘合剂可以应用于脱细胞膜的外缘与器官或组织的交界处,以允许膜与器官或组织表面结合以形成密封。在一些实施例中,脱细胞膜可以附着在内脏器官或组织的表面上,包括通过将膜的外缘缝合到器官或组织表面,并允许膜与器官或组织表面结合以创建密封来使用缝合。
如本文所用,内脏器官一词是指身体的内部器官,通常包含在受试者的胸部或腹部。内脏器官的例子包括但不限于心脏,肺,胃,小肠,大肠,肝脏,胰腺,肾脏,甲状腺,肾上腺,胆囊,脾脏,膀胱,卵巢和子宫。不一定被认为是器官的内脏组织的例子包括但不限于大血管,但不限于主动脉;内脏肌肉,但限于膈肌;腹膜;心包;内脏脂肪垫;外胸膜;内胸膜。
脱细胞膜以本文所述的方式附着在内脏器官或组织表面。这里使用的术语“表面”,当与内脏器官或组织一起使用时,用于表示器官或组织的外部部分,因此切割器官或组织通常不需要植入脱细胞膜。一般来说,本发明的方法可以通过检查内脏器官或组织来定位器官或组织的相对平坦的表面或区域,使脱细胞膜不会塌陷或包裹在器官或组织的表面。当脱细胞膜被放置在器官或组织的外表面时,以防止膜绕在周围或塌陷到器官表面,可以在器官或组织的外表面创造一个密封的空间。
在执行本发明的方法时创建的密封空间不需要很大,但该空间必须能够容纳细胞的植入或注射,通常分散在液体中,进入空间。空间必须密封,使细胞通常分散在液体中,包含在空间或袋中。然而,密封的空间不需要密封或不受液体的影响,只要植入的细胞在初始植入后保持在空间内。
一旦密封空间被创建,细胞的混合物就可以植入到空间中。本发明方法的细胞混合物可能需要至少两个不同的细胞群体。混合物中的一个细胞群可以包括一个支持细胞群。这里使用的术语“支持细胞,,用于表示具有支持目标细胞生长和/或数量增加的一个或多个特性的细胞群体。支持细胞的特性包括但不限于具有至少一种先天抗炎或先天免疫抑制特性的细胞。支持细胞的其他特性包括但不限于具有至少一种促血管生成或分化特性的细胞。如本文所使用的,支持细胞的支持特性可以通过任何手段来实现,例如细胞产生和分泌抗炎因子(或抑制促炎细胞的激活)、血管生成因子等。支持细胞能够完成其支持功能的其他手段包括具有或显示某些吸引或结合其他细胞类型的细胞表面标记物,如抗炎细胞,包括但不限于抗炎淋巴细胞。支持细胞提供支持功能的其他手段包括但不限于具有干细胞样的特性,但不限于增殖、分化等。
在一些实施例中,支持细胞包括羊膜上皮细胞(AECs)。在一些实施例中,支持细胞包括间充质干细胞、诱导多能干细胞、胚胎干细胞、脂肪干细胞或其他成人干细胞,包括但不限于上皮干细胞或其混合物。支持细胞可以从与目标细胞相同的个体中收获,也可以从与目标细胞相同的物种中收获支持细胞。在其他实施例中,支持细胞可能不是来自与目标细胞相同的物种。支持细胞可能来自哺乳动物。在某些实施例中,支持细胞可以来自狗、猫、老鼠、老鼠、牛、马、猪或人类或非人类灵长类动物。具体实施例中,所述支撑细胞可以从与所述方法被执行的主体相同的物种中收获,包括但不限于同一个体。在某些实施例中,支撑细胞包括人类AEC,并且正在实施这些方法的主体是人类。
混合物中的第二个细胞群可以包括目标细胞群。靶细胞可能是任何类型的细胞,可以为受试者提供治疗益处。一般来说,靶细胞可能是为了恢复组织或器官的功能或增强功能。例如,靶细胞可能是β胰岛细胞的群体,心肌细胞的群体,肠上皮细胞的群体,肝细胞的群体,肾小球细胞的群体,肺细胞的群体,或腺泡细胞的群体。
靶细胞的数量可能与支持细胞的数量混合。在一些实施例中,支持细胞的群体可以包括AEC,目标细胞的群体可以包括β胰岛细胞。在一些实施例中,目标细胞的群体可以与至少两个不同的支持细胞群体混合。例如,两个支持细胞群体可能包括从AECs中选择的两个细胞群体,间充质干细胞,诱导多能干细胞,胚胎干细胞,脂肪干细胞和其他成人干细胞,包括但不限于上皮干细胞。在某些实施例中,两个支持细胞群体可以包括AECs群体和从由间充质干细胞,诱导多能干细胞,胚胎干细胞,脂肪干细胞和上皮干细胞组成的群体中选择的群体。
本发明的方法包括在植入密封空间之前,支持细胞可以与目标细胞混合的场景。本发明还包括目标细胞和支持细胞可以单独植入密封空间的场景,当目标细胞和支持细胞在密封空间中相互接触时,目标细胞和支持细胞的混合发生在密封空间内。在这样的实施例中,当混合发生在密封空间时,目标细胞可以植入到支持细胞之前或之后。在某些实施例中,在将目标细胞植入密封空间之前,可以将支撑细胞植入密封空间。在某些实施例中,所述支撑细胞可在所述目标细胞植入所述密封空间后植入所述密封空间。
标准细胞培养技术可用于体外培养细胞群体。支持细胞和靶细胞通常都可以使用常规的细胞培养技术进行培养,这些技术是正常的,或者是被培养的细胞类型所接受的。在一些实施例中,目标细胞和支持细胞可以是人类细胞,并且可以使用无动物成分(人类除外)技术和组合物进行培养。例如,当目标和/或支持细胞是人类细胞时,细胞可以在无血清条件下培养,或者细胞可以用人血清而不是牛血清培养。
一旦在培养过程中产生足够数量的细胞,细胞就可以使用标准技术收获,并放置在液体培养基中。细胞可以放置在适合于给定细胞类型的任何介质或缓冲液中。例如,细胞可以从其体外环境中收获,并放置在缓冲液或其他液体介质中,例如Hank,s平衡盐溶液(HBSS),就在与其他细胞混合或植入空间之前。一旦从体外环境中收获,并放置在适当的液体培养基或缓冲液中,目标细胞和支持细胞可以简单地通过组合收获的群体来混合。在替代方案中,每个细胞群体可以从其体外环境中收获,并放置在适当的液体介质或缓冲液中,并分别植入密封空间,在密封空间内发生混合。
细胞群体的植入,无论是预先混合还是不混合,都可能通过任何不永久破坏脱细胞膜与内脏器官表面之间密封的手段发生。这种植入技术包括但不限于使用注射器注入空间或使用小吸管尖端植入空间。植入细胞的方式可能是为了在植入过程中溶解或破坏尽可能少的细胞。因此,应选择注射器针头来容纳细胞进入密封空间而不溶解细胞。
支持细胞和目标细胞的细胞群在混合之前可能是每种细胞类型的同质或基本同质的群体。这些方法可以包括每个支持细胞和目标细胞的任意数量的细胞。例如,混合物中包含的支持细胞的数量可能在大约100到1000个细胞之间,大约在1x10
在一些实施例中,如果目标细胞包括β胰岛细胞,则β胰岛细胞可能旨在增加胰岛素产量低于正常水平动物的胰岛素产量,包括不产生胰岛素的动物。为此,本发明还涉及当目标细胞包括β胰岛细胞时提高受试者糖耐量的方法。在一些实施例中,可以对已被诊断为糖尿病或糖尿病前期的受试者实施提高受试者糖耐量的方法。在某些实施例中,可对已被诊断为1型糖尿病的受试者实施提高受试者糖耐量的方法。在某些实施例中,可对已被诊断为2型糖尿病的受试者实施提高受试者糖耐量的方法。
这些方法可以使用任何手术手段,包括但不限于腹腔镜手术和开放手术,只要内脏器官或组织的表面可用于放置脱细胞膜。
本发明还可涉及包括完整内脏器官外表面、无细胞膜以及至少一种支持细胞和至少一种目标细胞群体的混合物的组合物。该组合物可以被配置为包括在脱细胞膜和完整内脏器官的外表面之间形成的密封空间,细胞的混合物在密封空间中分配。
羊膜是从一个病人捐赠的胎盘中获得的,该病人在Med Star Georgetown大学医院OB/GYN科接受了剖腹产手术。从四分之一的膜中分离出人羊膜上皮细胞(hAECs),其余四分之三的膜进行膜制备。
使用先前发布的方法的修改版本分离hAECs。见Gramignoli,R.,et al.,Curr.Protoc.Stem Cell Biol.,37:lE.10.1-lE10-13(2016)(doi:10.1002/cpsc.2),发表在Wiley在线图书馆。尤其是羊膜从胎盘剥离后的乙二醇四乙酸(EGTA)冲洗。用无钙HBSS洗涤收获的膜,用0.05%胰蛋白酶在37℃水浴中消化40min。第一次消化后在4℃,200gx10min下离心收集hAECs。然后对膜进行第二次消化,重复与第一次消化相同的程序。第二次消化后离心200gx10min(4℃)回收hAECs。在最后一步,所有来自每个消化的hAECs重新混合在离心管中。
SCID(Beige)小鼠具有常染色体隐性突变SCID(Prkdcscid)和Beige(Lystbg),购自MD Charles River实验室,并用作人类胰岛受体。这项研究遵循了乔治敦大学(GU)的当地指导方针,并根据批准的IACUC协议15030在GU动物设施内进行。通过腹腔注射SCID小鼠被化学转化为糖尿病。在柠檬酸盐缓冲液中注射150mg/kg链脲佐菌素(STZ,Zanosar,GU医院)。连续两次测量非空腹血糖超过250毫克/dL的小鼠被认为是糖尿病。在从尾静脉采集的血液样本中,用Bay或血糖仪测量血糖水平。
对于每只小鼠的手术,在连续1-2%异氟醚麻醉下,在腹侧腹壁做中线切口,腹腔打开,肝脏表面暴露。一个脱细胞的人羊膜,大小为1.0x1.0厘米,贴在左叶肝脏表面的膈肌一侧(见图2A)。将2000胰岛当量(IEQ)与4.0x10
进行胰岛移植的小鼠,每天用Bay或葡萄糖监测仪测量非空腹血糖,为期两周。正常被定义为连续两天不空腹血糖小于200mg/dL。如图1A所示,所有7只STZ诱导的糖尿病小鼠移植后血糖水平均正常。此外,每个动物的体重在移植后逐渐增加(见图IB)。移植后28天经组织学检查证实胰岛移植完整(图2B)。
比较了不含hAECs的细胞和不含hAECs的细胞混合体的小鼠。图3A和3B显示在没有hAECs的羊膜组中血管生成可以忽略不计,而图3C和3D显示在hAECs的羊膜组中促进和持续的血管生成和血管形成。
上述描述只是为了清晰的理解,因此不应理解为不必要的限制,因为在本发明范围内的修改对于那些在该行业中具有普通技能的人来说可能是显而易见的。
除上下文另有要求外,在本规范和随后的声明中,“构成”一词和诸如“构成”和“构成”等变化将被理解为意味着包含一个所述的整体或步骤或一组整体或步骤,但不排除任何其他整体或步骤或一组整体或步骤。
在整个规范中,如果组合物被描述为包括组件或材料,则设想该组合物还可以基本上由或由引用的组件或材料的任何组合组成,除非另有描述。同样,如果方法被描述为包括特定步骤,则设想这些方法也可以基本上由引用的步骤的任何组合组成,或由这些步骤组成,除非另有说明。本发明以说明性方式适当披露,可在没有本发明未具体披露的任何要素或步骤的情况下实施。
本报告所披露的一种方法的做法及其个别步骤,可在电子设备提供的辅助或自动化的情况下手动和/或进行。虽然过程是参照特定的实施例来描述的,但在该行业中具有普通技能的人将很容易理解,可以使用其他方式来执行与方法相关的行为。例如,除非另有说明,可以改变各种步骤的顺序,而不偏离方法的范围或精神。此外,一些单独的步骤可以组合、省略或进一步细分为附加步骤。
本文引用的所有专利、出版物和参考资料均以参考资料充分纳入。如果本披露与合并专利、出版物和参考资料之间存在冲突,本披露应加以控制。
- 细胞移植物的方法和组成
- 由基质和血清组成的无细胞移植物
