一种蛋白质电泳用凝胶、标记物、应用、及试剂盒
文献发布时间:2023-06-19 12:22:51
技术领域
本发明属于生物工程领域,更具体地,涉及一种蛋白质电泳用凝胶、标记物、应用及试剂盒。
背景技术
蛋白质是生物体的重要组成成分,是生命活动的主要承担者。蛋白质行使生物学功能常以多聚状态,复合体状态或修饰态存在,目前对于准确鉴定蛋白质不同状态以及蛋白质的相互作用仍然具有挑战性。
目前蛋白质形态结构的研究方法,首先是将蛋白质分离,然后提取单一种类的蛋白质进行研究。而蛋白质分离过程最常用的手段是蛋白质凝胶电泳。现阶段常用的凝胶电泳技术为SDS-PAGE和Native-PAGE。
SDS是一种强阴离子型去污剂,能够与蛋白质结合,破环球状蛋白质的结构,使蛋白质的分子量与蛋白质所带电荷量相关,因此蛋白质在电泳过程中的迁移速度仅取决于蛋白质分子量大小,并可以用蛋白质Marker指示目的蛋白的分子量。由于SDS-PAGE破坏了蛋白质的天然构象,常应用于变性蛋白质的研究,因此在SDS-PAGE中几乎观测不到蛋白质的修饰态或复合体状态。
Native-PAGE是一种没有加SDS的非变性凝胶电泳,在电泳过程中,蛋白质能够保持完整状态,由于蛋白质在Native-PAGE中的迁移速率同时受分子量大小,蛋白质形状及所带电荷影响,因此Native-PAGE没有统一的蛋白质Marker定标,对分析蛋白质的分子量、多聚状态和复合体状态造成了困扰。同时,由于酸性蛋白和碱性蛋白带电量不同,给实验操作带来了不便。
发明内容
针对现有技术的以上缺陷或改进需求,本发明提供了一种蛋白质电泳用凝胶、标记物、应用、及试剂盒;本发明既不破环蛋白质的二级结构,同时能够对电泳的目的蛋白质进行定标,半定量分析,操作简单,成本低廉,解决现有技术不能在维持蛋白质弱相互作用的前提下进行蛋白质质量凝胶电泳分析的技术问题。
为实现上述目的,按照本发明的一个方面,提供了一种蛋白质电泳用凝胶,其下层分离胶为含有表面活性剂的聚丙烯酰胺凝胶,其pH值呈碱性,所述下层分离胶的表面活性剂由0.025%-0.1%的质量体积比的月桂酰肌氨酸钠构成;表面活性剂摩尔浓度与上样蛋白质质量浓度之比在0.04-11.56mmol/g之间,优选在1.16-9.90mmol/g之间。
优选地,所述蛋白质电泳用凝胶,其所述下层分离胶pH值在8.0-9.5之间。
优选地,所述蛋白质电泳用凝胶,其所述下层分离胶pH值为8.8。
优选地,所述蛋白质电泳用凝胶,其上层浓缩胶为含有表面活性剂的聚丙烯酰胺凝胶,其pH值成弱酸性,优选含有质量体积分数在3.5-5%的聚丙烯酰胺,所述上层浓缩胶的表面活性剂由0.025~0.1%的质量体积比的月桂酰肌氨酸钠构成。
优选地,所述蛋白质电泳用凝胶,其所述上层分离胶pH值在6.0-7.0之间。
优选地,所述蛋白质电泳用凝胶,其所述上层分离胶pH值为6.8。
按照本发明的另一个方面,提供了一种蛋白质电泳用缓冲液,其含有表面活性剂,所述表面活性剂由0.025~0.1%的质量体积比的月桂酰肌氨酸钠构成,所述表面活性剂浓度与上样蛋白质的浓度存在如下关系:
表面活性剂摩尔浓度与上样蛋白质质量浓度之比在0.04-11.56mmol/g之间。
优选地,所述蛋白质电泳用缓冲液,其为上样缓冲液、电泳缓冲液、或用于溶解蛋白质标记物的缓冲液。
优选地,所述蛋白质电泳用缓冲液,其为上样缓冲液,上样蛋白质的质量浓度不超过40.32mg/mL。
优选地,所述蛋白质电泳用缓冲液,其上样蛋白质的质量浓度为0.59-2.94mg/mL。
按照本发明的另一个方面,提供了一种蛋白质电泳标记物,其包括4-20种稳定单体蛋白质,分子量分布范围5kDa-100 MDa,蛋白总浓度在0.005mmol/L-0.5mmol/L之间;所述稳定单体蛋白质,即用作标记物的蛋白质自身或多种用作标记物的蛋白质之间不形成聚合态;其溶解缓冲液中含有与上层浓缩胶相同浓度的月桂酰肌氨酸钠。
优选地,所述蛋白质电泳标记物,其包括10种稳定单体蛋白质。
按照本发明的另一个方面,提供了所述蛋白质电泳用凝胶的应用,其应用于分离并确定蛋白质的多聚状态、观测蛋白质修饰状态、观测蛋白质复合物、蛋白质纯度分析、蛋白质分子量测定、Western Blotting实验蛋白质鉴定、检测细胞内和细胞外膜蛋白的聚集态、或SDS-PAGE二维电泳分离的蛋白质复合物的鉴定。
优选地,所述蛋白质电泳用凝胶的应用,其应用于分离并确定蛋白质的多聚状态、观测蛋白质复合物、蛋白质纯度分析或蛋白质分子量测定、或检测细胞内和细胞外膜蛋白的聚集态,表面活性剂的摩尔浓度与上样蛋白质的质量浓度之比在0.04-11.56mmol/g之间。
优选地,所述蛋白质电泳用凝胶的应用,其应用于观测蛋白质修饰状态,所述下层分离胶的表面活性剂摩尔浓度与上样蛋白质质量浓度之比在0.17-2.31mmol/g之间。
优选地,所述蛋白质电泳用凝胶的应用,其应用于Western Blotting实验蛋白质鉴定、SDS-PAGE二维电泳分离的蛋白质复合物的鉴定,所述下层分离胶的表面活性剂摩尔浓度与上样蛋白质质量浓度之比在0.04-5.31mmol/g之间。
按照本发明的另一个方面,提供了一种蛋白质凝胶电泳试剂盒,其包括本发明提供的蛋白质电泳用凝胶上层浓缩胶母液和下层分离胶母液。
优选地,所述的蛋白质凝胶电泳试剂盒,其包括本发明提供的蛋白质电泳标记物。
优选地,所述的蛋白质凝胶电泳试剂盒,其所述上层浓缩胶母液包括:配方浓度的含有SAR和丙烯酰胺的缓冲液;所述下层分离胶母液包括:配方浓度的含有SAR和丙烯酰胺的缓冲液、浓度不低于0.01%w/v的过硫酸铵溶液、以及TEMED溶液。
总体而言,通过本发明所构思的以上技术方案与现有技术相比,能够取得下列有益效果:
①本发明在综合保留了传统SDS-PAGE和Native-PAGE可分离不同状态蛋白质,操作简单方便等特点外,克服了SDS-PAGE不能分析生理状态蛋白质修饰和Native-PAGE无法用蛋白质Marker定标及不能直接用来分析酸性蛋白质和碱性蛋白质的缺点;在不破环蛋白质的二级结构的条件下,能够对电泳的目的蛋白质进行定标,半定量分析。
②实验结果证明,该方法具有普适性,操作简单,成本低廉;
③可广泛应用于分子动力学、酶学、医药等领域的基础和应用学研究,为广大实验人员的蛋白质科学分析带来广泛的便利。
附图说明
图1是实施例1的05SAR-PAGE和05SAR-PAGE凝胶电泳图;其中图1a为05SAR-PAGE中,蛋白Marker及CxpA
图2是实施例2的PhoB
图3是实施例2的PhoB
图4是实施例3用0.05%(w/v)SAR分别滴定不同浓度的PhoB
图5是实施例4的不同浓度(0.2mmol/L,0.4mmol/L,0.8mmol/L,1.6mmol/L,3.2mmol/L)的Cyt c的05SAR-PAGE结果图;
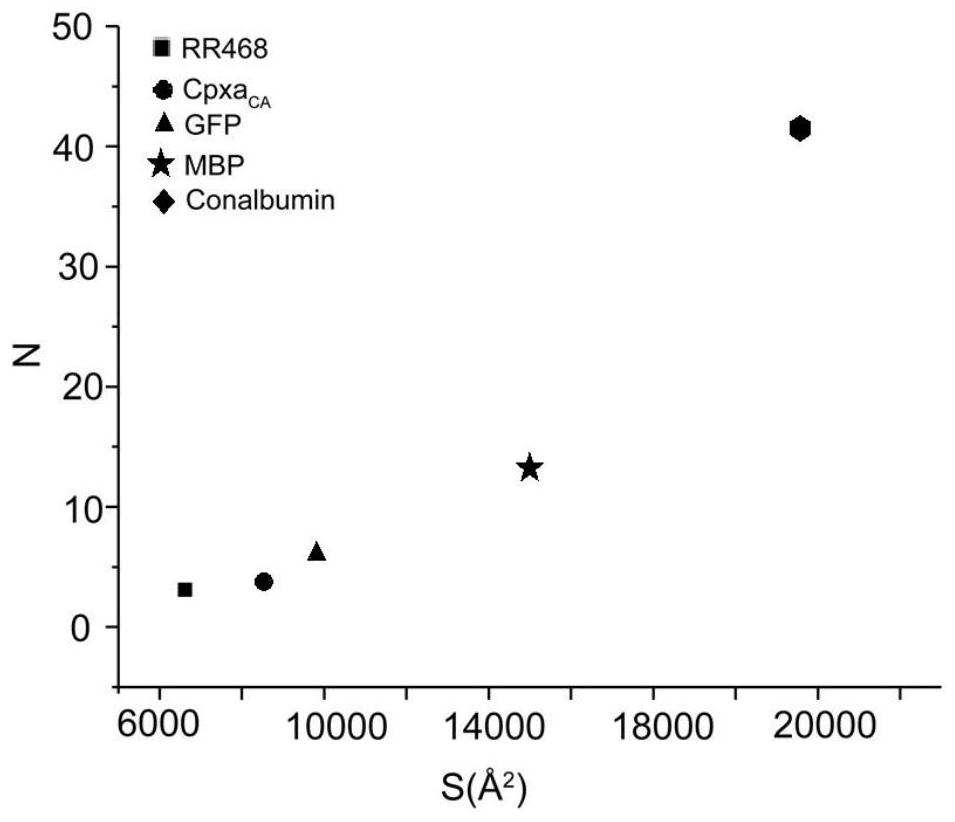
图6是实施例5蛋白质的相对分子质量与结合的SAR的个数的关系图;
图7是实施例5的05SAR-PAGE中蛋白质的分子量和蛋白质的迁移率的关系图,其中图7a为蛋白质Marker的05SAR-PAGE结果图;图7b为05SAR-PAGE结果中蛋白质Marker的相对分子量的对数和蛋白质的相对迁移率的关系图;
图8是实施例6的05SAR-PAGE鉴定0.5mmol/L Cyt c的寡聚状态结果图;
图9是实施例7PhoR
图10是实施例7PhoB
图11是实施例8CpxA凝胶电泳图;其中图11a为CpxA的05SAR-PAGE图;图11b为CpxA的SDS-PAGE图;
图12是实施例905SAR-PAGE鉴定蛋白质的修饰态结果图;其中图12a为用05SAR-PAGE鉴定0.3mmol/L磷酸化态和非磷酸化态的PhoB
图13是实施例10的05SAR-PAGE与Western Blotting结合对CpxA相对定量结果图;
图14是实施例10的05SAR-PAGE与Western Blotting结合分析细胞裂解液中可溶性蛋白质PhoB
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。此外,下面所描述的本发明各个实施方式中所涉及到的技术特征只要彼此之间未构成冲突就可以相互组合。
本发明提供的蛋白质电泳用凝胶,包括上层浓缩胶和下层分离胶;
所述下层分离胶为含有表面活性剂的聚丙烯酰胺凝胶,优选含有质量分数在6%至15%的聚丙烯酰胺,所述下层分离胶的表面活性剂由0.025%-0.1%的质量体积比的月桂酰肌氨酸钠构成,所述下层分离胶pH值呈碱性,在8.0-9.5之间,优选8.8。所述表面活性剂浓度与上样蛋白质的浓度存在如下关系:
表面活性剂摩尔浓度与上样蛋白质质量浓度之比在0.04-11.56mmol/g之间,优选在1.16-9.90mmol/g之间。
实验显示,蛋白质的表面结合SAR,由于蛋白质的体积远大于SAR,故在一定范围内SAR的摩尔浓度与上样蛋白质的质量浓度之比决定了SAR凝胶电泳的性能。当表面活性剂摩尔浓度与上样蛋白质质量浓度之比超过11.56mmol/g时,实验显示蛋白质变性,不能维持天然构象;当表面活性剂摩尔浓度与上样蛋白质质量浓度之比低于0.04mmol/g时,可能由于蛋白质表面没有结合足够的SAR,导致凝胶电泳的分辨率下降,无法区分分子质量相近的蛋白质。结合蛋白质变性和凝胶成像分辨率的实验结果,表面活性剂摩尔浓度与上样蛋白质质量浓度之比在0.04-11.56mmol/g之间时,本发明提供的蛋白质电泳能具有较好的分辨率并较佳的保持蛋白质天然构象。当表面活性剂摩尔浓度与上样蛋白质质量浓度之比在1.66-9.90mmol/g之间时,蛋白质的分子量与平均迁移率具有良好的线性关系,能较为准确的标记蛋白质分子量,具有良好的分辨率。
所述上层浓缩胶为含有表面活性剂的聚丙烯酰胺凝胶,优选含有质量体积分数在3.5-5%的聚丙烯酰胺,pH值呈弱酸性,在6.0-7.0之间,优选6.8,所述上层浓缩胶的表面活性剂由0.025~0.1%的质量体积比的月桂酰肌氨酸钠构成。
本发明提供的凝胶电泳用缓冲液,例如上样缓冲液、电泳缓冲液、用于溶解蛋白质标记物的缓冲液,含有表面活性剂,所述表面活性剂由0.025~0.1%的质量体积比的月桂酰肌氨酸钠构成,所述表面活性剂浓度与上样蛋白质的浓度存在如下关系:
表面活性剂摩尔浓度与上样蛋白质质量浓度之比在0.04-11.56mmol/g之间。
优选上样蛋白质的质量浓度不超过40.32mg/mL,优选为0.59-2.94mg/mL,当上样蛋白质浓度超过40.32mg/mL时,导致条带拖尾严重,无法清晰分离蛋白质。
本发明提供的蛋白质电泳标记物,包括4-20种稳定单体蛋白质,优选10种稳定单体蛋白质,分子量分布范围5kDa-100 MDa,应尽可能均匀分布,蛋白总浓度在0.005mmol/L-0.5mmol/L之间;所述稳定单体蛋白质,即用作标记物的蛋白质自身或多种用作标记物的蛋白质之间不形成聚合态;其溶解缓冲液中含有与上层浓缩胶相同浓度的月桂酰肌氨酸钠。由于本发明提供的蛋白质电泳凝胶,常用于多聚态蛋白质的观察,因此电泳标记物分子量范围相应扩大,需选择分布范围较广的稳定单体蛋白质。
蛋白质在SDS凝胶电泳缓冲液中,由于SDS强烈的变性作用,蛋白质呈精密的椭圆形或棒状结构,棒的短轴基本恒定,与蛋白质的种类无关;棒的长轴是变化的,而且与蛋白质的分子量成正比。同时SDS为阴离子表面活性剂,因此蛋白质表面带上负电荷,同时形成其长度与蛋白质分子量成正比的长棒状,消除了由于天然蛋白质分子形状差异导致的对不同电泳迁移率的影响,带电分子电泳迁移率的大小取决于三个方面,即带电荷的多少、分子量的大小和分子的形状。根据上面陈述可知,SDS和蛋白质结合后使其电泳迁移率仅取决于蛋白质分子量的大小,因而在SDS-凝胶电泳中可以通过比较未知分子量的蛋白质和已知分子量的蛋白质分子的迁移率,测定出未知蛋白质的分子量。然而正是由于SDS对蛋白质的强相互作用,使绝大多数蛋白质的结构被破环,因此不可能使蛋白质之间在维持很弱的相互作用的前提下进行凝胶电泳,如寡聚态、复合物、修饰态及聚合态的蛋白质,由于结构被SDS破坏,因此无法被鉴定出来。
Native-PAGE是一种没有加表面活性剂的温和的非变性凝胶电泳,在电泳过程中,蛋白质能够保持完整状态,由于蛋白质在Native-PAGE中的迁移速率同时受分子量大小,蛋白质形状及所带电荷影响,因此Native-PAGE无法用统一的蛋白质标记物定标,这对于分析蛋白质的分子量、多聚状态和复合体状态造成了困扰。同时,由于酸性蛋白和碱性蛋白带电量不同,不能实现一步分离,给实验操作带来了不便。换而言之,Native-PAGE只能分辨不同蛋白质,但是并不能确定蛋白质的大小。
在SDS凝胶电泳时,具有弱相互作用的蛋白质,由于蛋白质形态改变而无法维持弱相互作用,因此无法通过SDS凝胶电泳无法通过鉴定蛋白质分子量来鉴定弱相互作用的蛋白质,蛋白质弱相互作用的现象无法体现在凝胶电泳的结果中。而非变性凝胶电泳,则由于其本身不能排除分子量以外的影响因素对电泳结果的影响,尤其是带点电荷导致的影响,因此无法通过鉴定蛋白质的分子量来鉴定弱相互作用。
本发明采用SAR取代SDS作为蛋白质凝胶电泳的表面活性剂,优选用作活性蛋白质凝胶电泳的表面活性剂,例如蛋白质弱相互作用凝胶电泳、原位蛋白质凝胶电泳等,在恰当控制上样蛋白质的摩尔浓度和表面活性剂的用量的情况下,在不破坏蛋白质活性、维持蛋白质天然构象、保持蛋白质弱相互作用的前提下,为蛋白质带上负电荷,屏蔽蛋白质天然电量对凝胶电泳结果的影响,实现蛋白质弱相互作用鉴定。其中表面活性剂摩尔浓度与上样蛋白质质量浓度之比在0.04-11.56mmol/g之间。
SAR作为阴离子表面活性剂亦结合在蛋白质表面实施例5的滴定实验显示(图6)SAR的摩尔浓度与上样蛋白质质量浓度之比在1.66-9.90mmol/g的范围内,蛋白质的分子量与结合的SAR量具有良好的线性关系。因此在合适的pH值下,一方面使得蛋白质的天然构象不被破坏,另一方面使得SAR处于电离状态,即可实现在维持蛋白质活性状态包括弱相互作用的前提下,给蛋白质表面带上与蛋白质分子量线性正相关的负电荷,从而屏蔽带电量对凝胶电泳结果的影响,使得凝胶电泳的蛋白质的迁移速率仅与蛋白质的大小和形状相关。
由于不同蛋白质其分子量大小差异对于凝胶电泳迁移速率的影响远大于其形状所带来的影响,因此在分析不同蛋白质时,蛋白质条带的位置基本标识了蛋白质分子量。而当蛋白质的分子量大小十分接近时,则SAR-蛋白质凝胶电泳可能能分辨不同形状的蛋白质,例如化学修饰的蛋白质或者处于不同构象下的蛋白质。因此本发明提供的SAR-蛋白质凝胶电泳相较于SDS-蛋白质凝胶电泳具有更高的分辨率。
更重要的是,本发明提供了一种新的蛋白质弱相互作用检测方法,不同于目前通常应用于蛋白质弱相互作用的色谱检测、核磁共振检测及分析型离心检查,本发明提供的SAR-凝胶电泳应用于蛋白质弱相互作用,其优势在于同时克服了Native凝胶电泳不能用蛋白质Marker对蛋白质分子量进行标定,以及不能一步分离酸性和碱性蛋白质的缺点;SAR-凝胶电泳可用于蛋白质Marker检测蛋白质的寡聚状态,一步分析酸性蛋白质和碱性蛋白质,并鉴定不同的蛋白质修饰状态以及同一种蛋白质聚合态的修饰态。
进一步的,本发明提供的SAR-蛋白质凝胶电泳能够与Western Blotting结合,实现蛋白质弱相互作用原位检测,例如检测细胞内蛋白质的聚合态;能够检测膜蛋白的聚集态,能够与SDS-PAGE的组合进行二维电泳分离蛋白质复合物,可以根据目标蛋白的分子量SAR-蛋白质凝胶电泳中聚丙烯酰胺的浓度,以达到最佳分离效果。其应用范围广,成本低廉,操作和数据分析更简单,价格更低廉,结果更直观。
本发明提供的SAR-蛋白质凝胶电泳,控制SAR浓度与蛋白质的浓度是SAR能在维持蛋白质活性状态下进行凝胶电泳的关键所在。具体而言,SAR摩尔浓度与上样蛋白质质量浓度在0.04-11.56mmol/g之间时,能保持蛋白质弱相互作用的状态,而不破坏蛋白质结构。如果该比值过大,会破环蛋白质的天然构象,如果该比值过小,则蛋白质表面的电荷量与蛋白质分子量之间没有明显的线性关系,则SAR-蛋白质凝胶电泳不但分辨率会变差,更重要的是,无法较为准确的标识蛋白质分子量。以上两种情况都会导致SAR-凝胶电泳失败。
同时根据研究的目标蛋白弱相互作用的种类和性质不同,选择不同的SAR浓度、不同SAR和上样蛋白质浓度的比例、不同的聚丙烯酰胺浓度体现出不同的鉴定效果。
用于直接分离并确定蛋白质的多聚状态时,适合的表面活性剂的摩尔浓度与上样蛋白质的质量浓度之比0.04-11.56mmol/g,优选分离胶pH值8.8,浓缩胶pH值6.8。
用于观测蛋白质修饰状态时,由于修饰状态蛋白质分子量非常接近,因此需要凝胶电泳具有更高的分辨率并且能较好的维持蛋白质天然构象,故表面活性剂摩尔浓度/上样蛋白质质量浓度之比优选在0.17-2.70mmol/g之间。
用于观测蛋白质复合物时,适合的表面活性剂的摩尔浓度与上样蛋白质的质量浓度之比0.04-11.56mmol/g。
用于对蛋白质纯度分析及蛋白质分子量测定时,优选单体目的蛋白质分析,适合的表面活性剂的摩尔浓度与上样蛋白质的质量浓度之比0.04-11.56mmol/g。
取代SDS-PAGE,用于Western Blotting实验,观察细胞内蛋白质的多聚态及膜蛋白值的多聚态时,适合的SAR的摩尔浓度与上样蛋白质的质量浓度之比在0.04-5.31mmol/g之间。因为Western Blotting的显色方式比前面的普通凝胶更灵敏,蛋白质相互作用较为稳定,即蛋白质的浓度在极低的时候能够被显色。
用于SDS-PAGE二维电泳分离的蛋白质复合物的鉴定时,适合的SAR的摩尔浓度与上样蛋白质的质量浓度之比在0.04-5.31mmol/g之间。由于聚丙烯酰胺的浓度越低,凝胶孔径越大,分离蛋白质的分子量越大,因此,可以根据所分离的蛋白质的分子量,选择不同的聚丙烯酰胺的浓度,以及适用于目的蛋白质分子量的蛋白质Marker。
用于检测细胞内和细胞外膜蛋白的聚集态时,适合的表面活性剂的摩尔浓度与上样蛋白质的质量浓度之比0.04-11.56mmol/g。
本发明提供的蛋白质凝胶电泳试剂盒,包括上层浓缩胶母液和下层分离胶母液,优选包括本发明提供的电泳给标记物。
所述上层浓缩胶母液包括:配方浓度的含有SAR和丙烯酰胺的缓冲液;所述下层分离胶母液包括:配方浓度的含有SAR和丙烯酰胺的缓冲液、过硫酸铵溶液、以及TEMED溶液;过硫酸铵溶液浓度一般不低于0.01%w/v。
以下为实施例:
以下实施例中所用到的分离蛋白质的凝胶包括下层分离胶和上层浓缩胶:
下层分离胶和上层浓缩胶的长度和厚度相同;
下层分离胶高度:上层浓缩胶高度=2:1至8:1;
制备方法如下:
①凝胶板的制备
A、分离胶的制备
a、按分离胶配方表中用量配制分离胶,在干净的小烧杯中依次加入蒸馏水、以及除四甲基乙二胺(TEMED)以外的其他分离胶配方成分,轻轻混匀,最后加入四甲基乙二胺(TEMED),再次轻轻混匀;
b、用1mL移液枪将上述混合液混匀后加入长短制胶板缝隙内,分离胶53-63mm高,用1mL注射器取少许蒸馏水,沿长玻璃板注满水封,15-30min后,用滤纸条吸去多余的水分;
B、浓缩胶的制备
a、按浓缩胶配方表中用量配制浓缩胶,在干净的小烧杯中依次加入蒸馏水、以及除四甲基乙二胺(TEMED)以外的其他分离胶配方成分,轻轻混匀,最后加入四甲基乙二胺(TEMED),再次轻轻混匀;
b、用1mL移液枪将上述混合液混匀后加入分离胶上层,迅速插入样品槽模板,放置20-60min,待浓缩胶完全凝固后,取出样品槽模板,放入4℃冰箱备用;
②上样缓冲液(Loading buffer)的制备
A、按照上样缓冲液配方表配置相应母液;
B、取配方用量后加去离子水溶解后定容至5mL;
C、小份分装后室温保存;
③电泳缓冲液(Running buffer)的制备:
A、按照电泳缓冲液配方表配置相应母液;
B、加去离子水溶解后定容至500mL;
④蛋白质Marker的制备
蛋白质Marker包含4-8个分子量梯度,且蛋白质分子量范围在5kDa-300kDa之间,将浓度为0.05-0.5mmol/L的蛋白质Marker溶解于上样缓冲溶液中;本实施例所采用的蛋白质Marker为在市售蛋白质Marker中加入SAR,市售蛋白质Marker购于ThermoFisher(MA,USA),分子量范围10-180kDa。
⑤蛋白质样品的制备
将待分析蛋白质样本与上样缓冲液按体积比1:1混合即得到最后蛋白质样品,控制蛋白质样品浓度在0.05-0.5mM之内。
实施例105SAR-PAGE分离CpxA
1、凝胶板的配置:
表1配制Tris-甘氨酸6%05SAR-PAGE聚丙烯酰胺凝胶电泳分离胶配方表
表2配制Tris-甘氨酸8%05SAR-PAGE聚丙烯酰胺凝胶电泳分分离胶配方表
表3配制Tris-甘氨酸10%05SAR-PAGE聚丙烯酰胺凝胶电泳分离胶配方表
表4配制Tris-甘氨酸12%05SAR-PAGE聚丙烯酰胺凝胶电泳分离胶配方表
表5配制Tris-甘氨酸15%05SAR-PAGE聚丙烯酰胺凝胶电泳分离胶配方表
表6配制Tris-甘氨酸05SAR-PAGE聚丙烯酰胺凝胶电泳浓缩胶配方表
2、上样缓冲液的配方表:50mmol/LTris-HCl pH6.8,0.05%w/v SAR,0.1%w/v溴酚蓝,10%v/v甘油;
3、电泳缓冲液的配方表:25mmol/L Tris,0.25M/L甘氨酸,0.05%w/v SAR
4、蛋白质Marker配方表
分析结果如图1所示,以上结果说明,05SAR-PAGE能有效测定蛋白质分子量。
实施例2SAR浓度对于蛋白质结构影响
分别获取PhoB
PhoB
PhoB
实施例3上样蛋白质浓度影响
制备不同浓度的样品PhoB
图4中,灰色部分为PhoB
由图4可知,0.05%SAR使0.01mmol/L蛋白质变性,即表面活性剂摩尔浓度与上样蛋白质质量浓度之比不高于11.56mmol/g,否则蛋白质将结合过多的SAR导致蛋白质变性。
实施例4不同上样蛋白质量浓度05SAR-PAGE电泳结果比较
为探究高浓度的蛋白质是否会影响05SAR-PAGE的胶图质量,我们配置不同浓度的细胞色素c(Cytc)样品(0.2mmol/L,0.4mmol/L,0.8mmol/L,1.6mmol/L,3.2mmol/L),并按照实施例1的配方和步骤进行了05SAR-PAGE实验,结果如图5所示。
实验结果显示,当样品浓度逐渐升高时,蛋白质样品出现了拖尾,影响了05SAR-PAGE凝胶电泳的胶图质量。说明在05SAR-PAGE中,蛋白质的浓度过高会导致电泳的胶图出现明显的中部拖尾,当Cyt c的样品浓度低于0.2mmol/L时,可以获得质量较高的胶图。
0.05%SAR中,3.2mmol/L蛋白质使凝胶电泳的分辨率降低,故蛋白质浓度过高,会影响凝胶的分辨率,即表面活性剂摩尔浓度与上样蛋白质质量浓度之不低于0.04mmol/g。
实施例5表面活性剂摩尔浓度与上样蛋白质质量浓度比值实验
通过采集SAR的一维氢谱,用已知浓度的蛋白质滴定已知浓度的SAR,根据SAR的积分面积的变化,计算出每个蛋白质结合的SAR的个数如图6所示,并将蛋白质的相对分子质量与其结合的SAR的个数作图,发现蛋白质的相对分子质量越大,结合的SAR的量越多,成正相关,具有良好的线性关系,R
通过计算可得,如图6所示,SAR的摩尔浓度与上样蛋白质质量浓度之比在1.66-9.90mmol/g(该数值范围来源于MSP蛋白质)的范围内,蛋白质的分子量与结合的SAR量具有良好的线性关系。线性关系良好,R
为进一步探究在05SAR-PAGE中,蛋白质的迁移率与蛋白质分子量的关系,我们将购买的蛋白质Marker进行了处理,用biobeads吸附出去SDS后,加入0.05%w/v SAR,对蛋白质Marker按照分子量大小依次编号为1-10,如下表所示,统计所有蛋白质的相对分子质量并计算logM值,同时对处理后的蛋白质Marker进行了05SAR-PAGE实验,假设溴酚蓝迁移的距离d1,蛋白质迁移的距离定为d2,根据下面的公式计算出各种蛋白质的迁移率Rm。
Rm=d2/d1
根据蛋白质电泳的迁移位置用卡尺分别测出05SAR-PAGE中,溴酚蓝及每一个蛋白质的迁移距离,重复三次实验,并计算每一个蛋白质的平均迁移率d
表7蛋白质的分子量及其在05SAR-PAGE的电泳迁移率
以各蛋白质的相对分子质量的对数为横坐标,以各蛋白质分子的平均迁移率为纵坐标。绘制点线图如图7所示。
从统计的实验数据结果可见,当分子量在10-180kDa范围内时,蛋白质的相对分子质量越大,其在05SAR-PAGE中的迁移速率越快,说明蛋白质在05SAR-PAGE的迁移速率与相对分子质量的对数成正相关,可以用普适的蛋白质Marker对蛋白质的分子量进行标定。
实施例6采用05SAR-PAGE分离并确定蛋白质的多聚状态
采用的凝胶电泳系统类似实施例1表5的凝胶电泳系统,表面活性剂摩尔浓度与上样蛋白质质量浓度之比在0.04-11.56mmol/g。
我们选择酵母细胞的Cyt c作为研究对象,配制0.5mmol/L的Cyt c样品和浓度为15%的05SAR-PAGE进行凝胶电泳实验,即表面活性剂摩尔浓度与上样蛋白质质量浓度之比为0.27mmol/g。通过蛋白质Marker比对,采用实施例1的05SAR-PAGE进行电泳,结果如图8所示。
结果显示了Cyt c的单体,二聚体,三聚体及四聚体的条带(如图8)。说明05SAR-PAGE不仅能够用于检测蛋白质的二聚状态,也有望用于检测蛋白质的寡聚状态及高聚态,该条件下能较为清晰的辨认Cytc的各寡聚状态和单体。
实施例7采用05SAR-PAGE分离并确定蛋白质的同源低聚态
采用的凝胶电泳系统类似实施例1表5的凝胶电泳系统,表面活性剂的摩尔浓度与上样蛋白质的质量浓度之比为在0.04-11.56mmol/g。
PhoB
将PhoR
对于PhoR
对于PhoB
说明:05SAR-PAGE克服了传统Native-PAGE的该缺点,能够用蛋白质Marker标定,能够一步分离及鉴定酸性蛋白质和碱性蛋白质的二聚状态。
实施例8膜蛋白聚集状态鉴定
采用的凝胶电泳系统类似实施例1表4的凝胶电泳系统,表面活性剂的摩尔浓度与上样蛋白质的质量浓度之比为在0.04-11.56mmol/g。
膜蛋白的溶液环境复杂,鉴定膜蛋白的聚集状态很难,本实施例提供的含有SAR作为表面活性剂的上样缓冲液,可以很好的溶解膜蛋白,尽可能的维持多聚态,同时带上电荷,以利电泳。
将纯化后的CpxA样品溶解于20mmol/L Tris,150mmol/L NaCl,1mmol/L EDTA,0.05%(w/v)SAR缓冲液中。
将0.2mmol/L CpxA的样品在4度冰箱,90V恒压,分别进行SDS-PAGE和05SAR-PAGE实验,结果如图11所示。
从右图SDS-PAGE结果可以看出,CpxA全长为单体,但左图05SAR-PAGE的实验结果显示,CpxA全长有二聚。说明,CpxA全长在溶液中可能存在寡聚态。由于膜蛋白表达量低,分子量大,存在疏水区,溶解buffer复杂。因此膜蛋白寡聚状态检测到目前为止仍存在困难。我们用05SAR-PAGE检测了膜蛋白的寡聚态,且早期文献报道,CpxA胞内全长部分存在二聚,该结果与文献所报道的结果相吻合。其中,CpxA的浓度为0.20mM,即表面活性剂摩尔浓度与上样蛋白质质量浓度之比为0.16mmol/g,该条件下蛋白质条带可辨,较为清晰。
说明:05SAR-PAGE适合分离及鉴定膜蛋白质的二聚状态。
实施例9蛋白质修饰态的鉴定
采用的凝胶电泳系统类似实施例1表5的凝胶电泳系统,表面活性剂的摩尔浓度与上样蛋白质的质量浓度之比为在0.17-2.70mmol/g。
PhoB
PAM(monoanhydride with phosphoric acid)是一种常用的小分子磷酸盐供体,能够使PhoB
Cyt c的甲基化样品的制备:
Cyt c甲基化及非甲基化的样品制作的参考文献:P.Sun,Q.Wang,B.Yuan,Q.Zhu,B.Jiang,C.Li,W.Lan,C.Cao,X.Zhang,M.Liu,Monitoring alkaline transitions ofyeast iso-1cytochrome c at natural isotopicabundance using trimethyllysine asa native NMR probe,Chem.Commun.(Camb)54(2018)12630e12633.其中,Cyt c的浓度为0.05mmol/L,即表面活性剂摩尔浓度与上样蛋白质质量浓度之比为2.7mmol/g,该浓度下的实验结果如下图b所示,能清晰辨认Cyt c甲基化及非甲基化的样品,当Cyt c的浓度达到0.8mmol/L时,即表面活性剂摩尔浓度与上样蛋白质质量浓度之比为0.17mmol/g时,尚能辨认Cyt c甲基化及非甲基化的样品。
90V电压,于4℃冰上进行05SAR-PAGE电泳实验,电泳时长设置为5小时,结果如图12所示。
图12b中Cyt c的单体和二聚体用箭头标出用于观测蛋白质单体或多聚时的化学修饰状态。蛋白质的定向修饰对于蛋白质在生物体内发挥功能具有重要意义。由于0.05%w/v SAR对蛋白质的结构影响温和,因此,05SAR-PAGE可以用来研究蛋白质的修饰。在实验中,用05SAR-PAGE观测到了Cyt c的甲基化修饰和PhoB的磷酸化修饰。与常规的SDS-PAGE相比,我们看到了Cytc二聚状态的甲基化修饰。
实施例10与Western Blotting结合蛋白质聚合态的鉴定
05SAR-PAGE实验采用的凝胶电泳系统类似实施例1表4的凝胶电泳系统表面活性剂的摩尔浓度与上样蛋白质的质量浓度之比0.04-5.31mmol/g。
取代SDS-PAGE,用于Western Blotting实验,观察细胞内蛋白质的多聚态及膜蛋白值的多聚态时,适合的SAR的摩尔浓度与上样蛋白质的质量浓度:0.04-5.31mmol/g,由于Western Blotting的显色方式比前面的普通凝胶更灵敏,即蛋白质的浓度在极低的时候能够被显色。如图13所示,PhoRcp的量为12ug,根据灰度计算,当膜蛋白质CpxA的浓度最低为3.24ug时(条带5),仍能观察到CpxA的二聚条带,计算得到的比值为5.31mmol/g。若高于5.31mmol/g,凝胶灰度低,将检测CpxA的多聚状态不明显。若低于0.04mmol/g,由于蛋白质的浓度高导致凝胶拖尾,将影响凝胶电泳的分辨率。
电泳条件及Western Blotting操作步骤:将细菌细胞重悬于pH 8.0的50mmol/LTris,100mmol/LNaCl中。冰上超声裂菌10分钟,得细胞裂解液。将细胞裂解液在4摄氏度,90V条件下进行SDS-和05SAR-PAGE,然后通过半干转移设备在15V,30分钟的条件下转移到硝酸纤维素(NC)膜上。将NC膜与5%(w/v)脱脂奶在TBST(20mmol/LTris-HCl,500mmol/LNaCl,0.05%Tween-20,pH 8.0)中孵育1.5h,然后与小鼠抗His单克隆抗体孵育(1:3000)。二抗是山羊抗小鼠IgG-HRP(1:3000)。用TBST洗涤五次后,加入澄清的Western ECL底物溶液,并使用Gel扫描仪扫描凝胶。结果如图14所示。
对于细胞内表达量高的蛋白质,05SAR-PAGE可以结合免疫杂交实验,检测细胞内的蛋白质的聚集状态。
本领域的技术人员容易理解,以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 一种蛋白质电泳用凝胶、标记物、应用、及试剂盒
- 一种蛋白质PAGE凝胶电泳快速染色试剂盒及染色方法
