一类三萜化合物、制备方法及其在治疗2型糖尿病中的应用
文献发布时间:2023-06-19 19:28:50
技术领域
本发明属于天然药物领域,具体涉及一类三萜化合物、制备方法及其作为11β-HSD1抑制剂在治疗2型糖尿病中的应用。
背景技术
糖尿病(DM)是一种在遗传和环境因素长期共同作用下,由于胰岛素分泌绝对或相对不足,引起渐进性糖、脂肪、蛋白质、水和电解质代谢紊乱的疾病,以高血糖为主要标志。糖尿病主要有2种类型:1型糖尿病(胰岛素依赖型,IDDM),和2型糖尿病(非胰岛素依赖型,NIDDM),其中,2型糖尿病发病人数最为普遍,占糖尿病发病总人数的90%以上。糖皮质激素(GC)是由肾上腺皮质束状带分泌的一类调节机体糖类、脂类和蛋白质代谢的生物活性物质,是一种重要的胰岛素拮抗剂。局部组织中GC水平的异常升高,尤其在糖代谢比较旺盛的组织中,如肝脏、脂肪和骨骼肌等,会引起胰岛素抵抗。胰岛素抵抗是2型糖尿病发病的中心环节,因此,作为胰岛素重要拮抗剂的GC在2型糖尿病发病的过程中扮演着重要角色。11β-HSD1属于短链脱氢/还原酶蛋白超家族(SDR),是生物体内GC的代谢酶,催化有生物活性的皮质醇(Cortisol)和无生物活性的皮质酮(Cortisone)之间的相互转化。在代谢旺盛的组织中,11β-HSD1主要起到还原酶的作用,与还原性辅酶Ⅱ(烟酰胺腺嘌呤二核苷酸磷酸,NADPH)一起将皮质酮还原为有活性的皮质醇,提高局部组织GC的水平。天然产物的结构多样性和易于与生物大分子结合的特点,决定了其在参与生命生理过程中所具有的无可比拟的优势,这些都赋予了天然产物在新药研发中不可替代的重要地位,是发现候选药物和药物先导结构的重要来源。黄苞大戟作为一种重要的中药资源,其次级代谢产物已被报道具有结构和生物活性多样性。
发明内容
大量研究证实,11β-HSD1与2型糖尿病的发病紧密相关。通过受体前调节,抑制11β-HSD1的活性,减少局部组织的GC水平,能够改善胰岛素抵抗,达到治疗2型糖尿病的目的。因此,从黄苞大戟中发现具有抑制11β-HSD1活性的代谢产物对于研发治疗2型糖尿病的新型药物具有重要意义。
本发明通过以下措施来实现:
本发明的第一个目的是提供一类具有抑制11β-HSD1活性的三萜化合物。
本发明的三萜化合物,其结构如式(Ⅰ)所示:
式(I)
本发明的第二个目的是提供如式(Ⅰ)所示的三萜化合物的制备方法。
本发明的如式(Ⅰ)所示的三萜化合物的制备方法,其特征在于,包括以下步骤:
(1)黄苞大戟全草资源的获得;
(2)将步骤(1)得到的全草风干粉碎,用95%乙醇浸泡提取4次,每次7天,减压浓缩得到粗浸膏,然后用乙酸乙酯萃取,减压浓缩后得到乙酸乙酯萃取物;
(3)将步骤(2)所述的乙酸乙酯萃取物经过大孔树脂,正反相硅胶柱层析,以乙醇-水,石油醚-乙酸乙酯和甲醇-水作为洗脱体系,最后通过高效液相色谱进行纯化,得到专利要求1中式(I)所示的化合物1、化合物2、化合物3。
步骤(1)所述的黄苞大戟全草采集于贵阳市龙里县,其标本保存烟台新药创制山东省实验室(标本号:rcmcm-0001)。
步骤(2)所述的提取溶剂为95%乙醇,萃取溶剂为乙酸乙酯,所述的浓缩方法为减压浓缩。
步骤(3)所述的大孔树脂柱层析洗脱剂乙醇-水的比例是30%,50%,80%和95%;所述的硅胶柱层析洗脱剂石油醚-乙酸乙酯的比例是15:1-1:2;所述的反相柱层析洗脱剂甲醇-水的比例是30%-100%;所述的高效液相洗脱剂乙腈-水的比例分别是55%,55%,94%,时间分别是55 min,59 min,35 min,流速是3 mL/min。
本发明的第三个目的是提供如式(Ⅰ)所示的三种三萜化合物作为11β-HSD1酶抑制剂在治疗2型糖尿病研发方面的应用,其特征在于,包括有效量的作为活性成分的权利要求1所述的三种三萜化合物和药学上可以接受的载体。
通过进行体外酶活实验,结果显示,本发明如式(Ⅰ)所示的三萜化合物能够显著抑制11β-HSD1的活性,它们的IC
本发明具有以下有益效果:
第一,提供了本发明三种三萜化合物的分离提取方法。
第二,提供了三种新型的三萜化合物,丰富了化合物库。
第三,本发明提供的三种新型三萜化合物具有显著的抑制11β-
HSD1的活性,使其作为11β-HSD1抑制剂在治疗2型糖尿病方面有良好的应用前景。
附图说明
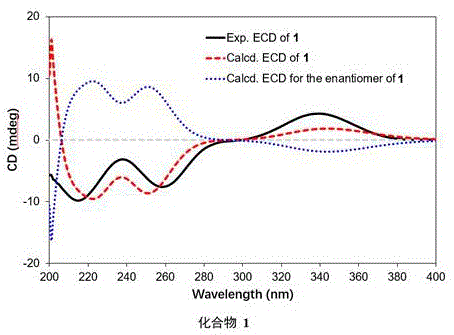
图1. 化合物1在甲醇中所测的ECD谱图;
图2. 化合物2在甲醇中所测的ECD谱图;
图3. 化合物3在甲醇中所测的ECD谱图;
图4. 化合物1的关键ROESY相关信号;
图5. 化合物2的关键ROESY相关信号。
具体实施方式
以下实施例是对本发明的进一步说明,而不是对本发明的限制。
实施例1:如式(I)所示的三萜化合物1-3的制备和结构鉴定。
式(I)
(1) 三萜化合物1-3的提取分离
黄苞大戟全草(10 kg)采自于贵阳市龙里县,经风干粉碎后,用95%乙醇浸泡提取4次,每次25 L,每次7天。将乙醇提取液合并,减压浓缩得到粗浸膏1.4 kg。粗浸膏悬浮于2 L的水中,用乙酸乙酯萃取三次,每次3 L。合并乙酸乙酯层,减压浓缩得到乙酸乙酯萃取物331 g。将该萃取物进行大孔树脂(D101)柱层析,用乙醇-水(v/v,30%,50%,80%和95%)洗脱,得到4个组分A-D。组分C(143 g)经正相硅胶(100-200目)柱层析,用石油醚-乙酸乙酯(v/v,15:1-1:2)洗脱,得到7个组分(C1-C7)。
将C7进行反相硅胶柱层析,以甲醇-水为洗脱体系,体积比从30%-100%进行梯度洗脱,得到4个组分C7-1-C7-4。组分C7-1经过半制备高效液相(色谱柱为YMC-Pack ODS-A 250x 10.0 mm,检测波长为210 nm和254 nm,流速为3 mL/min,流动相为94%的乙腈-水),分离纯化得到化合物3(1.6 mg,35 min)。组分C7-2经过半制备高效液相(色谱柱为YMC-PackODS-A 250×10.0 mm,检测波长为210 nm和254 nm,流速为3 mL/min,流动相为55%的乙腈-水),分离纯化得到化合物1(1.8 mg,55 min)和化合物2(1.6 mg,59 min)。
(2) 化合物1-3的结构鉴定
对化合物1-3进行核磁共振(NMR)、质谱(MS)、旋光、圆二色谱(ECD)等数据测试和解析,从而确定了其化学结构。
化合物1和化合物2的结构解析如下:
高分辨质谱(HR-ESIMS)显示,化合物1(
化合物3的结构解析如下:
综合解析高分辨质谱和
化合物1-3的氢谱和碳谱数据如表1所示:
实施例2:如式(I)所示的三萜化合物的11β-HSD1酶活实验:
通过LC-MS/MS的方法对如式(I)所示的化合物1-3进行对11β-HSD1抑制活性的测试。在96孔板中加入173.8μL buffer A(100 mM KCl, 20 mM NaCl, 20 mM Hepes, pH7.9),2.0μL 11β-HSD1酶,4.0μL NADP
实验结果显示,式(I)所示化合物1-3能显著抑制11β-HSD1的活性,它们的IC
表 2 .化合物1-3对11β-HSD1的抑制活性(IC
a
- 一种三萜类化合物及其制备方法和在制备抗癌药物中的应用
- 一种具有抗菌功能的三萜类化合物及其制备方法与在电子烟中的应用
- 一类用于治疗肝损伤的茋类化合物、其制备方法及其应用
- 一类檀香内生真菌来源的二苯酚酸类化合物及其制备方法和在制备抗菌药物中的应用
- 一类五元六元杂环化合物及其制备方法和治疗肿瘤的用途
- 翻白草三萜化合物在治疗糖尿病中的应用
- 翻白草三萜化合物在治疗糖尿病中的应用
