一种治疗脊髓损伤的水凝胶及其制备方法和应用
文献发布时间:2024-04-18 19:58:53
技术领域
本发明涉及干细胞生物医学领域,特别是涉及一种治疗脊髓损伤的水凝胶及其制备方法和应用。
背景技术
脊髓损伤(Traumatic spinal cord injury,SCI)在世界范围内仍然是一个严重的问题,其发病率和死亡率都很高。据估计,全球急性脊髓损伤住院死亡率在4.4-16.7%之间。随着人口老龄化,自2012年以来,因跌倒导致的创伤性脊髓损伤的记录病例从16%增加到30.5%。脊髓损伤后,患者通常会出现持续的认知或运动功能障碍,这对他们继续正常生活的能力造成了毁灭性的影响。
非编码RNA(ncRNAs)在包括SCI在内的多种疾病中的作用最近被发现。在这些非编码RNA中,已发现microRNAs(miRNAs)在SCI中起着至关重要的作用。干细胞移植已成为治疗脊髓损伤最有前途的治疗选择之一。由于其多能性,间充质干细胞(MSCs)已被证明具有调节愈合、分化、脑重塑和神经胶质瘢痕形成的能力然而,它们也与移植后较差的有效率相关。近年来,水凝胶因其优异的生物相容性和力学性能,被广泛应用于干细胞研究和神经、软骨等组织再生。它可以包封干细胞和生物分子,促进细胞增殖,使生物活性分子持续释放。目前还未见温敏水凝胶载带预转染miRNA的间充质干细胞应用于脊髓损伤治疗的报道。
发明内容
本发明的目的是提供一种治疗脊髓损伤的水凝胶及其制备方法和应用,以解决上述现有技术存在的问题,该水凝胶可以有效治疗脊髓损伤,促进运动功能的恢复,降低脊髓组织中神经细胞的凋亡。
为实现上述目的,本发明提供了如下方案:
本发明提供一种治疗脊髓损伤的水凝胶,所述治疗脊髓损伤的水凝胶为包含透明质酸的温敏水凝胶,并包封过表达miR-216a-5p的人间充质干细胞;
所述温敏水凝胶在25℃为液态,在37℃为固态。
本发明还提供一种上述的治疗脊髓损伤的水凝胶的制备方法,包括将过表达miR-216a-5p的人间充质干细胞包封于含有透明质酸的温敏水凝胶中,得到所述治疗脊髓损伤的水凝胶的步骤
进一步地,所述过表达miR-216a-5p的人间充质干细胞的制备方法,包括将过表达miR-216a-5p的表达载体转染至人间充质干细胞,筛选得到所述过表达miR-216a-5p的人间充质干细胞的步骤。
进一步地,所述过表达miR-216a-5p的表达载体为miR-216a-5p模拟物,所述miR-216a-5p模拟物的上游核苷酸序列包括如SEQ ID NO.3所示序列,下游核苷酸序列包括如SEQ ID NO.4所示序列。
进一步地,通过将所述过表达miR-216a-5p的人间充质干细胞与所述含有透明质酸的温敏水凝胶混合后,进行交联反应,使所述过表达miR-216a-5p的人间充质干细胞包封于所述含有透明质酸的温敏水凝胶中。
进一步地,所述交联反应在CaCl
本发明还提供上述的治疗脊髓损伤的水凝胶在制备治疗脊髓损伤的药物中的应用。
进一步地,所述药物通过促进脊髓损伤运动功能的恢复来治疗脊髓损伤。
进一步地,所述药物通过降低脊髓组织中神经细胞的凋亡来治疗脊髓损伤。
本发明还提供一种治疗脊髓损伤的药物,包括上述的治疗脊髓损伤的水凝胶。
本发明公开了以下技术效果:
本发明开发了一种治疗脊髓损伤的水凝胶,具体为包封人间充质干细胞的温敏水凝胶,该人间充质干细胞携带过表达治疗性miRNAmiR-216a-5p的表达载体。该治疗脊髓损伤的水凝胶结合了水凝胶载体和人间充质干细胞释放关键物质miR-216a-5p的优势,可以在脊髓损伤中发挥有效的治疗作用。通过动物实验证明,移植hMSCs-gel/miR-216a-5pagomiR可以逆转因脊髓损伤导致的miR-216a-5p表达水平降低,促进运动功能的恢复,降低脊髓组织中神经细胞的凋亡。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
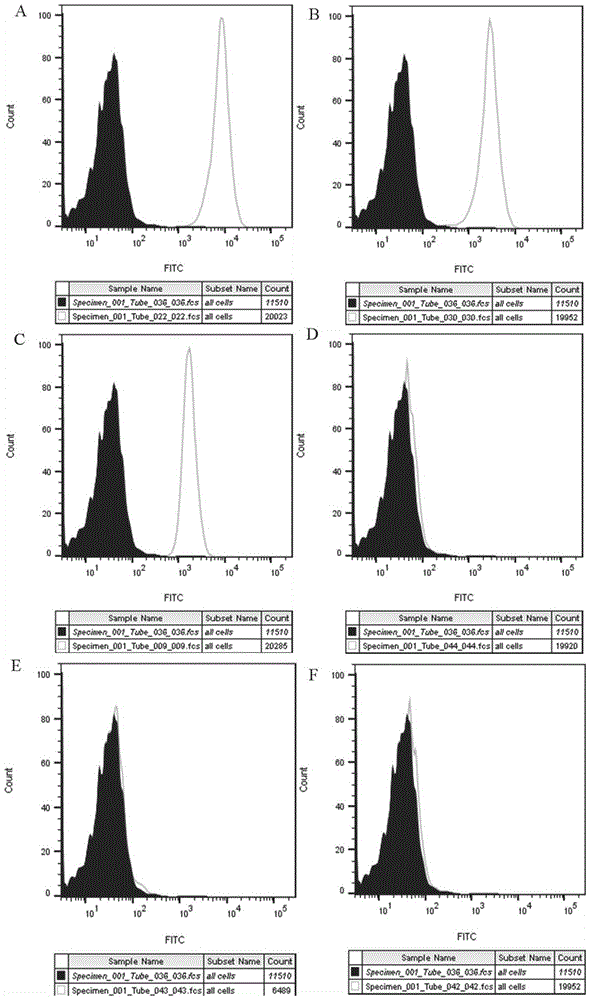
图1为hMSCs分化潜能的流式细胞术分析结果;其中A-F分别为用CD73、CD90、CD105、CD14、CD34和CD45抗体染色进行流式细胞术分析的结果;
图2为hMSCs分化潜能的染色检测结果;其中,A为hMSCs成骨分化后的茜素红染色结果;B为hMSCs成脂分化后,脂质Oil Red O染色结果;C为hMSCs软骨分化后的阿利新蓝染色结果;
图3为制备温度敏感型小肠水凝胶的实物图;
图4为温度敏感型小肠水凝胶的在不同温度下的状态;
图5为温度敏感型小肠水凝胶在不同温度下的溶胀率;
图6为hMSCs-gel/miR-216a-5p agomiR递送对SCI大鼠行为影响的检测结果;其中,A为Basso-Beattie-Bresnahan试验评分结果;B为机械戒断阈值(MWT)评估结果;C为热戒断潜伏期(TWL)评估结果;
图7为hMSCs-gel/miR-216a-5p agomiR递送对神经元凋亡影响的检测结果;其中,A为TUNEL染色结果;B为western blotting检测结果;
图8为hMSCs-gel/miR-216a-5p agomiR递送对miR-216a-5p表达水平影响的检测结果。
具体实施方式
现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。另外,对于本发明中的数值范围,应理解为还具体公开了该范围的上限和下限之间的每个中间值。在任何陈述值或陈述范围内的中间值,以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。
除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。
在不背离本发明的范围或精神的情况下,可对本发明说明书的具体实施方式做多种改进和变化,这对本领域技术人员而言是显而易见的。由本发明的说明书得到的其他实施方式对技术人员而言是显而易见得的。本发明说明书和实施例仅是示例性的。
关于本文中所使用的“包含”、“包括”、“具有”、“含有”等等,均为开放性的用语,即意指包含但不限于。
实施例1
1.人间充质干细胞(hMSCs)的分离与鉴定
从脐带样本中分离出人类沃顿果冻间充质干细胞。脐带样品用含有青霉素(200单位/mL)/链霉素(P/S,Gibco,USA,200μg/mL)和两性霉素B(Gibco,USA,5μg/mL)的1倍PBS彻底清洗。接下来,将样本切成小块(2cm),进一步纵向切割以去除血管。将组织片进一步转移到DMEM/F12(Gibco-Invitrogen,Carlsbad,CA,USA)培养基中,培养基中含有B型胶原酶(Sigma,USA,1μg/mL)、10%FBS(Life Technologies)、1%P/S和两性霉素B。组织在摇床中37℃消化4h。然后,500g离心20min。离心后,丢弃上清,将微球重悬于上述培养基中,不含胶原酶,加入10ng/mLbFGF(R&D Systems,USA)。然后用上述组分在150mm板上扩增细胞,直至融合度达到70-80%。使用0.25%胰蛋白酶-EDTA在37℃下分离5min,之后进行传代培养。
2.hMSCs分化潜能的检测
将P2-P5代的hMSCs分别镀于24孔板上。为了实现成脂分化,在60%的融合度下,细胞补充成脂培养基(低糖DMEM,10%FBS,1%P/S,1μM地塞米松,500μM异丁基甲基黄嘌呤(IBMX),5μg/mL胰岛素,200μg/mL抗坏血酸2-磷酸)。每3天更换一次培养基,持续4周。4周后,用4%PFA在室温下固定细胞15min。用无菌水和60%异丙醇洗涤细胞。0.5%油红O在异丙醇中染色30min。用无菌水冲洗细胞三次。为了成骨分化,在80%的合流度下,细胞用成骨培养基(低糖DMEM培养基,10%胎牛血清,1%P/S,100nM地塞米松,10mMβ-甘油磷酸和50μg/mL抗坏血酸-2-磷酸)处理。每3天更换一次培养基,持续3周。然后,用4%PFA固定细胞,按照制造商的说明使用碱性磷酸酶染色试剂盒(Millipore)确认成骨分化。为了软骨分化,细胞在1000rpm下离心10min。在细胞颗粒中仔细加入成软骨培养基(高糖DMEM、20ng/mL TGF-β3、100nM地塞米松、50ng/mL抗坏血酸-2-磷酸、1mM丙酮酸钠、1×ITS(胰岛素6.25μg/mL、转铁蛋白6.25μg/mL、亚硒酸6.25ng/mL)、50μg/mL脯氨酸),使其在37℃、5%CO
流式细胞术:用胰蛋白酶-EDTA分离hMSCs,用单细胞悬浮液制备。此外,细胞分别用CD73、CD90、CD105、CD14、CD34或CD45抗体染色(Biolegend,CA,USA)。此外,使用FACS细胞细胞仪(BD Biosciences,San Jose,CA)对细胞进行评估。
结果发现该细胞群对CD73、CD90和CD105呈阳性,而对CD14、CD34和CD45呈阴性(图1中A-F)。结果表明,MSCs来源于人脐带。接下来,本发明将细胞分化为成骨、成脂和成软骨谱系,以显示分离的hMSCs的多能性。分化21d后,成骨组细胞外基质(ECM)矿化,茜素红染色显示出钙化(图2中A)。在成脂分化组,脂质Oil Red O染色显示细胞内脂质囊泡积聚(图2中B)。软骨细胞组阿利新蓝染色显示软骨形成(图2中C)。
3.miR-216a-5p慢病毒载体的构建与转染
miR-216a-5p模拟物和正常对照(NC)来自GenePharma(Shanghai,China)。利用Lipofectamine 2000(Invitrogen,Carlsbad,USA),按照生产商的说明书将miR-216a-5p模拟物和NC慢病毒分别转染到hMSCs中。24h后,用5μg/mL嘌呤霉素(Sigma-Aldrich)筛选稳定表达的克隆,分别得到过表达miR-216a-5p的hMSCs和过表达NC的hMSCs。miR-control和miR-216a-5p模拟物的序列分别为:NC mimics-F:UUCUCCGAACGUGUCACGUTT(SEQ ID NO.1)、NC mimics-R:ACGUGACACGUUCGGAGAATT(SEQ ID NO.2);miR-216a-5pmimics-F:5'-UAAUCUCAGCUGGCAACUGUGA-3'(SEQ ID NO.3)和miR-216a-5pmimics-R:5'-ACAGUUGCCAGCUGAGAUUAUU-3'(SEQ ID NO.4)。
4.脱细胞基质温度敏感水凝胶的制备与表征
在无菌条件下取健康成年家兔小肠,去除质膜及邻近脂肪组织,切开肠管,在此过程中用蒸馏水在4℃下连续冲洗。然后在4℃下缓慢裂解肠道,用0.01%SDS(质量/体积)脱细胞24h,用7%CHAPS溶液洗涤48h。1%(vol/vol)Triton X-100溶液洗涤30min,再用去离子水洗涤去除残留洗涤剂,最后将脱细胞组织冻干,4℃保存备用。将脱细胞小肠用0.01M盐酸磨碎,调整浓度至10mg/mL,加入胃蛋白酶裂解脱细胞小肠组织48h。加入1/10体积0.1M氢氧化钠调节pH至7.2-7.4,加入1/9体积10×PBS调节渗透溶液至等渗,获得温度敏感型小肠水凝胶。最后,将获得的温度敏感型小肠水凝胶放入4℃的冰箱中备用。温度敏感型小肠水凝胶制备过程的实物图见图3。
经测试,本实施例制备的温度敏感型小肠水凝胶在不同温度呈现出不同的状态(图4),并且在生理盐水环境中具有明显的温度敏感性,其溶胀率随着温度的升高而降低,其低临界溶液温度出现在37.5℃左右(图5)。
5.水凝胶复合透明质酸钠的制备及间充质干细胞的包封
取上述制备好的温度敏感型小肠水凝胶4mL,加入80μL透明质酸水溶液(该透明质酸水溶液中透明质酸的浓度为40mg/mL,该透明质酸购自Sigma-Aldrich,USA),继续搅拌至均匀,最终形成含透明质酸钠的水凝胶(HA-gel)。将HA-Gel水凝胶倒入消毒过的玻璃小瓶中,在37℃下磁力搅拌。缓慢加入10
按照上述同样的方法,将过表达miR-216a-5p的hMSCs替换为过表达NC的hMSCs,制备得到hMSCs-gel/NC agomiR。
实施例2
1.方法
1.1脊髓损伤(SCI)大鼠模型的建立及分组
健康成年雄性SD大鼠,体重220~260g,饲养于首都医科大学实验动物中心。动物饲养在SPF动物中心23±0.5℃的受控环境中,光照/黑暗循环12h。最初,大鼠腹腔注射浓度为3mL/kg体重的10%水合氯醛深度麻醉。本发明通过切开背部的皮肤和肌肉进一步暴露了脊柱。本发明进一步切除T10椎板。暴露脊髓后,用10g棒将大鼠从12.5mm的高度扔下。接下来,这些老鼠被迅速缝合并仔细监测。手动轻抽大鼠膀胱,直至大鼠膀胱恢复,排尿反射控制恢复。最初,大鼠腹腔注射浓度为3mL/kg体重的10%水合氯醛深度麻醉。
将大鼠随机分为假手术组(Sham)、脊髓损伤组(SCI组)、阴性对照组(hMSCs-gel/NC agomiR)和过表达组(hMSCs-gel/miR-216a-5p agomiR)(n=6/组)。脊髓损伤组、阴性对照组和过表达组均行脊髓损伤,阴性对照组鞘内注射hMSCs-gel/NC agomiR,过表达组鞘内注射hMSCs-gel/miR-216a-5p agomiR,假手术组和脊髓损伤组鞘内注射等量生理盐水。
1.2行为学测试
从脊髓损伤后第1天开始进行运动试验,并进行Basso-Beattie-Bresnahan(BBB)试验评估脊髓损伤大鼠运动功能的恢复情况。先将大鼠置于开阔场地,评估其肢体运动、负重、协调和两后肢行走等行为4min,并考虑两后肢的平均BBB评分进行进一步分析。分别于SC损伤后第1、3、7、14、21、28天进行测量。所有评估均由两名盲法审查员进行。
采用机械戒断阈值(MWT,in g)和热戒断潜伏期(TWL,in s)评估脊髓损伤大鼠模型的超敏反应。为了评估MWT,将大鼠置于透明塑料盒中,底部有金属网。使用校准过的电子von Frey灯丝(Electronic von Frey 2393;IITC,伍德兰山,美国)。用TWL来评估对热的超敏反应。采用45℃加热和30s截止时间来评估刺激后的阈值戒断。
1.3TUNEL染色
切片用4%PFA(可溶性聚四氟乙烯)固定,用1%BSA(牛血清白蛋白)封闭。进一步,切片用TUNEL比色反应混合物(Promega,美国)孵育,并用DAPI(4',6-二脒基-2-苯基吲哚)染色。使用荧光显微镜获得图像。观察各组TUNEL阳性细胞数。
1.4实时聚合酶链反应
根据制造商的方案,使用TRIzol试剂(Invitrogen)从L4-L6脊髓区域分离总RNA。逆转录酶PCR使用primer-script RT试剂盒(Takara Biotechnology,中国)进行,进一步的qRT-PCR使用SYBR绿色混合物(Bio-Rad,Hercules,CA)在ABI 7500热循环仪(AppliedBiosystems,美国)上进行。
2.结果
2.1hMSCs-gel/miR-216a-5p agomiR递送对脊髓损伤大鼠行为的影响
使用运动实验检查移植hMSCs-gel/miR-216a-5p agomiR的SCI大鼠的行为改变。与阴性对照组相比,过表达miR-216a-5p的SCI大鼠运动活动显著改善,BBB评分得到改善(图6中A)。此外,本发明检测了过表达组与阴性对照组的MWT和TWL,结果显示过表达miR-216a-5p可显著改善MWT和TWL水平(图6中B和C)。根据这些发现,过表达miR-216a-5p可显著改善SCI损伤大鼠模型的行为。
2.2hMSCs-gel/miR-216a-5p agomiR递送对神经元凋亡的影响
通过TUNEL凋亡实验检测miR-216a-5p过表达,发现脊髓损伤显著增加了大鼠脊髓中TUNEL阳性凋亡细胞的数量。移植hMSCs-gel/miR-216a-5p agomiR后,TUNEL阳性细胞凋亡明显减少(图7中A)。还进行了western blotting并评估了关键凋亡标志物(如cleavedcaspase-3、Bcl-2和Bax)的水平。脊髓损伤大鼠cleaved caspase-3和Bax水平升高,Bcl-2水平降低。移植hMSCs-gel/miR-216a-5p agomiR降低了cleaved caspase-3和Bax水平,同时增加了Bcl-2水平(图7中B)。这些结果表明,脊髓损伤确实增加了神经元的凋亡,这可以通过移植hMSCs-gel/miR-216a-5p agomiR来逆转。
2.3hMSCs-gel/miR-216a-5p agomiR递送对miR-216a-5p的影响
为了进一步了解miR-216a-5p对SCI的影响,本发明在移植hMSCs-gel/miR-216a-5pagomiR后,评估了脊髓损伤大鼠L4-L6脊髓标本中miR-216a-5p和NUDT21的相对水平,并将其与各自的对照组进行比较。结果如图8所示,与假手术组相比,脊髓损伤组的miR-216a-5p水平明显降低,阴性对照组的情况与之相似。然而,在移植了hMSCs-gel/miR-216a-5pagomiR的损伤大鼠中,miR-216a-5p的表达水平显著恢复。
以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
- 一种子宫内膜损伤修复的水凝胶及其制备方法
- 一种Cu-Ag双金属水凝胶的制备方法与一种晶体的制备方法
- 一种Ru-BSA水凝胶及其制备方法与应用
- 一种用于脊髓损伤修复的可注射水凝胶及其制备方法与应用
- 一种用于脊髓损伤的水凝胶材料及其制备方法和应用
