一种抑制肿瘤生长及肺转移的人工外泌体及其应用
文献发布时间:2024-04-18 20:01:23
技术领域
本发明涉及生物医药领域,具体涉及一种抑制肿瘤生长及肺转移的人工外泌体及其应用。
背景技术
肿瘤是威胁人类健康的重要因素,常规的抗肿瘤药物大多只能针对原位肿瘤,对转移性肿瘤的效果有限,因此有必要开发能有效抑制肿瘤转移的药物。研究发现除了癌细胞的固有特性外,肺部微环境与癌细胞之间的相互作用也参与了肺部病变的形成和发展。癌细胞可以扰乱肺脏重塑过程,启动一个恶性循环,支持肺部播散性肿瘤细胞的发展。值得注意的是,肺部微环境也会对肿瘤细胞进行重编程,赋予它们不同于原发癌症的特征,从而促进继发性转移。这些突破有助于阐明癌症肺转移级联反应并改变患者的治疗方法。
外泌体是一种由真核细胞分泌的50-150 nm 粒径的细胞外囊泡。对于骨肉瘤,外泌体是早期诊断和预测预后的有希望的生物标志物。此外,在肿瘤发展过程中,外泌体通过转移生物活性货物(包括脂质、蛋白质和调节RNA)来调节细胞生长、转移和血管生成。骨间充质干细胞来源的外泌体miRNA-769-5p通过靶向双特异性磷酸酶16 (DUSP16)促进骨肉瘤转移。此外,降低骨肉瘤中的miRNA-135a也可以抑制骨肉瘤进展和肺转移。然而,有研究报道单个miRNA作用具有不确定性和矛盾性,使其无法用作有效的治疗靶点。一组位于染色体上相邻的miRNA基因产生miRNA簇;组织成簇的miRNA可以共享相同的转录调节方式,因此它们可能是更可靠的生物标志物和药物靶标。
外泌体作为细胞间通讯, 参与生理和病理过程的货物分子从亲本细胞转移到受体细胞。这种细胞间运输可以针对邻近细胞,作为旁分泌信号的一种形式,和/或远处细胞,作为一种内分泌信号传导。这一特性赋予了外泌体作为靶向药物递送载体的巨大潜力。
发明内容
本发明的目的是提供一种抑制肿瘤肺转移miRNA簇表达的人工外泌体在转移性肿瘤中的治疗及药物中的应用。
本发明的另一目的是提供所述人工外泌体的制备方法,该方法简单,易于操作,成本低。
本发明还提供所述外泌体的应用。
本发明的目的采用如下技术方案实现:
一种用于治疗转移性肿瘤的人工外泌体,所述的人工外泌体为外泌体膜包裹的miRNA-194-5p/miRNA-215-5p簇拮抗剂纳米颗粒所得;所述的miRNA-194-5p /miRNA-215-5p簇拮抗剂纳米颗粒为含有针对miRNA-194-5p的拮抗剂和针对miRNA-215-5p的拮抗剂的纳米颗粒;miRNA-194-5p序列如SEQ ID NO.1所示,miRNA-215-5p序列如SEQ ID NO.2所示。
作为本发明的一种优选,所述的miRNA-194-5p/miRNA-215-5p簇拮抗剂纳米颗粒由阳离子牛血清白蛋白(CBSA)偶联针对miRNA-194-5p的拮抗剂和针对miRNA-215-5p的拮抗剂所得。
作为本发明的一种优选,针对miRNA-194-5p的拮抗剂为对5’-
作为本发明的一种优选,CBSA与miRNA-194-5p和miRNA-215-5p的质量比为45~25:1。
作为本发明的一种优选,所述的miRNA-194-5p和miRNA-215-5p簇纳米颗粒通过以下方法制备得到:将anta-miRNA-194-5p和anta-miRNA-215-5p用无RNA酶的水溶解后,按照比例与CBSA溶液混合,然后在0~4℃下孵育20~40分钟。
一种制备本发明所述的人工外泌体的制备方法,包括以下步骤:
a) 制备外泌体膜;
b) 制备miRNA-194-5p/miRNA-215-5p簇拮抗剂纳米颗粒;
c) 利用外泌体膜包被miRNA-194-5p/miRNA-215-5p簇拮抗剂纳米颗粒,形成所述人工外泌体。
作为本发明的一种优选,miRNA-194-5p/miRNA-215-5p簇拮抗剂纳米颗粒的制备方法为:将针对miR-194-5p和miR-215-5p的拮抗剂用无RNA酶的水溶解后,与CBSA溶液混合,然后在0~4℃下孵育20~40分钟。
作为本发明的一种优选,CBSA与针对miRNA-194-5p和miRNA-215-5p的拮抗剂的质量比为45~25:1;针对miRNA-194-5p的拮抗剂为对5’-
本发明还提供所述所述的人工外泌体的制备方法,包括如下步骤:
1、肿瘤细胞外泌体的分离:
a. 培养肿瘤细胞(例如HOS-LuT3)48小时。
b. 收集培养上清,并使用差速离心法分离外泌体。
c. 首次离心(2000 g,10分钟),收集上清。
d. 第二次离心(10000 g,30分钟),再次收集上清。
e. 第三次离心(110000 g,70分钟),收集沉淀,并用PBS重悬。
f. 第四次离心(110000 g,70分钟),收集并重悬外泌体于适量PBS中。
2、外泌体膜的制备:
a. 将收集的外泌体重悬于冰冷的Tris-MgCl2缓冲液中。
b. 在-80℃下快速冷冻,然后在室温下解冻。
c. 重复冻融循环五次以上。
d. 将混合物与1M蔗糖混合至终浓度0.25M,后2000 g离心10分钟。
e. 收集上清,加入RNA酶,进一步3000 g离心30分钟,收集外泌体膜。
f. 用0.25M蔗糖的低温TM缓冲液洗涤外泌体膜,再3000 g离心30分钟。
3、miRNA-194-5p/miRNA-215-5p簇拮抗剂纳米颗粒的制备:
a. 用无RNA酶水将anta-miRNA-194-5p和anta-miRNA-215-5p按照质量比1:1溶解。
b. 按照比例(anta-miRNA/CBSA = 1/30,w/w)将anta-miRNA-194-5p和anta-miRNA-215-5p溶液与CBSA溶液混合,使得CBSA终浓度为1 mg/mL,然后在4℃下孵育30分钟。
4、人工外泌体纳米颗粒的制备:
a. 将miRNA-194-5p/miRNA-215-5p簇拮抗剂纳米颗粒与外泌体膜按照质量比1:1混合,在4℃下共孵育30分钟。
b. 在37℃下振荡孵育1小时。
c. 将混合物通过200 nm聚碳酸酯膜共挤出20次,以形成anta-miRNAs@Exo纳米颗粒。
本发明所述的人工外泌体的医药用途。
本发明所述的人工外泌体在制备治疗肿瘤和/或肿瘤转移的药物中的应用;所述的肿瘤优选骨肉瘤、乳腺癌、黑色素瘤。
有益效果
本发明使用外泌体膜包裹组织成簇的miRNA-194-5p/miRNA-215-5p的拮抗剂制备成人工外泌体,充分利用了外泌体膜的转运功能,miRNA-194-5p/miRNA-215-5p的拮抗剂与外泌体膜协同起效,显著抑制肿瘤生长和转移。
附图说明
图1 抑制骨肉瘤转移纳米颗粒anta-miRNA@Exo的电位。
图2 抑制骨肉瘤转移纳米颗粒anta-miRNA@Exo的粒径。
图3抑制骨肉瘤转移纳米颗粒anta-miRNA@Exo的透射电镜图。
图4 抑制骨肉瘤转移纳米颗粒anta-miRNA@Exo的细胞递送荧光图。
左一图为红色荧光标记的anta-miRNA194-5p,左二图绿色荧光标记的anta-miRNA215-5p,左三图为鬼笔环肽标记的细胞骨架,右图为合并三种荧光图。
图5 抑制骨肉瘤转移纳米颗粒anta-miRNA@Exo在体内递送的分布图。
上方显示了不同的检测时间,右边的标尺显示了荧光强度,标尺上由下至上荧光强度逐渐减小。
图6 不同比例的anta-miRNAs@Exo对骨肉瘤生长的影响。
图7 抑制骨肉瘤转移纳米颗粒anta-miRNAs@Exo抑制骨肉瘤生长。
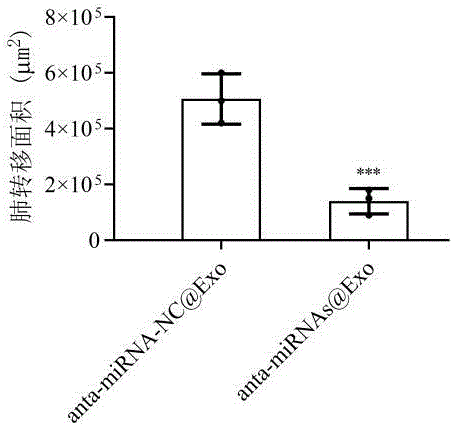
图8 抑制骨肉瘤转移纳米颗粒anta-miRNAs@Exo抑制骨肉瘤转移。
图9 抑制乳腺癌转移纳米颗粒anta-miRNAs@Exo抑制乳腺癌生长。
图10 抑制乳腺癌转移纳米颗粒anta-miRNAs@Exo抑制乳腺癌转移。
图11 抑制黑色素瘤转移纳米颗粒anta-miRNAs@Exo抑制黑色素瘤生长。
图12 抑制黑色素瘤转移纳米颗粒anta-miRNAs@Exo抑制黑色素瘤转移。
具体实施方式
实施例1 抑制骨肉瘤转移纳米颗粒anta-miRNAs@Exo的制备
抑制骨肉瘤转移miRNA簇表达的人工外泌体anta-miRNAs@Exo纳米颗粒的制备方法,包括如下步骤:
(1)骨肉瘤细胞外泌体(HOS-LuT3-Exo)的分离
传代骨肉瘤细胞HOS-LuT3培养48 h后收集的上清,采用差速离心法分离外泌体。第一次离心(4℃,2000 g,10 min)收集上清,第二次离心(4℃,10000 g,30 min)收集上清。第三次离心(4℃,110000 g,70 min)收集沉淀,用PBS重悬,第四次离心(4℃,110000 g,70min)收集外泌体,用适量PBS重悬外泌体。
(2)外泌体膜的制备
将外泌体重悬在冰冷的Tris (0.01 M)-镁(0.001 M MgCl
(3)CBSA-miRNA簇拮抗剂 (CBSA-anta-miRNAs) 纳米颗粒的制备
miR-194-5p序列:5’-GCCTGTAACAGCAACTCCATGTGG-3’(SEQ ID NO.1),
miR-215-5p序列:5’-GCCGCGATGACCTATGAATTG-3’(SEQ ID NO.2),
miR-194-5p拮抗剂序列:5’-
miR-215-5p拮抗剂序列:5’-
用无RNA酶水将anta-miRNA-194-5p和anta-miRNA-215-5p按照质量比1:1溶解。按照不同比例(anta-miRNA/CBSA = 1/45,1/40,1/35,1/30,1/25,w/w)将anta-miRNA-194-5p和anta-miRNA-215-5p溶液与CBSA溶液混合,使得CBSA终浓度为1 mg/mL,并在4℃下孵育30分钟,获得含有不同浓度miRNA簇拮抗剂的CBSA-anta-miRNAs纳米颗粒。
(4)anta-miRNAs@Exo纳米颗粒的制备
采用孵育和挤出法用外泌体膜包被CBSA-anta-miRNAs制备anta-miRNAs@Exo纳米颗粒。首先将CBSA-anta-miRNAs纳米颗粒和外泌体膜按照质量比1:1混合,4℃下孵育30分钟,然后在37℃下振荡孵育1小时。随后将混合物通过 200 nm 聚碳酸酯膜共挤出20次,获得anta-miRNAs@Exo纳米颗粒。
实施例2 抑制乳腺癌转移纳米颗粒anta-miRNAs@Exo的制备
抑制乳腺癌转移miRNA簇表达的人工外泌体anta-miRNAs@Exo纳米颗粒的制备方法,包括如下步骤:
(1)乳腺癌细胞外泌体(MDA-MB-231-LuT3-Exo)的分离
传代乳腺癌细胞MDA-MB-231-LuT3培养48 h后收集的上清,采用差速离心法分离外泌体。第一次离心(4℃,2000 g,10 min)收集上清,第二次离心(4℃,10000 g,30 min)收集上清。第三次离心(4℃,110000 g,70 min)收集沉淀,用PBS重悬,第四次离心(4℃,110000 g,70 min)收集外泌体,用适量PBS重悬外泌体。
(2)外泌体膜的制备
将外泌体重悬在冰冷的Tris (0.01 M)-镁(0.001 M MgCl
(3)CBSA-miRNA簇拮抗剂 (CBSA-anta-miRNAs) 纳米颗粒的制备
用无RNA酶水将anta-miRNA-194-5p和anta-miRNA-215-5p按照质量比1:1溶解。按照比例(anta-miRNA/CBSA = 1/30,w/w)将anta-miRNA-194-5p和anta-miRNA-215-5p溶液与CBSA溶液混合,使得CBSA终浓度为1 mg/mL,并在4℃下孵育30分钟。
(4)anta-miRNAs@Exo纳米颗粒的制备
采用孵育和挤出法用外泌体膜包被CBSA-anta-miRNAs制备anta-miRNAs@Exo纳米颗粒。首先将CBSA-anta-miRNAs纳米颗粒和外泌体膜按照质量比1:1混合,4℃下孵育30分钟,然后在37℃下振荡孵育1小时。随后将混合物通过 200 nm 聚碳酸酯膜共挤出20次,获得anta-miRNAs@Exo纳米颗粒。
实施例3 抑制黑色素瘤转移纳米颗粒anta-miRNAs@Exo的制备
抑制黑色素瘤转移miRNA簇表达的人工外泌体anta-miRNAs@Exo纳米颗粒的制备方法,包括如下步骤:
(1)黑色素瘤细胞外泌体(A375-LuT3-Exo)的分离
传代黑色素瘤细胞A375-LuT3培养48 h后收集的上清,采用差速离心法分离外泌体。第一次离心(4℃,2000 g,10 min)收集上清,第二次离心(4℃,10000 g,30 min)收集上清。第三次离心(4℃,110000 g,70 min)收集沉淀,用PBS重悬,第四次离心(4℃,110000 g,70 min)收集外泌体,用适量PBS重悬外泌体。
(2)外泌体膜的制备
将外泌体重悬在冰冷的Tris (0.01 M)-镁(0.001 M MgCl
(3)CBSA-miRNA簇拮抗剂 (CBSA-anta-miRNAs) 纳米颗粒的制备
用无RNA酶水将anta-miRNA-194-5p和anta-miRNA-215-5p按照质量比1:1溶解。按照比例(anta-miRNA/CBSA = 1/30,w/w)将anta-miRNA-194-5p和anta-miRNA-215-5p溶液与CBSA溶液混合,使得CBSA终浓度为1 mg/mL,并在4℃下孵育30分钟。
(4)anta-miRNAs@Exo纳米颗粒的制备
采用孵育和挤出法用外泌体膜包被CBSA-anta-miRNAs制备anta-miRNAs@Exo纳米颗粒。首先将CBSA-anta-miRNAs纳米颗粒和外泌体膜按照质量比1:1混合,4℃下孵育30分钟,然后在37℃下振荡孵育1小时。随后将混合物通过 200 nm 聚碳酸酯膜共挤出20次,获得anta-miRNAs@Exo纳米颗粒。
实施例4 荧光anta-miRNAs@Exo纳米颗粒的制备
1.双色荧光anta-miRNAs@Exo纳米颗粒的制备方法,包括如下步骤:
(1)骨肉瘤细胞外泌体(HOS-LuT3-Exo)的分离
传代骨肉瘤细胞HOS-LuT3培养48 h后收集的上清,采用差速离心法分离外泌体。第一次离心(4℃,2000 g,10 min)收集上清,第二次离心(4℃,10000 g,30 min)收集上清。第三次离心(4℃,110000 g,70 min)收集沉淀,用PBS重悬,第四次离心(4℃,110000 g,70min)收集外泌体,用适量PBS重悬外泌体。
(2)外泌体膜的制备
将外泌体重悬在冰冷的Tris (0.01 M)-镁(0.001 M MgCl
(3)双色荧光CBSA-miRNA簇拮抗剂 (CBSA-anta-miRNAs)纳米颗粒的制备
用无RNA酶水将Cy5荧光标记的anta-miRNA-194-5p和FAM荧光标记的anta-miRNA-215-5p按照质量比1:1溶解。按照比例(荧光anta-miRNA/CBSA = 1/30,w/w)将anta-miRNA-194-5p和anta-miRNA-215-5p溶液与CBSA溶液混合,使得CBSA终浓度为1 mg/mL,并在4℃下孵育30分钟。
(4)双色荧光anta-miRNAs@Exo纳米颗粒的制备
采用孵育和挤出法用外泌体膜包被荧光CBSA-anta-miRNA制备荧光anta-miRNA@Exo纳米颗粒。首先将荧光CBSA-anta-miRNAs纳米颗粒和外泌体膜按照质量比1:1混合,4℃下孵育30分钟,然后在37℃下振荡孵育1小时。随后将混合物通过 200 nm 聚碳酸酯膜共挤出20次,获得双色荧光anta-miRNAs@Exo纳米颗粒。
2.单色荧光anta-miRNA@Exo纳米颗粒的制备方法,包括如下步骤:
(1)骨肉瘤细胞外泌体(HOS-LuT3-Exo)的分离和染色
传代骨肉瘤细胞HOS-LuT3培养48 h后收集的上清,采用差速离心法分离外泌体。第一次离心(4℃,2000 g,10 min)收集上清,第二次离心(4℃,10000 g,30 min)收集上清。第三次离心(4℃,110000 g,70 min)收集沉淀,用PBS重悬,第四次离心(4℃,110000 g,70min)收集外泌体,用适量PBS重悬外泌体。外泌体用荧光染料PKH26染色30分钟,离心(4℃,110000 g,70 min)收集荧光的外泌体。
(2)PKH26荧光标记的外泌体膜的制备
将PKH26荧光标记的外泌体重悬在冰冷的Tris (0.01 M)-镁(0.001 M MgCl
(3)CBSA-miRNA拮抗剂 (CBSA-anta-miRNA)纳米颗粒的制备
用无RNA酶水将anta-miRNA-194-5p和anta-miRNA-215-5p按照质量比1:1溶解。按照比例(anta-miRNA/CBSA = 1/30,w/w)将anta-miRNA-194-5p和anta-miRNA-215-5p溶液与CBSA溶液混合,使得CBSA终浓度为1 mg/mL,并在4℃下孵育30分钟。
(4)PKH26荧光标记的anta-miRNA@Exo纳米颗粒的制备
采用孵育和挤出法用带荧光的外泌体膜包被CBSA-anta-miRNA制备单色荧光anta-miRNA@Exo纳米颗粒。首先将CBSA-anta-miRNA纳米颗粒和PKH26荧光标记的外泌体膜按照质量比1:1混合,4℃下孵育30分钟,然后在37℃下振荡孵育1小时。随后将混合物通过200 nm 聚碳酸酯膜共挤出20次,获得PKH26荧光标记的anta-miRNA@Exo纳米颗粒。
实施例5 对照纳米颗粒的制备
1. 抑制miRNA-194-5p表达的人工外泌体anta-miRNA-194-5p@Exo纳米颗粒的制备方法,包括如下步骤:
(1)骨肉瘤细胞外泌体(HOS-LuT3-Exo)的分离
传代骨肉瘤细胞HOS-LuT3培养48 h后收集的上清,采用差速离心法分离外泌体。第一次离心(4℃,2000 g,10 min)收集上清,第二次离心(4℃,10000 g,30 min)收集上清。第三次离心(4℃,110000 g,70 min)收集沉淀,用PBS重悬,第四次离心(4℃,110000 g,70min)收集外泌体,用适量PBS重悬外泌体。
(2)外泌体膜的制备
将外泌体重悬在冰冷的Tris (0.01 M)-镁(0.001 M MgCl
(3)CBSA-miRNA-194-5p拮抗剂 (CBSA-anta-miRNA) 纳米颗粒的制备
用无RNA酶水将anta-miRNA-194-5p溶解,按照比例(anta-miRNA/CBSA = 1/30,w/w)将anta-miRNA-194-5p溶液与CBSA溶液混合,使得CBSA终浓度为1 mg/mL,然后立即混合并在4℃下孵育30分钟。
(4)anta-miRNA-194-5p @Exo纳米颗粒的制备
采用孵育和挤出法用外泌体膜包被CBSA-anta-miRNA-194-5p制备anta-miRNA-194-5p @Exo纳米颗粒。首先将CBSA-anta-miRNA-194-5p纳米颗粒和外泌体膜按照质量比1:1混合,4℃下孵育30分钟,然后在37℃下振荡孵育1小时。随后将混合物通过 200 nm 聚碳酸酯膜共挤出20次,获得anta-miRNA-194-5p @Exo纳米颗粒。
2. 抑制miRNA-215-5p表达的人工外泌体anta-miRNA-215-5p@Exo纳米颗粒的制备方法,包括如下步骤:
(1)骨肉瘤细胞外泌体(HOS-LuT3-Exo)的分离
传代骨肉瘤细胞HOS-LuT3培养48 h后收集的上清,采用差速离心法分离外泌体。第一次离心(4℃,2000 g,10 min)收集上清,第二次离心(4℃,10000 g,30 min)收集上清。第三次离心(4℃,110000 g,70 min)收集沉淀,用PBS重悬,第四次离心(4℃,110000 g,70min)收集外泌体,用适量PBS重悬外泌体。
(2)外泌体膜的制备
将外泌体重悬在冰冷的Tris (0.01 M)-镁(0.001 M MgCl
(3)CBSA-miRNA-215-5p拮抗剂 (CBSA-anta-miRNA) 纳米颗粒的制备
用无RNA酶水将anta-miRNA-215-5p溶解,按照比例(anta-miRNA/CBSA = 1/30,w/w)将anta-miRNA-215-5p溶液与CBSA溶液混合,使得CBSA终浓度为1 mg/mL,然后立即混合并在4℃下孵育30分钟。
(4)anta-miRNA-215-5p @Exo纳米颗粒的制备
采用孵育和挤出法用外泌体膜包被CBSA-anta-miRNA-215-5p制备anta-miRNA-215-p@Exo纳米颗粒。首先将CBSA-anta-miRNA-215-p纳米颗粒和外泌体膜按照质量比1:1混合,4℃下孵育30分钟,然后在37℃下振荡孵育1小时。随后将混合物通过 200 nm 聚碳酸酯膜共挤出20次,获得anta-miRNA-215-5p @Exo纳米颗粒。
3. 对照人工外泌体anta-miRNA-NC@Exo纳米颗粒的制备方法,包括如下步骤:
(1)骨肉瘤细胞外泌体(HOS-LuT3-Exo)的分离
传代骨肉瘤细胞HOS-LuT3培养48 h后收集的上清,采用差速离心法分离外泌体。第一次离心(4℃,2000 g,10 min)收集上清,第二次离心(4℃,10000 g,30 min)收集上清。第三次离心(4℃,110000 g,70 min)收集沉淀,用PBS重悬,第四次离心(4℃,110000 g,70min)收集外泌体,用适量PBS重悬外泌体。
(2)外泌体膜的制备
将外泌体重悬在冰冷的Tris (0.01 M)-镁(0.001 M MgCl
(3)CBSA-miRNA-NC纳米颗粒的制备
用无RNA酶水将anta-miRNA-NC溶解,按照比例(anta-miRNA/CBSA = 1/30,w/w)将anta-miRNA-NC溶液与CBSA溶液混合,使得CBSA终浓度为1 mg/mL,然后立即混合并在4℃下孵育30分钟。
(4)anta-miRNA-NC @Exo纳米颗粒的制备
采用孵育和挤出法用外泌体膜包被CBSA-anta-miRNA-NC 制备anta-miRNA-NC@Exo纳米颗粒。首先将CBSA-anta-miRNA-NC纳米颗粒和外泌体膜按照质量比1:1混合,4℃下孵育30分钟,然后在37℃下振荡孵育1小时。随后将混合物通过 200 nm 聚碳酸酯膜共挤出20次,获得anta-miRNA-NC @Exo纳米颗粒。
实施例6 anta-miRNAs@Exo纳米颗粒的生物特性分析
本实施例中CBSA-anta-miRNAs纳米颗粒来源于实施例1,按照比例anta-miRNA/CBSA = 1/30 (w/w)制备纳米颗粒,本实施例中anta-miRNAs@Exo 纳米颗粒来源于实施例1。
利用使用Malvern Nano ZS90 Particle Size Potentiometer分析仪检测纳米颗粒的zeta电位,检测结果显示CBSA-anta-miRNAs纳米颗粒的电荷为21.83±1.01 mV,而anta-miRNAs@Exo纳米颗粒的电荷为−24.43±0.70 mV,与外泌体表面的电荷(−26.53±1.01 mV)相似(图1),表明anta-miRNAs@Exo纳米颗粒表面已经成功包被了外泌体膜。Malvern Zetasizer Nano分析粒径显示,anta-miRNAs@Exo纳米颗粒的平均粒径为229.13±7.75 nm(图2)。从图3可见,anta-miRNAs@Exo纳米颗粒在透射电镜下呈典型的囊泡结构,证实anta-miRNAs@Exo纳米颗粒表面已经成功包被了外泌体膜。
实施例7 anta-miRNAs@Exo纳米颗粒细胞递送能力评估
本实施例中双荧光标记的anta-miRNAs@Exo纳米颗粒来源于实施例4。
将荧光anta-miRNAs@Exo纳米颗粒与传代骨肉瘤HOS细胞共孵育24小时,随后检测细胞中荧光强度,实验结果如图4,孵育细胞中呈现明显的FAM(绿色)和Cy5(红色)信号,表明荧光anta-miRNAs@Exo纳米颗粒能够有效递送miRNA-194-5p /215-5p簇拮抗剂。
实施例8 anta-miRNAs@Exo纳米颗粒体内递送能力评估
本实施例中荧光anta-miRNAs@Exo纳米颗粒来源于实施例4。
将anta-miRNA-194-5p /215-5p装载到PKH26标记的外泌体膜囊泡中,制备荧光anta-miRNAs@Exo纳米颗粒,并通过尾静脉注射到原位骨肉瘤小鼠体内。小鼠活体成像仪观察结果显示,注射24小时后小鼠胫骨肿瘤富集的BLI信号最强,证明了外泌体膜囊泡系统能够将anta-miRNA-194-5p /215-5p递送到原位骨肉瘤细胞(图5)。
实施例9 anta-miRNAs@Exo纳米颗粒抑制原位骨肉瘤转移的作用
本实施例中anta-miRNAs@Exo 纳米颗粒来源于实施例1,外泌体HOS-LuT3-Exo来源于实施例1。
为了考察不同比例的anta-miRNA和CBSA 对anta-miRNAs@Exo纳米颗粒抑制原位骨肉瘤转移作用的影响,动物分为6组,分别为PBS组,anta-miRNA和CBSA比为1:45组,anta-miRNA和CBSA比为1:40组,anta-miRNA和CBSA比为1:35组,anta-miRNA和CBSA比为1:30组,anta-miRNA和CBSA比为1:25组。传代骨肉瘤HOS细胞原位注射到6~ 8周龄NCG-HLA-A2.1雄性小鼠胫骨中。3 d后,每3天尾静脉注射1.25×10
进一步考察anta-miRNAs@Exo纳米颗粒抑制原位骨肉瘤转移作用,实验分为4组,分别为anta-miRNAs@Exo组、anta-miRNA-194-5p@Exo组、anta-miRNA-215-5p@Exo组和anta-miRNA-NC@Exo组。传代骨肉瘤HOS细胞原位注射到6~ 8周龄NCG-HLA-A2.1雄性小鼠胫骨中。3 d后,每3天尾静脉注射1.25×10
实施例10 anta-miRNAs@Exo纳米颗粒抑制乳腺癌转移的作用
本实施例中anta-miRNAs@Exo 纳米颗粒来源于实施例2,MDA-MB-231-LuT3-Exo来源于实施例2。
为了考察anta-miRNAs@Exo纳米颗粒抑制乳腺癌转移的作用,动物分为2组,分别为anta-miRNAs@Exo组和anta-miRNA-NC@Exo组。传代乳腺癌MDA-MB-231细胞接种到7~ 8周龄NCG-HLA-A2.1雌性小鼠乳腺。3 d后,每3天尾静脉注射1.25×10
实施例11 anta-miRNAs@Exo纳米颗粒抑制黑色素瘤转移的作用
本实施例中anta-miRNAs@Exo 纳米颗粒来源于实施例3,A375-LuT3-Exo来源于实施例3。
为了考察anta-miRNAs@Exo纳米颗粒抑制黑色素瘤转移的作用,动物分为2组,分别为anta-miRNAs@Exo组和anta-miRNA-NC@Exo组。传代人恶性黑色素瘤A375细胞注射到6~8周龄NCG-HLA-A2.1雄性小鼠皮下。3 d后,每3天尾静脉注射1.25×10
本说明书中CBSA-miRNA簇拮抗剂纳米颗粒和miRNA-194-5p/miRNA-215-5p簇拮抗剂纳米颗粒为相同概念的两种表述。
- 一种刚挠结合多层板阻焊制作方法
- 厚铜多层板压合制作方法及厚铜多层板
- 一种超厚多层板及其压合制作方法
