一株膜醭毕赤酵母XML001及其应用
文献发布时间:2024-04-18 20:01:23
技术领域
本申请涉及泡菜生产技术领域,特别是一株用于加速云南泡小米辣发酵过程“生花”表征的膜醭毕赤酵母XML001及其应用。
背景技术
泡菜是我国代表性发酵蔬菜,是指以新鲜蔬菜等为主要原料,添加或不添加辅料,经食用盐或食用盐水渍制,利用新鲜蔬菜表面的微生物进行发酵并产生特殊风味物质的蔬菜制品。
为避免影响泡菜的口感和发酵效果,并不进行特定灭菌处理,在发酵过程中,泡菜容易受病原菌、污染菌污染,影响泡菜风味和品质。
“生花”是泡制蔬菜发酵过程中常见的腐败现象,泡菜表面会出现一层白膜,泡菜水易出现浑浊,长时间无法消除时,会出现馊酸味,降低菜的脆度,导致腐烂变质,无法食用,造成经济损失。
针对泡制蔬菜制品“生花”现象,现有技术中为防止泡制蔬菜制品“生花”,提升产品稳定性从装置、方法等多个方面提供了解决方法:例如CN201920725600.2中公开了一种防生花的装置,该装置设计复杂,增加生产成本,无法适用于泡制蔬菜制品的工业化大规模生产。
CN201510849442.8中公开了一种抑制泡菜生花的方法,利用肠膜明串株菌按10
CN201310395803.7中公开了一种泡菜生花病害菌分选挑取方法,对疑似的病害生花微生物进行了接种培养和分离,但该方法无法直接解决生花问题,无法有效防治生花微生物。
现有膜醭毕赤酵母主要用于清除棒曲霉素(CN201210044927.6)、手性合成(R)-1,3-丁二醇(CN201510055145.6),棒曲霉素并不属于泡菜中的致霉菌,且未见膜醭毕赤酵母在泡制蔬菜制品中的相关应用报道。
公开于背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不应当被视为承认或以任何形式暗示该信息构成已为本领域普通技术人员所公知的现有技术。
发明内容
本申请针对上述技术问题提供了一株膜醭毕赤酵母XML001及其应用,所分离得到的膜醭毕赤酵母用于泡小米辣发酵中能有效加快“生花”表征,获得对该菌引起的泡小米辣泡菜“生花”控制参数,可有效防治泡小米辣产品发酵过程中的“生花”。
本申请提供了一种用于加速泡小米辣“生花”表征的膜醭毕赤酵母XML001,膜醭毕赤酵母XML001菌株的保藏号:CGMCC No.28332。
优选地,膜醭毕赤酵母XML001的分离方法包括以下步骤:
1)将“生花”小米辣发酵液至于10mL浓度为0.9%的无菌生理盐水中,搅匀后以150rpm、30℃下培养30min,得到发酵液;
2)将发酵液采用10倍稀释法稀释到10
优选地,膜醭毕赤酵母XML001的发酵液制备方法为:纯化的XML001菌株接种于PD培养基中,在摇床上150rpm、30℃下好氧环境下培养24~48h得到发酵液。
本申请的另一方面还提供了一种加速泡小米辣“生花”表征的方法,将如上述膜醭毕赤酵母XML001接种于小米辣与泡制水的混合物中,进行泡小米辣“生花”表征。
优选地,膜醭毕赤酵母XML001的接种量为混合物的10
优选地,泡小米辣“生花”表征包括以下步骤:将所得混合物在常温常压下静置有氧发酵3天。
优选地,泡制水的pH为5.6,泡制水中盐浓度为11%,泡制水中乙醇浓度为2%。
优选地,小米辣与泡制水按体积比为1:2混合;
优选地,泡制料为泡制水为量百分比为11%的食用盐、2%的49~51°白酒、3%的麦芽糖添加于水中制得。
本申请的另一方面还提供了一种防治泡小米辣“生花”的方法,包括以下步骤:将小米辣与泡制水的混合物在常温常压下,厌氧条件下静置发酵得到小米辣泡菜制品;
泡制水的pH为2.5;或泡制水中盐浓度为14%;或泡制水中乙醇浓度为10%;
满足上述任一指标的泡小米辣在发酵过程中均能防治如上述用于加速泡小米辣“生花”表征的膜醭毕赤酵母XML001引发的“生花”。
优选地,获得一种防治小米辣发酵过程中“生花”的措施,包括以下步骤,泡制料为泡制水质量百分比为11~14%的食用盐、2~10%的白酒、3%的麦芽糖添加于水中,用冰乙酸调节泡制水pH为3.5~5.5得到;
优选地,小米辣与泡制水按体积比为1:2混合。
上述未详述的泡菜制备步骤操作,均按现有工业化泡菜生产工艺进行,例如灭菌等操作,在此不累述。
本申请能产生的有益效果包括:
1)本申请所提供的用于加速泡小米辣“生花”表征的膜醭毕赤酵母XML001及其应用,在“生花”泡菜中分离得到膜醭毕赤酵母,该菌接种于泡小米辣制品中进行“生花”试验能加速结果表征,利用所分离得到的膜醭毕赤酵母可加速泡小米辣“生花”的表征作用特点,加速获得准确的控制泡小米辣“生花”参数,按所得控制参数制得的泡小米辣咸度和酸度适宜,且能在发酵过程中有效避免“生花”,提升产品品质。
2)本申请所提供的用于加速泡小米辣泡菜“生花”表征的膜醭毕赤酵母XML001及其应用,该菌可对泡小米辣的“生花”问题加速表征,可显著缩短其发酵“生花”已知措施的评估周期,当发酵环境体系分别为pH≤2.5、盐浓度≥14%、乙醇浓度≥10%和厌氧环境下,任一发酵工艺均可有效提升发酵蔬菜体系的防腐能力和品质稳定性。
附图说明
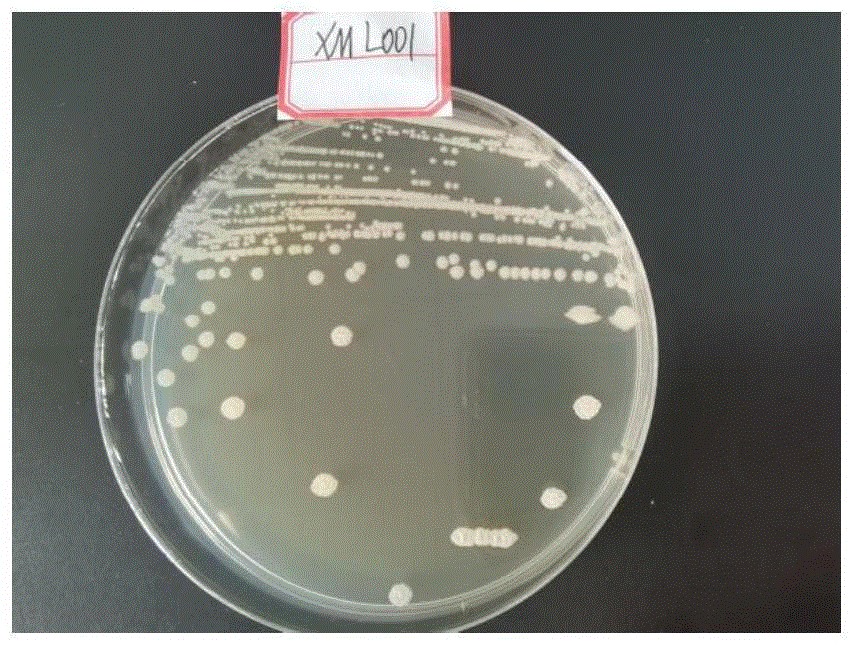
图1为本申请实施例中所得膜醭毕赤酵母XML001菌株在PDA培养基上生长的菌落形态图;
图2为本申请实施例中所得膜醭毕赤酵母XML001菌株的显微形态图;
图3为本申请实施例中所得膜醭毕赤酵母XML001菌株系统发育树;
图4为本申请实施例中所得膜醭毕赤酵母XML001菌株在有氧环境和厌氧环境下的生长状态图;
图5为本申请实施例中所得膜醭毕赤酵母XML001菌株在不同pH下的生长曲线图;
图6为本申请实施例中所得膜醭毕赤酵母XML001菌株在不同盐浓度下的生长曲线图;
图7为本申请实施例中所得膜醭毕赤酵母XML001菌株在不同乙醇浓度下的生长曲线图;
图8为本申请实施例中所得膜醭毕赤酵母XML001菌株发酵小米辣的生产工艺流程图;
膜醭毕赤酵母XML001,已于2023年09月01日保藏于中国微生物菌种保藏管理委员会普通微生物中心(CGMCC),地址:北京市朝阳区北辰西路1号院3号,邮政编码:100101,保藏号:CGMCC No.28332,鉴定为膜醭毕赤酵母(Pichia membranifaciens)。
具体实施方式
下面结合附图与实施例对本发明作进一步的详细说明,但不以任何方式对本发明加以限制,基于本发明教导所作的任何变换或改进,均落入本发明的保护范围。
实施例
以下实施例中所用物料和仪器如无特殊说明均为商业渠道获得;所用检测方法如无特殊说明,均为现有方法。
实施例
以下实施例中所用物料和仪器如无特殊说明均为商业渠道获得;所用检测方法如无特殊说明,均为现有方法。
实施例1膜醭毕赤酵母XML001的分离采集
1、材料准备:
菌株分离来源:泡池中“生花”泡制蔬菜发酵液。
商用马铃薯葡萄糖琼脂培养基(PDA培养基,环凯微生物021050)、冰乙酸、食用盐、49-51°白酒:市售购买。
2、产膜酵母分离与纯化
PDA固体培养基的制备:准确称取20.05g商用马铃薯葡萄糖琼脂培养基(PDA培养基),加入500mL蒸馏水,搅拌均匀,封瓶,放于高压灭菌锅中121℃,灭菌15min。灭菌后,在无菌超净工作台倒平板,每皿25mL,待冷却凝固后用于菌株的分离。
用接种环挑取3环泡制蔬菜发酵液“生花”于10mL浓度为0.9%的无菌生理盐水中,放置于摇床上150rpm、30℃培养30min,采用10倍稀释法,稀释到10
实施例2XML001菌株分类鉴定与保藏
1、XML001菌株形态分类鉴定
将纯化的XML001菌株在PDA培养基上划线,置于生化恒温培养箱中30℃,培养48h,观察其培养状态,其形态特征为:奶白色样菌落,形态扁平,略有褶状,边缘整齐。
2、XML001菌株显微形态图
用接种环挑取少量菌体置于洁净载玻片,进行革兰氏染色,在100X油镜下观察菌体细胞状态,结果见图2:营养体细胞为椭圆形,出芽生殖,多极芽殖,无假菌丝。
3、XML001菌株的分子鉴定
3.1NCBI序列比对结果
将纯化的产膜酵母菌株XML001送至上海生工生物公司进行测序,该菌株的18S基因序列片段大小580bp,在NCBI
(https://www.ncbi.nlm.nih.gov/)上进行BlastN比对后,结果显示XML001菌株与Pichia membranifaciens(登录号:MG983972.1)具有100%相似性。
3.2 18S基因序列构建系统发育树
基于18S基因序列的N-J(Neighbor-Joining)算法构建系统发育树,如图3所示:XML001菌株与膜醭毕赤酵母Pichia membranifaciens(登录号:KM521818.1)聚为一个分支,同源性为99%,Devereux学者认为同源性≥98%时,可认为是同一个种。因此,初步鉴定XML001菌株为膜醭毕赤酵母Pichia membranifaciens。
3.3XML001菌株保藏
已于2023年09月01日保藏于中国微生物菌种保藏管理委员会普通微生物中心(CGMCC),地址:北京市朝阳区北辰西路1号院3号,邮政编码:100101,保藏号:CGMCCNo.28332,鉴定为膜醭毕赤酵母(Pichia membranifaciens)。
实施例3XML001菌株的生长特性测定
1、PDA固体培养基的制备:准确称取20.05g商用PDA培养基,加入500mL蒸馏水,搅拌均匀,封瓶,放于高压灭菌锅中121℃,灭菌15min。灭菌后,在无菌超净工作台倒平板,每皿25mL,用于活菌数的检测。
2、PD培养基的制备:准确称取4.01g商用PDA培养基,加入100mL蒸馏水,搅拌均匀,用滤纸进行过滤,去除培养基,得马铃薯葡萄糖液体培养基(PD培养基),封瓶,放于高压灭菌锅中121℃,灭菌15min,用于供试菌株菌悬液的制备。
3、取一环纯化的XML001菌株在马铃薯葡萄糖液体培养基(PD培养基)中,置于摇床上150rpm、30℃培养24h,采用10倍稀释法,稀释到10
图4结果表明:置于厌氧环境培养的XML001菌株均未生长,而置于有氧环境下的XML001菌株正常生长,说明XML001菌株生长特性为严格好氧菌。
实施例4XML001菌株耐酸能力测定
1、以下各项检测所用培养基均为PD培养基,制备方法:准确称取20.05g商用PDA培养基,加入500mL蒸馏水,搅拌均匀,用滤纸进行过滤,去除培养基,得马铃薯葡萄糖液体培养基(PD培养基),封瓶,放于高压灭菌锅中121℃,灭菌15min,备用。
2、以下各检测中所用菌悬液制备:取100mL无菌PD培养基,置于超净操作台中,用接种环挑取1环纯化好的XML001菌株,于30℃、150RMP摇床培养48h,制备供试菌的菌悬液。
3、酸度耐受性性各处理培养基
3.1.1量取50mL PD培养基,用食品级的冰乙酸将培养基调至pH1.5后,吸取9mL培养基于试管中,每个处理做5个重复。
3.1.2量取50mL PD培养基,用食品级的冰乙酸将培养基调至pH2.5后,吸取9mL培养基于试管中,每个处理做5个重复。
3.1.3量取50mL PD培养基,用食品级的冰乙酸将培养基调至pH3.5后,吸取9mL培养基于试管中,每个处理做5个重复。
3.1.4量取50mL PD培养基,用食品级的冰乙酸将培养基调至pH4.5后,吸取9mL培养基于试管中,每个处理做5个重复。
3.1.5量取50mL PD培养基,用食品级的冰乙酸将培养基调至pH5.5后,吸取9mL培养基于试管中,每个处理做5个重复。
3.2检测耐酸度:
每个不同pH处理的样本,均接种1mL的菌悬液(后续实施例均接种同量)后置于生化恒温培养箱中30℃静置孵育72h,每24h监测培养液的λ=600nm吸光值,以CK-(1mL纯水+9mL培养基为阴性对照)作为调零,以CK+(以原菌液为阳性对照)并观察其产膜情况,产膜情况如下表1。
所得OD600数据使用Microsoft Office Excel 2010处理,结果表示为MD±SD形式,将数据导入OriginPro 8.5软件中,绘制不同pH环境下的生长曲线,所得结果如图5。
表1不同pH处理下培养的XML001菌株产膜情况
注:表1中“+”表示产膜(“+”越多产膜越厚);“-”表示不产膜。
分析表1和图5可知:pH越低,酸度越高,XML001产膜越少;反之,产膜越多。当pH=2.5时,可完全抑制XML001生长,不产膜,菌株XML001对生长环境的pH耐受范围为3.5~5.5。
实施例5 XML001菌株耐盐能力测定
1、盐度耐受性各处理培养基
1.1量取50mL PD培养基,用食用盐将培养基调至盐浓度为8%后,吸取9mL培养基于试管中,每个处理做5个重复。
1.2量取50mL PD培养基,用食用盐将培养基调至盐浓度为10%后,吸取9mL培养基于试管中,每个处理做5个重复。
1.3量取50mL PD培养基,用食用盐将培养基调至盐浓度为12%后,吸取9mL培养基于试管中,每个处理做5个重复。
1.4量取50mL PD培养基,用食用盐将培养基调至盐浓度为14%后,吸取9mL培养基于试管中,每个处理做5个重复。
1.5量取50mL PD培养基,用食用盐将培养基调至盐浓度为16%后,吸取9mL培养基于试管中,每个处理做5个重复。
2、检测耐盐度:
在上述各盐浓度处理培养基中均接种等量菌悬液,置于生化恒温培养箱中30℃静置孵育72h,每24h监测λ=600nm的吸光值,以CK-(1mL纯水+9mL培养基为阴性对照)作为调零,以CK+(以原菌液为阳性对照)并观察其产膜情况,产膜情况如下表2所示。
所得OD600数据使用Microsoft Office Excel 2010处理,结果表示为MD±SD形式,将数据导入OriginPro 8.5软件中,绘制不同盐浓度环境下的生长曲线,所得结果如图6。
表2不同盐浓度处理下培养的XML001菌株产膜情况
注:表1中“+”表示产膜(“+”越多产膜越厚);“-”表示不产膜。
分析表2和图6可知:菌株培养环境的盐浓度越高,XML001菌株产膜越少;反之,产膜越多。当盐浓度为14%时,可完全抑制XML001菌株的生长,不产膜,其对盐浓度耐受性在8%~12%。
实施例6XML001菌株耐乙醇能力测定
1、乙醇耐受性各处理培养基
1.1量取50mL PD培养基,用酒精度为49~51°白酒将培养基调至乙醇浓度为2%后,吸取9mL培养基于试管中,每个处理做5个重复。
1.2量取50mL PD培养基,用酒精度为49~51°白酒将培养基调至乙醇浓度为4%后,吸取9mL培养基于试管中,每个处理做5个重复。
1.3量取50mL PD培养基,用酒精度为49~51°白酒将培养基调至乙醇浓度为6%后,吸取9mL培养基于试管中,每个处理做5个重复。
1.4量取50mL PD培养基,用酒精度为49~51°白酒将培养基调至乙醇浓度为8%后,吸取9mL培养基于试管中,每个处理做5个重复。
1.5量取50mL PD培养基,用酒精度为49~51°白酒将培养基调至乙醇浓度为10%后,吸取9mL培养基于试管中,每个处理做5个重复。
2、检测耐乙醇度:
每个不同乙醇浓度处理的样本,置于生化恒温培养箱中30℃静置孵育72h,每24h监测λ=600nm的吸光值,以CK-(1mL纯水+9mL培养基为阴性对照)作为调零,以CK+(以原菌液为阳性对照)并观察其产膜情况,产膜情况如下表2所示。所得OD600数据使用MicrosoftOffice Excel2010处理,结果表示为MD±SD形式,将数据导入OriginPro 8.5软件中,绘制不同盐浓度环境下的生长曲线,所得结果如图6。
表3不同乙醇浓度处理下培养的XML001菌株产膜情况
注:表3“+”表示产膜(“+”越多产膜越厚);“-”表示不产膜。
分析表3和图7可知:乙醇浓度越高,菌株XML001产膜越少;反之,产膜越多。菌株XML001对乙醇的耐受性较强,当乙醇浓度达到10%时,无明显的抑制作用,这可能与乙醇易挥发的理化特性有关。膜醭毕赤酵母XML001对其生长环境中的乙醇浓度耐受范围为2~10%。
实施例7生产发酵工艺、加速生产发酵工艺、厌氧发酵工艺和调节pH、盐浓度、乙醇浓度改进发酵工艺对比实验
泡制小米辣不同发酵工艺的制备方法,按照以下步骤进行生产:
1、材料准备
菌种:实施例1中分离到的XML001。
小米辣、食用盐、冰乙酸、麦芽糖、49-51°白酒:市售购买。对接种菌株XML001的小米辣发酵参数按下表进行设置后分别进行发酵处理。
表4不同发酵处理的关键工艺参数
注:上述表4中的添加量,均按照发酵总质量体系进行添加。
2、生产发酵工艺(处理1)
(1)原料挑拣:选择个体大小基本均匀的新鲜淡黄色小米辣,去除红色、发黑、坏烂、生虫的小米辣,用风选机进行风选,去除辣椒叶、辣椒柄、杂草等杂物;
(2)原料清洗:将步骤(1)中的原料放入气泡清洗机中,连续用清水清洗两次,清洗掉小米辣上的灰尘和杂质后,放入箩筐中,放至水不成股流下,沥水完成;
(3)入坛:按照发酵坛的大小,将步骤(2)获得的原料准确称取100kg倒入发酵坛中至坛颈口,小米辣表面用尼龙网压住,并用两根竹片呈十字交叉压住小米辣,防止加入料水后,小米辣因浮力作用浮出水面;
(4)配制料水:在专用的配料桶中加入200kg清水,按料水和小米辣的总质量体系,按表4中生产发酵工艺的料水配方比例加入食用盐、49-51°白酒和麦芽糖,不断用料水棒进行溶解和均匀:所述的料水配方配比为(按重量份数计算),食用盐11%;49-51°白酒2%;麦芽糖3%;
(5)调整成分:将处理好的步骤(4)中加入食品级冰乙酸,搅拌均匀,并用pH仪监测pH,直至pH=5.60时,料水成分调整完成;
(6)常温常压发酵:将步骤(5)中的料水加入到处理好的步骤(3)中,加满坛口水,常温常压下静置有氧发酵30天。
3、加速“生花”发酵工艺
参见图8,(1)前期处理步骤与“生产发酵工艺(处理1)”中的“步骤(1)、步骤(2)、步骤(3)、步骤(4)和步骤(5)、步骤(6)”相同;
区别为:接菌种:在处理好的步骤(5)中,接入300mL的XML001发酵液,保证初始发酵体系菌活性达到10
4、厌氧发酵改进工艺
参见图8,(1)前期处理步骤与“生产发酵工艺(处理1)”中的“步骤(1)、步骤(2)、步骤(3)、步骤(4)和步骤(5)”相同;
区别为:接菌种:在处理好的步骤(5)中,接入300mL的XML001发酵液,保证初始发酵体系菌活性达到10
常温常压发酵:将料水加入到装好辣椒的发酵坛中,加满坛口水,点燃酒精棉棒,在坛口绕圈,直至酒精棉球熄灭,耗尽坛内氧气,迅速盖上坛盖,加满坛口水,在坛口处用塑料膜将其密封严实,阻隔外界氧气的进入,常温常压下静置厌氧发酵30天。
5、调节pH改进发酵工艺
参见图8,
(1)前期处理步骤与“生产发酵工艺(处理1)”中的“步骤(1)、步骤(2)、步骤(3)、步骤(4)、步骤(6)”相同;
区别为:调整成分:将处理好的步骤(4)中加入食品级冰乙酸,搅拌均匀,并用pH仪监测pH,直至pH=2.50时,料水成分调整完成;
接菌种:在处理1处理好的步骤(5)中,接入300mL的XML001发酵液,保证初始发酵体系菌活性达到10
6、调节盐浓度改进发酵工艺
参见图8,(1)前期处理步骤与“生产发酵工艺(处理1)”中的“步骤(1)、步骤(2)、步骤(3)、步骤(5)、步骤(6)”相同;
区别为:配制料水:在专用的配料桶中加入200kg清水,按料水和小米辣的总质量体系,按表4中生产发酵工艺的料水配方比例加入食用盐、49-51°白酒和麦芽糖,不断用料水棒进行溶解和均匀:所述的料水配方配比为(按重量份数计算),食用盐14%;49-51°白酒2%;麦芽糖3%;
接菌种:在处理1处理好的步骤(5)中,接入300mL的XML001发酵液,保证初始发酵体系菌活性达到10
7、调节乙醇浓度改进发酵工艺
参见图8,(1)前期处理步骤与“生产发酵工艺(处理1)”中的“步骤(1)、步骤(2)、步骤(3)、步骤(5)、步骤(6)”相同;
区别为:配制料水:在专用的配料桶中加入200kg清水,按料水和小米辣的总质量体系,按表4中生产发酵工艺的料水配方比例加入食用盐、49-51°白酒和麦芽糖,不断用料水棒进行溶解和均匀:所述的料水配方配比为(按重量份数计算),食用盐14%;49-51°白酒10%;麦芽糖3%;
接菌种:在处理1处理好的步骤(5)中,接入300mL的XML001发酵液,保证初始发酵体系菌活性达到10
8、结果分析:不同发酵工艺的“产膜”情况
根据生产上“生花”的时间,前期每3d观察一次发酵情况,共观察记录3次,后期直至发酵到第30天成熟后,再进行观察记录,详细结果见下表5:
表5不同发酵工艺的“产膜”情况
注:表5中“+”表示产膜(“+”越多产膜越厚);“-”表示不产膜。
综上所述,在泡小米辣发酵过程中,将分离到的“生花”酵母XML001菌株制成发酵液,将XML001发酵液接种至泡小米辣中,按照10
针对该菌进行的泡小米辣加快“生花”表征所得控制参数可以有效防止发酵过程中小米辣发生“生花”。改进的发酵工艺适用于工厂实际生产,满足产品内控标准,实现产业化落地。
尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 一种基于多线结构光点云数据的轮对尺寸测量方法
- 一种基于线结构光的钢板尺寸测量方法及系统
