一种NK细胞培养体系及应用
文献发布时间:2023-06-19 11:13:06
技术领域
本发明涉及免疫细胞治疗技术领域,具体涉及一种NK细胞培养体系及应用。
背景技术
肿瘤是一种死亡率较高、易复发、易转移的疾病。近年来研究发现,肿瘤的发生发展及手术后肿瘤的转移与机体免疫功能的抑制有重要关系,因此,通过免疫学方法抑制肿瘤的发生发展、减少及防止术后转移成为抗肿瘤研究的热点。2013年,美国科学杂志发布肿瘤免疫治疗时代来临。肿瘤免疫治疗是通过激发或调动机体的免疫功能,增强肿瘤微环境抗肿瘤免疫力,从而达到控制和杀伤肿瘤细胞的目的。目前在肿瘤免疫治疗研究中应用较多的有淋巴因子激活的杀伤细胞、肿瘤浸润淋巴细胞、自然杀伤细胞、细胞因子诱导的杀伤细胞和树突状细胞等。其中,自然杀伤(NK)细胞作为一种独特的淋巴细胞,与B细胞和T细胞不同,起着联系先天性免疫和获得性免疫的作用,具有杀伤肿瘤细胞和病毒感染细胞的能力,在机体固有免疫及过继免疫治疗中发挥着重要作用。
自然杀伤细胞(natural killer cell,NK细胞)是机体固有免疫系统的重要组成部分之一,它无需特异性抗原刺激即可杀伤靶细胞,具有免疫清除和免疫监视的功能,它不仅与抗肿瘤、抗病毒感染和免疫调节有关,而且在某些情况下参与自身免疫性疾病的发生。NK细胞主要通过免疫清除和免疫监视发挥抗肿瘤的功能,其清除肿瘤细胞的机制可以分为三大类:一是通过释放细胞毒性颗粒杀伤肿瘤细胞;二是通过细胞表面合成的蛋白激活靶细胞凋亡系统杀伤肿瘤细胞;三是通过与肿瘤细胞表面抗体结合发挥细胞毒性作用进而杀伤靶细胞。研究表明,NK细胞在抑制肺癌、乳腺癌、大肠癌、肝癌和白血病等肿瘤的生长和转移方面有一定的意义。
由于NK细胞在人外周血中的含量较低,且在肿瘤组织中分布频率较低,如何在保证临床安全性的前提下,提高NK细胞的体外扩增效率及杀伤活性仍是研究的重点及难点。专利CN106011061A公开了一种NK细胞的体外大规模扩增的方法,该方法包括采集、分离外周血单个核细胞,免疫磁珠分选NK细胞,NK细胞培养、收集等步骤。专利CN107022525A也公开了一种NK细胞的培养方法,该方法包括单核细胞的分离、洗涤,NK细胞的培养等步骤。所述的NK细胞的培养工艺操作较为繁琐,成本较高。
因此,亟需开发一种安全、大规模离体培养NK细胞的方法,增强其扩增效率及抗肿瘤功能。
发明内容
针对上述不足,本发明提供了一种NK细胞培养体系及其应用。本发明通过外周血单个核细胞分离,NK细胞活化、增殖等步骤制备得到NK细胞回输液,所述的制备方法简单,安全,扩增效率高,抗肿瘤能力好,成本低。
为了实现上述发明目的,本发明的技术方案如下:
一方面,本发明提供了一种NK细胞培养体系,所述的NK细胞培养体系包含:包被抗体、NK细胞激活因子、NK细胞基础培养基、NK细胞激活培养基和NK细胞扩增培养基。
具体地,所述的包被抗体包含:95-98%PBS、0.2-0.8%anti-CD3 mAb、0.5-1.5%anti-CD137 mAb、0.2-0.8%anti-CD161 mAb、0.5-1.5%anti-CD16 mAb、0.1-0.4%anti-HER2 mAb和0.1-0.4%anti-PD-L1 mAb。
进一步具体地,所述的包被抗体包含:96.5%PBS、0.5%anti-CD3 mAb、1%anti-CD137 mAb、0.5%anti-CD161 mAb、1%anti-CD16 mAb、0.25%anti-HER2 mAb和0.25%anti-PD-L1 mAb。
具体地,所述的NK细胞激活因子包含:97-99%PBS、0.5-1.5%IL-2、0.01-0.1%IL-7、0.01-0.1%IL-9、0.01-0.1%IL-12、0.01-0.1%IL-15、0.1-1.0%IL-18、0.01-0.1%IL-21、0.01-0.1%IFN-alpha和0.01-0.1%IFN-lamda。
进一步具体地,所述的NK细胞激活因子包含:98.25%PBS、1%IL-2、0.02%IL-7、0.02%IL-9、0.03%IL-12、0.05%IL-15、0.5%IL-18、0.03%IL-21、0.05%IFN-alpha和0.05%IFN-lamda。
具体地,所述的NK细胞基础培养基包含:98.8-99.7%无血清培养基、0.05-0.5%维生素混合物(A/B/C/D/E)、0.1-0.5%多糖硫酸酯和0.1-0.5%茶活性多糖。
进一步具体地,所述的NK细胞基础培养基包含:99.5%无血清培养基、0.1%维生素混合物(A/B/C/D/E)、0.2%多糖硫酸酯和0.2%茶活性多糖。
具体地,所述的NK细胞激活培养基包含:80-95%NK细胞基础培养基、0.001-0.1%脂多糖、0.001-0.02%白藜芦醇、0.1-1%NK细胞激活因子和4-20%自体灭活血浆。
进一步具体地,所述的NK细胞激活培养基包含:89.488%NK细胞基础培养基、0.01%脂多糖、0.002%白藜芦醇、0.5%NK细胞激活因子和10%自体灭活血浆。
具体地,所述的NK细胞扩增培养基包含:NK细胞基础培养基和500IU/mL IL-2。
另一方面,本发明提供了上述NK细胞培养体系在制备NK细胞回输液中的应用。
又一方面,本发明提供了一种NK细胞回输液,所述的NK细胞回输液由权利要求1-6任一项所述的NK细胞培养体系培养得到。
具体地,所述的NK细胞回输液包括NK细胞、50mg/mL的人血白蛋白和0.9%氯化钠注射液,所述的NK细胞总数≥3×10
又一方面,本发明提供了一种NK细胞回输液的制备方法,所述的制备方法包括以下步骤:抗体包被,自体血浆制备和外周血单个核细胞分离,NK细胞激活,NK细胞扩增和NK细胞收集。
具体地,所述的NK细胞激活步骤为在细胞培养第0天、第3天和第5天补充NK细胞激活培养基,使细胞密度维持在(1.0-1.5)×10
具体地,所述的NK细胞扩增步骤为在细胞培养第7天、第9天和第11天补充NK细胞扩增培养基,使细胞密度维持在(1.0-1.5)×10
具体地,所述的NK细胞收集为在第15-17天进行细胞收集。
又一方面,本发明提供了上述NK细胞回输液在制备治疗和/或预防肿瘤药物中的应用。
具体地,所述的肿瘤包括但不限于肺癌、乳腺癌、大肠癌、肝癌和白血病。
与现有技术相比,本发明的积极和有益效果在于:
1.本发明提供了一种NK细胞培养体系,利用所述的NK细胞培养体系制备NK细胞回输液,无需添加外源动物血清,也无需采用外源滋养层细胞,制备方法更安全,操作简单,成本低,适用于NK细胞的临床级生产。
2.本发明所述的NK细胞更适用于肿瘤病人的治疗。目前常规的NK培养方法或试剂盒基本能满足对于正常人外周血NK细胞的培养要求。但肿瘤患者的NK细胞在外周血中含量较低,且基本处于抑制状态。常规的NK培养方法或试剂盒对于癌症病人NK细胞的培养效果较差,NK细胞纯度、活率或杀伤能力均较低,因而大大降低了NK细胞回输液疗效。本发明所述的NK细胞培养体系能够更大程度地解除NK细胞抑制,激活NK细胞,提升其肿瘤杀伤活性。
附图说明
图1为细胞纯度检测结果图,其中A为实施例2的流式检测结果,B为对比例1的流式检测结果。
图2为细胞凋亡检测结果图,其中A为实施例2的流式检测结果,B为对比例1的流式检测结果。
图3为肿瘤细胞杀伤能力检测结果图,其中A为实施例2制备得到的NK细胞与靶细胞孵育前细胞凋亡检测结果,B为实施例2制备得到的NK细胞与靶细胞孵育后细胞凋亡检测结果,C为对比例1制备得到的NK细胞与靶细胞孵育前细胞凋亡检测结果,D为对比例1制备得到的NK细胞与靶细胞孵育后细胞凋亡检测结果。
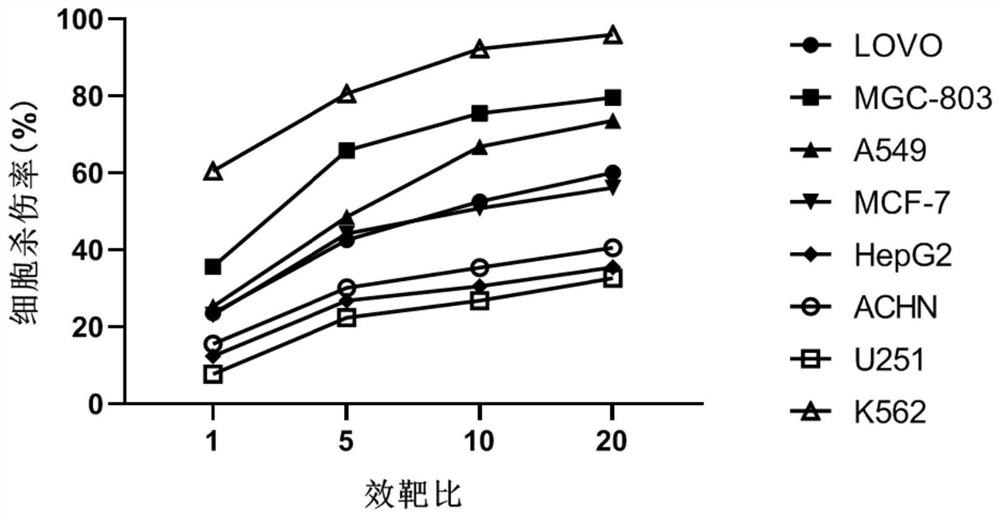
图4为实验例5实体瘤杀伤能力检测结果图。
具体实施方式
下面结合具体实施例,对本发明作进一步详细的阐述,下述实施例不用于限制本发明,仅用于说明本发明。以下实施例中所使用的实验方法如无特殊说明,实施例中未注明具体条件的实验方法,通常按照常规条件,下述实施例中所使用的材料、试剂等,如无特殊说明,均可从商业途径得到。
除非另外定义,否则本文中所用的全部技术与科学用语均具有本领域技术人员通常理解的含义。
实施例1NK细胞培养体系
1.包被抗体:96.5%PBS、0.5%anti-CD3 mAb、1%anti-CD137 mAb、0.5%anti-CD161 mAb、1%anti-CD16 mAb、0.25%anti-HER2 mAb和0.25%anti-PD-L1 mAb。
2.NK细胞激活因子:98.25%PBS、1%IL-2、0.02%IL-7、0.02%IL-9、0.03%IL-12、0.05%IL-15、0.5%IL-18、0.03%IL-21、0.05%IFN-alpha和0.05%IFN-lamda。
3.NK细胞基础培养基:99.5%无血清培养基(RPMI1640)、0.1%维生素混合物(A/B/C/D/E)、0.2%多糖硫酸酯和0.2%茶活性多糖。
4.NK细胞激活培养基包含:89.488%NK细胞基础培养基、0.01%脂多糖、0.002%白藜芦醇、0.5%NK细胞激活因子和10%自体灭活血浆。
5.NK细胞扩增培养基:NK细胞基础培养基和500IU/mL IL-2。
实施例2NK细胞的体外培养扩增
1.抗体包被:将包被抗体用生理盐水1:5稀释后,加入T75细胞培养瓶。4℃放置过夜或室温孵育2h后,缓慢倾倒去除上清液,取10mL生理盐水洗涤培养瓶一次,缓慢倾倒掉生理盐水后待用。
2.自体血浆制备和外周血单个核细胞分离
1)将抗凝处理的全血以2000rpm转速,常温下离心10min。取上清,并将上清置于56℃水浴锅中灭活30min。然后再以3500rpm转速,常温下离心10min。取上清,作为灭活自体血浆。
2)下层血积层与0.9%氯化钠注射液1:1稀释后,加入至淋巴分离液上方,稀释液与淋巴分离液比例为2:1,2000rpm离心18min,设置升速6、降速3。
3)离心完成后吸取白膜层,加生理盐水重悬至50mL,1800rpm离心8min。
4)离心完成后加入40mL生理盐水重悬沉淀,1200rpm离心10min后取样计数。
3.NK细胞激活
将分离得到的PBMC按照(1.0-1.5)×10
4.NK细胞扩增
培养第7天,将NK细胞转移至细胞培养袋中,并补充400mL NK细胞扩增培养基。在培养第9天、第11天分别补充700mL、900mL NK细胞激活培养基,使细胞维持在(1.0-1.5)×10
5.NK细胞收集
培养第16天收集细胞,将细胞悬液通过离心、生理盐水重悬3次的方式去除培养基,并加入5mL人血白蛋白(BAXTERAG),NK细胞输液终体积约为150mL。
对比例1
选取常规NK细胞培养试剂盒进行NK细胞的培养,本对比例采用CSTI ALyS505NK培养试剂盒,其中包括ALys505NK-AC培养基、ALys505NK-EX培养基、Lymactin-NK、NK-AReagent和NK-B Reagent,并采用试剂盒标准操作法培养NK细胞(NK细胞培养3.0操作中文说明书)。
实验例1细胞数量与活性检测
将实施例2与对比例1制备得到的细胞悬液与0.2-0.4%台盼蓝溶液1:1混合,采用countstar自动细胞计数仪进行计数。检测结果如下表1所示。
表1
实验例2细胞纯度检测(CD3-CD56+比例)
调整细胞密度为(0.5-1)×10
由图1可知,实施例2的细胞纯度为94.89%,明显优于对比例1的55.16%。
实验例3细胞凋亡检测
调整细胞密度为(0.5-1)×10
由图2可知,实施例2中90.25%的细胞未发生凋亡,而对比例仅83.33%的细胞未发生凋亡。
实施例4肿瘤细胞杀伤能力
对照组:在24孔板中,加入400μL 5×10
实验组:在24孔板中,加入200μL 5×10
37℃,5%CO
由图3的结果计算可知,实施例2制备得到的NK细胞的杀伤力为92.3%,对比例1制备得到的NK细胞的杀伤力为50.5%。
实验例5实体瘤杀伤能力
检测NK细胞对消化道肿瘤细胞系(胃癌MGC803细胞、结肠癌Lovo细胞)、泌尿系统肿瘤细胞系(肾癌ACHN细胞)、胶质瘤细胞U251、肝癌细胞HepG2、乳腺癌细胞MCF-7及肺癌细胞A549的杀伤效果,采用髓性白血病细胞K562作为对照。其中,效靶比分别1:1、5:1、10:1、20:1,效应细胞为实施例2中培养的NK细胞。检测结果如图4所示。
由图4可知,本发明制备得到的NK细胞具有较好的实体瘤杀伤能力。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 一种IL-12蛋白突变体及其制备方法和应用、NK细胞培养体系和培养NK细胞的方法
- 一种NK细胞培养体系及应用
