一种停乳链球菌的LAMP引物组、试剂盒以及检测方法
文献发布时间:2024-04-18 20:02:18
技术领域
本发明涉及微生物技术检测领域,具体涉及一种停乳链球菌的LAMP引物组、试剂盒以及检测方法。
背景技术
牛源停乳链球菌是引起奶牛乳房炎的主要病原菌之一,严重危害奶牛健康。停乳链球菌对人的危害也不容忽视,随着患慢性病老年人的逐渐增多,停乳链球菌引起的菌血症报告率在2%-18%之间,对人类的危害正在不断扩大。
环介导等温扩增技术作为一种新型核酸检测技术,它是针对靶基因的6个区域设计4条特异引物,利用Bst DNA聚合酶的链置换活性在同一反应体系中恒温高效扩增,大量合成目的DNA的同时,产生白色焦磷酸镁沉淀。由于扩增反应依赖于靶DNA的6个独立的区域,因此特异性非常高。一般借助恒温水浴锅即可满足实验温度需求,适合基层的快速检测。但现有技术中关于停乳链球菌的LAMP检测技术的灵敏度并不高,而且其仅仅表示的是对提取纯化后停乳链球菌的检测结果,不是直接指示采样品中停乳链球菌的感染情况,同样无从考究对采样品的检测限和灵敏度。
发明内容
针对以上技术问题,本发明提供一种停乳链球菌的LAMP引物组、试剂盒以及检测方法。以停乳链球菌gapC基因为靶基因设计环介导等温扩增引物,利用LAMP技术实现停乳链球菌的快速检测,为停乳链球菌的检测提供了有效且快速的筛查方法。
为解决上述技术问题,本发明采用了如下技术方案:
第一方面,本发明提供一种基于LAMP技术的停乳链球菌检测引物组,引物组核苷酸序列如下所示:
F3:ACTGGTGACCAAATGATCCTTG;
B3:GTTGATTTCGTCAACAGAAACGT;
FIP:TAGCTTTAGCAGCACCAGTTGAGTT-TGGTGGTGACCTTCGTCG;
BIP:AATGGTAAACTTGATGGTGCTGCAC-TCAAGAGTTACAACCAACTCAGT;
LF:GTTTGCAGCACCAGCACGAG;
LB:AACGTGTTCCTGTTCCAACTGGAT。
其中,正向外引物F3,其核苷酸序列如SEQ ID NO.1所示;反向外引物B3,其核苷酸序列如SEQ ID NO.2所示;正向内引物FIP,其核苷酸序列如SEQ ID NO.3所示;反向内引物BIP,其核苷酸序列如SEQ ID NO.4所示,正向环引物LF,其核苷酸序列如SEQ ID NO.5所示,反向环引物LB,其核苷酸序列如SEQ ID NO.6所示。该引物组以停乳链球菌gapC基因为靶基因,按照引物设计原则进行设计,经过筛选分析后最终确定。该引物组能特异性扩增停乳链球菌的DNA,结合显色反应或凝胶电泳图像,能够快速鉴定检测停乳链球菌。
第二方面,本发明提供上述引物组在制备试剂盒中的应用,试剂盒可用于鉴定停乳链球菌或检测待测样本中是否含有停乳链球菌。
第三方面,一种检测停乳链球菌的试剂盒,含有上述的引物组以及LAMP反应所需的反应体系。
第四方面,本发明提供一种检测待测样本中是否含有停乳链球菌的方法,含有如上述的引物组,包括以下步骤:
S1:提取待检样品总DNA;
S2:以S1中提取的总DNA为模板,用权利要求1所述的引物组或权利要求3所述的试剂盒进行LAMP扩增;
S3:鉴定结果:如果采用S2中所述引物组或试剂盒可以实现以所述总DNA为模板的特异性扩增,待测样本中含有或疑似含有停乳链球菌;
所述方法用于非疾病诊断与治疗。
将提取待检样品的细菌总DNA,加入含有本发明所提供的特异性引物组的LAMP反应体系进行等温扩增反应,后根据结果判断生鲜乳中是否含有停乳链球菌。在实际检测中,待检样品中的低浓度细菌以及存在的干扰物质会阻碍DNA提取,或是提取到到DNA浓度过低,使用的检测方法不能正确反应待检样品中是否含有停乳链球菌以及其浓度。与现有技术相比,本发明所建立的方法,具有简便、快速、特异性高,灵敏性强,可视化灵敏度可达到10
进一步地,S3中鉴定结果的方法为加入用于判断待鉴定样品DNA是否成功扩增的显色材料至LAMP反应体系中,通过反应体系显色状态作为鉴定结果;或取LAMP扩增产物,点样于琼脂糖凝胶,观察凝胶成像系统中成像结果作为鉴定结果。
在扩增完成后的反应体系中加入显色材料,混匀,肉眼观察显色状态,对照阳性对照品和阴性对照品的显色状态即可判断生鲜乳中是否含有停乳链球菌;吸取一定量的LAMP扩增产物,加入到琼脂糖凝胶中进行电泳检测,肉眼观察电泳结果,如出现阶梯式条带判为阳性,即检测生鲜乳中含有停乳链球菌;如不出现阶梯式条带则判为阴性,即检测生鲜乳中不含有停乳链球菌。
进一步地,LAMP扩增在25μL或50μL LAMP扩增体系中进行;LAMP扩增体系包括,内引物、外引物、环引物、dNTP、DNA模板、Bst DNA聚合酶、Buffer、无酶水;体系中内引物与外引物浓度比为4-10:1,体系中内引物终浓度为8.0-20.0μM/L。
建立停乳链球菌gapC基因的单重LAMP反应体系,与常见的无乳链球菌、乳房链球菌、大肠杆菌、金黄色葡萄球菌、李斯特菌等无交叉反应,特异性验证高,可视化灵敏性为9.53×10
示例性地,本发明提供一种可视化的25μL的LAMP扩增体系包括:
WarmStart Colorimetric LAMP 2×Master Mix 12.5μL
10×Primers 2.5μL(8.0-20.0μM FIP/BIP、2μM F3/B3、4μM LF/LB)
DNA模板1.0-5.0μL
无酶水加至25μL。
使用LAMP变色预混液,反应结束后肉眼即可观察颜色反应,在阴性对照呈红色或橙红色、阳性对照呈黄色的前提下,待检样品呈黄色判为阳性,即检测生鲜乳中含有停乳链球菌;待检样品呈红色或橙红色判为阴性,即检测生鲜乳中不含有停乳链球菌。
更进一步地,体系中内引物与外引物浓度比为8:1,体系中内引物终浓度为16.0μM/L。
优化后内外引物比例,可减少引物比例对整个可视化LAMP检测方法的影响。
进一步地,进行LAMP扩增的温度为61-64℃。
进一步地,反应时间为30-60min。
更进一步地,进行LAMP扩增的温度为62-63℃。
更进一步地,反应时间为30min。
进一步地,待测样本为生鲜乳;所述提取待检样品总DNA的方法为EDTA-Tris法。
生鲜乳中的低浓度细菌以及存在的钙离子、脂肪、蛋白质等,会阻碍有效的DNA提取,而且由于牛奶蛋白去除不完全、细胞破碎效率差、残留杂质多等问题,导致提取得到的牛奶微生物DNA浓度很低且纯度不高,导致结果容易出现假阴性。本发明将EDTA-Tris法应用于生鲜乳中细菌DNA的提取,来提高检测停乳链球菌的DNA回收率以及屏蔽影响后续LAMP扩增的干扰因素。对本方法进行临床检测模拟验证,经人工污染生鲜乳检测证实,本方法具有良好的特异性,其可视化灵敏度和脂糖凝胶电泳检测的灵敏度约为2.94×10
附图说明
图1为本发明实施例2中停乳链球菌gapC基因LAMP引物非特异性验证;
M,Marker;1,阳性对照;2,阴性对照;3,空白对照;
图2为本发明实验例1中停乳链球菌LAMP检测方法反应温度优化结果;
M,Marker;1-8,58-65℃;9,阴性对照;
图3为本发明实验例1中停乳链球菌LAMP检测方法反应时间优化结果;
M,Marker;1-6,10-60min;7,阴性对照;
图4为本发明实验例1中停乳链球菌LAMP检测方法内外引物比例优化结果;
M,100bp DNA Marker;1-6,内外引物比依次1:1、2:1、4:1、6:1、8:1、10:1;7代表阴性对照;
图5为本发明实验例2中停乳链球菌LAMP检测方法特异性验证结果;
M,100bp DNA Marker;1,停乳链球菌;2-12,依次为产色葡萄球菌、缓慢葡萄球菌、乳房链球菌、人葡萄球菌、金黄色葡萄球菌、无乳链球菌、大肠杆菌、海氏肠球菌、停乳链球菌、单增李斯特菌LM90、单增李斯特菌LM-EDGe;13,阴性对照;
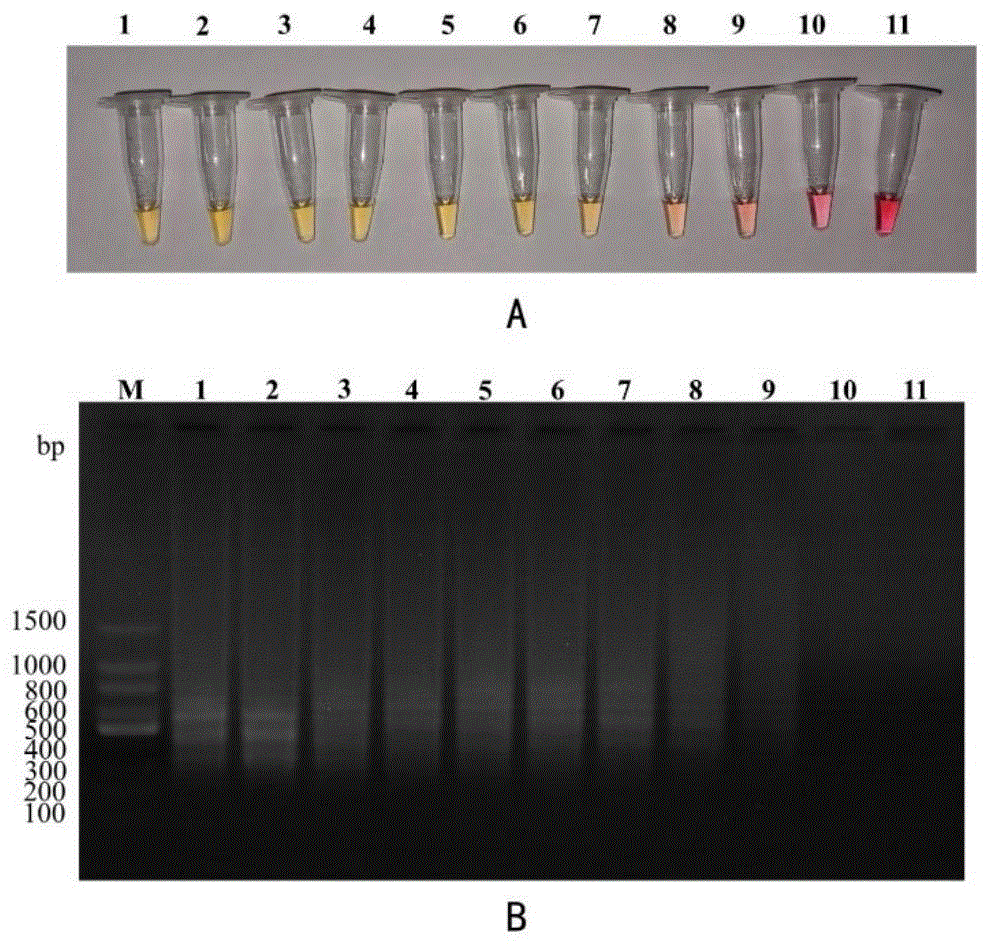
图6为本发明实验例3中停乳链球菌LAMP检测方法灵敏性评价结果;
M,100bp DNA Marker;1-10依次为9.53×10
图7为本发明实施例4及对比例1-7中人工污染生鲜乳中不同DNA提取方法的停乳链球菌LAMP检测效果;
M,100bp DNA Marker;1,EDTA-Tris法,2,NaOH-Tris-HCL法,3,NaOH裂解法,4,PBS裂解法;5,煮样法;6,Chelex100法;7,EtNa法;8,试剂盒法;9代表阴性对照;10代表空白对照;
图8为本发明实施例4中检测生鲜乳中停乳链球菌的方法特异性验证结果;
M,100bp DNA Marker;1,停乳链球菌人工污染乳;2-11依次为产色葡萄球菌、缓慢葡萄球菌、乳房链球菌、人葡萄球菌、金黄色葡萄球菌、无乳链球菌、大肠杆菌、海氏肠球菌、停乳链球菌、单增李斯特菌LM90人工污染乳;12,阴性对照;13,空白对照;
图9为本发明实施例4中检测生鲜乳中停乳链球菌的方法灵敏性评价结果;
M,100bp DNA Marker;1-8依次为2.94×10
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合具体实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用于解释本发明,并不用于限定本发明。
下述微生物均由石河子大学人兽共患病试验室储存。下述实施例中所使用的实验方法如无特殊说明,均为常规方法;所用的材料、试剂等,均可从商业途径得到。停链球菌阳性质粒标准品,以本发明所提供的引物,自行构建。
实施例1引物设计
将从NCBI查询下载的停乳链球菌gapC基因序列导入在线设计LAMP引物软件Primer ExplorerV5,在线生成多组引物,参考网站提供的引物设计指导手册进行引物的筛选。将选取的引物再输入NCBI进行Primer Blast比对,进而选取特异性强的引物进行后续试验。经过筛选分析,最终确定停乳链球菌的引物,引物合成由青岛睿博兴科负责完成。
表1引物设计
外引物F3核苷酸序列见SEQ ID NO.1,外引物B3核苷酸序列见如SEQ ID NO.2,内引物FIP核苷酸序列见SEQ ID NO.3,内引物BIP核苷酸序列见SEQ ID NO.4,环引物LF核苷酸序列见SEQ ID NO.5,反环引物LB核苷酸序列见SEQ ID NO.6。
实施例2停乳链球菌LAMP反应体系的初步探索
参照购于NEB公司的WarmStart Colorimetric LAMP 2×Master Mix说明书构建LAMP反应体系(表2)进行加样,1号管中DNA模板为停乳链球菌基因DNA(DNA提取试剂盒提取),2号管为阴性对照(无酶水),3号管为空白对照(去除模板的溶液)。在65℃进行LAMP反应30min后,观察管中LAMP溶液的颜色变化。取出5μL的反应产物,进行琼脂糖凝胶电泳,观察电泳情况,结果见图1。
表2停乳链球菌LAMP反应体系
注:LAMP引物组混合液是由16μL 100μM的FIP、16μL 100μM的BIP、2μL 100μM的F3、2μL 100μM的B3,无酶水64μL组成。
停乳链球菌gapC基因的LAMP反应的1号管中的反应液颜色改变,而阴性对照(2号管)、空白对照(3号管)均未发生变化(图1A),这也与琼脂糖凝胶电泳结果一致(图1B)。故,本发明提供的引物组制备的试剂盒可用于鉴定停乳链球菌或检测待测样本中是否含有停乳链球菌。
实施例3
本实施例提供一种检测待测样本中是否含有停乳链球菌的方法。
待检测样本为停乳链球菌,步骤如下:
S1:使用细菌基因组DNA提取试剂盒提取停乳链球菌的总DNA;
S2:以S1中提取的总DNA为模板,使用实施例1制备的引物组进行LAMP扩增;反应体系:WarmStart Colorimetric LAMP 2×Master Mix 12.5μL、10×Primers2.5μL(8μM FIP/BIP、2μM F3/B3、4μM LF/B)、DNA模板2.0μL,无酶水加至25μL。
反应条件:62℃恒温30min。
S3:观察反应体系溶液的颜色变化。取出5μL的反应产物,进行琼脂糖凝胶电泳,观察电泳结果。结果如图2所示。
实验例1反应体系的优化
1.反应温度优化
以停乳链球菌阳性质粒标准品为模板,采用实施例3中反应体系,将反应温度进行梯度调整,分别为58、59、60、61、62、63、64、65℃,并以无酶水为阴性对照,阴性对照反应温度为65℃。反应30min后,通过观察颜色变化以及电泳条带有无进行结果判定。
当温度在61-64℃时,LAMP反应液开始发生肉眼可见的变化,且在62-63℃时,颜色变化更加明显(图2A)。结合电泳结果(图2B),停乳链球菌gapC基因的LAMP反应最适温度为62 -63℃。故反应体系的最佳温度为62℃。
2.反应时间优化
采用实施例3中LAMP反应体系,以停乳链球菌阳性质粒标准品为模板,反应温度为62℃,将反应时间进行梯度设置(10、20、30、40、50、60min)进行LAMP反应。以无酶水为阴性对照,反应时间为30min,通过观察颜色变化以及电泳条带有无进行结果判定。
当扩增时间为30-60min时,停乳链球菌的LAMP反应液颜色都变为橙黄色(图3A),为了进一步确定最佳反应时间,在1.5%琼脂糖凝胶电泳发现,当反应时间为20min时,开始出现条带,而30-60min时,条带则更加清晰明亮,且眼观无明显区别(图3B)。为了实现LAMP检测技术的快速性,选择30min为反应体系的最佳反应时间。
3.停乳链球菌LAMP检测方法内外引物比例的优化
为了减少引物比例对整个可视化LAMP检测方法的影响。以标准质粒为模板,反应条件为:62℃恒温30min,对内外引物比例分别调整为1:1、2:1、4:1、6:1、8:1、10:1。以此LAMP体系进行试验,反应结束后,进行试验结果判定。
从图4A可明显看出,当引物比例为2:1时,管中反应液变为橙黄色,随着比例升高,颜色变化逐渐加剧。琼脂糖凝胶电泳结果(图4B),在引物比例为4-10:1时,观察到产生的梯度条带,当内外引物比例为8:1时的条带明显更加清晰。因此,反应体系的最佳内外引物比例为8:1。
实验例2特异性评价
基于优化后的停乳链球菌LAMP检测方法,分别以停乳链球菌、产色葡萄球菌、缓慢葡萄球菌、乳房链球菌、人葡萄球菌、金黄色葡萄球菌、无乳链球菌、大肠杆菌、海氏肠球菌、沙门菌、单增李斯特菌LM90、单增李斯特菌LM-EDGe等菌株基因组DNA为模板进行检测。无酶水为阴性对照。
可视化的LAMP反应发现,只有阳性样本的LAMP反应液由红色变为橘黄色,其余样本均未发生变化(图5A)。琼脂糖凝胶结果与可视化结果一致(图5B)。证明本试验建立的停乳链球菌LAMP检测方法特异性高,与其他菌株不发生交叉反应。
实验例3灵敏性评价
将构建好的停乳链球菌阳性质粒使用Nano Drop 2000测量浓度,并计算具体拷贝数。使用ddH
本发明建立的停乳链球菌LAMP检测方法的可视化灵敏性为9.53×10
实施例4
本实施例提供一种检测生鲜乳中停乳链球菌的方法。
检测样本为人工污染生鲜乳:将培养后停乳链球菌与生鲜乳混合,进行人工样品的污染。
S1:采用EDTA-Tris法提取人工污染生鲜乳中总DNA;
S2:以S1中提取的总DNA为模板,使用实施例1制备的引物组进行LAMP扩增;反应体系:WarmStart Colorimetric LAMP 2×Master Mix 12.5μL、10×Primers 2.5μL(16μMFIP/BIP、2μM F3/B3、4μM LF/B)、DNA模板2.0μL,无酶水加至25μL。反应条件:62℃恒温30min。
S3:观察反应体系溶液颜色变化。取出5μL的反应产物,进行琼脂糖凝胶电泳,观察电泳结果。
对比例1-6
对比例1-6分别采用NaOH-Tris-HCL法、NaOH裂解法、PBS裂解法、煮样法、Chelex100法、EtNa法、试剂盒法提取生鲜乳样品中细菌DNA,其它步骤及参数与实施例4相同。
实施例4与对比例1-6的结果见图7。由结果可知,采用EDTA-Tris法提取生鲜乳中DNA进行LAMP检测效果最优。由图7A中可视化结果中只有试管1有颜色变化,试管2-8均为假阴性,无法正确显示结果。
实验例4检测生鲜乳中停乳链球菌的方法特异性评价
分别使用产色葡萄球菌、缓慢葡萄球菌、乳房链球菌、人葡萄球菌、金黄色葡萄球菌、无乳链球菌、大肠杆菌、海氏肠球菌、沙门菌、单增李斯特菌LM90等菌种进行人工污染生鲜乳,使用实施例4中检测生鲜乳中停乳链球菌的方法进行特异性验证,并以未人工污染的生鲜乳作为阴性对照,以无菌水作为空白对照,结果如图8所示。
由结果可知,含停乳链球菌生鲜乳的显示阳性结果,其余均为阴性,与其他菌无假阳性出现,表明本发明建立检测生鲜乳中停乳链球菌的方法特异性强。
实验例5检测生鲜乳中停乳链球菌的方法灵敏性评价
将活化后的停乳链球菌与生鲜乳混合,乳液中停乳链球菌浓度为2.94×10
由图9可知,本发明建立的生鲜乳中停乳链球菌LAMP检测方法在模拟临床试验中的可视化灵敏性为2.94×10
以上所述仅为本发明的较佳实施方式而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 猫泛白细胞减少症病毒LAMP检测引物组、试剂盒以及检测方法
- 一种用于多重耐药鲍曼不动杆菌LAMP检测的引物组、试剂盒及应用
- 一种建兰茎腐病菌LAMP检测引物组及其快速检测方法
- 一种水稻黄单胞菌的环介导等温扩增检测引物组、检测方法和检测试剂盒
- 一种LAMP法鉴别布鲁氏菌流行株和M5株的引物组、试剂盒及其应用
- 一种检测肺炎链球菌的LAMP引物组、试剂盒和方法
- 一种检测肺炎链球菌的LAMP引物组、试剂盒和方法
