分解HLEG1蛋白的方法、糖苷酶的应用、筛选方法和应用
文献发布时间:2023-06-19 18:34:06
技术领域
本申请涉及蛋白质的功能与应用技术领域,具体而言,涉及一种分解HLEG1蛋白的方法、糖苷酶的应用、筛选方法和应用。
背景技术
近年来,随着人们生活水平的提高,肥胖症病例在全球范围的数量不断增长。肥胖症有多种并发症,包括心血管疾病和糖尿病等危害人类健康的重大疾病,对人类健康生活造成了几大威胁。目前世界范围内对肥胖症的关注越来越多,但有效治疗肥胖症的药物与方法的研究成果还比较少。
专利CN201611229669.3公开了人类的HLEG1(全称为human liver-enriched gene1,简称HLEG1)蛋白(UniProt id Q6P5S2)与机体内的脂肪合成密切相关,HLEG1蛋白可以作为靶点蛋白用于制备与脂肪合成调控相关的药物中,例如治疗肥胖症或增肥相关的药物。
但是,目前还没有有效的干预HLEG1蛋白功能的药物以及方法,导致干预HLEG1蛋白功能以实现治疗肥胖症的研究进程存在突破瓶颈。
发明内容
本申请的目的在于提供一种分解HLEG1蛋白的方法、糖苷酶在用于分解HLEG1蛋白中的应用、糖苷酶在用于制备治疗肥胖症或预防肥胖症或减肥的口服药物中的应用、筛选用于抑制HLEG1蛋白功能的分子的方法以及抑制HLEG1蛋白功能的分子在用于制备治疗肥胖症或预防肥胖症或减肥的口服药物中的应用,其旨在有效实现干预HLEG1蛋白功能。
第一方面,本申请提供一种分解HLEG1蛋白的方法,包括:使用糖苷酶处理HLEG1蛋白,然后加入蛋白酶进行孵育;蛋白酶包括胰蛋白酶、糜蛋白酶以及胃蛋白酶中的至少一种。
本申请的申请人研究发现,HLEG1蛋白是一种糖基化修饰的载脂蛋白质,HLEG1蛋白的24位和69位点存在N-糖基化修饰,糖基化修饰使得HLEG1在含有胃蛋白酶的消化道以及含有糜蛋白酶和胃蛋白酶的肠道中均可以稳定存在;且HLEG1蛋白为唾液腺分泌的蛋白,HLEG1蛋白的268aa-330aa区段可以携带脂肪酸,并经消化道进入肠道上皮细胞;因此,HLEG1蛋白能够从唾液腺分泌到唾液,再经消化道进入肠道表皮细胞并调控机体内的脂类代谢,如脂肪酸转运以及合成脂肪等。
本申请通过向含有HLEG1蛋白的体系中加入糖苷酶,可以有效去除HLEG1蛋白的糖基化修饰降低HLEG1蛋白的稳定性;胰蛋白酶、糜蛋白酶或胃蛋白酶的存在,可以有效分解去糖基化修饰的HLEG1蛋白,进而有效分解HLEG1蛋白使之丧失载脂能力(即有效阻止HLEG1蛋白与脂肪酸结合),失去生物活性。
采用本申请提供的分解HLEG1蛋白的方法,可以在胰蛋白酶(肠道中存在)、糜蛋白酶(肠道中存在)或胃蛋白酶(消化道中存在)存在的环境(例如消化道环境,或消化过程)中有效分解去糖基化修饰的HLEG1蛋白使之丧失载脂能力,失去生物活性;为有效降低消化道和肠道中的HLEG1蛋白水平以实现干预HLEG1蛋白功能,进而为治疗或者预防肥胖或减肥等药物的研发提供新的手段和思路。
在本申请第一方面的一些实施例中,糖苷酶包括动物源糖苷酶、植物源糖苷酶以及真菌源糖苷酶中的至少一种。
上述物质,可以有效实现去除HLEG1蛋白的糖基化修饰,以使得胰蛋白酶、糜蛋白酶或胃蛋白酶可以有效分解去糖基化修饰的HLEG1蛋白。
可选地,糖苷酶包括肽N-糖苷酶F、内切糖苷酶H以及内切糖苷酶D中的至少一种。
可选地,糖苷酶包括肽N-糖苷酶F。
第二方面,本申请提供一种糖苷酶在用于分解HLEG1蛋白中的应用,HLEG1蛋白作为糖苷酶的靶点蛋白。HLEG1蛋白被糖苷酶作用后的产物能够被蛋白酶分解;蛋白酶包括胰蛋白酶、糜蛋白酶以及胃蛋白酶中的至少一种。
糖苷酶可以应用于分解HLEG1蛋白,糖苷酶在用于分解HLEG1蛋白时,糖苷酶靶向HLEG1蛋白后可以有效去除HLEG1蛋白的糖基化修饰。HLEG1蛋白被糖苷酶作用后的产物(即去除糖基化修饰的HLEG1蛋白)能够有效被包括胰蛋白酶、糜蛋白酶以及胃蛋白酶中的至少一种的蛋白酶分解,进而实现HLEG1蛋白的分解。
在本申请第二方面的一些实施例中,糖苷酶包括动物源糖苷酶、植物源糖苷酶以及真菌源糖苷酶中的至少一种。
上述物质,可以有效实现去除HLEG1蛋白的糖基化修饰,以使得胰蛋白酶、糜蛋白酶或胃蛋白酶可以有效地分解去糖基化修饰的HLEG1蛋白。
可选地,糖苷酶包括肽N-糖苷酶F、内切糖苷酶H以及内切糖苷酶D中的至少一种。
可选地,糖苷酶包括肽N-糖苷酶F。
第三方面,本申请提供一种糖苷酶在用于制备口服药物中的应用,口服药物包括治疗肥胖症的药物、预防肥胖症的药物以及减肥的药物中的至少一种;HLEG1蛋白作为糖苷酶的靶点蛋白。
糖苷酶可以用于制备治疗肥胖症或减肥的口服药物,当口服含有糖苷酶成分的药物时,糖苷酶可以靶向唾液以及食道中分布的HLEG1蛋白,并有效去除HLEG1蛋白的糖基化修饰;被去除糖基化修饰的HLEG1蛋白进入含有胃蛋白酶的消化道和含有胰蛋白酶以及糜蛋白酶的肠道后,可以被胃蛋白酶、胰蛋白酶以及糜蛋白酶有效分解,进而有效降低最终肠道中含有的HLEG1蛋白水平,进而减少HLEG1蛋白携带的脂肪酸的量,有效减少肠道表皮细胞并进行机体内的脂类代谢的HLEG1蛋白水平(即实现有效干预HLEG1蛋白功能实现),有利于治疗肥胖症。
在本申请第三方面的一些实施例中,糖苷酶包括动物源糖苷酶、植物源糖苷酶以及真菌源糖苷酶中的至少一种。
上述物质,可以有效实现去除HLEG1蛋白的糖基化修饰,以使得胰蛋白酶、糜蛋白酶或胃蛋白酶可以有效地分解去糖基化修饰的HLEG1蛋白。
可选地,糖苷酶包括肽N-糖苷酶F、内切糖苷酶H以及内切糖苷酶D中的至少一种。
可选地,糖苷酶包括肽N-糖苷酶F。
第四方面,本申请提供一种筛选用于抑制HLEG1蛋白功能的分子的方法,包括:向含有HLEG1蛋白的体系中加入待筛选分子;若待筛选分子可与HLEG1蛋白靶向结合,且待筛选分子与HLEG1蛋白靶向结合后,HLEG1蛋白不能与脂肪酸结合,则待筛选分子为可抑制HLEG1蛋白功能的分子。
本申请的申请人研究发现,HLEG1蛋白的268aa-330aa区段可以携带脂肪酸;HLEG1蛋白能够从唾液腺分泌到唾液,再经消化道进入肠道表皮细胞并调控机体内的脂类代谢,如脂肪酸转运以及合成脂肪等。基于此,若HLEG1蛋白为某分子的靶点蛋白,且在该分子作用下HLEG1蛋白不能与脂肪酸结合,那么该分子为可以抑制HLEG1蛋白功能的分子。通过本申请提供的筛选用于抑制HLEG1蛋白功能的分子的方法,为筛选用于制备治疗肥胖症或预防肥胖症或减肥的口服药物提供新的思路。
在本申请第三方面的一些实施例中,待筛选分子的分子量≤1000。
第五方面,本申请提供一种抑制HLEG1蛋白功能的分子在用于制备口服药物中的应用,口药物包括治疗肥胖症的药物、预防肥胖症的药物以及减肥的药物中的至少一种;HLEG1蛋白作为分子的靶点蛋白,且HLEG1蛋白在分子作用下不能与脂肪酸结合。
在本申请第五方面的一些实施例中,口服药物为小分子药物。
附图说明
为了更清楚地说明本申请实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本申请的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
图1示出了Leg1基因敲除突变体小鼠(mleg1
图2示出了Leg1基因敲除突变体小鼠(mleg1
图3示出了Leg1基因敲除突变体小鼠(mleg1
图4示出了了Leg1基因敲除突变体小鼠(mleg1
图5示出了HLEG1蛋白的晶体X-衍射结构图。
图6示出了HLEG1蛋白和mLeg1蛋白的质谱结果总离子图。
图7示出了HLEG1蛋白、mLeg1蛋白与亚油酸(13C-Linolenic Acid)出峰结果图。
图8示出了HLEG1蛋白、mLeg1蛋白与硬脂酸(13C-Stearic Acid)出峰结果图。
图9示出了NetNGly 1.0server分析预测HLEG1上N-糖基化修饰位点的结果图。
图10示出了PNGaseF酶切前后的Western Blot实验结果图。
图11示出了过表达糖基化修饰缺失的HLEG1蛋白Western Blot实验结果图。
图12示出了mLeg1蛋白在WT小鼠的胃液、小肠液和大肠液中的分布含量图。
图13示出了用生理盐水(saline)和唾液(saliva)处理的肠道部位样品荧光图。
图14示出了过表达糖基化修饰缺失的mLeg1蛋白Western Blot实验结果图。
图15示出了HLEG1蛋白和mLeg1蛋白在小肠液中孵育后的蛋白质含量考染图。
图16示出了mLeg1-4N2A蛋白以及WT小鼠唾液中mLeg1蛋白分别在小鼠胃液和PBS溶液中孵育后的蛋白质含量结果图。
具体实施方式
为使本申请实施例的目的、技术方案和优点更加清楚,下面将对本申请实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
需要说明的是,在本申请中,HLEG1蛋白的氨基酸序列与专利CN106749601A中的hLeg1蛋白的氨基酸序列相同。
本申请提供一种分解HLEG1蛋白的方法,包括:使用糖苷酶处理HLEG1蛋白,然后加入蛋白酶进行孵育;蛋白酶包括胰蛋白酶、糜蛋白酶以及胃蛋白酶中的至少一种。
可以理解的是,蛋白酶可以同时选用胰蛋白酶、糜蛋白酶以及胃蛋白酶,也可以仅选用胰蛋白酶、糜蛋白酶以及胃蛋白酶中的任意两种或一种。
本申请的申请人研究发现,HLEG1蛋白是一种糖基化修饰的载脂蛋白质,HLEG1蛋白的24位和69位点存在N-糖基化修饰,糖基化修饰使得HLEG1在含有胃蛋白酶的消化道以及含有糜蛋白酶和胃蛋白酶的肠道中均可以稳定存在;且HLEG1蛋白为唾液腺分泌的蛋白,HLEG1蛋白的268aa-330aa区段可以携带脂肪酸,并经消化道进入肠道上皮细胞;因此,HLEG1蛋白能够从唾液腺分泌到唾液,再经消化道进入肠道表皮细胞并调控机体内的脂类代谢,如脂肪酸转运以及合成脂肪等。
本申请通过加入糖苷酶,可以有效去除HLEG1蛋白的糖基化修饰;胰蛋白酶、糜蛋白酶或胃蛋白酶的存在降低HLEG1蛋白的稳定性,可以有效分解去糖基化修饰的HLEG1蛋白,进而实现有效分解HLEG1蛋白使之丧失载脂能力。
由于胃蛋白酶是消化道(胃液)中的主要蛋白酶,胰蛋白酶和糜蛋白酶是肠道(肠液)中的主要蛋白酶。本申请提供的分解HLEG1蛋白的方法,可以在胰蛋白酶、糜蛋白酶或胃蛋白酶存在的环境(例如消化道环境,或消化过程)中有效分解去糖基化修饰的HLEG1蛋白;为有效降低消化道和肠道中的HLEG1蛋白水平以实现干预HLEG1蛋白功能,进而为治疗或者预防肥胖或减肥等药物的研发提供新的手段和思路。
在本申请中,糖苷酶包括动物源糖苷酶、植物源糖苷酶以及真菌源糖苷酶中的至少一种。上述物质,可以有效实现去除HLEG1蛋白的糖基化修饰,以使得胰蛋白酶、糜蛋白酶或胃蛋白酶可以有效分解去糖基化修饰的HLEG1蛋白。
进一步地,糖苷酶包括肽N-糖苷酶F、内切糖苷酶H(Endoglycosidase H,Endo H)以及内切糖苷酶D(Endoglycosidase DEndo D)中的至少一种。由于HLEG1蛋白的24位和69位点存在N-糖基化修饰,糖苷酶选自肽N-糖苷酶F、内切糖苷酶H(Endoglycosidase H,EndoH)以及内切糖苷酶D(Endoglycosidase DEndo D)中的至少一种,可以有效去除HLEG1蛋白的N-糖基化修饰,去除N-糖基化修饰的HLEG1蛋白更易被胰蛋白酶、糜蛋白酶或胃蛋白酶分解。
再进一步地,在本申请的实施例中,糖苷酶选自N-糖苷酶F(PNGase F)。糖苷酶选自PNGase F,更有利于有效去除HLEG1蛋白的N-糖基化修饰。具体的,PNGase F的分子量为36kDa,可以在N-连糖蛋白的高甘露糖、杂合和复合寡糖部分最内侧的N-乙酰葡萄糖胺(GlcNAc)和天冬酰氨残基之间进行切割;PNGase F的切割位点为糖蛋白内侧N-乙酰葡萄糖胺(GlcNAc)和天冬酰氨残基之间的酰胺键,同时将酶解后蛋白上的天冬氨酰转化为天冬氨酸;PNGase F不会去除常见植物糖蛋白上含有核心α-(1,3)-岩藻糖连接的寡糖。
本申请还提供一种糖苷酶在用于分解HLEG1蛋白中的应用,HLEG1蛋白作为糖苷酶的靶点蛋白。
HLEG1蛋白被糖苷酶作用后的产物能够被蛋白酶分解;蛋白酶包括胰蛋白酶、糜蛋白酶以及胃蛋白酶中的至少一种。
糖苷酶在用于分解HLEG1蛋白时,糖苷酶靶向HLEG1蛋白后可以有效去除HLEG1蛋白的糖基化修饰。HLEG1蛋白被糖苷酶作用后的产物(即去除糖基化修饰的HLEG1蛋白)能够有效被包括胰蛋白酶、糜蛋白酶以及胃蛋白酶中的至少一种的蛋白酶分解,进而实现HLEG1蛋白的分解使之丧失载脂能力。
在本申请中,糖苷酶包括动物源糖苷酶、植物源糖苷酶以及真菌源糖苷酶中的至少一种。进一步地,糖苷酶包括肽N-糖苷酶F、内切糖苷酶H(Endoglycosidase H,Endo H)以及内切糖苷酶D(Endoglycosidase DEndo D)中的至少一种。再进一步地,在本申请的实施例中,糖苷酶选自肽N-糖苷酶F。
本申请还提供一种糖苷酶在用于制备口服药物中的应用;其中,口药物包括治疗肥胖症的药物、预防肥胖症的药物以及减肥的药物中的至少一种;HLEG1蛋白作为糖苷酶的靶点蛋白。
当口服含有糖苷酶成分的药物时,糖苷酶可以靶向唾液以及食道中分布的HLEG1蛋白,并有效去除HLEG1蛋白的糖基化修饰;被去除糖基化修饰的HLEG1蛋白进入含有胃蛋白酶的消化道和含有胰蛋白酶以及糜蛋白酶的肠道后,可以被胃蛋白酶、胰蛋白酶以及糜蛋白酶有效分解,进而有效降低最终肠道中含有的HLEG1蛋白水平,进而减少HLEG1蛋白携带的脂肪酸的量,有效减少肠道表皮细胞并进行机体内的脂类代谢的HLEG1蛋白水平(即实现有效干预HLEG1蛋白功能实现),有利于治疗肥胖症。
在本申请中,糖苷酶包括动物源糖苷酶、植物源糖苷酶以及真菌源糖苷酶中的至少一种。进一步地,糖苷酶包括肽N-糖苷酶F、内切糖苷酶H(Endoglycosidase H,Endo H)以及内切糖苷酶D(Endoglycosidase DEndo D)中的至少一种。再进一步地,糖苷酶选自肽N-糖苷酶F。
本申请还提供一种筛选用于抑制HLEG1蛋白功能的分子的方法,包括:向含有HLEG1蛋白的体系中加入待筛选分子;若待筛选分子可与HLEG1蛋白靶向结合,且待筛选分子与HLEG1蛋白靶向结合后,HLEG1蛋白不能与脂肪酸结合,则待筛选分子为可抑制HLEG1蛋白功能的分子。
由于本申请的申请人研究发现,HLEG1蛋白的268aa-330aa区段可以携带脂肪酸;HLEG1蛋白能够从唾液腺分泌到唾液,再经消化道进入肠道表皮细胞并调控机体内的脂类代谢,如脂肪酸转运以及合成脂肪等。基于此,若HLEG1蛋白为某分子的靶点蛋白,且在该分子作用下HLEG1蛋白不能与脂肪酸结合,那么该分子为可以抑制HLEG1蛋白功能的分子。通过本申请提供的筛选用于抑制HLEG1蛋白功能的分子的方法,为筛选用于制备治疗肥胖症或预防肥胖症或减肥的口服药物提供新的思路。
进一步地,上述待筛选分子的分子量≤1000。筛选出的分子可以作为小分子药物以用于治疗肥胖症或预防肥胖症或减肥等。
本申请还提供一种抑制HLEG1蛋白功能的分子在用于制备口服药物中的应用,口服药物包括治疗肥胖症的药物、预防肥胖症的药物以及减肥的药物中的至少一种;HLEG1蛋白作为分子的靶点蛋白,且HLEG1蛋白在分子作用下不能与脂肪酸结合。
进一步地,口服药物为小分子药物。
以下结合实施例对本申请的特征和性能作进一步的详细描述。
mLeg1蛋白的氨基酸序列与专利CN106749601A中的mLeg1蛋白的氨基酸序列相同。HLEG1蛋白与小鼠中的同源蛋白mLeg1蛋白具有71.2%的相似性,因此,本申请通过对鼠的mLeg1蛋白的编码基因即mLeg1基因和mLeg1蛋白的功能研究能够为人类的HLEG1基因和HLEG1蛋白的功能和应用提供指导和参考的意义,同时为研发相关治疗或预防脂肪疾病的药物提供理论依据。
专利CN106749601A公开mleg1
实施例1
mleg1
对同周龄的WT小鼠(即野生型小鼠)和mleg1
从图1至图4的结果可以看出,WT小鼠和mleg1
实施例2
对HLEG1蛋白进行结构解析。
在SF9昆虫表达系统中表达纯化HLEG1蛋白并进行结构解析,使用X射线衍射方法获得蛋白结构信息如图5所示。
从图5可以看出,两个HLEG1蛋白分子通过C端相互作用形成同源二聚体。在C端形成一个口袋结构并结合了一个18碳的脂分子。N端氨基酸位置为开始至43aa,C端氨基酸位置为268aa至330aa,表明HLEG1蛋白的268aa-330aa区段可以携带脂肪酸。
实施例3
对HLEG1蛋白和mLeg1蛋白进行脂肪酸含量与种类鉴定。
纯化蛋白用甲醇/氯仿方法萃取含脂质有机相,真空浓缩干燥后重悬于120μL的溶液(异丙醇、乙腈以及水的体积比为2:1:1)中,两次常温离心取上清液,分别加入0.1,0.5,1μg/mL的同位素标品stearic acid(硬脂酸,13C
表1
从图7和图8可以看出,:HLEG1蛋白和mLeg1蛋白与硬脂酸和亚油酸出峰时间一致。
从图6至图8可以看出,在HLEG1蛋白和mLeg1蛋白中均检测到了亚麻酸(linolenicacid)、亚油酸(linoleic acid)、油酸(oleic acid)和硬脂酸(stearic acid),表明HLEG1蛋白和mLeg1蛋白均能够携带脂肪酸。
从表1可以看出,HLEG1蛋白和mLeg1蛋白均能够携带亚油酸和硬脂酸。
实施例4
HLEG1糖基化位点的鉴定
经网站NetNGly 1.0server分析(如图9所示,其中N-glycosylation sites是指N-糖基化修饰位点),HLEG1在第24位和69位的天冬酰胺上进行N-糖基化修饰。
通过点突变将pCS2+-HLEG1质粒上这两个天冬酰胺位点(N)都突变为丙氨酸(A),获得了pCS2+-HLEG1-2N2A(2N2A)质粒,将野生型pCS2+-HLEG1质粒和突变体pCS2+-HLEG1-2N2A质粒分别转染293T细胞,在转染后48h收集细胞培养上清和细胞裂解液,并用PNGaseF进行酶切处理,Western Blot实验结果如图10所示;其中,“+”是指进行PNGaseF酶切处理,“-”是指未进行PNGaseF酶切处理;saliva是指唾液,ds red-cell lysate是指转染了dsred-pCS2+质粒的对照组细胞裂解液,HLEG1-cell lysate是指转染了pCS2+-HLEG1质粒的细胞裂解液,HLEG1 2N2A-cell lysate是指转染了pCS2+-HLEG1-2N2A(2N2A)质粒的细胞裂解液,ds red-media是指转染了dsred-pCS2+质粒的对照组细胞培养上清,HLEG1-media是指转染了pCS2+-HLEG1质粒的细胞培养上清,HLEG1 2N2A-media是指转染了pCS2+-HLEG1-2N2A(2N2A)质粒的细胞培养上清。
从图10可以看出,在细胞培养上清和细胞裂解液中均能检测到HLEG1-2N2A蛋白,上清和细胞裂解液提取的HLEG1-2N2A蛋白在PNGaseF酶切后都不发生条带迁移,说明N-糖基化的缺失不影响HLEG1的分泌,HLEG1-2N2A蛋白已完全失去N-糖基化修饰,而且24位和69位天冬酰胺是HLEG1的全部N-糖基化发生位点。
此外,分别对HLEG1的第24位天冬酰胺和第69位天冬酰胺进行了点突变获得了pCS2+-HLEG1-24N2A和pCS2+-HLEG1-69N2A两种单突变体,将两种质粒分别转染293T细胞,转染后48小时收样,收集上清和细胞裂解液进行检测,检测结果如图11所示;其中,media是指上清液,lysate是指裂解液。
从图11可以看出,在细胞上清中检测到HLEG1突变体蛋白,说明第24位天冬酰胺和第69位天冬酰胺这两个位点的N-糖基化缺失不会影响HLEG1的分泌。上清和沉淀中检测到的HLEG1-69N2A蛋白条带高于HLEG1-24N2A蛋白,说明连接在24位天冬酰胺上的糖链质量要大于69位天冬酰胺上的糖链。
实施例5
mLeg1蛋白在胃液(gastric juice)、小肠液(small intestinal juice)和大肠液(large intestinal juice)中分布情况。
对WT小鼠进行饥饿处理,禁食过夜后第二天早上再喂食普通饲料,10min、3h、6h以及9h后分别提取胃液、小肠液和大肠液,并用Western Blot法检测mLeg1蛋白的分布情况,mLeg1蛋白的分布情况如图12所示;其中,图12中左部分为Western Blot图,右部分为考马斯亮蓝染色(CBB staining)图。
其中,WT小鼠胃液或肠液提取方法如下:对WT小鼠进行断颈处死后分别取出小鼠的胃部或肠部分,在冰上压取胃部或肠内容物,加适量预冷PBS稀释并转移至离心管中,4℃条件下15000g离心20min,用枪头吸取上清液,得到的上清液即为胃液或肠液。
从图12可以看出,WT小鼠饥饿处理后进食10min后,即可在胃液中检测到mLeg1蛋白;饥饿处理后进食后3h后mLeg1蛋白存在于小肠液中,且3h后小肠液中mLeg1蛋白的含量逐渐降低;饥饿处理后进食,mLeg1蛋白不会到达大肠处。表明饥饿处理后再进食而分泌的mLeg1蛋白能够在胃液和小肠液中稳定存在一段时间。
实施例6
验证mLeg1蛋白能够进入小肠上表皮细胞。
在小鼠饥饿再喂食食物之后半小时将小鼠麻醉,然后打开腹腔,此时膨大的胃部清晰可见,使用聚乙烯缝合线将胃与小肠的连接处(即幽门)双线结扎,接着在小肠与盲肠的连接部位也用聚乙烯缝合线进行双线结扎,使得小肠成为一个两端封闭的管腔。1mL注射器吸取37℃水浴后的600μL唾液(saliva)或生理盐(saline)水从幽门部斜向十二指肠内进行缓慢注射,将小鼠放在适温加热垫上保持体温,维持小肠的正常蠕动,充分吸收30分钟,取肠道部位样品进行免疫荧光实验,实验结果如图13所示;图13中蓝色部分为DAPI染色的细胞核,红色部分为mLeg1蛋白,绿色部分为上皮细胞钙黏蛋白。
从图13可以看出,小鼠唾液中含有mLeg1蛋白,且mLeg1蛋白可以进入小肠上表皮细胞。
实施例7
对mLeg1蛋白的N-糖基化修饰位点进行验证。
根据网站
为了确认这四个位点的天冬酰胺是否有N-连接糖基化修饰,申请人对pCS2+-mleg1质粒上这四个位点的天冬酰胺(N)进行了突变,获得了117,171,196,257各位点单独突变为丙氨酸(A)和四个位点全部突变为丙氨酸(A)共五种突变体,即pCS2+-mleg1-117N2A,pCS2+-mleg1-171N2A,pCS2+-mleg1-196N2,pCS2+-mleg1-257N2A和pCS2+-mleg1-4N2A质粒。使用野生型pCS2+-mleg1质粒和五种突变体质粒分别转染293T细胞,在转染后48h收集细胞培养上清和细胞裂解液并用PNGaseF进行酶切处理,Western Blot实验结果如图14所示。其中,图14中A部分是细胞培养上清(cell media)的检测结果,图14中B部分是细胞裂解液(293T cell)的检测结果。
从图14中可以看出,细胞培养上清和细胞裂解液中均能检测到五种突变体蛋白,只有细胞裂解液提取的mLeg1-4N2A样品在PNGaseF酶切后条带的迁移不发生改变,说明mLeg1-4N2A蛋白已完全失去N-糖基化修饰且N-糖基化的缺失不影响蛋白的分泌。
实施例8
对HLEG1蛋白和mLeg1蛋白耐受和小肠液的稳定性进行测试,实验结果如图15所示。具体实验方法如下:
(1)饥饿mleg1
(2)4℃条件下13kg离心10min,吸取上清液。使用Bradford法测上清液的蛋白浓度,稀释10
(3)取一份步骤(2)得到的小肠液放(即ij)在冰上备用;然后将步骤(2)得到的小肠液(即ij)于95℃水浴中灭活10min,得到灭活小肠液(即为inactived ij),置于冰上备用。
(4)冰浴下,向每个1.5mL离心管中加20μL冰上预冷的PBS,然后再向每个离心管中再分别加入10μL的小肠液(ij)、10μL的灭活小肠液(inactived ij)或10μL的PBS;然后将每个离心管于37水浴5min。
(5)水浴后将离心管置于室温,分别向每个离心管中加入10uL的BSA(牛血清白蛋白)、10uL的MLEG1、10uL的HLEG1或10uL的PBS;快速涡旋混匀后,于37℃水浴20min。此处MLEG1,HLEG1蛋白均由SF9昆虫表达系统表达纯化。
(6)结束水浴,向每个离心管中加入20uL 4
从图15可以看出,在添加小肠液后,BSA被完全降解,而HLEG1蛋白和mLeg1蛋白出现条带位移但没有被完全降解,表明HLEG1蛋白和mLeg1蛋白在小肠液中具有一定的抗降解能力。
实施例9
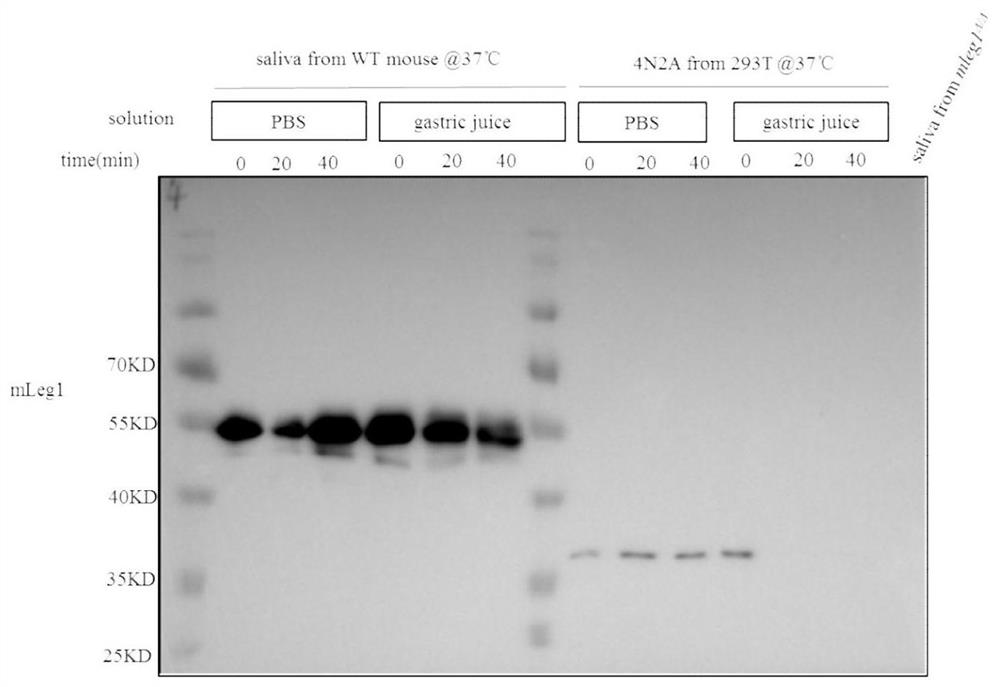
去N-糖基化修饰的mLeg1蛋白在胃液中的稳定性。
在50μL的小鼠胃液中分别加入50μL的WT小鼠唾液(即含有mLeg1蛋白)或mLeg1-4N2A蛋白,在50μL的PBS溶液中分别加入50μL的WT小鼠唾液或mLeg1-4N2A蛋白。于37℃恒温箱中孵育,分别在孵育0min、20min以及40min后加入100μL的2
从图16可以看出,mLeg1蛋白和mLeg1-4N2A蛋白在PBS溶液中孵育40min后均稳定存在,且mLeg1蛋白(即WT小鼠唾液中含有的蛋白)条带大小高于mLeg1-4N2A。而在胃液中,反应20min时,mLeg1-4N2A在小鼠胃液中被迅速分解,而小鼠唾液中的mLeg1含量却只有轻微减少(即几乎保持稳定);表明,mLeg1蛋白(即未去除糖基化修饰的蛋白)相较于mLeg1-4N2A(即去除了羰基化修饰的蛋白)在小鼠胃液中表现出更强的耐受性,即去糖基化的mLeg1-4N2A能够在小鼠胃液中被分解。由于从唾液分泌地蛋白是先经过胃液再进入小肠液然后再进入小肠上表皮细胞的,所以去糖基化的mLeg1-4N2A能够在小鼠胃液中被分解,表明可进入小肠液进而再进入小肠上表皮细胞的去糖基化的mLeg1-4N2A含量会明显降低,导致不利于进行脂肪的合成。
综上,糖苷酶可以作为口服药物以用于治疗或预防肥胖症。服用含有糖苷酶的口服药物,糖苷酶可以靶向唾液以及消化道中分布的HLEG1蛋白,并有效去除HLEG1蛋白的糖基化修饰;被去除糖基化修饰的HLEG1蛋白进入含有胃蛋白酶的消化道和含有胰蛋白酶以及糜蛋白酶的肠道后,可以被胃蛋白酶、胰蛋白酶以及糜蛋白酶有效分解,进而有效降低最终肠道中含有的HLEG1蛋白水平,有效减少肠道表皮细胞以及体内的调控脂类代谢的HLEG1蛋白水平(即实现有效干预HLEG1蛋白功能实现),有利于治疗或预防肥胖症。
以上所述仅为本申请的优选实施例而已,并不用于限制本申请,对于本领域的技术人员来说,本申请可以有各种更改和变化。凡在本申请的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本申请的保护范围之内。
- α-葡萄糖苷酶抑制剂的筛选模型及筛选方法和应用
- 一种hLeg1蛋白及其应用和药物
