一种洗消评估方法
文献发布时间:2024-04-18 19:52:40
技术领域
本发明涉及畜牧养殖技术领域,特别涉及一种洗消评估方法。
背景技术
迄今为止非洲猪瘟(ASF)仍然是严重危害养猪业的重要传染病,面对缺乏安全有效的疫苗现状,生物安全措施仍然是防控非洲猪瘟的唯一有效方法,其中彻底清除传染源是最为关键的环节。因而清洗消毒流程是否科学,清洗消毒执行是否到位十分重要。
由于目前缺乏田间科学的量化评估方法和标准,导致非洲猪瘟不可控的现状仍然没有根本性的改变。现有评估感染场所是否清洗消毒完全,主要是检测其病毒核酸是否为阳性,当核酸为阳性时表示未消杀完全,需要重新进行消杀,然而消毒剂可以破坏病毒活性,却不能彻底降解核酸,导致病毒完全灭活后,可能残留有核酸,此时核酸检测仍然为阳性,如果重新进行消杀,耗费时间长,成本高,工作量大。
发明内容
基于此,本发明提供一种洗消评估方法,该方法构建了包含目的基因的改造菌,将改造菌布点在感染场所,再进行洗消,洗消后对布点处取样,进行蓝白斑筛选试验,由于细菌的稳定性远远高于病毒,即若未产生白色菌落,则洗消合格,病毒完全灭活,无需重新进行洗消;该洗消评估方法建立了畜牧养殖行业新的洗消评估标准,充分发挥微生物的安全性和评估方法的科学性,精简生物安全防控流程,重塑高效低成本的生物安全防控体系,降低了洗消评估成本,大大缩短了评估时间。
本发明采用的技术方案是:
一种洗消评估方法,其特征在于,包括如下步骤:
步骤S1. 构建改造菌,将目的基因插入载体构建重组质粒,再转入感受态细菌,得到改造菌;
步骤S2. 病原布点,培养改造菌以获得菌液;将菌液用布点溶液稀释后,对感染的场所进行病原布点;
步骤S3. 清洗消毒,将病原布点后的场所进行清洗消毒;
步骤S4. 洗消评估,洗消后,对病原布点处取样,进行蓝白斑筛选试验;当蓝白斑筛选试验结果为产生白色菌落,表明病原布点处洗消未合格;当蓝白斑筛选试验结果为未产生白色菌落,表明病原布点处洗消合格。
在本申请公开的洗消评估方法中,所述步骤S1中,目的基因为一种或多种病原微生物的致病基因。
在本申请公开的洗消评估方法中,所述步骤S1中,载体为pUC57,酶切位点为EcoRⅠ、HindⅢ;感受态细菌为Top10菌株。
在本申请公开的洗消评估方法中,所述步骤S1中,所述改造菌具有抗生素抗性基因。
在本申请公开的洗消评估方法中,所述步骤S2中,培养改造菌以获得菌液的具体步骤为:
步骤S21. 取复苏后的菌液,在含有抗生素的LB-琼脂平板培养基上均匀涂开,平板倒置,置于37 ℃恒温箱中培养12h;
步骤S22. 挑取平板上的单个菌落放入含抗生素的LB液体培养基中,于37 ℃,200rpm的摇床上,培养2h进行增菌;
步骤S23. 将增菌的菌液转移至含抗生素的LB液体培养基中,置于37 ℃,200 rpm的摇床上,培养10~15 h进行增菌,得到菌液。
在本申请公开的洗消评估方法中,所述步骤S22中,增菌后,对菌液进行检测以排出假阳性,其具体步骤为:取增菌后的菌液,进行菌液PCR鉴定,菌液 PCR扩增后的产物,使用琼脂糖凝胶电泳检测,检测时设置阳性对照组和阴性对照组;将符合的菌液进行测序,以排除假阳性。
在本申请公开的洗消评估方法中,所述步骤S2中,布点溶液为生理盐水、PBS、脱脂奶粉、血清、血浆、粪便、蛋白质、脂质中的一种或多种。
在本申请公开的洗消评估方法中,所述步骤S2中,菌液用布点溶液稀释,其稀释倍数为3~10倍。
在本申请公开的洗消评估方法中,所述步骤S2中,病原布点的方法为:按照非洲猪瘟防控洗消原则,进行采样区域划分,分为猪舍内、猪舍外、生活区和生产物资区;对划分区域内多个位置进行病原布点,每个位置使用喷壶进行布点,布点面积大于0.5m²,所选位置根据五点分布法至少采集5个样。
在本申请公开的洗消评估方法中,所述步骤S4中,蓝白斑筛选试验的具体步骤为:
步骤S41. 将抗生素溶液加入LB固体培养基中,倒平板;在x-gal溶液中加入IPTG溶液,并在无菌条件下涂布于平板上,平板置于37℃培养箱中2~3h;
步骤S42. 将20μL取样样本、20μL野生大肠杆菌、20μL改造菌在无菌条件下接种涂布于平板中,正面朝上放置30min,37℃倒置培养12~18h。
发明的有益效果是:
(1)本申请构建了包含目的基因的改造菌,将改造菌布点在感染场所,再进行洗消,洗消后对布点处取样,进行蓝白斑筛选试验,由于细菌的稳定性远远高于病毒,即若未产生白色菌落,则洗消合格,病毒完全灭活,无需重新进行洗消;相较于荧光定量检测方法,该洗消评估方法避免了气溶胶污染对实验结果的影响,并且对可疑阳性区域可快速洗消检测,不受荧光定量检测阈值的影响。
(2)本申请通过细菌的洗消效果,确定病毒是否消杀完全,同时也对场所内的细菌进行了安全评估,提高了畜牧养殖行业的洗消评估标准。
(3)本申请的洗消评估方法建立了畜牧养殖行业新的洗消评估标准,充分发挥微生物的安全性和评估方法的科学性,精简生物安全防控流程,重塑高效低成本的生物安全防控体系,降低了洗消评估成本,大大缩短了评估时间。
附图说明
为了更清楚地说明本申请实施例的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本申请的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
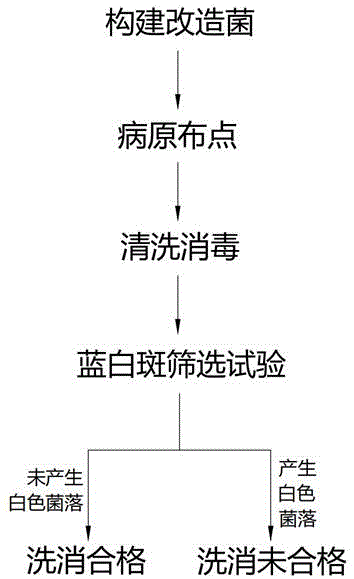
图1为洗消评估方法的流程示意图;
图2为改造菌进行蓝白斑筛选试验的结果图;
图3为改造菌与非重组质粒野生菌混合接种进行蓝白斑筛选试验的结果图;
图4为琼脂糖凝胶电泳试验的结果图;
图5为某养殖场的布局图;
图6为一实施例中阴性对照(非重组质粒野生菌,右)与阳性对照(改造菌,左)的蓝白斑筛选试验结果图;
图7为一实施例中取样样本的蓝白斑筛选结果图。
具体实施方式
在下文中,仅简单地描述了某些示例性实施例。正如本领域技术人员可认识到的那样,在不脱离本发明的精神或范围的情况下,可通过各种不同方式修改所描述的实施例。
在本申请中提及“实施例”意味着,结合实施例描述的特定特征、结构或特性可以包含在本申请的至少一个实施例中。在说明书中的各个位置出现该短语并不一定均是指相同的实施例,也不是与其它实施例互斥的独立的或备选的实施例。本领域技术人员显式地和隐式地理解的是,本文所描述的实施例可以与其它实施例相结合。
下面对本发明的实施例进行详细说明。
由于目前缺乏田间科学的量化评估方法和标准,导致非洲猪瘟不可控的现状仍然没有根本性的改变。现有评估感染场所是否清洗消毒完全,主要是检测其病毒核酸是否为阳性,当核酸为阳性时表示未消杀完全,需要重新进行消杀,然而消毒剂可以破坏病毒活性,却不能彻底降解核酸,导致病毒完全灭活后,可能残留有核酸,此时核酸检测仍然为阳性,如果重新进行消杀,耗费时间长,成本高,工作量大。
为了解决现有技术的问题,请参见图1所示,本发明提供一种洗消评估方法,包括如下步骤:
步骤S1. 构建改造菌,将目的基因插入载体构建重组质粒,再转入感受态细菌,得到改造菌;
步骤S2. 病原布点,培养改造菌以获得菌液;将菌液用布点溶液稀释后,对感染的场所进行病原布点;
步骤S3. 清洗消毒,将病原布点后的场所进行清洗消毒;
步骤S4. 洗消评估,洗消后,对病原布点处取样,进行蓝白斑筛选试验;当蓝白斑筛选试验结果为产生白色菌落,表明病原布点处洗消未合格;当蓝白斑筛选试验结果为未产生白色菌落,表明病原布点处洗消合格。
本申请的洗消评估方法构建了包含目的基因的改造菌,将改造菌布点在感染场所,再进行洗消,洗消后对布点处取样,进行蓝白斑筛选试验,由于细菌的稳定性远远高于病毒(
随着养猪集约化程度的提高、气候的剧变以及病原菌耐药性的增强,猪呼吸道疾病和猪肠道病菌逐渐成为困扰养猪场的一类重要疾病。常见的主要是呼吸道和肠道细菌引起的病征,如副猪嗜血杆菌、巴氏杆菌和胸膜肺炎放线杆菌等。目前的生物安全评估措施未曾验证养殖厂内细菌洗消效果,使复产和日常养殖存在隐患。由于细菌的稳定性远远高于病毒,本申请通过细菌的洗消效果,确定病毒是否消杀完全,同时也对病所内的细菌进行了安全评估,提高了病所洗消评估标准。
该洗消评估方法建立了畜牧养殖行业新的洗消评估标准,充分发挥微生物的安全性和评估方法的科学性,精简生物安全防控流程,重塑高效低成本的生物安全防控体系,降低了洗消评估成本,大大缩短了评估时间。
在一个实施例中,步骤S1中,目的基因为一种或多种病原微生物的致病基因。具体地,病原微生物可以为病毒、细菌等,其中,病毒可以为非洲猪瘟病毒、猪蓝耳病毒、猪流行性腹泻病毒、猪伪狂犬病毒、猪圆环病毒中的一种或多种。细菌可以为副猪嗜血杆菌、巴氏杆菌、胸膜肺炎放线杆菌中的一种或多种。应当理解地是,本申请所指目的基因并不局限于上述病毒和细菌的基因,其可以为畜牧养殖领域内的各种致病基因。
具体地,改造菌具有抗生素抗性基因,可以为氨基苄青霉素抗性,氯霉素抗性等,便于改造菌的培养。
在一个具体的实施场景中,将三种病毒(非洲猪瘟病毒ASFV、猪蓝耳病毒PRRSV、猪流行性腹泻病毒PEDV)目的基因插入连接载体pUC57构建重组质粒,酶切位点为EcoRⅠ、HindⅢ,再转入Top10菌株,得到改造菌。如表1所示,为pUC-K196R-M-N质粒序列。
表1 pUC-K196R-M-N质粒序列
将改造菌进行蓝白斑筛选试验,如附图2所示,培养基上长出白色菌落;
将改造菌与非重组质粒野生菌混合接种,进行蓝白斑筛选试验,如附图3所示,培养基上长出白色菌落和蓝色菌落,且有明显的单菌落,两者差异显著。
根据改造菌序列,设计普通PCR引物对白色菌落和蓝色菌落进行验证,确定是否可进行区分,验证白色菌落为改造菌。分别挑取培养基上白色菌落和蓝色菌落进行菌落PCR,取菌落PCR产物进行琼脂糖凝胶电泳试验。PCR引物序列如表2所示,具体加样体系和反应体系如表3、表4所示。电泳试验如附图4所示,阳性为目的条带,无杂带及引物二聚体,阴性无条带。
表2 PCR引物序列
表3 PCR加样体系
表4 反应程序
在一个实施例中,步骤S2中,培养改造菌以获得菌液的具体步骤为:
步骤S21. 取复苏后的菌液,在含有AMP(氨苄青霉素)的LB-琼脂平板培养基上均匀涂开,平板倒置,置于37 ℃恒温箱中培养12h;
步骤S22. 挑取平板上的单个菌落放入含AMP的LB液体培养基中,于37 ℃,200rpm的摇床上,培养2h进行增菌;
步骤S23. 将增菌的菌液转移至含AMP的LB液体培养基中,置于37 ℃,200 rpm的摇床上,培养10~15 h进行增菌,得到菌液。
具体地,步骤S22中,增菌后,对菌液进行检测以排出假阳性,其具体步骤为:取增菌后的菌液,进行菌液PCR鉴定,菌液 PCR扩增后的产物,使用琼脂糖凝胶电泳检测,检测时设置阳性对照组和阴性对照组;将符合的菌液进行测序,排除假阳性。
在一个实施例中,步骤S2中,布点溶液可以为无机溶液、有机溶液中的一种或多种,其中,无机溶液包括生理盐水、PBS(磷酸缓冲液)等,有机溶液包括脱脂奶粉、血清、血浆、粪便、蛋白质、脂质等。由于无机溶液布点后更宜消杀,因此本申请优选为有机溶液进行病原布点。
在一个实施例中,菌液用布点溶液稀释,其稀释倍数为3~10倍。具体地,稀释倍数可以为3倍、5倍、7倍、10倍等。
在一个具体的实施场景中,将25g脱脂奶粉混入100mL改造菌液中,并加入生理盐水定容至500mL,对感染的场所进行病原布点。由于脱脂奶粉具有一定的粘性,将菌液与脱脂奶粉混合,再用生理盐水稀释至液体浓稠,便于病原布点。
在一个实施例中,步骤S2中,病原布点的方法为:按照非洲猪瘟防控洗消原则,进行采样区域划分,分为猪舍内、猪舍外、生活区和生产物资区(请参见图5所示,为某养殖场的布局图);对划分区域内多个位置(如表5所示,为区域内的位置选择)进行病原布点,每个位置使用喷壶进行布点,布点面积大于0.5m²,所选位置根据五点分布法至少采集5个样。
表5 划分区域内病原布点位置选择表
在一个实施例中,步骤S4中,蓝白斑筛选试验的具体步骤为:
步骤S41. 将Amp溶液加入LB固体培养基中,倒平板;在x-gal(5-溴-4-氯-3-吲哚-β-D-半乳糖苷)溶液中加入IPTG(异丙基-β-D-硫代半乳糖苷)溶液,并在无菌条件下涂布于平板上,平板置于37℃培养箱中2~3h;
步骤S42. 将20μL取样样本、20μL野生大肠杆菌、20μL改造菌在无菌条件下接种涂布于平板中,正面朝上放置30min,37℃倒置培养12~18h。
具体地,x-gal溶液的配制:用二甲基甲酰胺将x-gal溶解至20mg/ml,用0.22μm滤膜过滤除菌,得到x-gal溶液,避光保存,备用;
IPTG溶液和Amp溶液的配制为:用去离子水配制0.2g/mL 的IPTG溶液和100mg/mLAmp溶液,-20℃保存,备用;
平板具体制备为:将125μL的Amp溶液加入250mL 培养基中,倒平板;在40μL x-gal溶液中加入4μL IPTG溶液,并在无菌条件下涂布于平板上,平板置于37℃培养箱中2~3h。
在一个具体的实施场景中,请参见图6所示,为20μL非重组质粒野生菌(阴性对照,右)与20μL改造菌(阳性对照,左)的对照图,显示阴性对照没有菌落生长,阳性对照只有白色菌落生长;请参见图7所示,为取样样本的蓝白斑筛选结果图,显示长有白色菌落,即场所洗消未合格,需要重新消杀。
基于上述各实施例,本发明实施例的洗消评估方法具有以下优点:本申请构建了包含目的基因的改造菌,将改造菌布点在感染场所,再进行洗消,洗消后对布点处取样,进行蓝白斑筛选试验,由于细菌的稳定性远远高于病毒,即若未产生白色菌落,则洗消合格,病毒完全灭活,无需重新进行洗消;相较于荧光定量检测方法,该洗消评估方法避免了气溶胶污染对实验结果的影响,并且对可疑阳性区域可快速洗消检测,不受荧光定量检测阈值的影响。本申请通过细菌的洗消效果,确定病毒是否消杀完全,同时也对场所内的细菌进行了安全评估,提高了畜牧养殖行业的洗消评估标准。本申请的洗消评估方法建立了畜牧养殖行业新的洗消评估标准,充分发挥微生物的安全性和评估方法的科学性,精简生物安全防控流程,重塑高效低成本的生物安全防控体系,降低了洗消评估成本,大大缩短了评估时间。
以上仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
