一种EPSC来源简单高效分化获得神经干细胞及星形胶质细胞的方法
文献发布时间:2024-04-18 19:58:30
技术领域
本发明属于干细胞生物技术领域,具体地,本发明涉及一种EPSC来源简单高效分化获得神经干细胞及星形胶质细胞的方法。
背景技术
脊髓作为中枢神经系统(Central nervous system,CNS)的一部分,在运动和感觉信息的传递中起着至关重要的作用。脊髓损伤(Spinal cord injury,SCI)导致脊髓功能受损,进而导致感觉、运动和内脏功能丧失,常以瘫痪告终。神经干细胞(neural stem cells,NSCs)移植被认为是促进脊髓损伤后功能恢复的一种有前途的治疗策略。近年来,神经干细胞移植已广泛应用于脑卒中、肌萎缩性侧索硬化症、脊髓损伤等神经疾病治疗中以及基于神经干细胞的抗癌基因治疗中。体外制造NSCs的方案多种多样,如从胚胎干细胞(ESCs)或诱导多能干细胞(iPSCs)分化而来的NSCs,以及从体细胞干细胞重新编程而来的NSCs,这些NSCs有可能用于神经干细胞移植治疗。
星形胶质细胞是中枢神经系统中最重要的一类胶质细胞,参与血脑屏障的组成、神经突触修剪、神经元营养供应及稳态维持、维持胶质淋巴系统正常运行、小胶质细胞碎片清除等多种生理功能。星形胶质细胞具有通过谷氨酸转运体(EAAT)摄取脑组织中谷氨酸的能力,防止谷氨酸的积累引起的神经毒性。星形胶质细胞功能异常与中枢神经系统衰老及功能障碍以及多种神经退行性疾病相关。Vieira R等人研究发现使用健康的星形胶质细胞进行鞘内回输治疗可以替换脑部原有的功能受损的星形胶质细胞,并在部分中枢神经系统疾病中发挥治疗作用(文献1:Vieira R,Mariani J N,Huynh N P T,et al.Young glialprogenitor cells competitively replace aged and diseased human glia in theadult chimeric mouse brain[J].Nature Biotechnology,2023:1-12.)。
Swistowski A等人先使胚胎干细胞(ESC)形成拟胚体(EB),之后在神经诱导培养基(DMEM/F12基础培养基、1% Glutamax、1% NEAA、0.5% N2及20ng/mL FGF2)中继续悬浮培养2-3天,再将细胞转移至预先使用含CellstartTM包被的培养板中贴壁培养,2-3天后出现神经花环结构,分化成的NSC需要用玻璃吸管挑取并转移到新的孔中以提升纯度(文献2:Swistowski A,Peng J,Han Y,et al.Xeno-free defined conditions for culture ofhuman embryonic stem cells,neural stem cells and dopaminergic neurons derivedfrom them[J].PloS one,2009,4(7):e6233)。但是该方案所使用的多能干细胞为hESC,存在伦理问题,获得的NSC分化为多巴胺能神经元能力尚可,但胶质细胞分化潜能尤其是星形胶质细胞(astrocyte,ATC)分化潜能低。
Liu B C等人以人胚胎干细胞(hEMS)或诱导多能干细胞(iPSC)为前体细胞进行分化,培养过程中每天更换新的CL培养基直至神经花环出现,其细胞具有NESTIN和N-cadherin双阳特征,消化处理后继续使用CL培养基半换液培养,6-7天后神经球形成(文献3:Liu B C,Liu F Y,Gao X Y,et al.Global transcriptional analyses of the Wnt-induced development of neural stem cells from human pluripotent stem cells[J].International Journal of Molecular Sciences,2021,22(14):7473)。该方法使用的hESC同样存在伦理问题,此外,iPSC干性及向神经分化潜能不如EPSC,CL培养基成分复杂,NSC成球培养步骤多时间长(14d),且该方案得到的NSC分化的神经元和星形胶质细胞在形态上不是典型的神经元和星形胶质细胞的形态。
Chen Y等人采用hESC或iPSC,先使用含Y-27632的E8培养基培养,神经诱导培养阶段,经筛选发现以E6作为基础培养基同时添加DN-193189+2μMA83-01(LA)时,分化效率最高,第6天时PAX6阳性细胞率达到90%(文献4:Chen Y,Tristan C A,Mallanna S K,etal.Chemically Defined Neural Conversion of Human Pluripotent Stem Cells[J].Neural Stem Cells:Methods and Protocols,2019:59-72)。但是该方法形成的NSC向星形胶质细胞分化的能力较弱,且需要使用较多小分子抑制剂,存在分化时间长、成本高和安全性差等问题。
可见,目前大多数神经干细胞分化方案步骤繁琐,且需要多种激活剂或抑制剂来改变干细胞命运,造成了分化时间长、成本高等问题。部分已有方案使用胚胎干细胞作为iNSC来源,在研究和临床应用方面具有伦理问题。另一些已有方案使用iPSC为iNSC来源,而iPSC干性的维持及向神经外胚层分化的潜能欠佳,具体表现为得到的iNSC向胶质细胞分化的潜能不强。扩展潜能干细胞或扩展多能干细胞(EPSCs)是一种新型的、基因表达更类似于四细胞或八细胞阶段的更稳定的细胞系,具有扩展的发育潜力,可以形成胚胎和胚胎外(ExEm)谱系,其单细胞克隆率高、高效的嵌合能力和高效的胚外组织发育能力,被证明是具有比iPSC更佳发育潜能的干细胞。
有鉴于此,为了克服目前本领域存在的上述技术问题,本发明提供一种通过人扩展性多能干细胞分化为神经干细胞的方法,这种方法简单高效,成本低且分化时间短,获得的神经干细胞可以高效诱导分化为星形胶质细胞和神经元。
发明内容
本发明的目的是为了克服目前本领域存在的上述技术问题,为本领域提供一种通过人扩展性多能干细胞分化为神经干细胞的方法。
本发明的上述目的通过以下技术方案得以实现:
本发明的第一方面提供了一种诱导扩展性多能干细胞分化为神经干细胞的方法。
进一步,所述方法包括如下步骤:将扩展性多能干细胞在神经干细胞诱导培养基中进行培养,得到扩展性多能干细胞来源的神经干细胞;
所述神经干细胞诱导培养基包含如下组分:基础培养基DMEM/F12,基础培养基Neurobasal Medium,N2 supplementary,B27 supplementary,Glutmax,NEAA,2-mercaptoethanol,Penicillin-Streptomycin Solution。
进一步,所述神经干细胞诱导培养基中各组分的含量如下:基础培养基DMEM/F12:Neurobasal Medium 1:(0.5-1.5),N2 supplementary(0.1-1)%,B27supplementary(0.5-1.5)%,Glutmax(0.5-1.5)%,NEAA(0.5-1.5)%,2-mercaptoethanol(0.05-0.5)%,Penicillin-Streptomycin Solution(0.5-1.5)%;
优选地,所述神经干细胞诱导培养基中各组分的含量如下:基础培养基DMEM/F12:Neurobasal Medium 1:1,N2 supplementary 0.5%,B27 supplementary1%,Glutmax1%,NEAA1%,2-mercaptoethanol 0.1%,Penicillin-Streptomycin Solution 1%。
进一步,所述方法包括如下步骤:
(1)Day0,将扩展性多能干细胞在神经干细胞诱导培养基中进行培养;
(3)Day6-8,得到扩展性多能干细胞来源的神经干细胞;
优选地,每隔24h更换一次神经干细胞诱导培养基。
在一些实施方案中,所述扩展性多能干细胞(Expanded pluripotent stem cell,EPSC)并无特别限制,其可来源自基本上任何合适的来源,合适的扩展性多能干细胞的来源方面可以是各种哺乳动物体细胞来源的扩展性多能干细胞,可以是各种合适的干细胞来源的扩展性多能干细胞。
在一些实施方案中,所述体细胞包括但不限于:哺乳动物来源(例如来自啮齿类动物、猫、犬、猪、山羊、绵羊、马、牛,或灵长类动物,例如人,优选为人)的各种体细胞,例如肌细胞、软骨细胞、内皮细胞、上皮细胞等。或者,所述扩展性多能干细胞是自公共细胞资源库获得或是购买的商品化产品。
在一些实施方案中,所述合适的干细胞包括但不限于:胚胎干细胞(Embryonicstem cell,ESC)、单倍体胚胎干细胞(Haploid embryonic stem cell,haESC)、诱导多能干细胞(Inducedpluripotent stem cell,iPSC)、成体干细胞(Somatic stem cell,例如骨髓、脂肪、神经或皮肤中提取的干细胞)。
在具体实施方案中,本发明所述的扩展性多能干细胞采用如下方法制备得到:使用DMEM/F12培养基稀释matrigel至终浓度为0.5%,包被细胞培养板,CO
在具体实施方案中,所述EPSC培养基包含如下组分:Advanced DMEM/F-12,Neurobasal Medium,KSR,Glutamax,NEAA,ITSX,N2 supplementary,B27supplementary,L-AA-pi,Y-27632(ROCKi),LIF,Activin A,SDM,CHIR99021,Minocycline HCl,XAV939,GSK126,Trolox。
在具体实施方案中,所述EPSC培养基中各组分的含量如下:Advanced DMEM/F-1246%,Neurobasal Medium 46%,KSR 3%,Glutamax 1%,NEAA1%,ITSX 1%,N2supplementary 1%,B27 supplementary 0.5%,L-AA-pi 100μg/mL,Y-27632(ROCKi)1.6μg/mL,LIF 10ng/mL,Activin A40ng/mL,SDM 0.9μg/mL,CHIR99021 0.5μg/mL,MinocyclineHCl 0.85μg/mL,XAV939 0.65μg/mL,GSK126 0.53μg/mL,Trolox 2.6μg/mL。
在具体实施方案中,所述方法还包括如下步骤:Day-1,将本发明实施例中制备得到的扩展性多能干细胞在如前所述的EPSC培养基中进行培养,培养至融合度大约到90%。TryplE消化酶与DPBS按照1:1稀释。EPSC用DPBS洗一遍后用TryplE稀释液消化,镜下观察至细胞四周发亮细胞间产生间隙,收集并吹散成单细胞,以60-80%密度铺盘至6孔板,6孔板需提前用1:300稀释的Matrigel包被1小时,24h后(Day0),将EPSC培养基更换为如前所述的方法中的神经干细胞诱导培养基进行如前所述的培养过程。
在具体实施方案中,可通过观察不同阶段的细胞形态变化和检测神经干细胞标志物NESTIN/SOX2的表达来判断是否成功将扩展性多能干细胞诱导分化为神经干细胞。其中,检测标志物的表达是指测定基因(标志物)的RNA转录物或其表达产物的相对水平。用于检测基因的表达/转录的方法,即基因表达/转录谱分析,包括基于多核苷酸的杂交分析的方法、基于多核苷酸的测序的方法、免疫组织化学方法、基于蛋白质组学的方法。所述方法一般检测感兴趣的基因的表达/转录产物(例如mRNA)。在一些实施方式中,可使用基于PCR的方法例如逆转录PCR(RT-PCR),以及基于阵列的方法例如微阵列。
采用本发明所述的方法制备得到的扩展性多能干细胞来源的神经干细胞具有极强的分化潜能,包括向功能性星形胶质细胞分化的能力和向功能性神经元分化的能力,且显著优于采用现有技术报道的神经干细胞诱导培养基诱导分化得到的神经干细胞。采用本发明所述的方法制备得到的神经干细胞可直接应用于各种医药和科研用途,也可将其诱导分化成不同的目标细胞后应用于各种医药和科研用途。
本发明的第二方面提供了一种诱导扩展性多能干细胞分化为神经干细胞的神经干细胞诱导培养基。
进一步,所述神经干细胞诱导培养基包含如下组分:基础培养基DMEM/F12,基础培养基Neurobasal Medium,N2 supplementary,B27 supplementary,Glutmax,NEAA,2-mercaptoethanol,Penicillin-Streptomycin Solution;
优选地,所述神经干细胞诱导培养基中各组分的含量如下:基础培养基DMEM/F12:Neurobasal Medium 1:(0.5-1.5),N2 supplementary(0.1-1)%,B27supplementary(0.5-1.5)%,Glutmax(0.5-1.5)%,NEAA(0.5-1.5)%,2-mercaptoethanol(0.05-0.5)%,Penicillin-Streptomycin Solution(0.5-1.5)%;
更优选地,所述神经干细胞诱导培养基中各组分的含量如下:基础培养基DMEM/F12:Neurobasal Medium 1:1,N2 supplementary 0.5%,B27 supplementary1%,Glutmax1%,NEAA1%,2-mercaptoethanol 0.1%,Penicillin-Streptomycin Solution 1%。
在一些实施方案中,本发明所述的组分是指可用于细胞培养基中以维持和/或促进细胞生长和/或分化的任何化合物或其他材料,无论其来源是化学的还是生物的。术语“组分”和“成分”可互换使用。用于细胞培养基的常规成分可包括但不限于氨基酸、盐、金属、糖、脂质、核酸、激素、维生素、脂肪酸、蛋白质等等。促进和/或维持离体或体外细胞培养的其他成分可通过本领域普通技术人员根据期望效果的需要而加以选择。
在一些实施方案中,本发明对所述神经干细胞诱导培养基中各组分的具体含量并无特别限制,只要由具体含量的各组分组成的所述神经干细胞诱导培养基能够发挥或基本发挥预期的效果(例如:能够有效或基本有效地诱导扩展性多能干细胞分化为神经干细胞),其均在本发明的保护范围内。
在具体实施方案中,本发明通过对比实验验证发现,相对于采用现有技术报道的常规的神经干细胞诱导培养基(例如:CL培养基和N-induce培养基)诱导分化得到的神经干细胞而言,采用本发明所述的神经干细胞诱导培养基诱导分化得到的神经干细胞具有更强的向星形胶质细胞和神经元分化的潜能。
本发明的第三方面提供了一种诱导扩展性多能干细胞分化为星形胶质细胞的方法。
进一步,所述方法包括如下步骤:采用本发明第一方面所述的方法将扩展性多能干细胞诱导分化为神经干细胞,将得到的神经干细胞在星形胶质细胞培养基中进行培养,得到星形胶质细胞;
优选地,在星形胶质细胞培养基中培养28天后得到星形胶质细胞;
优选地,每隔48h更换一次星形胶质细胞培养基。
进一步,所述星形胶质细胞培养基包含如下组分:Advanced DMEM/F12,Neurobasal Medium,N2 supplementary,B27 supplementary,Glutamax,NEAA,2-mercaptoethanol,Penicillin-Streptomycin Solution,CNTF;
优选地,所述星形胶质细胞培养基中各组分的含量如下:Advanced DMEM/F12(20-60)%,Neurobasal Medium(20-60)%,N2 supplementary(0.1-1)%,B27 supplementary(0.5-1.5)%,Glutamax(0.5-1.5)%,NEAA(0.5-1.5)%,2-mercaptoethanol(0.05-0.5)%,Penicillin-Streptomycin Solution(0.5-1.5)%,CNTF(5-15)ng/mL;
更优选地,所述星形胶质细胞培养基中各组分的含量如下:Advanced DMEM/F1248%,Neurobasal Medium 48%,N2 supplementary 0.5%,B27supplementary 1%,Glutamax 1%,NEAA1%,2-mercaptoethanol 0.1%,Penicillin-Streptomycin Solution1%,CNTF 10ng/mL。
在具体实施方案中,可通过检测星形胶质细胞标志物S100B、AQP4、NFIB、OCT4、EAAT1等的表达来判断是否成功将扩展性多能干细胞来源的神经干细胞诱导分化为神经干细胞。
本发明的第四方面提供了一种诱导扩展性多能干细胞分化为神经元的方法。
进一步,所述方法包括如下步骤:采用本发明第一方面所述的方法将扩展性多能干细胞诱导分化为神经干细胞,将得到的神经干细胞在神经扩增培养基中进行培养,得到神经元;
优选地,在神经扩增培养基中培养5天后得到神经元;
优选地,每隔24h更换一次神经扩增培养基。
进一步,所述神经扩增培养基包含如下组分:Neurobasal Medium,B27supplementary,Glutamax,Penicillin-Streptomycin Solution,bFGF;
优选地,所述神经扩增培养基中各组分的含量如下:Neurobasal Medium(93-97)%,B27 supplementary(1-3)%,Glutamax(0.5-2)%,Penicillin-StreptomycinSolution(0.5-2)%,bFGF(10-30)ng/mL;
更优选地,所述神经扩增培养基中各组分的含量如下:Neurobasal Medium96%,B27 supplementary 2%,Glutamax 1%,Penicillin-Streptomycin Solution 1%,bFGF20ng/mL。
在具体实施方案中,可通过检测神经细胞标志物MAP2等的表达来判断是否成功将扩展性多能干细胞来源的神经干细胞诱导分化为神经元。
本发明的第五方面提供了一种诱导神经干细胞分化为星形胶质细胞的星形胶质细胞培养基、一种诱导神经干细胞分化为神经元的神经扩增培养基。
进一步,所述星形胶质细胞培养基为本发明第三方面中所述的星形胶质细胞培养基,所述神经扩增培养基为本发明第四方面中所述的神经扩增培养基。
本发明的第六方面提供了如下任一方面的应用,所述应用包括:
(1)本发明的第二方面所述的神经干细胞诱导培养基在诱导扩展性多能干细胞分化为神经干细胞中的应用;
(2)本发明的第二方面所述的神经干细胞诱导培养基和/或本发明的第五方面中所述的星形胶质细胞培养基在诱导扩展性多能干细胞分化为星形胶质细胞中的应用;
(3)本发明的第二方面所述的神经干细胞诱导培养基、本发明的第五方面中所述的星形胶质细胞培养基和/或本发明的第五方面中所述的神经扩增培养基在诱导扩展性多能干细胞分化为神经元中的应用;
(4)采用本发明第一方面所述的方法制备得到的神经干细胞、采用本发明第三方面所述的方法制备得到的星形胶质细胞和/或采用本发明第四方面所述的方法制备得到的神经元在神经疾病相关的细胞模型构建、神经疾病相关的药物筛选、神经疾病相关的体外实验研究中的应用。
在一些实施方案中,所述神经疾病包括但不限于:脑卒中、肌萎缩性侧索硬化症、脊髓损伤、运动性神经元病、脑萎缩、多发性硬化症、脱髓鞘病、亨廷顿病舞蹈症、阿尔茨海默氏症、帕金森病、脑瘫、脑外伤、脑肿瘤、先天性脑发育不全、化学药物中毒等引起大脑神经组织损伤、急性感染性多发性神经根炎、小儿麻痹。任何由遗传、先天发育不良造成的小儿脑瘫,智力低下等脑部疾病,任何由外伤造成的急性脑损伤后遗症、脑血管病造成的脑中风后遗症等脑部疾病,任何因中枢神经纤维损伤进而造成脑神经细胞衰老退化造成的慢性退行性疾病均在本发明所述的神经疾病的范围内。
相对于现有技术,本发明具有的优点和有益效果:
(1)与目前常规的iPSC/ESC向NSC诱导分化的方法相比,本发明提供的方法中使用EPSC代替iPSC和ESC,不存在ESC伦理风险,且向神经外胚层的分化潜能显著优于iPSC。此外,本发明提供的方法分化过程简单,铺盘后每天换液至所需天数即可,不需要形成拟胚体和单克隆成神经球等步骤;分化时间短,D3-D4即可出现大量NESTIN阳性细胞,且细胞增殖能力强,收获量大。
(2)本发明提供的方法中所采用的培养基成分简单,不含小分子药物如CHIR99032、XAV929、LDN193189、SB431542、LIF以及腐胺中的一种或多种。本发明使用易得的抗氧化剂2-mercaptoethanol,使用易得的基质胶matrigel进行包被,分化成本更低,且分化得到的神经干细胞具有很强的向星形胶质细胞及神经元分化的潜能。本发明提供的方法能够实现EPSC来源的神经干细胞及星形胶质细胞的大规模生产,且具有操作简单、成本低、分化效率高、分化周期短、分化产生的细胞数量多等优点。
附图说明
图1为EPSC分化神经干细胞第4天(D4)、第7天(D7)的明场图;
图2为EPSC来源iNSC免疫荧光染色鉴定结果图;
图3为EPSC来源iNSC相关标志物NESTIN、PAX6及神经元标记物TUBB3表达水平检测结果图;
图4为iNSC来源的神经元GFAP染色结果图;
图5为iNSC来源的星形胶质细胞GFAP染色结果图;
图6为EPSC来源神经干细胞分化得到的星形胶质细胞相关特征蛋白S100B、AQP4、NFIB、OCT4、EAAT1表达水平检测结果图;
图7为iNSC来源的神经元和星形胶质细胞共培养,形成突触-端脚结构的结果图;
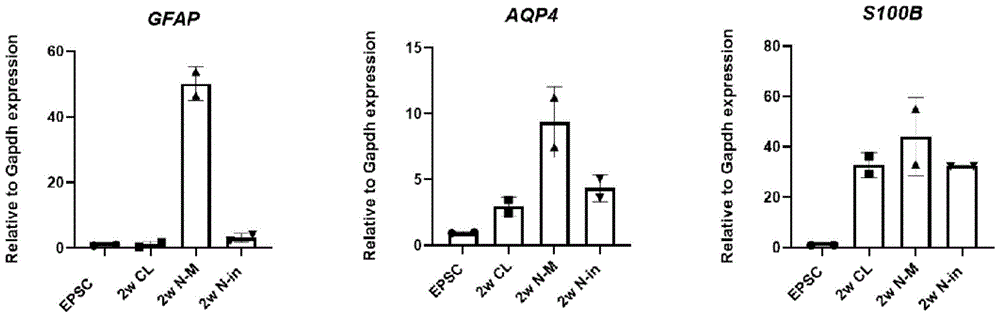
图8为不同神经干细胞诱导培养基分化得到的iNSC向星形胶质细胞分化的潜能比较结果图。
具体实施方式
本发明实施例中所使用的主要仪器耗材和实验试剂的具体信息见下表1和下表2。
表1本发明使用的仪器耗材
表2本发明使用的试剂信息
下面结合具体实施例,进一步阐述本发明,仅用于解释本发明,而不能理解为对本发明的限制。本领域的普通技术人员可以理解为:在不脱离本发明的原理和宗旨的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由权利要求及其等同物限定。下列实施例中未注明具体条件的实验方法,通常按照常规条件或按照厂商所建议的条件实施检测。
实施例1由人扩展性多能干细胞(EPSC)制备神经干细胞
1、实验方法
(1)人扩展性多能干细胞(EPSC)的诱导及传代培养
EPSC由本公司自行制备,制备方法如下:使用DMEM/F12培养基稀释matrigel至终浓度为0.5%,包被细胞培养板,CO
表3EPSC培养基成分表
(2)人扩展性多能干细胞(EPSC)向神经干细胞(NSC)的诱导分化培养
将EPSC在EPSC培养基(成分见表3)中培养至融合度大约到90%。TryplE消化酶与DPBS按照1:1稀释。EPSC用DPBS洗一遍后用TryplE稀释液消化,镜下观察至细胞四周发亮细胞间产生间隙,收集并吹散成单细胞,以60-80%密度铺盘至6孔板,6孔板需提前用1:300稀释的Matrigel包被1小时,此时分化时间记为D-1。
24小时后,EPSC培养基更换为神经干细胞诱导培养基(N-M培养基),此时分化天数为D0,后续每隔24小时更换NSC诱导培养基,培养6-8天,得到神经干细胞。诱导分化过程中观察细胞形态变化,并检测神经干细胞标志物NESTIN、PAX6和神经细胞特异性标志物TUBB3的表达情况。
神经干细胞诱导培养基(N-M培养基)成分(见表4):基础培养基DMEM/F12:Neurobasal Medium 1:1,N2 supplementary 0.5%,B27 supplementary 1%,Glutmax1%,NEAA1%,2-mercaptoethanol 0.1%,Penicillin-Streptomycin Solution1%。
表4N-M培养基
2、实验结果
(1)EPSC向iNSC分化阶段细胞形态变化
结果如图1所示,结果显示,EPSC在神经干细胞诱导培养基条件下,增殖迅速,在第四天即可出现神经花环状结构,到第七天即可出现大量神经花环结构。
(2)EPSC向iNSC分化阶段神经干细胞标志物表达情况
为鉴别分化第7天(D7)时神经干细胞的特征,对分化细胞进行神经干细胞标志物NESTIN染色,可以看到NESTIN阳性的放射状花环结构(图2左)。将其进行消化成为单细胞后重新铺盘,进行NESTIN/SOX2染色,可以看到NESTIN定位于细胞骨架,SOX2定位于细胞核,认定即为神经干细胞(图2右)。
检测分化第0、2、3、4、5、7天时神经干细胞标志物NESTIN、PAX6表达情况,以及神经细胞特异性标志物TUBB3的表达变化。结果如图3所示,结果显示,在分化第0到第7天,神经干细胞标志物NESTIN和PAX6的表达量逐渐升高,而神经细胞特异性标志物TUBB3在分化第3天之后基本维持不变。表明在神经干细胞分化过程中,细胞可以维持在神经干细胞阶段不向神经细胞分化。
实施例2EPSC分化得到的神经干细胞的功能检测
1、实验方法
(1)诱导神经干细胞(iNSC)向星形胶质细胞及神经元的分化
iNSC汇合度达到60%时,按照1:2传代至12孔板,更换星形胶质细胞培养基(ATC培养基,成分见表5)诱导其向星形胶质细胞的分化,当细胞汇合度达到90%时按照1:2传代(参考文献Shaltouki A,Peng J,Liu Q,et al.Efficient generation of astrocytesfrom human pluripotent stem cells in defined conditions[J].Stem cells,2013,31(5):941-952)。
表5ATC培养基成分表
EPSC来源的iNSC在神经干细胞诱导培养基(N-M培养基)中培养到第14天后,accutase消化,低密度传代,使用神经扩增培养基(N-expanding培养基,成分见表6)培养5天即可诱导为MAP2阳性神经元样细胞。
EPSC来源的iNSC诱导分化为星形胶质细胞:将EPSC来源的iNSC在星形胶质细胞诱导培养基(ATC培养基)中进行培养,培养28天后得到星形胶质细胞,期间每隔48h更换一次培养基,达到90%时按照1:2传代。
EPSC来源的iNSC诱导分化为神经元:将EPSC来源的iNSC在神经扩增培养基(N-expanding培养基)中进行培养,培养5天后得到神经元,期间每隔24h更换一次培养基(该方法得到的神经元用于进行与星形胶质细胞共培养实验)。
表6N-expanding培养基
(2)诱导神经干细胞(iNSC)来源的星形胶质细胞和神经元标志物检测
EPSC来源的神经干细胞在向神经元分化7天后,免疫荧光检测神经细胞标志物MAP2。EPSC来源的iNSC向星形胶质细胞诱导分化4周后,免疫荧光检测星形胶质细胞特异性标志物GFAP;EPSC来源的iNSC向星形胶质细胞诱导分化的第6代细胞使用RT-qPCR检测星形胶质细胞标志物S100B、AQP4、NFIB、EAAT1,以及多能干细胞标志物Oct4。
2、实验结果
EPSC来源的神经干细胞在向神经元分化七天后出现大量神经突触,免疫荧光染色显示神经细胞标志物MAP2阳性(见图4)。表明该EPSC来源的神经干细胞具有神经元分化能力。
EPSC来源的iNSC向星形胶质细胞诱导分化4周后进行特异性标志物GFAP染色,结果显示细胞具有GFAP阳性并呈现星形胶质细胞细胞形态(见图5),表明该EPSC来源神经干细胞具有星形胶质细胞分化能力。
EPSC来源的iNSC向星形胶质细胞诱导,6代后进行相关marker的qPCR检测。结果显示星形胶质细胞相关特征蛋白S100B、AQP4、NFIB、EAAT1表达上调,多能干基因Oct4表达下调。细胞具有GFAP阳性并呈现星形胶质细胞细胞形态(见图6),表明该EPSC来源神经干细胞具有星形胶质细胞分化能力。
星形胶质细胞在体内参与对神经突触的重塑,在形态上表现为星形胶质细胞的端脚(end-feet)能够与神经突触结合。将EPSC分化得到的iNSC来源的神经元与星形胶质细胞共培养,结果显示星形胶质细胞的端脚与神经突触的共定位(见图7),表明得到的iNSC具有分化为功能性星形胶质细胞的能力。
对比例本发明使用的神经干细胞诱导培养基(N-M培养基)与现有技术报道的神经干细胞诱导培养基的效果对比
1、实验方法
在其它步骤和方法不变的情况下,将实施例1步骤(2)中的N-M培养基更换为背景技术中引用的文献3中的所使用的CL培养基和文献4中所使用的N-induce培养基(成分分别见表7和表8),以分别作为对照。比较本发明使用的N-M培养基与现有文献中使用的CL培养基和N-induce培养基得到的神经干细胞向星形胶质细胞分化的潜能。
表7CL培养基成分表
表8N-induce培养基成分表
2、实验结果
和现有文献中使用的C-L培养基(C-L)及N-induce培养基(N-in)相比,使用本发明所述的N-M培养基分化得到的iNSC,在星形胶质细胞诱导培养基(ATC培养基)中诱导2周后,星形胶质细胞标志蛋GFAP、AQP4、S100B表达显著提升(见图8),表明使用本发明所述的神经干细胞诱导培养基N-Mmedium分化得到的iNSC具有更强的向星形胶质细胞分化的潜能。
上述实施例的说明只是用于理解本发明的方法及其核心思想。应当指出,对于本领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也将落入本发明权利要求的保护范围内。
- 体外快速高效分化获得人多能干细胞来源的NK细胞的方法及应用
- 一种高效、快捷的诱导性多能干细胞向神经干细胞分化的方法
