EPPT肽-逆磷脂、EPPT肽靶向的紫杉醇逆磷脂脂质体制剂及制备方法和应用
文献发布时间:2024-04-18 19:58:21
技术领域
本发明涉及生物医药技术领域,尤其涉及EPPT肽-逆磷脂、EPPT肽靶向的紫杉醇逆磷脂脂质体制剂及制备方法和应用。
背景技术
乳腺癌具有发展迅速、致死率高的特点,是一种常见的妇科肿瘤。紫杉醇是一种紫杉烷类化合物,具有较强的抗恶性肿瘤的效果,目前已被广泛用于治疗乳腺癌。目前紫杉醇注射液中所用的载体多为聚氧乙烯蓖麻油,易导致过敏反应,影响其药效及安全性。
靶向给药系统是指将药物最大限度地输送至靶器官或者靶细胞,从而减小对非靶器官以及非靶细胞的影响,达到降低全身毒副作用、提高疗效的目的。目前现有技术中靶向给药系统包括物理化学靶向制剂、被动靶向制剂、主动靶向制剂以及双重和多重靶向制剂。
紫杉醇脂质体制剂作为一种被动靶向制剂,是通过卵磷脂包裹紫杉醇,在增加药物溶解性的同时,又可避免因溶媒引起的过敏反应,有利于强化患者机体的耐受力,进一步提高治疗效果以及患者用药后的生活质量。然而用卵磷脂制备的紫杉醇脂质体制剂容易被人体内的网状内皮系统(RES)吞噬,并且在肿瘤区域仅依靠高通透性和滞留效应(EPR)实现富集,这种程度的富集对肿瘤的杀伤能力不足。
发明内容
本发明的目的在于提供一种EPPT肽-逆磷脂、EPPT肽靶向的紫杉醇逆磷脂脂质体制剂及制备方法和应用,以本发明提供的EPPT肽-逆磷脂同时复配逆磷脂作为主要辅材制备EPPT肽靶向的紫杉醇逆磷脂脂质体,能够使紫杉醇精准靶向乳腺癌细胞并对乳腺癌细胞造成杀伤,具有优异的乳腺癌治疗效果。
为了实现上述发明目的,本发明提供以下技术方案:
本发明提供了一种EPPT肽-逆磷脂,具有式I所示结构:
本发明提供了上述技术方案所述EPPT肽-逆磷脂的制备方法,包括以下步骤:
将羧基-逆磷脂、EPPT肽、N-羟基琥珀酰亚胺、1-(3-二甲基氨基丙基)-3-乙基碳二亚胺与水混合,进行缩合反应,得到具有式I所示结构的EPPT肽-逆磷脂;
所述羧基-逆磷脂具有式A所示结构:
所述EPPT肽的氨基酸序列如SEQ ID NO.1所示。
优选地,所述缩合反应的温度为15~35℃,时间为20~28h。
本发明提供了一种EPPT肽靶向的紫杉醇逆磷脂脂质体制剂,包括以下制备原料:
紫杉醇0.01~0.5wt%,逆磷脂0.1~2.0wt%,EPPT肽-逆磷脂0.01~0.5wt%,胆固醇0.05~1.0wt%,糖0.1~10wt%,缓冲剂0.1~10wt%,余量为水;所述EPPT肽-逆磷脂为上述技术方案所述EPPT肽-逆磷脂或上述技术方案所述制备方法制备得到的EPPT肽-逆磷脂。
优选地,所述糖包括蔗糖和/或葡萄糖;所述缓冲剂包括组氨酸、甘氨酸、磷酸二氢钾、磷酸氢二钾、磷酸氢二钠、磷酸二氢钠、4-羟乙基哌嗪乙磺酸、三羟甲基氨基甲烷盐酸盐、氢氧化钠、氢氧化钾、盐酸和冰醋酸中的一种或几种。
优选地,所述EPPT肽靶向的紫杉醇逆磷脂脂质体制剂中脂质体的粒径为122.4~248.2nm,粒径分布指数为0.203~0.266。
本发明提供了上述技术方案所述EPPT肽靶向的紫杉醇逆磷脂脂质体制剂的制备方法,包括以下步骤:
将逆磷脂、EPPT肽-逆磷脂、胆固醇、紫杉醇与醇溶剂混合,得到第一混合物;
将糖、缓冲剂与水混合,得到第二混合物;
向所述第一混合物中加入第二混合物,在超声且搅拌条件下进行乳化处理,得到乳液;
去除所述乳液中醇溶剂,得到所述EPPT肽靶向的紫杉醇逆磷脂脂质体制剂。
优选地,所述乳化处理的条件包括:温度为45~55℃,超声功率为100~300W,搅拌速率为500~1000rpm,时间为10~60min。
本发明提供了上述技术方案所述EPPT肽靶向的紫杉醇逆磷脂脂质体制剂或上述技术方案所述制备方法制备得到的EPPT肽靶向的紫杉醇逆磷脂脂质体制剂在制备治疗乳腺癌的药物中的应用。
本发明提供了一种治疗乳腺癌的药物,活性成分为上述技术方案所述EPPT肽靶向的紫杉醇逆磷脂脂质体制剂或上述技术方案所述制备方法制备得到的EPPT肽靶向的紫杉醇逆磷脂脂质体制剂。
本发明提供了一种具有式I所示结构的EPPT肽-逆磷脂,以本发明提供的EPPT肽-逆磷脂同时复配逆磷脂作为主要辅材制备EPPT肽靶向的紫杉醇逆磷脂脂质体,能够使紫杉醇精准靶向乳腺癌细胞并对乳腺癌细胞造成杀伤,具有优异的乳腺癌治疗效果。具体的,uMUC-1(Underg Lycosy Latedmucin-1)抗原是包括乳腺癌在内的多种肿瘤早期特征之一,本发明中EPPT肽可以精准识别乳腺癌细胞上的uMUC-1抗原,故EPPT肽可作为药物主动运输的配体,将紫杉醇精准输送至乳腺癌细胞区域并造成杀伤;逆磷脂能够实现药物的有效保护与高效运输。因此,本发明提供的EPPT肽靶向的紫杉醇逆磷脂脂质体,能够使紫杉醇精准靶向乳腺癌细胞并对乳腺癌细胞造成杀伤,具有优异的乳腺癌治疗效果。
附图说明
图1为实施例2中PPT肽靶向的紫杉醇逆磷脂脂质体制剂中脂质体的粒径分布图;
图2为实施例3中PPT肽靶向的紫杉醇逆磷脂脂质体制剂中脂质体的粒径分布图;
图3为实施例4中PPT肽靶向的紫杉醇逆磷脂脂质体制剂中脂质体的粒径分布图;
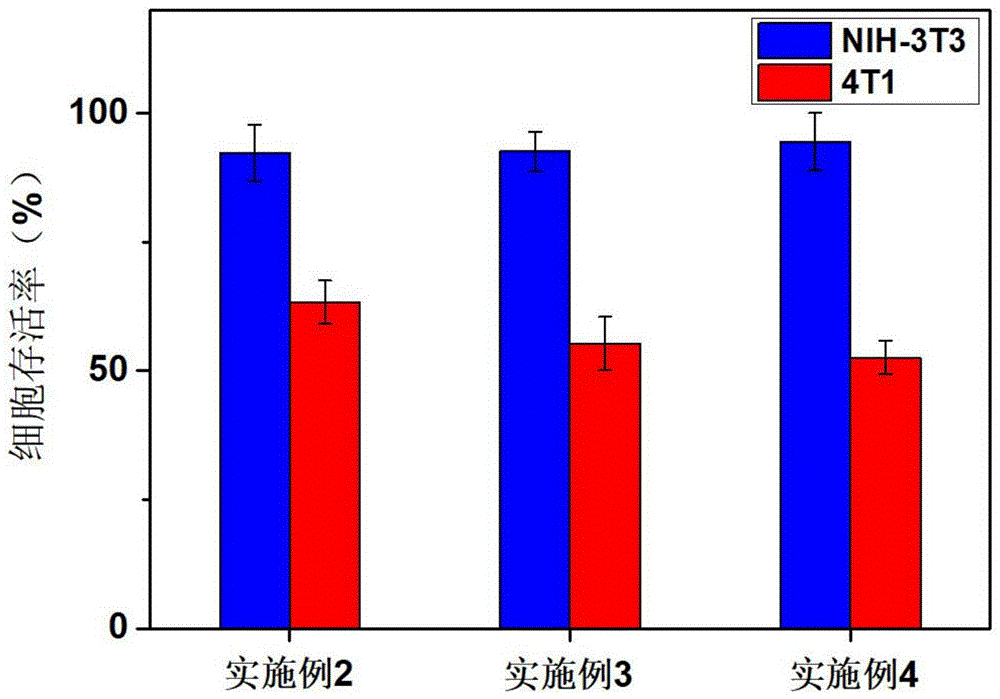
图4为实施例2~4中PPT肽靶向的紫杉醇逆磷脂脂质体制剂的乳腺癌细胞靶向能力评价结果图。
具体实施方式
本发明提供了一种EPPT肽-逆磷脂,具有式I所示结构:
本发明中所述EPPT肽-逆磷脂具体是由羧基-逆磷脂(结构式如式A所示)中的羧基与EPPT肽中酪氨酸(缩写Y)上的氨基共价键合而成;所述EPPT肽的氨基酸序列如SEQ IDNO.1,具体为:YCAREPPTRTFAYWG。
本发明提供了上述技术方案所述EPPT肽-逆磷脂的制备方法,包括以下步骤:
将羧基-逆磷脂、EPPT肽、N-羟基琥珀酰亚胺、1-(3-二甲基氨基丙基)-3-乙基碳二亚胺与水混合,进行缩合反应,得到具有式I所示结构的EPPT肽-逆磷脂;
所述羧基-逆磷脂具有式A所示结构:
所述EPPT肽的氨基酸序列如SEQ ID NO.1所示。
在本发明中,若无特殊说明,所用原料均为本领域技术人员熟知的市售商品或采用本领域技术人员熟知的方法制备得到。
本发明将羧基-逆磷脂(其制备方法在后文详细说明)、EPPT肽、N-羟基琥珀酰亚胺、1-(3-二甲基氨基丙基)-3-乙基碳二亚胺与水混合。在本发明中,所述羧基-逆磷脂与EPPT肽的质量比优选为1.8~2.2:1,更优选为2:1;所述羧基-逆磷脂、N-羟基琥珀酰亚胺、1-(3-二甲基氨基丙基)-3-乙基碳二亚胺与水的用量比优选为0.18~0.22g:0.018~0.022g:0.045~0.055g:8~12mL,更优选为0.2g:0.02g:0.05g:10mL;所述水优选为二次水,其中所述N-羟基琥珀酰亚胺为催化剂,所述1-(3-二甲基氨基丙基)-3-乙基碳二亚胺为除水剂。本发明优选将所述羧基-逆磷脂、EPPT肽、N-羟基琥珀酰亚胺与1-(3-二甲基氨基丙基)-3-乙基碳二亚胺加入到水中,进行缩合反应,在本发明中,所述缩合反应的温度优选为15~35℃,具体可以在室温条件下进行所述缩合反应,本发明所述室温具体为25℃;所述缩合反应的时间优选为20~28h,更优选为24h。所述缩合反应后,本发明优选将所得产物体系进行透析以实现纯化,得到具有式I所示结构的EPPT肽-逆磷脂。
本发明提供了一种EPPT肽靶向的紫杉醇逆磷脂脂质体制剂,包括以下制备原料:
紫杉醇0.01~0.5wt%,逆磷脂0.1~2.0wt%,EPPT肽-逆磷脂0.01~0.5wt%,胆固醇0.05~1.0wt%,糖0.1~10wt%,缓冲剂0.1~10wt%,余量为水;所述EPPT肽-逆磷脂为上述技术方案所述EPPT肽-逆磷脂或上述技术方案所述制备方法制备得到的EPPT肽-逆磷脂。
本发明以紫杉醇为主药,以EPPT肽-逆磷脂与逆磷脂为主要辅材,制备得到的EPPT肽靶向的紫杉醇逆磷脂脂质体可以用于治疗乳腺癌,具有较高的肿瘤靶向能力与较低的毒副作用,可实现对乳腺癌细胞的精准杀伤。下面进行详细说明。
本发明所述EPPT肽靶向的紫杉醇逆磷脂脂质体制剂的制备原料包括紫杉醇0.01~0.5wt%,优选为0.1~0.4wt%,更优选为0.2~0.3wt%。
本发明所述EPPT肽靶向的紫杉醇逆磷脂脂质体制剂的制备原料包括逆磷脂(也称胆碱磷酸脂质,其制备方法在后文详细说明)0.1~2.0wt%,优选为0.5~1.8wt%,更优选为1.0~1.7wt%,进一步优选为1.5~1.6wt%。在本发明中,所述逆磷脂能够实现药物的有效保护与高效运输。
本发明所述EPPT肽靶向的紫杉醇逆磷脂脂质体制剂的制备原料包括EPPT肽-逆磷脂0.01~0.5wt%,优选为0.05~0.4wt%,更优选为0.1~0.3wt%,进一步优选为0.15~0.2wt%。在本发明中,所述EPPT肽-逆磷脂的作用是提供主动靶向功能。
本发明所述EPPT肽靶向的紫杉醇逆磷脂脂质体制剂的制备原料包括胆固醇0.05~1.0wt%,优选为0.1~0.8wt%,更优选为0.3~0.7wt%,进一步优选为0.4~0.5wt%。在本发明中,所述胆固醇能够增加脂质体制剂的稳定性。
本发明所述EPPT肽靶向的紫杉醇逆磷脂脂质体制剂的制备原料包括糖0.1~10wt%,优选为0.5~8wt%,更优选为1~6wt%,进一步优选为2~4wt%。在本发明中,所述糖优选包括蔗糖和/或葡萄糖,更优选为蔗糖。在本发明中,所述糖起到渗透压保护剂的作用。
本发明所述EPPT肽靶向的紫杉醇逆磷脂脂质体制剂的制备原料包括缓冲剂0.1~10wt%,优选为0.5~8wt%,更优选为1~6wt%,进一步优选为2~4wt%。在本发明中,所述缓冲剂优选包括组氨酸、甘氨酸、磷酸二氢钾、磷酸氢二钾、磷酸氢二钠、磷酸二氢钠、4-羟乙基哌嗪乙磺酸、三羟甲基氨基甲烷盐酸盐、氢氧化钠、氢氧化钾、盐酸和冰醋酸中的一种或几种,更优选为磷酸二氢钾与磷酸氢二钠。
本发明所述EPPT肽靶向的紫杉醇逆磷脂脂质体制剂的制备原料包括余量的水,所述水优选为注射用水。
本发明所述EPPT肽靶向的紫杉醇逆磷脂脂质体制剂中脂质体的粒径优选为122.4~248.2nm,粒径分布指数优选为0.203~0.266。本发明所述EPPT肽靶向的紫杉醇逆磷脂脂质体制剂的pH值优选为7.4。
本发明提供了上述技术方案所述EPPT肽靶向的紫杉醇逆磷脂脂质体制剂的制备方法,包括以下步骤:
将逆磷脂、EPPT肽-逆磷脂、胆固醇、紫杉醇与醇溶剂混合,得到第一混合物;
将糖、缓冲剂与水混合,得到第二混合物;
向所述第一混合物中加入第二混合物,在超声且搅拌条件下进行乳化处理,得到乳液;
去除所述乳液中醇溶剂,得到所述EPPT肽靶向的紫杉醇逆磷脂脂质体制剂。
本发明将逆磷脂、EPPT肽-逆磷脂、胆固醇、紫杉醇与醇溶剂混合,得到第一混合物。在本发明中,所述醇溶剂优选为乙醇,所述紫杉醇与醇溶剂的用量比优选为0.7g:1~20mL,更优选为0.7g:2~3mL。本发明对所述混合没有特殊限定,能够将各制备原料混合均匀即可。
本发明将糖、缓冲剂与水混合,得到第二混合物。本发明对所述混合没有特殊限定,能够将各制备原料混合均匀即可。
得到第一混合物与第二混合物后,本发明向所述第一混合物中加入第二混合物,在超声且搅拌条件下进行乳化处理,得到乳液。在本发明中,所述乳化处理的条件包括:温度优选为45~55℃,更优选为50℃;超声功率优选为100~300W,更优选为200~300W;搅拌速率优选为500~1000rpm,更优选为800rpm;时间优选为10~60min,更优选为30min。在本发明的中,所述乳化处理的过程中,体系中形成粒径为100~200nm具有双层结构的囊泡。
得到乳液后,本发明去除所述乳液中醇溶剂,得到所述EPPT肽靶向的紫杉醇逆磷脂脂质体制剂。本发明优选采用旋转减压蒸发的方式去除所述乳液中醇溶剂。去除所述乳液中醇溶剂后,本发明优选将所得悬液进行除菌,之后将所得EPPT肽靶向的紫杉醇逆磷脂脂质体制剂分装于西林瓶中,压盖密封并于4℃条件下储存;本发明所述除菌的方式优选为采用0.22μm微孔滤膜过滤。
本发明提供了上述技术方案所述EPPT肽靶向的紫杉醇逆磷脂脂质体制剂或上述技术方案所述制备方法制备得到的EPPT肽靶向的紫杉醇逆磷脂脂质体制剂在制备治疗乳腺癌的药物中的应用。本发明对所述应用的具体方式没有特殊限定,采用本领域技术人员熟知的方式即可。
本发明提供了一种治疗乳腺癌的药物,活性成分为上述技术方案所述EPPT肽靶向的紫杉醇逆磷脂脂质体制剂或上述技术方案所述制备方法制备得到的EPPT肽靶向的紫杉醇逆磷脂脂质体制剂。本发明对所述治疗乳腺癌的药物中活性成分的含量没有特殊限定。本发明所述治疗乳腺癌的药物中还含有药学上可接受的辅料,本发明对所述药学上可接受的辅料的具体种类没有特殊限定,采用本领域技术人员熟知的药学上可接受的辅料即可。
下面对本发明中所述逆磷脂以及羧基-逆磷脂的制备方法分别进行说明。
在本发明中,所述逆磷脂的制备方法优选包括以下步骤:
将2-氯-2-氧-二氧磷杂环戊烷、乙醇、三乙胺与四氢呋喃混合,进行取代反应,得到化合物E:
将所述化合物E、3-二甲胺基-1,2-丙二醇与乙腈混合,进行开环反应,得到化合物D;
将所述化合物D、十八酸、N,N'-二异丙基碳二亚胺、4-二甲氨基吡啶与二氯甲烷混合,进行酯化反应,得到所述逆磷脂;
所述化合物E具有式E所示结构,所述化合物D具有式D所示结构,所述逆磷脂具有式C所示结构:
本发明将2-氯-2-氧-二氧磷杂环戊烷、乙醇、三乙胺与四氢呋喃混合,进行取代反应,得到化合物E。在本发明中,所述2-氯-2-氧-二氧磷杂环戊烷、乙醇与三乙胺的摩尔比优选为0.5:0.48~0.52:0.48~0.52,更优选为0.5:0.5:0.51;所述乙醇优选为无水乙醇。在本发明中,所述四氢呋喃优选为无水四氢呋喃,本发明对所述四氢呋喃的用量没有特殊限定,其作为溶剂,保证反应顺利进行即可。本发明优选将三乙胺、乙醇与四氢呋喃混合,在氮气保护条件下向所得混合物中滴加2-氯-2-氧-二氧磷杂环戊烷,进行取代反应。在本发明中,所述取代反应的温度优选为-2~2℃,更优选为在冰水浴(0℃)条件下进行所述取代反应;所述取代反应的时间优选为1.5~2.5h,更优选为2h,所述取代反应的时间以2-氯-2-氧-二氧磷杂环戊烷滴加完毕开始计;所述取代反应优选在氮气保护条件下进行。所述取代反应后,本发明优选将所得产物体系过滤,除去滤液中四氢呋喃,得到化合物E。
得到化合物E后,本发明将所述化合物E、3-二甲胺基-1,2-丙二醇与乙腈混合,进行开环反应,得到化合物D。在本发明中,所述化合物E与3-二甲胺基-1,2-丙二醇的摩尔比优选为1:1.0~1.5,更优选为1:1.2。在本发明中,所述乙腈优选为无水乙腈;本发明对所述乙腈的用量没有特殊限定,其作为溶剂,保证反应顺利进行即可。本发明对所述化合物E、3-二甲胺基-1,2-丙二醇与乙腈混合的方式没有特殊限定,保证各组分充分混合即可。在本发明中,所述开环反应的温度优选为65~75℃,更优选为70℃;时间优选为40~55h,更优选为48h。所述开环反应后,本发明优选将所得产物体系在四氢呋喃中沉淀,所得沉淀物为化合物D。
得到化合物D后,本发明将所述化合物D、十八酸、N,N'-二异丙基碳二亚胺、4-二甲氨基吡啶与二氯甲烷混合,进行酯化反应,得到所述逆磷脂。在本发明中,所述化合物D、十八酸、N,N'-二异丙基碳二亚胺与4-二甲氨基吡啶的摩尔比优选为0.10:0.20~0.25:0.20~0.25:0.04~0.06,更优选为0.10:0.22:0.22:0.05。本发明对所述二氯甲烷的用量没有特殊限定,其作为溶剂,保证反应顺利进行即可。本发明优选将所述化合物D与十八酸加入到二氯甲烷中,充分搅拌均匀后加入N,N'-二异丙基碳二亚胺和4-二甲氨基吡啶,进行酯化反应。在本发明中,所述酯化反应的温度优选为15~35℃,具体可以在室温条件下进行所述酯化反应;所述酯化反应的时间优选为20~28h,更优选为24h。所述酯化反应后,本发明优选将所得产物体系过滤,将滤液浓缩后进行重结晶提纯,得到所述逆磷脂。
在本发明中,所述羧基-逆磷脂的制备方法优选包括以下步骤:
将羟基-逆磷脂、戊二酸酐、4-二甲氨基吡啶与二氯甲烷混合,进行羧基化反应,得到羧基-逆磷脂;所述羟基-逆磷脂具有式B所示结构:
本发明优选参照逆磷脂的制备方法制备所述羟基-逆磷脂,不同之处在于将制备所述化合物E时所用乙醇替换为乙二醇。在本发明中,所述羟基-逆磷脂、戊二酸酐、4-二甲氨基吡啶与二氯甲烷的用量比优选为10g:1.3~1.7g:0.08~0.12g:180~220mL,更优选为10g:1.5g:0.1g:200mL;其中所述4-二甲氨基吡啶为催化剂。本发明优选将所述羟基-逆磷脂、戊二酸酐与4-二甲氨基吡啶加入到二氯甲烷中,进行羧基化反应。在本发明中,所述羧基化反应的温度优选为15~35℃,具体可以在室温条件下进行所述羧基化反应;所述羧基化反应的时间优选为10~15h,更优选为12h。所述羧基化反应后,本发明优选将所得产物体系在四氢呋喃中沉出,将所得沉淀物用四氢呋喃洗涤以将多余的戊二酸酐与催化剂除去,得到所述羧基-逆磷脂。
下面将结合本发明中的实施例,对本发明中的技术方案进行清楚、完整地描述。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
制备例1
制备逆磷脂,步骤如下:
(1)将三乙胺(51g,0.51mol)与无水乙醇(22g,0.5mol)加入到装有300mL无水四氢呋喃的支口烧瓶中,在氮气保护条件下从恒压滴液漏斗中滴加2-氯-2-氧-二氧磷杂环戊烷(71g,0.5mol),滴加完毕保持冰水浴反应2h;反应结束后,将所得产物体系过滤,除去滤液中四氢呋喃,得到化合物E;
(2)将化合物E(4.56g,30mmol)与3-二甲胺基-1,2-丙二醇(4.28g,36mmol)加入到装有50mL无水乙腈的烧瓶中,加热到70℃反应48h;反应结束后,将所得产物体系在四氢呋喃中沉淀三次,得到化合物D;
(3)将十八酸(62g,0.22mol)与化合物D(27g,0.1mol)加入到300mL二氯甲烷中,充分搅拌均匀后加入N,N'-二异丙基碳二亚胺(DIC,27.8g,0.22mol)和4-二甲氨基吡啶(DMAP,6.1g,0.05mol),室温条件下充分搅拌反应24h;反应结束后,将所得产物体系过滤,将滤液浓缩后进行重结晶提纯三次,得到逆磷脂。
制备例2
将制备例1的步骤(1)中无水乙醇替换为乙二醇,其它操作与制备例1相同,最终得到羟基-逆磷脂。
实施例1
(1)将羟基-逆磷脂10g、戊二酸酐1.5g与催化剂4-二甲氨基吡啶(DMAP)0.1g加入到二氯甲烷200mL中,室温反应12h;反应结束后,将所得产物体系在四氢呋喃中沉出,将所得沉淀物用四氢呋喃洗涤三次以将多余的戊二酸酐与催化剂除去,得到羧基-逆磷脂;
(2)将羧基-逆磷脂0.2g、EPPT肽(氨基酸序列如SEQ ID NO.1所示)0.1g、催化剂N-羟基琥珀酰亚胺(NHS)0.02g与除水剂1-(3-二甲基氨基丙基)-3-乙基碳二亚胺(EDC)0.05g加入到10mL二次水中,室温反应24h;反应结束后,将所得产物体系进行透析以将催化剂除去,得到EPPT肽-逆磷脂。
实施例2
(1)依次将逆磷脂5g、EPPT肽-逆磷脂0.5g、胆固醇1.5g与紫杉醇0.7g溶于乙醇3mL中,并搅拌混合均匀,得到第一混合物;将PBS溶液(溶剂为注射用水)300mL与蔗糖混合,得到第二混合物,所述第二混合物中蔗糖的浓度为2wt%;
(2)向所述第一混合物加入所述第二混合物,在超声功率为300W且搅拌速率为800rpm条件下加热至50℃并保温进行乳化处理0.5h,得到乳剂,然后采用旋转减压蒸发的方式去除乙醇,得到悬液;
(3)将所述悬液用0.22μm微孔滤膜过滤除菌,得到EPPT肽靶向的紫杉醇逆磷脂脂质体制剂(pH值为7.4),分装于西林瓶中,压盖密封并于4℃条件下储存。
图1为实施例2制备的PPT肽靶向的紫杉醇逆磷脂脂质体制剂中脂质体的粒径分布图,结果显示,所述PPT肽靶向的紫杉醇逆磷脂脂质体制剂中脂质体的粒径为248.2nm,PDI=0.203。
实施例3
按照实施例2的方法制备PPT肽靶向的紫杉醇逆磷脂脂质体制剂,不同之处仅在于本实施例中EPPT肽-逆磷脂的用量为0.7g。
图2为实施例3制备的PPT肽靶向的紫杉醇逆磷脂脂质体制剂中脂质体的粒径分布图,结果显示,所述PPT肽靶向的紫杉醇逆磷脂脂质体制剂中脂质体的粒径为184.7nm,PDI=0.266。
实施例4
按照实施例2的方法制备PPT肽靶向的紫杉醇逆磷脂脂质体制剂,不同之处仅在于本实施例中EPPT肽-逆磷脂的用量为0.9g。
图3为实施例4制备的PPT肽靶向的紫杉醇逆磷脂脂质体制剂中脂质体的粒径分布图,结果显示,所述PPT肽靶向的紫杉醇逆磷脂脂质体制剂中脂质体的粒径为122.4nm,PDI=0.213。
对比例1
按照实施例4的方法制备紫杉醇脂质体制剂,不同之处在于省略掉EPPT肽-逆磷脂,且将逆磷脂替换为卵磷脂。
测试例1
EPPT肽靶向的紫杉醇逆磷脂脂质体制剂的细胞靶向效果评价方法如下:
将小鼠成纤维细胞(NIH-3T3细胞系)以及小鼠乳腺癌细胞(4T1细胞系)在96孔板中以1×10
细胞存活率(%)=(样品荧光强度/对照荧光强度)×100%。
图4为实施例2~4中EPPT肽靶向的紫杉醇逆磷脂脂质体制剂的乳腺癌细胞靶向能力评价结果图,由图4可知,实施例2~4中EPPT肽靶向的紫杉醇逆磷脂脂质体制剂均展现了较高的靶向能力,其中采用实施例4中EPPT肽靶向的紫杉醇逆磷脂脂质体制剂的NIH-3T3细胞存活率为94.5%,4T1细胞存活率为52.6%,杀伤性差异最大,靶向效果最优。
测试例2
EPPT肽靶向的紫杉醇逆磷脂脂质体制剂与不含EPPT肽的紫杉醇脂质体制剂的肿瘤靶向效果对比:
将小鼠乳腺癌细胞(4T1细胞系)在96孔板中以1×10
细胞存活率(%)=(样品荧光强度/对照荧光强度)×100%。
结果显示,采用实施例4中EPPT肽靶向的紫杉醇逆磷脂脂质体制剂的乳腺癌细胞存活率为46.5%,而采用对比例1中紫杉醇脂质体制剂的乳腺癌细胞存活率为63.3%。这说明本发明中EPPT肽-逆磷脂以及逆磷脂的加入使得脂质体制剂的靶向治疗效果得到了显著的提升,相比于不含EPPT肽-逆磷脂且用卵磷脂制备的紫杉醇脂质体制剂,具有更高的肿瘤靶向能力与更低的毒副作用,可实现对乳腺癌细胞的精准杀伤。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- EPPT多肽-聚乙二醇-磷脂复合膜材料、其制备方法及主动靶向脂质体递药系统和应用
- EPPT多肽‑聚乙二醇‑磷脂复合膜材料、其制备方法及主动靶向脂质体递药系统和应用
