基于CT增强影像的儿童肝母细胞瘤手术方式预测方法及系统
文献发布时间:2024-04-18 20:01:23
技术领域
本发明涉及儿童肝脏肿瘤测量技术领域,尤其涉及一种基于CT增强影像的儿童肝母细胞瘤手术方式预测方法、儿童肝母细胞瘤手术方式预测系统、计算机设备及计算机可读存储介质。
背景技术
肝脏体积是间接反映肝脏储备功能的一项重要指标,是客观评价病肝对手术的承受能力,以及选择恰当术式的重要因素之一。肝切除是目前治疗肝母细胞瘤首选的和最有效的手术方案,残肝比是影响手术成功与否的重要因素。计算残肝体积是临床医生选择手术方案、评价术后肝功能等的有效指标。根据《残肝体积简化计算方法及其临床意义》文中所述,计算残肝体积,首先要在术前CT增强影像上手工绘出每层肝脏的拟切除区(肿瘤及邻近正常肝组织),再应用医学图像分析软件测出每个层面的全肝面积、拟切除面积和残肝面积。手工绘制CT每层的ROI是一个主观且耗时巨大的工作,极易带来误差。
目前,残肝比的计算方法包括:
(1)标准残肝体积比:手工绘出CT上每个图层肝脏的拟切除区(肿瘤及邻近正常肝组织);拟切除区内遇较大门静脉属支无法保留时,则将该支供应的肝段一并归拟切除区。应用医学图像分析软件测出每个层面的全肝面积、拟切除面积和残肝面积,最后计算出全肝体积、拟切除体积、肿瘤体积,全肝体积和拟切除体积的差值为残肝体积,全肝体积和肿瘤体积的差值为功能肝体积,残肝体积占功能肝体积的百分数为残肝体积比;
(2)简化残肝体积比:将第一肝门层面、第二肝门层面、肝脏最大面积层面和胆囊窝层面(取胆囊最大面积的层面)作为4个典型代表层面,各典型层面中拟切除面积之和为拟切除体积,4个典型层面面积之和即为全肝体积,全肝体积和拟切除体积的差值为残肝体积,各典型层面中肿瘤面积之和为肿瘤体积,全肝体积和肿瘤体积的差值为功能肝体积。
目前的肝和肝肿瘤分割模型几乎没有应用到儿童数据上,因此儿童患者残肝比的计算只能依靠医生手动勾画,这种方式计算的残肝比,不仅耗时,极易带来误差,尤其影像表现为大肿瘤的情况下,肿瘤挤压正常肝脏和肝血管,医生无法正确识别肝段,导致计算的残肝比与真实残肝比误差极大。
目前针对相关技术中存在的无法正确识别肝段、难以计算残肝比等问题,尚未提出有效的解决方案。
发明内容
本发明的目的是针对现有技术中的不足,提供一种基于CT增强影像的儿童肝母细胞瘤手术方式预测方法、儿童肝母细胞瘤手术方式预测系统、计算机设备及计算机可读存储介质,以解决相关技术中存在的无法正确识别肝段、难以计算残肝比等问题。
为实现上述目的,本发明采取的技术方案是:
第一方面,本发明提供一种基于CT增强影像的儿童肝母细胞瘤手术方式预测方法,包括:
获取CT增强影像,其中,所述CT增强影像包括动脉期影像、门静脉期影像;
对所述CT增强影像进行分割处理,以获得肝脏图像,其中,所述肝脏图像包括肝脏区域,所述肝脏区域包括肝肿瘤区域、瘤周区域、正常肝脏区域;
对所述肝脏图像进行特征提取,以获得图像特征,其中,所述图像特征包括组学特征、深度特征、临床特征;
根据所述图像特征进行决策,以获得决策结果,其中,所述决策结果包括化疗、切除。
在其中的一些实施例中,对所述CT增强影像进行分割处理以获得肝脏图像包括:
对所述CT增强影像进行预处理,以获得标准图像;
将所述标准图像输入至肝脏分割模型,以获得肝脏图像。
在其中的一些实施例中,对所述CT增强影像进行预处理包括:
对所述CT增强影像进行重采样,以获得预设分辨率的初始图像;
对所述初始图像的图像像素值进行归一化,以获得标准图像。
在其中的一些实施例中,构建肝脏分割模型包括:
获取训练图像;
对所述训练图像依次进行重采样、归一化、随机采样,以获得训练图像块;
将所述训练图像块输入至深度学习网络模型进行训练,以获得肝脏分割模型。
在其中的一些实施例中,对所述肝脏图像进行特征提取以获得图像特征包括:
对所述肝脏图像进行提取,以获得肝肿瘤区域,其中,所述肝脏图像包括肝脏区域;
对所述肝肿瘤区域进行膨胀,以获得肿瘤膨胀区域;
对所述肝肿瘤区域与所述肿瘤膨胀区域进行差集计算,以获得瘤周区域;
对所述肝脏区域、所述肝肿瘤区域、所述瘤周区域进行差集计算,以获得正常肝脏区域;
分别对所述肝肿瘤区域、所述瘤周区域、所述正常肝脏区域进行特征提取,以分别获得初始图像特征,其中,所述初始图像特征包括组学特征、深度特征、临床特征;
对所述初始图像特征进行第一特征降维,以获得降维图像特征。
在其中的一些实施例中于,根据所述图像特征进行决策以获得决策结果包括:
对所述图像特征进行融合,以获得第一多序列多区域特征;
对所述多序列多区域特征进行第二特征降维,以获得第二多序列多区域特征;
基于所述第二多序列多区域特征,进行决策,以获得决策结果,其中,所述决策结果包括化疗、切除。
第二方面,提供一种基于CT增强影像的儿童肝母细胞瘤手术方式预测系统,包括:
图像获取单元,用于获取CT增强影像,其中,所述CT增强影像包括动脉期影像、门静脉期影像;
图像分割单元,用于对所述CT增强影像进行分割处理,以获得肝脏图像,其中,所述肝脏图像包括肝脏区域,所述肝脏区域包括肝肿瘤区域、瘤周区域、正常肝脏区域;
特征提取单元,用于对所述肝脏图像进行特征提取,以获得图像特征,其中,所述图像特征包括组学特征、深度特征、临床特征;
决策单元,用于根据所述图像特征进行决策,以获得决策结果,其中,所述决策结果包括化疗、切除。
在其中的一些实施例中,所述特征提取单元包括:
区域提取模块,用于对所述肝脏图像进行提取,以获得肝肿瘤区域,其中,所述肝脏图像包括肝脏区域;
膨胀模块,用于对所述肝肿瘤区域进行膨胀,以获得肿瘤膨胀区域;
第一差集计算模块,用于对所述肝肿瘤区域与所述肿瘤膨胀区域进行差集计算,以获得瘤周区域;
第二差集计算模块,对所述肝脏区域、所述肝肿瘤区域、所述瘤周区域进行差集计算,以获得正常肝脏区域;
特征提取模块,用于分别对所述肝肿瘤区域、所述瘤周区域、所述正常肝脏区域进行特征提取,以分别获得初始图像特征,其中,所述初始图像特征包括组学特征、深度特征、临床特征;
第一降维模块,用于对所述初始图像特征进行第一特征降维,以获得降维图像特征。
在其中的一些实施例中,所述决策单元包括:
融合模块,用于对所述图像特征进行融合,以获得第一多序列多区域特征;
第二降维模块,用于对所述多序列多区域特征进行第二特征降维,以获得第二多序列多区域特征;
决策模块,用于基于所述第二多序列多区域特征,进行决策,以获得决策结果,其中,所述决策结果包括化疗、切除。
第三方面,本发明提供一种计算机设备,包括存储器、处理器以及存储在所述存储器上并可在所述处理器上运行的计算机程序,所述处理器执行所述计算机程序时实现如第一方面所述的儿童肝母细胞瘤手术方式预测方法。
第四方面,本发明提供一种计算机可读存储介质,其上存储有计算机程序,该程序被处理器执行时实现如第一方面所述的儿童肝母细胞瘤手术方式预测方法。
本发明采用以上技术方案,与现有技术相比,具有如下技术效果:
本发明的一种基于CT增强影像的儿童肝母细胞瘤手术方式预测方法、、儿童肝母细胞瘤手术方式预测系统、计算机设备及计算机可读存储介质,通过对CT增强影像依次进行分割处理、特征提取,可以获得辅助决策的肝脏的图像特征,进而自动预测儿童肝母细胞瘤手术方式,有助于辅助指导医生制定合理的手术方案。
附图说明
图1是根据本发明实施例的儿童肝母细胞瘤手术方式预测方法的流程图(一);
图2是根据本发明实施例的儿童肝母细胞瘤手术方式预测方法的流程图(二);
图3是根据本发明实施例的儿童肝母细胞瘤手术方式预测方法的流程图(三);
图4是根据本发明实施例的儿童肝母细胞瘤手术方式预测方法的流程图(四);
图5是根据本发明实施例的儿童肝母细胞瘤手术方式预测方法的流程图(五);
图6是根据本发明实施例的儿童肝母细胞瘤手术方式预测方法的流程图(六);
图7是根据本发明实施例的儿童肝母细胞瘤手术方式预测系统的框架图;
图8是根据本发明实施例的特征提取单元的框架图;
图9是根据本发明实施例的决策单元的框架图;
图10是根据本发明实施例的一个具体实施方式的示意流程图;
图11是根据本发明实施例的肝脏自动分隔的流程图;
图12是根据本发明实施例的肝脏分割模型的示意图;
图13是根据本发明实施例的一个具体实施方式的具体流程图;
图14是根据本发明实施例的模型构建流程图。
其中的附图标记为:700、儿童肝母细胞瘤手术方式预测系统;710、图像获取单元;720、图像分割单元;730、特征提取单元;731、区域提取模块;732、膨胀模块;733、第一差集计算模块;734、第二差集计算模块;735、特征提取模块;736、第一降维模块;740、决策单元;741、融合模块;742、第二降维模块;743、决策模块;750、模型训练单元。
具体实施方式
为了使本申请的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本申请进行描述和说明。应当理解,此处所描述的具体实施例仅用以解释本申请,并不用于限定本申请。基于本申请提供的实施例,本领域普通技术人员在没有作出创造性劳动的前提下所获得的所有其他实施例,都属于本申请保护的范围。
显而易见地,下面描述中的附图仅仅是本申请的一些示例或实施例,对于本领域的普通技术人员而言,在不付出创造性劳动的前提下,还可以根据这些附图将本申请应用于其他类似情景。此外,还可以理解的是,虽然这种开发过程中所作出的努力可能是复杂并且冗长的,然而对于与本申请公开的内容相关的本领域的普通技术人员而言,在本申请揭露的技术内容的基础上进行的一些设计,制造或者生产等变更只是常规的技术手段,不应当理解为本申请公开的内容不充分。
在本申请中提及“实施例”意味着,结合实施例描述的特定特征、结构或特性可以包含在本申请的至少一个实施例中。在说明书中的各个位置出现该短语并不一定均是指相同的实施例,也不是与其它实施例互斥的独立的或备选的实施例。本领域普通技术人员显式地和隐式地理解的是,本申请所描述的实施例在不冲突的情况下,可以与其它实施例相结合。
除非另作定义,本申请所涉及的技术术语或者科学术语应当为本申请所属技术领域内具有一般技能的人士所理解的通常意义。本申请所涉及的“一”、“一个”、“一种”、“该”等类似词语并不表示数量限制,可表示单数或复数。本申请所涉及的术语“包括”、“包含”、“具有”以及它们任何变形,意图在于覆盖不排他的包含;例如包含了一系列步骤或单元(单元)的过程、方法、系统、产品或设备没有限定于已列出的步骤或单元,而是可以还包括没有列出的步骤或单元,或可以还包括对于这些过程、方法、产品或设备固有的其它步骤或单元。本申请所涉及的“连接”、“相连”、“耦接”等类似的词语并非限定于物理的或者机械的连接,而是可以包括电气的连接,不管是直接的还是间接的。本申请所涉及的“多个”是指两个或两个以上。“和/或”描述关联对象的关联关系,表示可以存在三种关系,例如,“A和/或B”可以表示:单独存在A,同时存在A和B,单独存在B这三种情况。字符“/”一般表示前后关联对象是一种“或”的关系。本申请所涉及的术语“第一”、“第二”、“第三”等仅仅是区别类似的对象,不代表针对对象的特定排序。
实施例1
本实施例涉及本发明的儿童肝母细胞瘤手术方式预测方法。
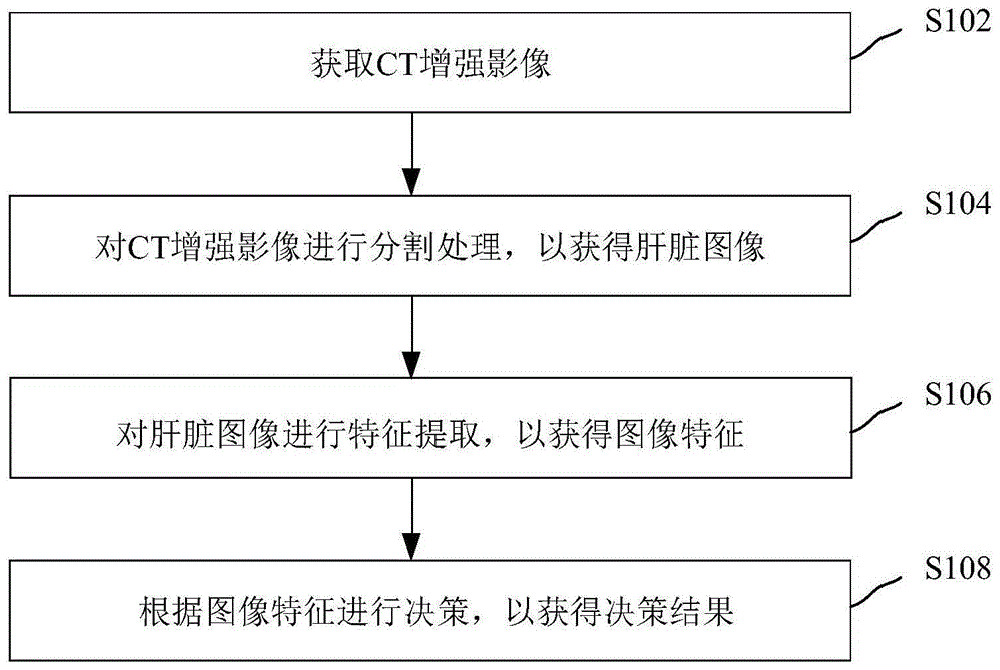
图1是根据本发明实施例的儿童肝母细胞瘤手术方式预测方法的流程图(一)。如图1所示,一种基于CT增强影像的儿童肝母细胞瘤手术方式预测方法,包括:
步骤S102、获取CT增强影像,其中,CT增强影像包括动脉期影像、门静脉期影像;
步骤S104、对CT增强影像进行分割处理,以获得肝脏图像,其中,肝脏图像包括肝脏区域,肝脏区域包括肝肿瘤区域、瘤周区域、正常肝脏区域;
步骤S106、对肝脏图像进行特征提取,以获得图像特征,其中,图像特征包括组学特征、深度特征、临床特征;
步骤S108、根据图像特征进行决策,以获得决策结果,其中,决策结果包括化疗、切除。
在步骤S102中,获取的CT增强影像的数量为若干个。一般地,至少获取一张动脉期影像和至少一张门静脉期影像。
优选地,获取若干张动脉期影像和若干张门静脉期影像。
在步骤S104中,采用肝脏分割模型对CT增强影像进行分割处理。
一般地,肝脏分割模型采用深度学习算法进行训练。在本发明中,深度学习算法采用U-Net框架。
在步骤S104中,分别对动脉期影像、门静脉期影像进行分割处理,以获得第一肝脏图像和第二肝脏图像,其中,第一肝脏图像对应于动脉期影像,第二肝脏图像对应于门静脉期影像。
其中,第一肝脏图像包括第一肝脏区域,第一肝脏区域包括第一肝肿瘤区域、第一瘤周区域、第一正常肝脏区域;第二肝脏图像包括第二肝脏区域,第二肝脏区域包括第二肝肿瘤区域、第二瘤周区域、第二正常肝脏区域。
在步骤S106中,图像特征包括肝肿瘤区域的肝肿瘤图像特征、瘤周区域的瘤周图像特征、正常肝脏区域的正常肝脏图像特征。
在步骤S106中,分别对第一肝脏图像、第二肝脏图像进行特征提取,,以获得第一图像特征和第二图像特征,其中,第一图像特征对应于第一肝脏图像,第二图像特征对应于第二肝脏图像。
其中,第一图像特征包括第一肝肿瘤图像特征、第一瘤周图像特征、第一正常肝脏图像特征,第二图像特征包括第二肝肿瘤图像特征、第二瘤周图像特征、第二正常肝脏图像特征。
在步骤S108中,决策包括筛选处理、融合处理。
在其中的一些实施例中,步骤S108包括:
步骤S1081、对图像特征进行筛选,以获得图像特征子集;
步骤S1082、对图像特征进行融合,以获得多序列多区域特征;
步骤S1083、对多序列多区域特征进行处理,以获得多序列多区域特征子集;
步骤S1084、基于多序列多区域特征子集进行决策,以获得决策结果。
在步骤S1081中,图像特征子集包括肝肿瘤图像特征子集、瘤周图像特征子集、正常肝脏图像特征子集。
在步骤S1081中,分别对第一图像特征、第二图像特征进行筛选,以分别获得第一图像特征子集、第二图像特征子集,其中,第一图像特征子集对应于第一图像特征,第二图像特征子集对应于第二图像特征。
其中,第一图像特征子集包括第一肝肿瘤图像特征子集、第一瘤周图像特征子集、第一正常肝脏图像特征子集,第二图像特征子集包括第二肝肿瘤图像特征子集、第二瘤周图像特征子集、第二正常肝脏图像特征子集。
在步骤S1082中,将第一图像特征子集和第二图像特征子集进行融合,,以获得多序列多区域特征。
其中,融合是指合并,即将第一图像特征子集和第二图像特征子集合并得到融合特征集,该融合特征集就是多序列多区域特征集。
其中,多序列是指第一图像、第二图像等不同模态数据,多区域包括肝肿瘤、瘤周、正常肝脏多个ROI上分别提取的特征。
在步骤S1083中,处理包括降维处理、筛选处理,用于去除线性冗余特征。
在步骤S108中,手术方式还包括其他方式,包括但不限于肿瘤活检、肿瘤切除。
通过上述步骤,通过对CT增强影像依次进行分割处理、特征提取,可以获得辅助决策的肝脏的图像特征,进而自动预测儿童肝母细胞瘤手术方式,有助于辅助指导医生制定合理的手术方案。
图2是根据本发明实施例的儿童肝母细胞瘤手术方式预测方法的流程图(二)。如图2所示,步骤S104包括:
步骤S202、对CT增强影像进行预处理,以获得标准图像;
步骤S204、将标准图像输入至肝脏分割模型,以获得肝脏图像。
在步骤S202中,标准图像是指预设分辨率、预设像素值的图像。
在步骤S202中,对CT增强影像进行预处理的目的是,将不同来源的CT增强影像进行标准化,从而提高后续血管分割的精度、效率,便于按照统一标准进行分析。
通过上述步骤,对于不同参数的CT增强影像进行预处理,以获得统一参数的标准图像,便于后续图像分割、形态学分析。
图3是根据本发明实施例的儿童肝母细胞瘤手术方式预测方法的流程图(三)。如图3所示,步骤S202包括:
步骤S302、对CT增强影像进行重采样,以获得预设分辨率的初始图像;
步骤S304、对初始图像的图像像素值进行归一化,以获得标准图像。
在步骤S302中,将CT增强影像的分辨率重采样到[0.48,0.48,1.25]mm的物理空间。
在步骤S304中,使用Z-SCORE进行归一化。
通过上述步骤,对于不同参数的CT增强影像进行预处理,以获得统一参数的标准图像,便于后续图像分割、形态学分析。
图4是根据本发明实施例的儿童肝母细胞瘤手术方式预测方法的流程图(四)。如图4所示,构建肝脏分割模型包括:
步骤S402、获取训练图像;
步骤S404、对训练图像依次进行重采样、归一化、随机采样,以获得训练图像块;
步骤S406、将训练图像块输入至深度学习网络模型进行训练,以获得肝脏分割模型。
在步骤S402中,训练图像属于训练数据集,训练数据集中包括预设数量的训练图像。
在步骤S402中,训练图像为有肺动脉mask、降主动脉mask的图像。
在步骤S404中,对训练图像进行重采样包括:
根据训练数据集的所有训练图像的分辨率分布情况,将训练图像的分辨率重采样到[0.48,0.48,1.25]mm的物理空间。
在步骤S404中,对训练图像进行归一化包括:
统计训练数据集的所有的mask的像素的第一Hu值范围;
截出[0.05,99.5]百分比范围的第二Hu值范围;
基于第二Hu值范围,使用Z-SCORE进行归一化。
在步骤S404中,对训练图像进行随机采样包括:
从训练图像随机截取大小为[160,192,56]的训练图像块。
在步骤S404中,进行随机采样的目的是获取更多的训练样本,从而进行数据增强。
在步骤S406中,深度学习网络模型采用U-Net框架。U-Net框架采用了编码器-解码器级联的形式,通过连续下采样模块学习图像的全局特征,利用上采样模块将学习到的语义特征解码到输入图像空间得到分割结果,利用跳接模块将底层的位置信息与深层的语义信息相融合,得到更为准确的分割结果。U-Net框架学习图像特征,实现自动分割肺动脉及降主动脉的目标。
此外,深度学习网络模型还可以采用V-Net框架。
此外,还可以将将训练图像块输入至机器学习模型、大语言模型等进行训练。
通过上述步骤,采用深度学习网络模型进行训练,可以获得更为精确的肝脏分割模型。
图5是根据本发明实施例的儿童肝母细胞瘤手术方式预测方法的流程图(五)。如图5所示,步骤S106包括:
步骤S502、对肝脏图像进行提取,以获得肝肿瘤区域,其中,肝脏图像包括肝脏区域;
步骤S504、对肝肿瘤区域进行膨胀,以获得肿瘤膨胀区域;
步骤S506、对肝肿瘤区域与肿瘤膨胀区域进行差集计算,以获得瘤周区域;
步骤S508、对肝脏区域、肝肿瘤区域、瘤周区域进行差集计算,以获得正常肝脏区域;
步骤S510、分别对肝肿瘤区域、瘤周区域、正常肝脏区域进行特征提取,以分别获得初始图像特征,其中,初始图像特征包括组学特征、深度特征、临床特征;
步骤S512、对初始图像特征进行第一特征降维,以获得降维图像特征。
在步骤S502中,分别对第一肝脏图像、第二肝脏图像进行提取,以获得第一肝肿瘤区域和第二肝肿瘤区域,其中,第一肝肿瘤区域对应于第一肝脏图像,第二肝肿瘤区域对应于第二肝脏图像。
在步骤S504中,分别对第一肝肿瘤区域、第二肝肿瘤区域进行膨胀,以获得第一肿瘤膨胀区域和第二肿瘤膨胀区域,其中,第一肿瘤膨胀区域对应于第一肝肿瘤区域,第二肿瘤膨胀区域对应于第二肝肿瘤区域。
在步骤S504中,膨胀方法如下:
基于肿瘤ROI的二值图像,使用结构元素对二值图像进行膨胀,结构元素包括但不限于方形、矩形、圆形或者根据实际情况定制的形状元素,其中,结构元素的大小和形状确定了膨胀的程度。
在步骤S506中,分别对第一肝肿瘤区域与第一肿瘤膨胀区域、第二肝肿瘤区域与第二肿瘤膨胀区域进行差集计算,以获得第一瘤周区域和第二瘤周区域,其中,第一瘤周区域对应于第一肝肿瘤区域,第二瘤周区域对应于第二肝肿瘤区域。
在步骤S508中,对第一肝脏区域、第一肝肿瘤区域、第一瘤周区域进行差集计算,以获得第一正常肝脏区域;以及对第二肝脏区域、第二肝肿瘤区域、第二瘤周区域进行差集计算,以获得第二正常肝脏区域;其中,第一正常肝脏区域对应于第一肝肿瘤区域,第二正常肝脏区域对应于第二肝肿瘤区域。
在步骤S510中,初始图像特征包括肝肿瘤初始图像特征、瘤周初始图像特征、正常肝脏初始图像特征。
在步骤S510中,分别对第一肝肿瘤区域/第二肝肿瘤区域、第一瘤周区域/第二瘤周区域、第一正常肝脏区域/第二正常肝脏区域进行特征提取,以分别获得第一肝肿瘤初始图像特征/第二肝肿瘤初始图像特征、第一瘤周初始图像特征/第二瘤周初始图像特征、第一正常肝脏初始图像特征/第二正常肝脏初始图像特征,其中,第一肝肿瘤初始图像特征对应于第一肝肿瘤区域,第一瘤周初始图像特征对应于第一瘤周区域,第一正常肝脏初始图像特征对应于第一正常肝脏区域,第二肝肿瘤初始图像特征对应于第二肝肿瘤区域,第二瘤周初始图像特征对应于第二瘤周区域,第二正常肝脏初始图像特征对应于第二正常肝脏区域。
在步骤S513中,降维图像特征包括肝肿瘤降维图像特征、瘤周降维图像特征、正常肝脏降维图像特征。
在步骤S512中,分别对第一肝肿瘤初始图像特征/第二肝肿瘤初始图像特征、第一瘤周初始图像特征/第二瘤周初始图像特征、第一正常肝脏初始图像特征/第二正常肝脏初始图像特征进行第一特征降维,以获得第一肝肿瘤降维图像特征/第二肝肿瘤降维图像特征、、第一瘤周降维图像特征/第二瘤周降维图像特征、第一正常肝脏降维图像特征/第二正常肝脏降维图像特征,其中,第一肝肿瘤降维图像特征对应于第一肝肿瘤初始图像特征,第一瘤周降维图像特征对应于第一瘤周初始图像特征,第一正常肝脏降维图像特征对应于第一正常肝脏初始图像特征,第二肝肿瘤降维图像特征对应于第二肝肿瘤初始图像特征,第二瘤周降维图像特征对应于第二瘤周初始图像特征,第二正常肝脏降维图像特征对应于第二正常肝脏初始图像特征。
在步骤S512中,采用LASSO(The Least Absolute Shrinkage and SelectionOperator)算法进行第一特征降维。
通过上述步骤,可以获得与手术方式最相关的图像特征。
图6是根据本发明实施例的儿童肝母细胞瘤手术方式预测方法的流程图(六)。如图6所示,步骤S108包括:
步骤S602、对图像特征进行融合,以获得第一多序列多区域特征;
步骤S604、对多序列多区域特征进行第二特征降维,以获得第二多序列多区域特征;
步骤S606、基于第二多序列多区域特征,进行决策,以获得决策结果,,其中,决策结果包括化疗、切除。
在步骤S602中,将肝肿瘤降维图像特征、瘤周降维图像特征、正常肝脏降维图像特征进行融合。更具体地,将第一肝肿瘤降维图像特征、第二肝肿瘤降维图像特征、、第一瘤周降维图像特征、第二瘤周降维图像特征、第一正常肝脏降维图像特征、第二正常肝脏降维图像特征进行融合。
在步骤S604中,采用LASSO(The Least Absolute Shrinkage and SelectionOperator)算法进行第二特征降维。
通过上述步骤,通过对图像特征进行融合处理、降维处理,可以获得辅助决策的肝脏的最优图像特征,进而自动预测儿童肝母细胞瘤手术方式,有助于辅助指导医生制定合理的手术方案。
另外,本申请实施例的儿童肝母细胞瘤手术方式预测方法可以由计算机设备来实现。计算机设备的组件可以包括但不限于处理器以及存储有计算机程序指令的存储器。。
在一些实施例中,处理器可以包括中央处理器(CPU),或者特定集成电路(Application Specific Integrated Circuit,简称为ASIC),或者可以被配置成实施本申请实施例的一个或多个集成电路。
在一些实施例中,存储器可以包括用于数据或指令的大容量存储器。举例来说而非限制,存储器可包括硬盘驱动器(Hard Disk Drive,简称为HDD)、软盘驱动器、固态驱动器(Solid State Drive,简称为SSD)、闪存、光盘、磁光盘、磁带或通用串行总线(UniversalSerial Bus,简称为USB)驱动器或者两个或更多个以上这些的组合。在合适的情况下,存储器可包括可移除或不可移除(或固定)的介质。在合适的情况下,存储器可在数据处理装置的内部或外部。在特定实施例中,存储器是非易失性(Non-Volatile)存储器。在特定实施例中,存储器包括只读存储器(Read-Only Memory,简称为ROM)和随机存取存储器(RandomAccess Memory,简称为RAM)。在合适的情况下,该ROM可以是掩模编程的ROM、可编程ROM(Programmable Read-Only Memory,简称为PROM)、可擦除PROM(Erasable ProgrammableRead-Only Memory,简称为EPROM)、电可擦除PROM(Electrically Erasable ProgrammableRead-Only Memory,简称为EEPROM)、电可改写ROM(Electrically Alterable Read-OnlyMemory,简称为EAROM)或闪存(FLASH)或者两个或更多个以上这些的组合。在合适的情况下,该RAM可以是静态随机存取存储器(Static Random-Access Memory,简称为SRAM)或动态随机存取存储器(Dynamic Random Access Memory,简称为DRAM),其中,DRAM可以是快速页模式动态随机存取存储器(Fast Page Mode Dynamic Random Access Memory,简称为FPMDRAM)、扩展数据输出动态随机存取存储器(Extended Date Out Dynamic RandomAccess Memory,简称为EDODRAM)、同步动态随机存取内存(Synchronous Dynamic Random-Access Memory,简称SDRAM)等。
存储器可以用来存储或者缓存需要处理和/或通信使用的各种数据文件,以及处理器所执行的可能的计算机程序指令。
处理器通过读取并执行存储器中存储的计算机程序指令,以实现上述实施例中的任意一种儿童肝母细胞瘤手术方式预测方法。
在其中一些实施例中,计算机设备还可包括通信接口和总线。其中,处理器、存储器、通信接口通过总线连接并完成相互间的通信。
通信接口用于实现本申请实施例中各单元、装置、单元和/或设备之间的通信。通信接口还可以实现与其他部件例如:外接设备、图像/数据采集设备、数据库、外部存储以及图像/数据处理工作站等之间进行数据通信。
总线包括硬件、软件或两者,将计算机设备的部件彼此耦接在一起。总线包括但不限于以下至少之一:数据总线(Data Bus)、地址总线(Address Bus)、控制总线(ControlBus)、扩展总线(Expansion Bus)、局部总线(Local Bus)。举例来说而非限制,总线可包括图形加速接口(Accelerated Graphics Port,简称为AGP)或其他图形总线、增强工业标准架构(Extended Industry Standard Architecture,简称为EISA)总线、前端总线(FrontSide Bus,简称为FSB)、超传输(Hyper Transport,简称为HT)互连、工业标准架构(Industry Standard Architecture,简称为ISA)总线、无线带宽(InfiniBand)互连、低引脚数(Low Pin Count,简称为LPC)总线、存储器总线、微信道架构(Micro ChannelArchitecture,简称为MCA)总线、外围组件互连(Peripheral Component Interconnect,简称为PCI)总线、PCI-Express(PCI-X)总线、串行高级技术附件(Serial AdvancedTechnology Attachment,简称为SATA)总线、视频电子标准协会局部(Video ElectronicsStandards Association Local Bus,简称为VLB)总线或其他合适的总线或者两个或更多个以上这些的组合。在合适的情况下,总线可包括一个或多个总线。尽管本申请实施例描述和示出了特定的总线,但本申请考虑任何合适的总线或互连。
该计算机设备可以执行本申请实施例中的儿童肝母细胞瘤手术方式预测方法。
另外,结合上述实施例中的儿童肝母细胞瘤手术方式预测方法,本申请实施例可提供一种计算机可读存储介质来实现。该计算机可读存储介质上存储有计算机程序指令;该计算机程序指令被处理器执行时实现上述实施例中的任意一种儿童肝母细胞瘤手术方式预测方法。
实施例2
本实施例涉及本发明的儿童肝母细胞瘤手术方式预测系统。
图7是根据本发明实施例的儿童肝母细胞瘤手术方式预测系统的框架图。如图7所示,一种基于CT增强影像的儿童肝母细胞瘤手术方式预测系统700,包括图像获取单元710、图像分割单元720、特征提取单元730和决策单元740。其中,图像获取单元710用于获取CT增强影像,其中,CT增强影像包括动脉期影像、门静脉期影像;图像分割单元720用于对CT增强影像进行分割处理,以获得肝脏图像,其中,肝脏图像包括肝脏区域,肝脏区域包括肝肿瘤区域、瘤周区域、正常肝脏区域;特征提取单元730用于对肝脏图像进行特征提取,以获得图像特征,其中,图像特征包括组学特征、深度特征、临床特征;决策单元740用于根据图像特征进行决策,以获得决策结果,其中,决策结果包括化疗、切除。
进一步地,图像分割单元720包括第一预处理模块和分割模块。其中,第一预处理模块对CT增强影像进行预处理,以获得标准图像;分割模块用于将标准图像输入至肝脏分割模型,以获得肝脏图像。
进一步地,第一预处理模块包括第一重采样子模块和第一归一化子模块。其中,第一重采样子模块用于对CT增强影像进行重采样,以获得预设分辨率的初始图像;第一归一化子模块用于对初始图像的图像像素值进行归一化,以获得标准图像。
图8是根据本发明实施例的特征提取单元的框架图。如图8所示,特征提取单元730包括区域提取模块731、膨胀模块732、第一差集计算模块733、第二差集计算模块734、特征提取模块735和第一降维模块736。区域提取模块731用于对肝脏图像进行提取,以获得肝肿瘤区域,其中,肝脏图像包括肝脏区域;膨胀模块732用于对肝肿瘤区域进行膨胀,以获得肿瘤膨胀区域;第一差集计算模块733用于对肝肿瘤区域与肿瘤膨胀区域进行差集计算,以获得瘤周区域;第二差集计算模块734对肝脏区域、肝肿瘤区域、瘤周区域进行差集计算,以获得正常肝脏区域;特征提取模块735用于分别对肝肿瘤区域、瘤周区域、正常肝脏区域进行特征提取,以分别获得初始图像特征,其中,初始图像特征包括组学特征、深度特征、临床特征;第一降维模块736用于对初始图像特征进行第一特征降维,以获得降维图像特征。
图9是根据本发明实施例的决策单元的框架图。如图9所示,决策单元740包括融合模块741、第二降维模块742和决策模块743。其中,融合模块741用于对图像特征进行融合,以获得第一多序列多区域特征;第二降维模块742用于对多序列多区域特征进行第二特征降维,以获得第二多序列多区域特征;决策模块743用于基于第二多序列多区域特征,进行决策,以获得决策结果,其中,决策结果包括化疗、切除。
进一步地,儿童肝母细胞瘤手术方式预测系统700还包括模型训练单元750。其中,模型训练单元750用于构建肝脏分割模型。
进一步地,模型训练单元750包括训练数据获取模块、第二预处理模块和训练模块。其中,训练数据获取模块用于获取训练图像;第二预处理模块用于对训练图像依次进行重采样、归一化、随机采样,以获得训练图像块;训练模块用于将训练图像块输入至深度学习网络模型进行训练,以获得肝脏分割模型。
进一步地,第二预处理模块包括第二重采样子模块、第二归一化子模块和随机采样模块。其中,第二重采样子模块用于对训练图像进行重采样,以获得预设分辨率的初始图像;第二归一化子模块用于对初始图像的图像像素值进行归一化,以获得标准图像;随机采样模块用于对标准图像进行随机采样,以获得训练图像块。
本实施例的技术效果同实施例1基本相同,在此不再赘述。
实施例3
本实施例涉及本发明的一个具体实施方式。
如图10所示,儿童肝母细胞瘤患者的手术方式AI预测系统包括肝及肝癌分割模块和手术方式AI预测模块。其流程如下:
输入CT增强影像;
肝及肝癌分割模块对CT增强影像进行分割处理,以获得肝肿瘤区域、、瘤周区域和正常肝脏区域;
手术方式AI预测模块分别对肝肿瘤区域、瘤周区域、正常肝脏区域进行特征提取、融合处理、降维处理,以获得最优图像特征;
手术方式AI预测模块基于最优图像特征进行预测,以生成建议手术方式;
输出建议手术方式。
如图11所示,肝及肝癌分割模块包括分割模型训练子模块和数据测试子模块。其中,模型训练子模块可以得到儿童CT增强影像的肝及肝母细胞瘤分割模型参数及配置参数;数据测试子模块加载肝及肝母细胞瘤分割模型参数及配置参数,对测试数据进推理分割,,得到肝脏区域自动分割结果。
在本发明中,如图12所示,肝脏分割模型包括输入模块、第一下采样模块、第二下采样模块、第三下采样模块、第四下采样模块、第一上采样模块、第二上采样模块、第三上采样模块、第四上采样模块、输出模块和激活函数层。
对于分割模型训练子模块,其包括如下流程:
(一)预处理
(1)重采样(将训练图像重采样为指定分辨率图像):根据训练集数据的分辨率分布,将输入CT增强影像的分辨率重采样到[0.48,0.48,1.25]mm的物理空间;
(2)归一化(对图像像素值进行归一化):统计整个数据集中mask内像素的HU值范围,截出[0.05,99.5]百分比范围的HU值范围,基于该范围,使用z-score方法进行归一化;
(3)随机采样:随机从图像前景中截取大小为[160,192,56]的图像块,,送入深度学习网络进行训练;
(二)深度学习网络
采用U-Net框架,U-Net框架采用了编码器-解码器级联的形式,通过连续下采样模块学习图像的全局特征,利用上采样模块将学习到的语义特征解码到输入图像空间得到分割结果,利用跳接模块将将底层的位置信息与深层的语义信息相融合,得到更为准确的分割结果。该网络框架学习图像特征,实现自动分割肝及肝瘤的目标。
对于数据测试子模块,其包括如下流程:
(一)预处理
(1)重采样(将测试图像重采样为指定分辨率图像):将输入CT增强影像的分辨率重采样到[0.48,0.48,1.25]mm的物理空间;
(2)归一化(对图像像素值进行归一化):使用z-score方法进行归一化;
其中,(1)~(2)同分割模型训练子模块的(一)预处理;
(二)图像分割
加载预先训练好的模型参数对分割网络进行初始化,对测试图像进行预处理后输入到分割模型,进行前向网络计算(主要运算为乘法和加法操作),得到对应的分割结果。
手术方式AI预测模块包括特征提取模块和决策模块。
特征提取模块:基于自动分割模块得到每个期相数据的肝及肝母细胞瘤的分割结果,分别提取肝肿瘤区域,并膨胀肿瘤区域,提取肿瘤膨胀区域与肿瘤区域的差集得到瘤周区域,提取肝脏区域与肿瘤及瘤周区域的差集得到正常肝脏区域;分别基于肿瘤区域、瘤周区域、正常肝脏区域提取高通量的图像特征,包括组学特征、深度特征、临床特征等;基于LASSO(The Least Absolute Shrinkage and Selection Operator)算法,分别对每个区域的特征进行降维,,得到与手术方式最相关的特征子集。
决策模块:将多期相数据上的肿瘤区域、瘤周区域、正常肝脏区域筛选得到的特征子集融合得到多序列多区域特征;基于LASSO算法,进一步做特征降维,剔除线性冗余特征,得到最终的多区域融合最优特征子集;基于最优特征子集,构建预测手术治疗方式的机器学习决策模型。
如图13所示,手术方式AI预测模块的工作流程如下:
输入多期相增强影像、网络分割结果;
提取肝肿瘤区域、瘤周区域、正常肝脏区域;
提取高通量图像特征,其中,高通量图像特征包括组学特征、深度特征、临床特征等;
对高通量图像特征进行高通量特征降维,以获得与手术方式最相关的特征子集;
进行多序列多区域特征融合;
对多序列多区域特征进行特征降维,以获得多区域融合最优特征子集;
将多区域融合最优特征子集输入至手术方式决策模型,以获得建议手术方式;
输出建议手术方式。
对于手术方式AI预测模型,其构建流程如图14所示。具体如下:
基于训练集,构建线性回归、随机森林等多个机器学习模型;
在测试集上进行模型验证,基于模型性能(AUC),从构建的多个机器学习模型中挑选出性能最好,最适合手术方式预测的决策模型;
将得到的最佳人工智能分类模型用于辅助临床决策。
以上所述仅为本发明较佳的实施例,并非因此限制本发明的实施方式及保护范围,对于本领域技术人员而言,应当能够意识到凡运用本发明说明书及图示内容所作出的等同替换和显而易见的变化所得到的方案,均应当包含在本发明的保护范围内。
- 图像转换方法、装置、电子设备及存储介质
- 任务执行方法、装置、电子设备及计算机可读存储介质
- 一种自动分配任务的方法、装置、电子设备以及存储介质
- 任务处理方法、装置、电子设备及计算机可读存储介质
- 任务价格预测方法、装置、电子设备及计算机存储介质
- 任务的转换方法和装置、电子设备及存储介质
- 任务频次转换方法、装置、电子设备、存储介质
