新型壳聚糖包裹的金纳米团簇材料及其制备方法、应用
文献发布时间:2024-04-18 19:53:33
技术领域
本发明属于纳米材料检测AFB1的技术领域,特别涉及一种新型壳聚糖包裹的金纳米团簇材料及其制备方法、应用。
背景技术
黄曲霉毒素属于中药霉菌毒素的检测范围。它是一类结构相似的化合物的总称,并且具有较强的毒性、致癌性、诱变性和致畸性。中药材在种植、收获、加工、贮藏和运输过程中容易被真菌污染,从而产生有毒的黄曲霉毒素。在这个毒素家族中,黄曲霉毒素B1(AFB1)的毒性最大。2020年版《中国药典》规定,橘皮及其煎煮片等25种中药材中黄曲霉毒素B1的含量不能超过5μg/kg。因此,能够敏感、快速、准确地检测黄曲霉毒素B1至关重要。目前,已经开发了多种检测AFB1的分析方法,包括:薄层色谱法、超高效液相色谱法、液相色谱-质谱联用技术、酶联免疫吸附法和荧光免疫分析法等。然而,这些分析方法具有一些局限性,如薄层色谱法的分析灵敏度不足;色谱法和质谱法需要样品预处理,操作成本高;酶联免疫吸附测定法需要复杂的步骤,且易失活,耗时较长。因此,迫切需要一种灵敏度高、成本低、速度快的新方法来检测AFB1。
无标记的电化学发光(ECL)分析法具有快速、简单、低成本的优点,非常适合开发快速、灵敏的AFB1检测方法。感应界面的构建是开发无标记ECL分析新策略的关键,而具有ECL性质的材料是组装感应界面的核心。金纳米簇(AuNCs)由于其独特的光学和电化学特性、多功能的分子状结构和生物相容性,成为一类具有吸引力的ECL发光体。然而,二者结合存在以下的缺点,限制了AuNCs的应用。首先,ECL量子产率比较低,不能满足超灵敏检测的要求;第二,纯化AuNCs需要透析过程,耗时、耗力且成本高;第三,其表面缺乏丰富的结合点来进一步构建;第四,当AuNCs直接修饰在电极表面时,ECL信号不够稳定。为了克服这些问题,人们提出了一些解决方法。例如,通过在GSH保护下的AuNCs上掺入银来提高其ECL发射的方法。或者提出了通过预氧化、电催化效应和聚集诱导发射三种机制来大大提高ECL的效率。但上述方法较为复杂、且成本较高。
因此,提出一种操作方法简单、成本低且能够准确测定中药材中黄曲霉素度B1的方法尤为重要。
发明内容
针对上述问题,第一方面,本发明提出了一种新型壳聚糖包裹的金纳米团簇材料,所述新型壳聚糖包裹的金纳米团簇材料由壳聚糖和所述壳聚糖包覆的AuNCs纳米簇组成。
第二方面,本发明还提出了一种所述的新型壳聚糖包裹的金纳米团簇材料的制备方法,
所述制备方法包括以下步骤:
将谷胱甘肽溶液加入到壳聚糖溶液中,得到混合物溶液;
将氯金酸溶液加入上述混合物溶液中,并加入氢氧化钠调节所述混合物溶液的pH到固定值;
将所述混合物溶液在水浴条件下反应,冷却至室温并离心、洗涤后分散在水中得到新型壳聚糖包裹的金纳米团簇材料。
进一步地,所述谷胱甘肽溶液的浓度为50mM,所述谷胱甘肽和壳聚糖溶液的体积比为0.3:8;
所述氯金酸溶液的浓度为24.28mM,所述氯金酸溶液和所述混合物溶液的体积比为0.41:8.3。
进一步地,所述氢氧化钠溶液用量为500uL,浓度为1mol/L;
所述壳聚糖溶液的浓度为2mg/mL。
进一步地,所述水浴反应的条件为80℃下反应6小时。
第三方面,本发明提出了一种无标记ECL免疫传感器的构建方法,所述构建方法包括以下步骤:
步骤一:对工作电极进行预处理并制备AFB1抗体修饰的cit-GNPs;
步骤二:将所述的新型壳聚糖包裹的金纳米团簇材料滴加到预处理后的工作电极表面;
步骤三:再滴加AFB1抗体修饰的cit-GNPs,4℃条件下反应9h;
步骤四:然后滴加BSA,37℃条件下作用40min;
步骤三和步骤四反应结束后用PBS缓冲液清洗电极三次。
进一步地,所述AFB1抗体修饰的cit-GNPs和所述BSA的体积均为40μL;
所述BSA为溶解在PBS缓冲液中的质量分数为1%的BSA。
第四方面,本发明还提出了一种按照所述构建方法构建的一种无标记ECL免疫传感器。
第五方面,本发明提出了一种AFB1的检测方法,利用所述的无标记ECL免疫传感器检测,具体为:
将40uL浓度呈现梯度的AFB1标准溶液滴加到所述无标记ECL免疫传感器中,37℃下分别反应60min,然后用PBS缓冲液进行清洗,观察所述无标记ECL免疫传感器的发光程度。
进一步地,所述PBS缓冲液为PBS缓冲液为10mM Na
所述的新型壳聚糖包裹的金纳米团簇材料可以在检测AFB1时应用、或者在构建无标记ECL免疫传感器时应用。
进一步地,所述AFB1来源于各类中药材,包括根茎类、果实和种子类、动物类三大类。
本发明的有益效果:
本发明利用多孔材料的空间限域效应来提高ECL效率,这种效应不仅可以在孔内容纳ECL发光体,还可以在电化学过程中促进电子和质量转移,本发明通过一步合成法制备凝胶包裹的金属纳米团簇,只需要简单的离心步骤,即可解决金属纳米团簇在制备过程中的透析问题,进而解决金属纳米团簇制备成本高、且耗时耗力的问题。
本发明利用凝胶来制备新型金属纳米团簇材料,可以增强材料的电化学发光,一是由于凝胶的空间限域作用,可以降低电化学发光反应过程中产生的自由基的扩散速率,包括发光物质和共反应试剂在反应中产生的自由基;二是凝胶可以延长发光物质激发态氧化产物的寿命。
本发明制备的新型金属纳米团簇材料具有良好的生物兼容性、成膜性和丰富的结合位点,易于修饰生物分子,进而用于构建稳定的传感界面。基于此,可以组装无标记电化学发光免疫传感器,实现了中药材中黄曲霉素度B1超高灵敏度(检测限为9.3×10
本发明的其它特征和优点将在随后的说明书中阐述,并且,部分地从说明书中变得显而易见,或者通过实施本发明而了解。本发明的目的和其他优点可通过在说明书、权利要求书以及附图中所指出的结构来实现和获得。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作一简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1示出了本发明实施例2中不同浓度的壳聚糖溶液制备的AuNCs@CS的TEM图;
图2示出了本发明实施例2中不同浓度的壳聚糖溶液制备的AuNCs@CS的ECL发光强度示意图;
图3示出了本发明实施例2中不同体积NaOH下合成的AuNCs@CS的ECL发光强度示意图;
图4示出了本发明实施例5中不同抗原-抗体孵化时间对ECL信号强度的影响结果示意图;
图5示出了本发明实施例2中制备的AuNCs@CS的流变图;
图6示出了本发明实施例2中制备的AuNCs@CS的FT-IR光谱图;
图7示出了本发明实施例1中制备的AuNCs和实施例2中制备的AuNCs@CS的TEM图;
图8示出了本发明实施例1中制备的AuNCs和实施例2中制备的AuNCs@CS的XPS图;
图9示出了本发明实施例1中制备的AuNCs、实施例2中制备的AuNCs@CS以及物理混合得到的AuNCs/CS的ECL发光强度示意图;
图10示出了本发明实施例1中制备的AuNCs、实施例2中制备的AuNCs@CS的ECL光谱图;
图11示出了本发明实施例2中制备的AuNCs@CS在不同气体环境下的IECL-E曲线图;
图12示出了本发明实施例2中制备的AuNCs@CS在0V-2.1V-0V的电压条件下进行循环伏安扫描,在24个稳定循环中获得的ECL信号图;
图13示出了本发明中测定AFB1的ECL免疫传感器的原理图;
图14示出了本发明测试例4中利用构建的AFB1免疫传感器检测不同材料的ECL发光强度图(A)和EIS图(B);
图15示出了本发明实施例5中不同抗原-抗体的孵育时间检测AFB1的校准曲线图。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地说明,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
针对现有技术中检测AFB1时所存在的问题,本发明提出通过简单的一步合成法合成了壳聚糖包覆的金纳米团簇(AuNCs@CS)。通过循环伏安法(CV)探索了AuNCs@CS的ECL特性,与AuNCs相比,AuNCs@CS的ECL发射和稳定性都很好。并提出了AuNCs@CS可能的ECL增强机制。并在此基础上,提出了一种用于定量检测黄曲霉毒素B1的无标记ECL免疫传感器。ECL免疫传感器的组装过程通过ECL和电化学阻抗谱(EIS)进行了表征。研究了测定AFB1的最佳条件。研究了所建传感平台的分析性能。最后,通过检测中药材中的AFB1含量,评估了所提出的免疫传感器对AFB1测定的适用性。
以下结合实施例对上述合成方法、无标记ECL免疫传感器及其组装过程进行详细说明。
实施例中所用的试剂均为分析纯,实验过程中使用的超纯水取自Milli-Q系统,所涉及的化学品、材料以及仪器的详细信息如下:
氯金酸(HAuCl
柠檬酸三钠购自国药集团化学试剂有限公司。
双面聚酰亚胺胶带(DSPT)购自凯珍公司(中国深圳)。
浓度为10mg/mL的壳聚糖(CS)(95%脱乙酰)是通过将壳聚糖溶解在2%的醋酸溶液中并在4000rpm下离心10分钟以去除不溶物而获得的。
牛血清白蛋白(BSA)购自上海阿拉丁试剂公司。
黄曲霉毒素B1抗原和黄曲霉毒素B1抗体购自上海生工生物工程有限公司。
黄曲霉毒素混合标准品购自中国食品和药物管理局。
ECL的检测采用自制的ECL/电化学电池系统,包括:CHI 760E电化学工作站(上海辰华)和RFL-1发光仪(西安瑞迈)。
EIS实验使用CHI 760E电化学工作站(中国辰华)进行。
透射电子显微镜(TEM)图像通过HT7700 Exalens(日立,日本)获得。AuNCs@CS的表面官能团由Vector-22傅里叶变换红外光谱仪(Bruker Instruments,Billerica,MA)使用KBr颗粒进行表征,扫描范围为4000-400cm
X射线光电子能谱(XPS)是在ESCALABMK II电子能谱仪(VG Scientific,UK)上进行的,以Al Kα辐射作为X射线源。
ECL光谱是用ECL光谱获取系统获得的,该系统由CHI 760D电化学工作站(中国辰华)、光谱仪(SpectraPro HRS-300,Teledyne Princeton Instruments,USA)和EMCCD(Newton,Andor Technology,UK)组成。
实施例1AuNCs的制备
AuNCs的制备方法如下:
将谷胱甘肽溶液在25℃下加入到HAuCl
然后将混合溶液转移到样品瓶中,于70℃水浴条件下反应24小时。
反应完成后,将反应液冷却到室温,通过透析膜(分子量截止=1000Da)采用超纯水透析12小时,以去除多余的前体。最后得到AuNCs溶液,避光储存于4℃冰箱中。
其中,谷胱甘肽溶液为50mM,2.4mL;HAuCl
实施例2Au NCs@CS的制备
AuNCs@CS是通过在壳聚糖存在下的AuNCs原位生长得到的。
2.1具体制备步骤如下:
首先,将0.3mL谷胱甘肽(50mM)加入到8mL壳聚糖溶液中。然后将0.41mL的氯金酸(24.28mM)溶液加入上述混合物中。通过滴加1.0M的氢氧化钠溶液将溶液调节到pH 6.0。将溶液转移到水浴中,在80℃下反应6小时。溶液冷却至室温后,将混合物离心并用水洗涤两次。最后分散在水中,避光储存于4℃冰箱中。
2.1.1为了研究壳聚糖对AuNCs@CS的ECL性能的影响,对比合成的两种材料的ECL性质,并对合成时加入的壳聚糖浓度进行了优化。
将10mg/mL壳聚糖溶液进行稀释,分别得到2mg/mL、3mg/mL、4mg/mL三种壳聚糖浓度,稀释后的壳聚糖体积为8mL,按照2.1步骤制备Au NCs@CS,避光储存于4℃冰箱中。
将含有不同浓度的壳聚糖溶液的AuNCs@CS进行TEM(透射电子显微镜)观察和ECL检测。含有不同浓度的壳聚糖溶液的AuNCs@CS的TEM图像如图1所示,其中,图1中A和B表示不同放大率下壳聚糖浓度为2mg/mL的AuNCs@CS的TEM图像,C和D表示不同放大率下壳聚糖浓度为3mg/mL的AuNCs@CS的TEM图像,E和F表示不同放大率下壳聚糖浓度为3mg/mL的AuNCs@CS的TEM图像。从图1可以看出,在壳聚糖的存在下,AuNCs@CS的形态是一个规则的球形,随着壳聚糖用量的增加,AuNCs@CS的形态逐渐变成椭圆形。这一观察表明,壳聚糖的浓度对AuNCs@CS的形态具有影响。其中当壳聚糖浓度为2mg/mL时,材料形貌较为均一且分散性较好。
含有不同浓度的壳聚糖溶液的AuNCs@CS的ECL的检测结果如图2所示,从图2可以看出,图2中横坐标为检测电压,纵坐标为ECL强度。从图2可以看出,其中CS为2mg/mL时,AuNCs@CS的ECL发射最强。故2mg/mL为合成AuNCs@CS的最佳壳聚糖浓度。
2.1.2pH值的优化
分别考察了在添加NaOH的体积分别为300μL、400μL、500μL、600μL时的ECL发射强度。当NaOH(1M)的体积超过600μL(pH>6)时,溶液出现了白色的絮状沉淀物。可能是过碱的环境影响了壳聚糖与GSH复合物的形成。
其不同pH检测结果如图3所示,当加入的NaOH体积为500μL时,ECL发射最强,该体积被选为最佳合成条件。
按照2.1.1和2.1.2中筛选出来的最佳壳聚糖浓度和最佳pH值制备Au NCs@CS。
实施例3柠檬酸钠金(cit-GNPs)和AFB1抗体结合的cit-GNPs的制备
将91mL超纯水加入5mL氯金酸(6mM)溶液中。当溶液沸腾时,加入4mL柠檬酸钠(w/w,1%)溶液并继续反应2小时,然后自然冷却到室温,得到cit-GNPs;
在6000r/min离心10分钟以去除cit-GNPs大颗粒后,用0.1M NaOH溶液将GNPs溶液调节到pH 8.0;
制备AFB1抗体修饰的cit-GNPs(Ab-GNPs):将25μL浓度为0.5mg/mL AFB1抗体与上述GNPs溶液混合过夜。得到Ab-GNPs溶液(抗体修饰的柠檬酸钠金溶液)。
通过静电作用以及疏水作用和弱共价作用进行修饰。在Ab-GNPs溶液中加入250μL5%(w/w)BSA溶液,然后静置反应5分钟。将Ab-GNPs以12500r/min的速度离心40分钟(Centrifuge 5430R,Eppendorf Centrifuge,Germany),去除上清液,将沉淀物分散在含有1%(w/w)BSA的PBS缓冲液(0.01mol/L,pH 7.4)中。将得到的Ab-GNPs保存在4℃。
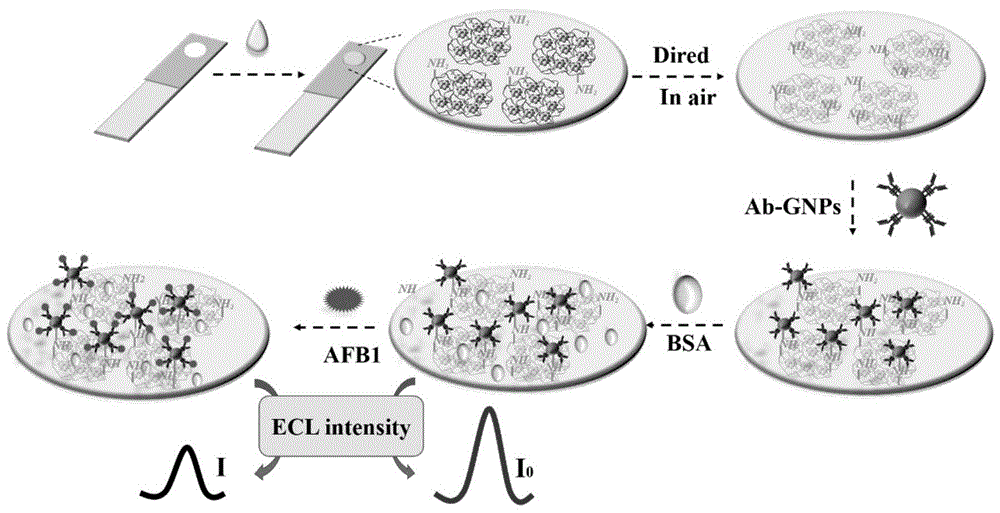
实施例4无标记ECL免疫传感器,用于检测AFB1。
工作电极为FTO导电玻璃,并按照参考文献(Shu等人,2015a)中的描述进行了预处理。FTO电极的导电区域用DSPT打了一个直径为6毫米的圆孔,作为后续组装的储存器。
组装步骤如下:
首先,将20uL的AuNCs@CS滴加到FTO电极的表面并自然干燥。然后滴加40μLAFB1抗体修饰的cit-GNPs,4℃条件下反应9h之后,为了避免AFB1的非特异性结合,再滴加40μL溶解在PBS中的质量分数为1%的BSA来封闭非特异性位点,37℃条件下作用40min,上面的每一步组装在反应结束后都需要用PBS缓冲液清洗电极三次。最终BSA/Ab-GNPs/AuNCs@CS/FTO AFB1免疫传感器制作成功,可用于检测AFB1的含量。
实施例5AFB1检测
(1)利用实施例4构建的AFB1免疫传感器对AFB1将进行检测,检测方法如下:
将40uL浓度呈现梯度的AFB1标准溶液滴加到AFB1免疫传感器中,在37℃下分别反应60min(即抗原-抗体的孵育时间),然后用PBS缓冲液进行清洗。
由于AFB1溶于PBS缓冲液,所以用40uL PBS缓冲液作为空白实验。在没有AFB1和有AFB1的情况下,ECL反应信号的差值(ΔI)被用于AFB1的定量检测。
其中,PBS缓冲液为10mM Na
具体的,对AFB1免疫传感器的抗原-抗体的孵育时间进行优化,图4显示了不同时间滴加抗原孵育后AFB1免疫传感器的发光程度的信号。如图4所示,随着反应时间的增加,传感器的ECL发射强度不断下降,60min后逐渐稳定,表明抗体和抗原完全反应。因此,选用60min作为本实施例中抗原孵育的最佳反应时间。
测试例1AuNCs@CS表征
(1)对实施例2中制备的Au NCs@CS的流变学特性进行测试。
以贮能模量G’(反应材料的弹性)、损耗模量G"(反应材料的粘性)为指标进行考察,其结果如图5所示,图中横坐标为角频率,纵坐标为贮能模量G’/损耗模量G",从中可以看出,G’值高于G"值,证明Au NCs@CS凝胶态的成功形成。
(2)采用FT-IR光谱对实施例2中制备的Au NCs@CS的结构进行研究,其光谱图如图6所示,从中可以看出:
特征吸收峰主要是:在CS光谱中,位于3412cm
测试例2AuNCs和AuNCs@CS的形貌表征
(1)采用TEM对实施例1中制备的AuNCs和实施例2中制备的AuNCs@CS进行观察,其结果如图7所示,图中A为AuNCs的TEM的形貌图,B和C分别为不同放大率下的AuNCs@CS的形貌图,从中可以看出,AuNCs在水中分散良好,形态接近于球形,平均尺寸约为2纳米。但是在壳聚糖的存在下,AuNCs@CS的形态变成一个规则的球形,平均尺寸约为200nm,材料间间距约为500nm。
(2)通过X射线光电子能谱(XPS)分析金元素的还原状态。图8中A显示了AuNCs和AuNCs@CS的总XPS光谱。
与AuNCs的总光谱比较,AuNCs@CS材料依然存在Au 4f峰,这个峰应该是来自AuNCs。4f7/2轨道的结合能83.7eV和84.3eV分别归属于Au(0)和Au(1)。
图8中B和C分别展示了AuNCs和AuNCs@CS的XPS光谱,从图中可以看出,Au(0)/Au(1)的比例在AuNCs和AuNCs@CS中分别是0.92和1.07。据文献报道,由于壳聚糖对金离子具有还原作用(Carbohydrate Polymers 134(2015)680–686.)。因此,AuNCs@CS材料中Au(0)的含量高于AuNCs的。
测试例3
将实施例1中制备的AuNCs和实施例2中制备的AuNCs@CS滴在FTO电极的表面上,用循环伏安法研究其特性。
如图9示出了AuNCs@CS、AuNCs/CS和AuNCs的IECL-E曲线,初始扫描方向为负。在负电位扫描中观察到一个电位为-1.8V的ECL峰,AuNCs@C S、AuNCs两者的ECL光谱显示在大约700nm处发射(图10所示),图10为A uNCs和AuNCs@CS的ECL光谱,表明AuNCs和AuNCs@CS的ECL发射都与A uNCs有关。
在相同的条件下,通过循环伏安法研究了AuNCs@CS的ECL特性,以探索AuNCs@CS中CS的ECL效应。如图9所示,可以观察到AuNCs@CS的ECL强度是最强的,通过简单的物理方法混合得到的AuNCs/CS材料的ECL强度其次,AuNCs的强度最弱。表明CS可以增强ECL的发射。一方面,CS作为一种天然的聚合物可能遵循类似的机制,通过减少金簇表面产生的自由基的扩散,延长CS凝胶中激发态氧化产物AuNCs*的激发态寿命来增强ECL发射。另一方面,材料ECL强度会随着Au(0)含量的增加逐渐变强(DOI:10.1021/acsami.7b02446),根据上述XPS的结果,AuNCs@CS材料中Au(0)的含量是高于AuNCs的。因此,AuNCs@CS材料的ECL进一步强于通过简单的物理混合法得到的AuNCs/CS材料。
另外,为了探究材料的发光机理,本发明研究了空气、氧气和氮气环境对AuNCs@CS的ECL发射的影响。
其结果如图11所示,图中各曲线分别展示了AuNCs@CS在不同气体环境下使用初始负扫描的I
可能的发光的机制如下:
AuNCs+e→AuNCs
S
AuNCs
AuNCs
O
OOH
如图12所示,在0V--2.1V-0V的电压条件下进行循环伏安扫描,在24个循环中可以获得稳定的ECL信号。因此,AuNCs@CS表现出优异的ECL稳定性能,或许可以用于生物传感的纳米界面。
测试例4对实施例4构建无标记ECL免疫传感器的性能进行分析
(1)测定AFB1的ECL免疫传感器的原理图见图13,具体步骤如下:
将AuNCs@CS组装在处理后的FTO电极表面,并在避光条件下恒温干燥;
cit-GNPs具有良好的生物相容性、大表面积和导电性,因此将AFB1抗体与cit-GNPs结合,形成免疫金纳米粒子;
由于CS表面有大量的氨基,AuNCs@CS修饰的FTO电极可以形成一个富含氨基的薄膜,可以与Ab-GNPs相互作用产生共价Au-N键。因此Ab-GNPs被固定在AuNCs@CS修饰的FTO电极的表面;
最后用BSA封闭组装好的FTO电极上的非特异性结合点,形成BSA/Ab-GNPs/AuNCs@CS修饰的FTO电极,即无标记ECL免疫传感器。
在最佳检测条件下,测定无标记ECL免疫传感器的ECL信号。在AFB1存在的情况下,由于抗体-抗原复合物的形成,ECL信号会大大降低。在没有和存在AFB1的情况下,ECL信号分别记录为I
(2)无标记ECL免疫传感器组装过程的表征
为了确认电化学发光免疫传感器逐层组装步骤的成功构建,使用电化学发光信号图和EIS图对实施例4中组装的FTO电极进行了表征,图14中A为不同材料的ECL发光强度图,B为不同材料的EIS图;a为AuNCs@CS/FTO,b为Ab-GNPs/AuNCs@CS/FTO,c为BSA/Ab-GNPs/AuNCs@CS/FTO,d为AFB1/BSA/Ab-GNPs/AuNCs@CS/FTO。
从图14可以看出,AuNCs@CS/FTO具有电化学发光特性,由于壳聚糖的非导电性,修饰的FTO电极具有更明显的阻抗。当免疫金被修饰在AuNCs@CS/FTO中时,由于抗体是生物大分子,对电子转移有抑制作用,所以电化学发光信号减弱,EIS信号增强。当Ab-GNPs/AuNCs@CS/FTO与BSA滴定以关闭非特异性结合位点时,由于蛋白质对电子转移的抑制作用,电化学发光信号进一步降低,EIS信号进一步增强。同样,当修饰后的电极与靶标AFB1进一步反应时,抗体与靶标特异性结合产生的肽使ECL信号再次降低,而增强的EIS信号表明抗原-抗体结合成功,上述结果表明电化学发光免疫传感器组装成功。
(3)实施例5中提出的AFB1检测方法的性能分析
在实施例5优化的抗原-抗体的孵育时间的条件下(即反应时间为60min),通过测量ΔI值对AFB1浓度的影响,评估所制备的无标记ECL免疫传感器的定量性能。
检测AFB1的校准曲线见图15。免疫传感器在3.16×10
将无标记ECL免疫传感器与其他基于AFB1的检测方法进行比较,结果如表1所示:
表1检测黄曲霉毒素B1的不同方法的比较
从表1可以看出,本发明中构建的传感器平台可以实现更小的线性检测范围,更低的检测限,并且不需要标记技术,这意味着我们能够快速、定量地检测出即使是存在微量的AFB1。
(4)无标记ECL免疫传感器的选择性
为了验证本发明组装的无标记ECL免疫传感器的选择性,通过抗原和抗体的特异性结合实现对目标物的定量检测,因此选择混合标准品进行传感器的特异性实验。已知混合标准品中目标物AFB1的浓度为1.08ug/mL,而干扰物(AFB2,AFG1,AFG2)的总浓度为1.64ug/mL。将混合标准品中的AFB1浓度稀释至线性范围(AFB1=1.08×10
表2混合标准中的黄曲霉毒素B1的定量分析
从表2可以看出,即使在有干扰物存在的情况下,传感器也能对其中的目标物进行定量检测。这证明了该传感器具有良好的选择性和准确性。
(5)中药材中AFB1浓度的测定
通过检测中药材中AFB1的浓度,验证了本发明构建的无标记ECL免疫传感器的实用性。根据《中国药典》对中药材中真菌检测的规定,精确称取0.3g水蛭样品,加入0.06g氯化钠,然后加入1.5mL甲醇(w/w%,70%),高速搅拌2min。以4000rpm转速离心5min,精密称量0.3mL上清液,定容至1mL,混匀,使用相同转速离心10min,去除沉淀,得到储备液。
用0.01M PBS(pH 7.4)将上述处理后的储备液稀释到1000倍。该免疫传感器的结果如表3所示。
表3水蛭中黄曲霉毒素B1的定量分析
从表3可以看出,水蛭中的AFB1含量在3.16×10
尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的精神和范围。
