用于25-羟基维生素D的稳定组合物和替代基质及其应用
文献发布时间:2024-04-18 19:58:21
技术领域
本发明涉及检测试剂技术领域,尤其是涉及一种用于25-羟基维生素D的稳定组合物和替代基质及其应用。
背景技术
25-羟基维生素D主要包括25-羟基维生素D2和25-羟基维生素D3,属于脂溶性维生素,是调节骨代谢的重要维生素,婴幼儿缺乏维生素D会导致佝偻病,成人缺乏会导致骨质疏松症。当机体摄入并蓄积过量的维生素D时,体内维生素D负反馈调节作用失调,会导致高钙血症及一系列不良反应如恶心、呕吐、便秘、胰腺炎、急性肾脏损伤等。监测人体内25-羟基维生素D2和25-羟基维生素D3的含量,有助于评价人体维生素D的状况。
目前25-羟基维生素D的检测方法主要分为免疫法和色谱法,比如酶免免疫吸附法,化学发光免疫测定法,放射免疫法,高效液相色谱法(HPLC法)和液相色谱质谱法(LC-MS/MS)等。对于25-羟基维生素D的检测方法的改进目前主要聚焦于提升检测方法的灵敏度,以及如何降低检测成本,简化操作。但是试剂盒中样品在替代基质中的稳定性同样存在较大问题,25-羟基维生素D样品在替代基质中易发生降解,给生产和使用带来一定的影响。并且无论使用何种方法定量检测,均需要将标准品混合于替代基质中来构建标准曲线,因此替代基质的改进对25-羟基维生素D检测方法的改进也至关重要。并且若能实现样品和替代基质混合保存,避免现用现配也能简化前处理操作,加快检测速度。目前将样品保存在添加了稳定剂的替代基质中的相关研究较少。
有鉴于此,特提出本发明。
发明内容
本发明的第一目的在于提供一种用于25-羟基维生素D的稳定组合物,以缓解现有技术中存在的25-羟基维生素D2和25-羟基维生素D3在试剂中容易降解,不易保存的技术问题。
本发明的第二目的在于提供一种含有上述稳定组合物的用于25-羟基维生素D的替代基质。
本发明的第三目的在于提供上述稳定组合物或上述替代基质在制备用于25-羟基维生素D2和/或25-羟基维生素D3检测的试剂或试剂盒,或在非诊断和治疗目的的检测25-羟基维生素D2和/或25-羟基维生素D3中的应用。
为解决上述技术问题,本发明特采用如下技术方案:
根据本发明的一个方面,提供了一种用于25-羟基维生素D的稳定组合物,包括绿原酸0.05~0.3%wt和抗坏血酸0.1~0.2%wt;所述25-羟基维生素D包括25-羟基维生素D2和/或25-羟基维生素D3。
优选地,该稳定组合物还包括β-环糊精0.05~0.15%wt。
优选地,该稳定组合物包括绿原酸0.15%wt和抗坏血酸0.2%wt;
优选地,该稳定组合物还包括β-环糊精0.125%wt。
根据本发明的另一个方面,还提供了一种一种用于25-羟基维生素D的替代基质,该替代基质包含上述稳定组合物;所述25-羟基维生素D包括25-羟基维生素D2和/或25-羟基维生素D3。
优选地,还包括牛血清白蛋白和缓冲组分。
优选地,所述替代基质包括1~5%wt牛血清白蛋白和PBS。
根据本发明的一个方面,还提供了一种上述稳定组合物,或上述替代基质在制备用于25-羟基维生素D2和/或25-羟基维生素D3检测的试剂或试剂盒,或在非诊断和治疗目的的检测25-羟基维生素D2和/或25-羟基维生素D3中的应用。
根据本发明的一个方面,还提供了一种用于25-羟基维生素D2和/或25-羟基维生素D3检测的试剂或试剂盒,该试剂或试剂盒含有上述稳定组合物;或,含有上述替代基质;
以及,25-羟基维生素D2和/或25-羟基维生素D3。
优选地,所述试剂盒用于高效液相色谱法检测25-羟基维生素D2和/或25-羟基维生素D3,还包括沉淀剂、流动相和复溶液中的一种或几种的组合。
根据本发明的一个方面,还提供了一种非诊断和治疗目的的25-羟基维生素D2和/或25-羟基维生素D3的检测方法,该检测方法包括使用上述替代基质作为校准品的替代基质;
优选地,还包括使用上述替代基质作为质控品的替代基质。
优选地,所述替代基质是血清的替代基质。
与现有技术相比,本发明具有如下有益效果:
本发明提供的用于25-羟基维生素D的稳定组合物包括绿原酸和抗坏血酸,绿原酸含有一定量的R-OH基,可以消除羟基自由基和超氧阴离子等自由基的活性,保护目标物免受氧化作用的损害。抗坏血酸中的烯二醇基能够被氧化成二酮基,具有抗氧化作用。将绿原酸和抗坏血酸配合使用对于25-羟基维生素D的稳定作用优于单一组分的稳定剂,也优于其他组合方式的稳定组合物,加速测试回收率显示绿原酸和抗坏血酸配合使用能够有效降低25-羟基维生素D的降解。当用于25-羟基维生素D的稳定组合物还包括β-环糊精时,由于其分子中心呈疏水性,外表面相对为亲水性的特点,可以吸附25-羟基维生素D形成比较稳定的包合化合物,进一步稳定试剂中的25-羟基维生素D,可以实现25-羟基维生素D的长期保存,在-18℃±8℃储存条件下,对存放13个月内数据进行稳定性趋势检验,趋势不显著。
含有本发明提供的25-羟基维生素D的稳定组合物的替代基质,混合25-羟基维生素D标准品后能够减缓其中25-羟基维生素D的降解。应用本发明提供的稳定组合物或替代基质的试剂、试剂盒或检测方法,校准品和/或质控品中的25-羟基维生素D不易降解,有助于提高检测的准确度和简化前处理操作。
附图说明
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
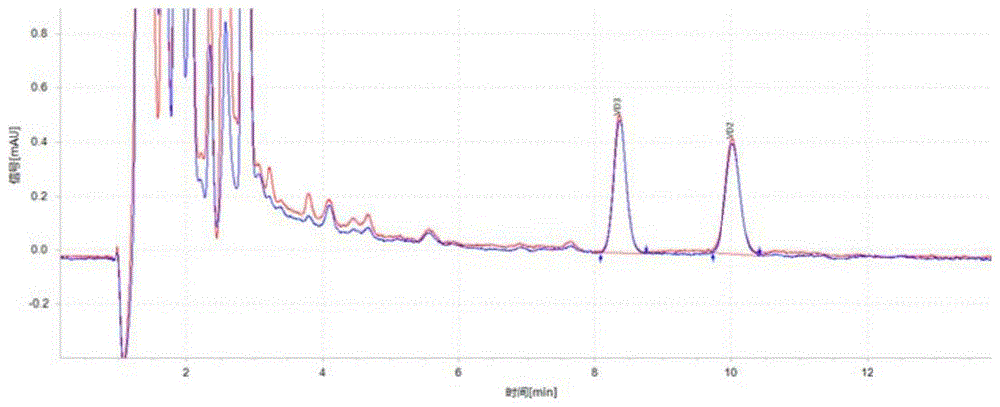
图1为低值质控品第0个月和第13个月的测试谱图;
图2为高值质控品第0个月和第13个月的测试谱图。
具体实施方式
下面将结合实施例对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
根据本发明的一个方面,提供了一种用于25-羟基维生素D的稳定组合物,所述25-羟基维生素D包括25-羟基维生素D2和/或25-羟基维生素D3,本发明提供的稳定组合物能够使25-羟基维生素D2和D3在混合体系中保持稳定,减缓25-羟基维生素D2和D3在混合体系中降解。
本发明提供的稳定组合物包括绿原酸和抗坏血酸。绿原酸含有一定量的R-OH基,能形成具有抗氧化作用的氢自由基,可以消除羟基自由基和超氧阴离子等自由基的活性,从而保护目标物免受氧化作用的损害。抗坏血酸分子中的烯二醇基能够被氧化成二酮基,具有抗氧化作用。
本发明提供的稳定组合物中绿原酸的浓度为0.05~0.3%wt,例如可以为但不限于0.05、0.1、0.15、0.2、0.25或0.3%wt,或其中任意两点之间的浓度范围;抗坏血酸浓度为0.1~0.2%wt,例如可以为但不限于0.1、0.15或0.2%wt,或其中任意两点之间的浓度范围。本发明通过实验发现,将绿原酸和抗坏血酸配合使用,对混合体系中25-羟基维生素D2和D3的稳定效果由于单独使用抗坏血酸,以及优于其他常规的稳定剂,比如EDTA-2Na;同时本发明还发现,将绿原酸和抗坏血酸配合使用缓解25-羟基维生素D2和D3的降解效果优于将抗坏血酸与其他稳定组分配合使用,比如将抗坏血酸和2,6-二叔丁基-4-甲基苯酚配合使用。本发明提供的稳定组合物能够使25-羟基维生素D2和/或25-羟基维生素D3的7天加速测试回收率达到或接近80%,优于其他稳定组分或其他稳定组合物。
在一些优选的实施方式中,上述稳定组合物还包括β-环糊精0.05~0.15%wt,例如可以为但不限于0.05、0.075、0.1、0.125或0.15%wt,或其中任意两点之间的浓度范围。β-环糊精其分子中心呈疏水性,而外表面相对为亲水性的特点,因此β-环糊精分子的简体中心的空穴可以吸附25-羟基维生素D形成比较稳定的包合化合物,起到分子囊的作用以防止25-羟基维生素D因挥发、氧化、光照等因素的作用而发生的散失。继续在绿原酸和抗坏血酸的稳定组合物中添加β-环糊精,能够进一步提高稳定组合物对25-羟基维生素D2和D3的稳定效果,经实验验证,绿原酸、抗坏血酸和β-环糊精配合使用,能够实现25-羟基维生素D2和25-羟基维生素D3在替代基质中长期保存的效果,在-18℃±8℃储存条件下,对存放13个月内数据进行稳定性趋势检验,趋势不显著。
在一些优选的实施方式中,上述稳定组合物包括抗坏血酸0.05~0.3%wt、绿原酸0.05~0.3%wt和β-环糊精0.05~0.15%wt。
本文中稳定组合物中各组分的浓度为使用时的工作浓度,即将25-羟基维生素D2和D3配置为液体试剂后,在含有25-羟基维生素D2和D3的混合体系中的浓度,混合体系中的其他组分本发明不做限定,本领域技术人员可以根据25-羟基维生素D2和D3的使用目的,根据本领域一般知识选择混合体系中的各组分,在一些可选的实施方式中,混合体系是下述任一实施方式中的替代基质。
根据本发明的另一个方面,本发明还提供了一种用于25-羟基维生素D的替代基质,该替代基质包含上述用于25-羟基维生素D的稳定组合物。可以理解的是,所述替代基质还可以包括本领域可接受的,常规的用于替代基质的组分,包括但不限于缓冲组分、盐或其他的功能组分等。
在一些可选的实施方式中,所述替代基质包括缓冲组分和牛血清蛋白,其中缓冲组分优选PBS缓冲液;牛血清蛋白的浓度优选为1~5%wt,例如可以为但不限于1、2、3、4或5%wt,或其中任意两点之间的浓度范围。
在一些可选的实施方式中,由于通常先使用溶剂溶解25-羟基维生素D2和25-羟基维生素D3标准品配制高一级的储备液,因此在使用替代基质配制不同浓度的含有25-羟基维生素D2和25-羟基维生素D3的试剂时,为了将高一级的储备液中的溶剂含量控制在一定比例,替代基质中还含有一定浓度的高一级储备液的溶剂,溶剂的具体浓度本领域技术人员可以根据实际配制时,添加的25-羟基维生素D2和25-羟基维生素D3的储备液进行定量,本发明对此不做限制。
根据本发明的另一个方面,还提供了上述稳定组合物,或上述替代基质在制备用于25-羟基维生素D2和/或25-羟基维生素D3检测的试剂或试剂盒,或在非诊断和治疗目的的检测25-羟基维生素D2和/或25-羟基维生素D3中的应用。本发明提供的用于25-羟基维生素D的稳定组合物至少能够保持配制后的含有25-羟基维生素D2和/或D3的试剂保存一段时间,尤其是当添加了β-环糊精稳定组合物,能够使配制后的含有25-羟基维生素D2和/或D3保持较长的时间,满足样品在替代基质中长期保存,可以实现制备出将25-羟基维生素D2和/或D3按照目标浓度预混在替代基质或其他体系中的试剂盒,在使用时避免了现用现配,实现简化前处理操作,加快检测速度的效果。
根据本发明的另一个方面,还提供了一种用于25-羟基维生素D2和/或25-羟基维生素D3检测的试剂或试剂盒,该试剂或试剂盒含有上述的稳定组合物,或上述的替代基质;以及25-羟基维生素D2和/或25-羟基维生素D3。本发明提供的试剂或试剂盒中各部分可以分别独立包装,或其中的几种预混后包装。可选的实施方式中,所述试剂或试剂盒含有前述的用于25-羟基维生素D的替代基质和以不同浓度预混于其中的25-羟基维生素D2和/或25-羟基维生素D3组成的系列试剂,作为试剂盒中的校准品和/或质控品;可选的实施方式这中,所述试剂或试剂盒含有前述的用于25-羟基维生素D的替代基质和预混于其中的25-羟基维生素D2和/或25-羟基维生素D3,以及独立包装的前述的用于25-羟基维生素D的替代基质作为稀释剂,所述稀释剂用于将预混有25-羟基维生素D2和/或25-羟基维生素D3的试剂配制为不同的工作试剂。
可以理解的是,所述试剂盒中还可选地含有本领域可接受的用于检测25-羟基维生素D的试剂或耗材,包括但不限于流动相、分析物、内标、萃取试剂、沉淀试剂、pH调节剂、复溶液、标记物和固相载体中的至少一种。
可选的实施方式中,所述试剂盒用于采用效液相色谱法检测25-羟基维生素D2和/或25-羟基维生素D3,还包括沉淀剂、流动相和复溶液中的一种或几种的组合。
可选的实施方式中,所述沉淀剂包括沉淀剂A和沉淀剂B,所述沉淀剂为硫酸盐的水溶液,所述沉淀剂B为有机相。可选的实施方式中,所述沉淀剂A为0.2mol/L的硫酸锌水溶液。可选的实施方式中,所述沉淀剂B为等体积混合的甲醇和乙腈。
可选的实施方式中,所述复溶液包括甲醇,异丙醇和异丁醇。可选的实施方式中,所述复溶液中甲醇,异丙醇和异丁醇的用量比本领域技术人员可以根据实际的流动相进行配置。
可选的实施方式中,所述流动相包括水相和有机相,所述水相为水,所述有机相包括甲醇、异丙醇和异丁醇组成。可选的实施方式中,所述水相和所述有机相还分别独立的含有乙酸。可选的实施方式中,复溶液中甲醇、异丙醇和异丁醇的体积比与流动相中的有机相相同。
根据本发明的另一个方面,还提供了一种非诊断和治疗目的的25-羟基维生素D2和/或25-羟基维生素D3的检测方法,该检测方法包括使用前述实施方式中的替代基质作为校准品的替代基质。优选地,还包括使用前述实施方式中的替代基质作为质控品的替代基质。
可选的实施方式中,所述替代基质是血清的替代基质。
可选的实施方式中,所述检测方法包括采用液相色谱法分析经前处理的样本,其中前处理优选采用固相萃取法进行前处理。
可选的实施方式中,固相萃取法包括先试用沉淀剂处理待测样本,然后再经活化的SPE固相萃取办中上样,淋洗后洗脱,氮吹复溶后进行液相色谱检测。
可选的实施方式中,所述检测方法包括:将经过前处理的待测样本使用液相色谱检测,将检测值带入标准曲线中,计算得到样本中25-羟基维生素D2和/或25-羟基维生素D3的含量。
需要说明的是,本发明提供的25-羟基维生素D检测方法是非诊断和治疗目的的,其检测的样本来源例如但不限于小鼠、大鼠、豚鼠、仓鼠、兔、雪貂、猫、狗、山羊、绵羊、奶牛、猪、马、猴或人。非诊断和治疗目的的检测25-羟基维生素D的实例例如可以为但不限于来源于上述哺乳动物的样本为实验动物样本,采用本发明的检测方法以提供实验结果,进一步用于25-羟基维生素D代谢机制研究或者与其相关的药物的研究;并且,知晓待测样本中的25-羟基维生素D的含量,也不意味着其可以直接反应样本的健康状况,因此本发明提供的检测方法是非诊断和治疗目的的。本发明提供的25-羟基维生素D检测方法的关键发明构思在于采用上述替代基质作为校准品的替代基质,在多种定量检测手段中均需要使用校准品构建标准曲线,因此本发明对具体的检测手段不做限制,具体的检测手段例如但不限于液相色谱法、气相色谱法、质谱法、高效液相色谱法和液相色谱串联质谱法等,只要使用以本发明提供的替代基质作为校准品的替代基质,则属于本发明提供的25-羟基维生素D2和/或25-羟基维生素D3的检测方法。
下面通过具体的实施例进一步说明本发明,但是,应当理解为,这些实施例仅仅是用于更详细地说明之用,而不应理解为用于以任何形式限制本发明。
下列实施例和效果例涉及到的标准品及试剂如下:
表1
仪器:
表2
实施例1~9
实施例1~9各提供了一种用于25-羟基维生素D的稳定组合物,包括绿原酸和抗坏血酸,各组分工作浓度如表3所示。
表3
将实施例1~9的稳定组合物按照如下方法分别配制成替代基质:
(1)精密量取22.5mL10×PBS缓冲液,加入到202.5mL超纯水中混匀;
(2)按照表3配方量分别称取抗坏血酸和绿原酸,加入到步骤(1)配制的缓冲液中,超声充分溶解;
(3)称取11.25g牛血清白蛋白加入到步骤(2)配制的溶液中,超声充分溶解;
(4)精密量取25mL甲醇到步骤(3)的溶液中混匀,最终得到250mL带稳定剂的替代基质H0溶液。
将实施例1~9的稳定组合物按照如下方法分别配制成校准品C6:
(1)精密量取18mL10×PBS缓冲液,加入到162mL超纯水中混匀;
(2)按照表3配方量分别称取抗坏血酸和绿原酸,加入到步骤(1)配制的缓冲液中,超声充分溶解;
(3)称取9g牛血清白蛋白加入到步骤(2)配制的溶液中,超声充分溶解;
(4)精密量取20mL SSC-D2/D3到步骤3)的溶液中混匀,最终得到200mL校准品C6。C6中各组分浓度为:D2:100ng/mL;D3:100ng/mL。SSC-D2/D3的配制方法参见实施例15。
实施例10~14
实施例10~14各提供了一种用于25-羟基维生素D的稳定组合物,包括绿原酸和抗坏血酸,各组分工作浓度如表4所示。
表4
按照上述实施例1~9中记载的方法配制得到替代基质H0溶液和校准品C6,除去稳定剂组分外,其余组分浓度同实施例1~9。
对比例1~6
对比例1~6各提供了一种稳定组分,其中对比例1~3的稳定组分为EDTA-2Na,对比例4~6的稳定组分为抗坏血酸,各对比例的稳定剂工作浓度如表5所示。
表5
按照上述实施例1~9中记载的方法配制得到替代基质H0溶液和校准品C6,除去稳定剂组分外,其余组分浓度同实施例1~9。
对比例7~9
对比例7~9各提供了一种稳定组合物,包括抗坏血酸和BHT(2,6-二叔丁基-4-甲基苯酚),各组分工作浓度如表6所示。
表6
按照上述实施例1~9中记载的方法配制得到替代基质H0溶液和校准品C6,除去稳定剂组分外,其余组分浓度同实施例1~9。
实施例15检测方法
(一)试剂配制:
1.25-羟基维生素D储备液配制:
1.1购置的25-羟基维生素D2(BePure,MU-0005-1mg)具有准确的质量,无需称量,直接加入1mL(准确移取)甲醇,超声至25-羟基维生素D2完全溶解,得1.00mg/mL的25-羟基维生素D2储备液(SSC-D2),转移至1.5mL棕色小瓶中,贴标签,-20℃保存。
1.2购置的25-羟基维生素D3(BePure,MU-0010-1mg)具有准确的质量,无需称量,直接加入1mL(准确移取)甲醇,超声至25-羟基维生素D3完全溶解,得1.00mg/mL的25-羟基维生素D3储备液(SSC-D3),转移至1.5mL棕色小瓶中,贴标签,-20℃保存。
最终得到以下储备液:
表7
2.替代基质H0配制:按照上述实施例或对比例的方法配制。
3.校准品及质控品配制:
3.1 25羟基维生素D2/D3浓储液(SSC-D2/D3)配制:
3.1.1精密量取25μLSSC-D2和25μLSSC-D3加入到棕色玻璃容器中。
3.1.2精密量取24.95mL甲醇到步骤2)中混匀,最终得到25mL 25羟基维生素D2/D3浓储液(SSC-D2/D3)。浓储液中各组分浓度为:D2:1000ng/mL;D3:1000ng/mL。
3.2校准品C6配制:按照上述与替代基质H0对应的实施例或对比例的方法配制。
3.3校准品C1~C5及质控品QCL、QCH配制:
校准品C1-C5及质控品QCL、QCH由校准品C6和替代基质H0稀释得到,稀释比例见下表(此处以生产50mL为例)。
表8
表9配制后浓度
(二)样品前处理准备及方法:
1.前处理试剂准备:
1.1沉淀剂A的配制
以配制100mL的量为例,称取5.751g七水硫酸锌(aladdin,Z111853-500g)放入一100mL的容量瓶中,加适量超纯水进行超声至完全溶解,再用超纯水定容至刻度线,混合均匀,配制成0.2mol/L沉淀剂A,贴标签,常温保存。
1.2沉淀剂B的配制
以配制400mL的量为例,用量筒分别准确量取200mL甲醇和200mL乙腈,放入一500mL的溶剂瓶中,超声混合均匀,配制成沉淀剂B,贴标签,常温保存。
1.3 5%甲醇水130mL:用量筒分别量取6.5mL甲醇和123.5mL超纯水倒入合适的容器中混合均匀即可。
1.4 50%甲醇水230mL:用量筒分别量取115mL甲醇和115mL超纯水倒入合适的容器中混合均匀即可。
1.5甲醇150mL:量取150mL HPLC级甲醇即可。
1.6复溶液10mL:用移液器分别量取甲醇9mL、异丙醇0.5mL、异丁醇0.5mL放入合适容器中混合均匀即可。
1.7流动相配制
流动相A液配制:用量筒准确移取500mL水,加入350μL乙酸溶液,混匀超声脱气,待用。
流动相B液配制:用量筒分别准确移取900mL色谱级甲醇、50mL色谱级异丙醇、50mL色谱级异丁醇,加入700μL乙酸溶液,混匀超声脱气,待用。
2.前处理方法:
2.1蛋白沉淀:在蛋白沉淀板各孔依次加入1200μL沉淀剂A和75μL沉淀剂B,再在以上各孔中分别加入300μL校准品、质控品、样本,静置5min,用排枪吹打5次后,采用正压装置(压力约0.02Mpa)将沉淀液过滤至2mL深孔板中。
2.2SPE板活化:在SPE板各孔中加入900μL甲醇,采用正压装置保持2S一滴的流速流至近干,再加入900μL 50%甲醇水,保持2S一滴的流速流至近干,待用,丢弃废液。
2.3上样:在第1步的2mL深孔板中用排枪取1100μL各样本加入已活化好的SPE板中,采用正压装置保持2S一滴的流速,流至近干,丢弃废液。
2.4淋洗:在上一步的SPE板各孔中加入1100μL 5%甲醇水,淋洗,再加入1100μL50%甲醇水,淋洗,以上两步均保持2S一滴的流速,流至近干,丢弃废液。
2.5洗脱:将SPE板放置到1mL96孔U型板上,在SPE板各孔加入400μL甲醇,收集洗脱液至U型板中,自然滴干后,采用正压装置压完残余液体即可。
2.6氮吹/复溶:将1mL96孔U型板放置于氮吹仪,60℃氮气吹干后,用复溶液80μL复溶。
2.7震荡:盖上96孔板垫,置于96孔板混匀仪中,1500rpm充分震荡5min。
2.8检测:将96孔板置于LC中,进行检测。
(三)HPLC分析色谱条件
表10
流动相组分及比例如表11所示:
表11
效果例1
(一)进行7天加速稳定性实验,比较对比例1~6的稳定剂,按照实施例15记载的检测方法检测,测试结果如表12所示。
表12
通过以上7天加速测试可知,单独使用EDTA-2Na和VC作为稳定剂,稳定效果无法达到预期效果。
(二)进行7天加速稳定性实验,比较对比例7~9的稳定组合物,按照实施例15记载的检测方法检测,测试结果如表13所示。
表13
通过以上7天加速测试可知,将抗坏血酸和BHT组合使用无法达到预期效果。
(三)进行7天加速稳定性实验,先比较实施例2、实施例5和实施例8的稳定组合物,按照实施例15记载的检测方法检测,测试结果如表14所示。
表14
通过以上7天加速测试可知,实施例2、实施例5和实施例8的稳定组合物对保持替代基质中25-羟基维生素D的稳定的效果明显优于抗坏血酸和BHT组合。
进一步比较实施例1~9的稳定组合物,按照实施例15记载的检测方法检测,测试结果如表15所示。
表15
从以上测试结果可知,实施例6中0.15%wt绿原酸与0.2%wt抗坏血酸的浓度,对25-羟基维生素D稳定性效果最佳,但7天加速测试回收率超过±110%,为使25-羟基维生素D达到预期13个月的有效期,7天加速测试回收率在±110%以内更佳。因预期13个月有效期,需要控制我们的测试回收率不超过±110%,超过该范围即判定产品已失效,无法达到正常测试时回收率的要求。
(四)比较实施例10~14的稳定组合物,按照实施例15记载的检测方法检测,测试结果如表16所示。
表16
从以上测试结果可知,当绿原酸、抗坏血酸和β-环糊精含量组合使用时,7天加速测试结果更佳,其中以实施例13中0.125%wt含量的β-环糊精、0.15%wt含量的绿原酸、0.2%wt含量的抗坏血酸组合在一起,对25羟基维生素D的稳定性效果最佳。因此后续使用实施例13的替代基质进一步验证对25羟基维生素D的长期保存效果。
效果例2基质效应结果评价
1、实验流程
1)验证方法:300μL血样前处理后测得峰面积A;300μL带基质的标样经前处理后测得峰面积B;150μL血样和150μL带基质的标样混合后经前处理测得峰面积C。
2)可接受标准:基质偏差(%)=(A+B)/2C(%),基质偏差≤±20%。
2、实验结果
表17VD3基质效应结果
表18VD2基质效应结果
3、实验小结
以上测试结果显示,HPLC测试相同血样的25-羟基维生素D2/D3的基质效应均≤±20%,基质效应评价满足方法学要求。
效果例3、血样干扰评价
1实验流程
1.1贮存液的配制
表19贮存液配制
1.2测试样本的配制
按照实验设计的干扰物浓度要求,在基础样本(混合血清)上添加一定量的干扰物贮存液作为测试样本,本实验方案添加量统一为基础样本的5%添加量。每个样本重测5次,取均值。
1.3对照样本的配制
在基础样本(混合血清)中统一添加5%制备贮存液的溶剂作为对照样本,其添加体积与测试样本相同。每个样本重测5次,取均值。
1.4进样列表
按交互顺序分析测试标本和对照标本,即:C1T1C2T2C3T3C4T4C5T5
1.5接受标准
若
2、实验结果
表20VD3干扰结果
表21VD2干扰结果
效果例4稳定性验证
1.验证方法:按照一定时间间隔,在每个时间点随机取在正常储存温度条件下(-18℃±8℃)储存的试剂盒检测,每次取2盒,每盒检测3次。对这些稳定性研究数据进行统计处理,使用公式(1)~公式(4)进行趋势显著性检验。
b1=SLOPE(,)…………………………………………公式(3)
t0.05,n-2=TINV(0.05,n-2)………………………………………………公式(4)
当|b1|<t0.05,n-2时,表示趋势不显著,否则趋势显著。
2.可接受标准:对实时稳定性研究数据进行统计处理,其中包括在正常储存温度条件下(-18℃±8℃)保存13个月试剂盒的数据,对这些数据进行趋势显著性检验,趋势应不显著。
3.结果:
表22
表23
表24
/>
表25
4.结果:质控品显示,趋势均不显著,稳定性合格。低值质控品和高值质控品第0个月和第13个月的测试谱图分别如图1和图2所示。
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
- 25-羟基维生素D的校准品基质、制备方法及应用
- 维生素D3和25-羟基-维生素D3用于治疗骨质疏松症和改善骨矿物质密度的组合用途
