肺腺癌预后的预测方法
文献发布时间:2023-06-19 10:05:17
技术领域
本发明涉及医学诊断领域,具体涉及一种用于肺腺癌预后的预测方法。
背景技术
肺癌是我国乃至全球主要癌种之一。根据2018年最新全球癌症统计数据,肺癌在所有癌种中发病率及致死率均居于首位。肿瘤标志物是指特征性存在于恶性肿瘤细胞,或由恶性肿瘤细胞异常产生的物质,并能反映肿瘤发生、发展,监测肿瘤对治疗反应的一类物质。因此寻找能预测肿瘤发生、发展、评估肿瘤预后的标志物对肿瘤的监测与治疗有重要意义。
当机体某个部位发生肿瘤时,肿瘤细胞代谢异常,使某些酶或同工酶合成增加;或由于肿瘤组织的压迫和浸润,导致某些酶的排泄受阻,使肿瘤患者血清中酶活性异常升高。酶是较早发现并用于临床诊断的一类肿瘤标志物,如患肝癌时γGT升高,患前列腺癌时PAP升高等。
越来越多的研究表明,肿瘤细胞脂肪酸从头合成的增多是癌症发生发展的一个显著特点,并且从头合成的激活与多种类型肿瘤的预后和无病存活期呈负相关,这一表型主要是由于脂生成相关基因在转录、翻译及翻译后修饰、酶活等多水平的上调,以及受这些基因或脂代谢变化而对癌基因的表达产生影响。脂生成的增加主要是为了合成更多细胞膜脂以满足癌细胞快速增殖及其对能量需求的飙升。
目前肺癌诊断与监测的主要手段是胸部CT,然而对预后的评估一直是个难点。
发明内容
本发明的提供了一种用脂类代谢途径中肿瘤标志物评估肿瘤预后的预测方法。
本发明一种肿瘤预后的预测方法,包括检测癌细胞的单酰基甘油脂肪酶(MGLL)水平。
根据本发明的一实施方式,当单酰基甘油脂肪酶水平与参考水平相比升高时,代表患者预后差。
根据本发明的另一实施方式,所述参考水平是来自非癌细胞的水平。
根据本发明的另一实施方式,用于预测肺癌。
根据本发明的另一实施方式,用于预测肺腺癌(LUAD)。
本发明通过检测MGLL表达水平实现肿瘤的预后预测,提供一种新的肿瘤预后预测方法。
附图说明
通过参照附图详细描述其示例实施方式,本发明的上述和其它特征及优点将变得更加明显。
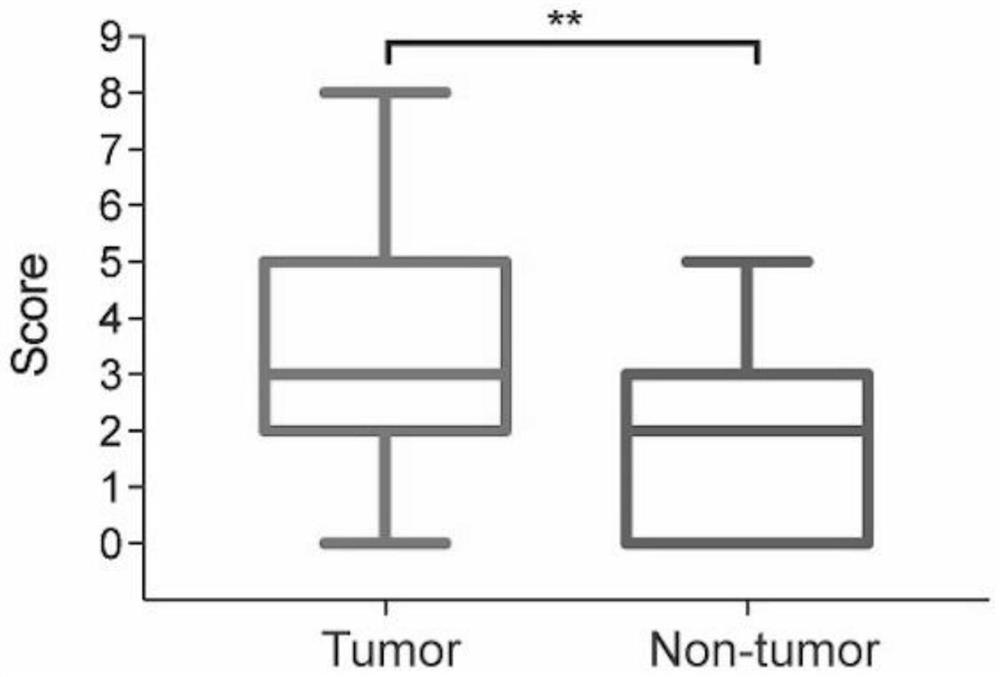
图1A是LUAD和邻近的正常组织中MGLL的免疫组化(IHC)评分(**P<0.01)。
图1B是LUAD和正常组织中MGLL免疫组化染色结果(比例尺=50μm)。
图1C是随机选择的LUAD样品和邻近的正常组织中MGLL表达的蛋白质印迹分析。
图1D是基于MGLL表达的Kaplan-Meier曲线分析,MGLL高表达预示总体生存率低。
图2A是5种LUAD细胞中MGLL表达的蛋白质印迹分析。
图2B是通过qRT-PCR验证LUAD细胞中的MGLL敲降效率。
图2C是通过CCK8测定法测量MGLL敲降和对照A549和H322细胞的增殖能力。
图2D是shMGLL和对照A549和H322细胞中集落形成测定图像。右边的列显示三个独立实验的平均克隆数。
图2E和图2F是皮下注射shMGLL或载体对照A549细胞的裸鼠的切除的异种移植肿瘤的图像。每组的生长曲线和平均肿瘤重量为如图所示。
图2G是流式细胞仪细胞周期分析,表明MGLL敲降会降低S和G2/M期细胞的百分比。
图2H是细胞凋亡分析,表明在A549和H322细胞中MGLL敲降后,凋亡细胞的百分比没有受到显著影响(ns,不显著)。
图2I是检测MGLL基因敲降和对照细胞中细胞周期蛋白Cyclin D1和Cyclin B1的表达以及凋亡相关蛋白BCL-2和BAX的表达的蛋白质印迹分析。*P<0.05,**P<0.01。
图3A和图3B是Transwell实验以测量shMGLL和对照A549和H322细胞的迁移和侵袭活性。
图3C是通过尾静脉注射shMGLL或载体对照A549细胞的小鼠分离的肺组织的图像。
图3D是shMGLL和对照组小鼠肺组织的HE染色图像,箭头示出转移性结节;比例尺=2mm。
图3E是测量MGLL敲降和对照A549和H322细胞中EMT标记的表达的蛋白质印迹分析。*P<0.05,**P<0.01。
图4A和图4B是示出通过RNA-seq分析确定的A549细胞中MGLL敲降后上调和下调的基因的热图和维恩图。
图4C是与上调和下调的基因相关的KEGG通路富集分析。
图4D是测量MGLL敲降和对照A549和H322细胞中MGLL和MMP14的蛋白质水平的蛋白质印迹分析。
图4E是MGLL敲降和对照异种移植肿瘤中MGLL和MMP14染色的IHC图像;比例尺=50μm。
图5A是IHC染色表明相对于相邻的正常组织,MMP14在LUAD中过表达(**P<0.01)。
图5B是LUAD和正常组织中MMP14的IHC染色图像;比例尺=50μm。
图5C是基于MMP14表达的Kaplan-Meier曲线分析,MMP14的高表达预示总体生存率低。
图5D卡方检验证明(P=0.036)MMP14的表达与MGLL的表达相关。
具体实施方式
下面结合具体实施方式对本发明作详细说明。
本发明的目的在于提供一种基于免疫组化(IHC)技术检测标志物MGLL的表达水平,该标志物应用于预测肿瘤患者预后。
本发明涉及的术语“预后”表示提供对癌症可能的进程和结果的预测。它既包括判断疾病的特定后果(如康复,某种症状、体征和并发症等其它异常的出现或消失及死亡),也包括提供时间线索,如预测某段时间内发生某种结局的可能性。预后可包括癌症并发症、转移、扩散的可能性,癌症的可能的结果,恢复的可能性,总存活率和/或总死亡率。
细胞系和细胞培养
H322和A549 LUAD细胞系分别在补充了10%胎牛血清(Corning,Mediatech Inc.)的Dulbecco改良的Eagle培养基(DMEM)和RPMI1640培养基(Corning,Corning,NY,USA)中培养。细胞系在37℃下用5%CO
患者样本
从2006年至2017年诊断为LUAD的156例患者中,福尔马林固定及石蜡包埋的癌组织以及76例配对的的非肿瘤组织均获自中国医学科学院肿瘤医院。从医疗记录中收集了包括年龄,性别和肿瘤结转移(TNM)阶段在内的信息。获得所有患者的知情同意,并且研究方案得到中国医学科学院肿瘤医院研究伦理委员会的批准。
免疫组织化学染色
对组织芯片进行免疫组化染色。简而言之,通过在pH 6.0的抗原修复液中采用微波修复法进行抗原修复。将切片与MGLL(1:200,Proteintech)或MMP14(1:200,Abclonal)抗体在4℃孵育过夜,然后与相应种属的二抗孵育。根据阳性染色细胞的百分比和染色强度对组织进行定量评分。简而言之,将染色强度分级为0(负),1(低),2(中)或3(高),并将染色比例评估为0(负),1(<1%),2(1–10%),3(11–30%),4(31-70%)或(71-100%),对两个评分进行相加。由一名病理学家和两名经验丰富的研究人员对染色结果进行了独立评分。
构建稳转细胞系
合成了两个shRNA,即5'-GGATGGTAGTGTCTGACTTCC-3'和5'-CAACTCCGTCTTCCATGAAAT-3'以抑制MGLL表达。将它们分别插入pLKO.1-puro慢病毒shRNA载体(Generay Biotech Co.,中国上海)中,在HEK293T细胞中产生慢病毒。使用含有2μg/ml嘌呤霉素(Sigma-Aldrich,美国)的培养基筛选细胞7天。
荧光定量PCR(qRT-PCR)
如先前所述(Huang J,Li J,Li Y,Lu Z,Che Y,Mao S,Lei Y,Zang R,Zheng S,Liu C,Wang X,Li N,Sun N and He J.Interferon-inducible lncRNA IRF1-ASrepresses esophageal squamous cell carcinoma by promoting interferonresponse.Cancer Lett 2019;459:86-99.)的方法进行qRT-PCR。用于MGLL的引物:正向,5'-CACAGTGGCCGCTATGAAGA-3';相反,5'-CCACATGCTGCAACACATCC-3'。
免疫印迹
如先前所述(Zhang H,Shao F,Guo W,Gao Y and He J.Knockdown of KLF5promotes cisplatininduced cell apoptosis via regulating DNA damage checkpointproteins in non-small cell lung cancer.Thorac Cancer 2019;10:1069-1077.)的方法进行蛋白质印迹。使用了以下一抗:MGLL(1:200,Abcam,Cambridge,UK),Tubulin(1:5,000,Sigma-Aldrich),CCNB1(1:1,000,Cell Signaling Technology,Danvers,MA,USA),CCND1(1:1,000,Cell Signaling Technology),BCL-2(1:1,000,Cell SignalingTechnology),BAX(1:1000,Cell Signaling Technology),E-钙粘蛋白(1:1,000,CellSignaling Technology),N-钙粘蛋白(1:1,000,Cell Signaling Technology)和MMP14(1:500,ABclonal)。
增殖和集落形成实验
通过细胞计数试剂盒8(CCK-8)测定法(Dojindo,熊本,日本)评估细胞活力。在450nm下测量光密度,并连续监测细胞3天。为了进行集落形成测定,将A549和H322细胞以600个细胞/孔接种在6孔板中,并使其分别生长1周和2周。然后固定菌落并用1%结晶紫染色。
迁移和侵袭实验
为了进行迁移和侵袭分析,将无血清RPMI 1640或DMEM培养基中的A549细胞(5×104)或H322细胞(1×105)分别接种到24孔板的小室中(Corning,8.0-未涂或未涂Matrigel的微孔(BD Biosciences,Franklin Lakes,NJ,美国)。如前所述(Lu Z,Li Y,Che Y,HuangJ,Sun S,Mao S,Lei Y,Li N,Sun N and He J.The TGFbetainduced lncRNA TBILApromotes non-small cell lung cancer progression in vitro and in vivo via cis-regulating HGAL and activating S100A7/JAB1 signaling.Cancer Lett 2018;432:156-168.)的方法进行实验。
细胞周期与细胞凋亡分析
对于细胞周期分析,收获细胞并在4℃下用70%酒精固定过夜,在37℃的RNase中消化30分钟,用碘化丙啶(PI)染色30分钟,并用BD流式细胞仪(Becton)分析。对于细胞凋亡分析,将细胞消化,洗涤,然后用结合缓冲液重悬。然后,将FITC annexin V和PI添加至细胞悬浮液,并在黑暗中孵育10分钟。用BD FACSCanto II流式细胞仪检测细胞凋亡。
RNA测序(RNA-seq)
在A549细胞中敲降MGLL后,RNA-seq用于测量mRNA表达谱。对于这些测定,在Novogene(中国北京)进行了总RNA提取,cDNA文库制备和RNA测序。使用|倍数变化|的临界值,通过Cuffdiff鉴定了差异表达基因(DEG)≥2.0是识别上调和下调mRNA的阈值(补充数据1)。
动物实验
BALB/c-nu小鼠(雌性,4-5周大)用于的异种移植模型。简而言之,将转染了MGLL-shRNA或载体对照的A549细胞注射到BALB/c-nu小鼠的右背侧面(每只动物1.5×10
统计
使用GraphPad Prism 7(GraphPad Software,Inc.,圣地亚哥,加利福尼亚,美国)进行数据分析。卡方检验用于鉴定临床病理特征与MGLL表达之间的关联。生存分析采用Kaplan-Meier方法和秩和检验。使用two-tailed Student's t-tests比较各组之间的数据,结果表示为平均值±标准差(SD)。P<0.05被认为具有统计学意义。
结果:MGLL在LUAD组织中明显过表达,并且MGLL水平升高与不良预后相关
首先使用IHC染色检测了156个LUAD样本和76个相邻的非肿瘤组织中的MGLL表达,发现相对于非肿瘤组织,MGLL表达在癌症组织中显著过表达(图1A和1B)。数据进一步表明,MGLL主要位于LUAD和非肿瘤组织的细胞质中(图1B)。然后,进行了蛋白质印迹分析,以测量7对随机选择的LUAD和非肿瘤样品中MGLL的水平,的数据证实,与相邻的非肿瘤组织相比,大多数肿瘤组织显示MGLL表达升高(图1C)。
进一步调查了MGLL水平与LUAD患者的临床病理特征之间的关联(表1)。卡方检验表明,MGLL的表达水平与TNM分期(P=0.041)和组织学分级(P=0.037)显著相关。此外,检查了MGLL表达水平与患者生存率之间的关系。根据Kaplan-Meier分析(P=0.042,对数秩检验;图1D)和单变量Cox回归分析(表2),MGLL表达水平与患者生存率显著相关,并且高MGLL表达患者的预后较差。然而,在调整年龄,组织学等级和TNM分期后,该队列的多变量Cox回归分析显示MGLL表达与总生存没有独立关联(表2)。
表1.MGLL表达与LUAD患者临床病理特征的关系。
表2.LUAD患者总体生存率的单因素和多因素分析
MGLL敲降在体外和体内抑制LUAD细胞增殖和肿瘤生长
为了研究MGLL对LUAD细胞恶性表型的影响,使用shRNA稳定地敲降了A549和H322细胞系中的MGLL表达(图2A和图2B)。然后通过CCK-8和集落形成实验评估细胞活力。数据显示,与空载体对照转染的细胞相比,MGLL敲降显著减弱了A549和H322细胞的细胞增殖和集落形成能力(图2C和图2D)。
为了进一步研究MGLL敲降对体内肿瘤生长的影响,将具有稳定MGLL敲降的A549细胞或阴性对照细胞皮下注射到裸鼠的右侧腹。与体外数据一致,发现与对照组相比,A549-shMGLL组的肿瘤大小和重量明显减少(图2E和图2F)。
先前的一项研究报道,在结肠直肠癌细胞中敲降MGLL可以通过下调Cyclin D1和BCL-2来抑制肿瘤细胞的增殖并诱导细胞凋亡。使用流式细胞仪,测试了是否可以在LUAD细胞中观察到类似的效果。实际上,与阴性对照相比,对于A549和H322细胞,检测到S和G2/M期的MGLL敲降细胞百分比降低(图2G)。但是,细胞凋亡表明,MGLL敲降后凋亡细胞的百分比没有受到显著影响(图2H)。然后,通过蛋白质印迹法测量了细胞增殖和凋亡相关蛋白的蛋白水平,发现MGLL敲降减弱了Cyclin D1和Cyclin B1的表达;而凋亡相关蛋白BCL-2和BAX的表达水平不受MGLL敲降的影响(图2I)。两者合计,结果表明增强的MGLL表达促进体外和体内肺癌细胞增殖和肿瘤生长。
MGLL敲降在体外和体内抑制LUAD细胞迁移和侵袭
为了研究MGLL对LUAD细胞迁移和侵袭的影响,使用稳定的MGLL敲降和对照细胞进行了transwell分析。发现相对于对照,MG549敲降显著抑制了A549和H322细胞的迁移和侵袭能力(图3A和图3B)。
然后,将含有shMGLL或对照质粒的A549细胞注射到NOD-SCID小鼠的尾静脉中,并量化8周后肺中转移性结节的数量。发现,与注射载体对照细胞的小鼠相比,注射A549-shMGLL细胞的小鼠显示出较少的肺转移性结节(图3C)。图3D中显示了肺组织标本的H&E染色图像。还测量了上皮-间充质转化(EMT)标记物E-钙粘着蛋白和N-钙粘着蛋白的表达水平,据报道(Zhu W,Zhao Y,Zhou J,Wang X,Pan Q,Zhang N,Wang L,Wang M,Zhan D,LiuZ,He X,Ma D,Liu S and Wang L.Monoacylglycerol lipase promotes progression ofhepatocellular carcinoma via NF-kappaB-mediated epithelial-mesenchymaltransition.J Hematol Oncol 2016;9:127.)它们在肝细胞癌中受到MGLL的调节。但是,结果表明,两种蛋白的表达水平不受MGLL敲降的影响(图3E)。
MGLL参与多种细胞途径并调节MMP14的表达
为了更好地了解MGLL在LUAD增殖和转移中的作用的分子机制,进行了RNA-seq分析,揭示了MGLL敲降后A549细胞的转录谱(图4A和图4B)。与MGLL的代谢作用相一致,KEGG通路分析表明MGLL主要影响生物过程,例如细胞因子-细胞因子受体相互作用,PI3K-Akt信号通路,神经活性配体-受体相互作用和逆行内源性大麻素信号传导(图4C)。然后,仔细检查了上调和下调的mRNA列表,发现MGLL敲降后MMP14的表达显著降低(图4A)。已知基质金属蛋白酶家族中的蛋白质参与细胞外基质成分的分解,并且通常与肿瘤侵袭有关。与转录谱一致,蛋白质印迹分析表明,在A549和H322细胞中MGLL敲降后,MMP14的表达显著降低(图4D)。此外,来自A549异种移植模型的组织的IHC染色证实了这一结果(图4E)。
MMP14在肺腺癌组织中表达上调并与LUAD组织的不良预后相关
为了进一步评估MMP14在肺癌中的临床意义,使用IHC测量了76LUAD和配对的相邻非肿瘤组织中MMP14的表达水平。结果表明,与非肿瘤组织相比,MMP14在肿瘤组织中显著过表达(图5A和图5B),而高MMP14表达与较差的总体存活率显著相关(P=0.019,图5C)。此外,在76个肿瘤组织样品中检测到MGLL和MMP14的表达呈正相关(P=0.036,图5D)。两者合计,数据表明,MGLL促进细胞增殖和转移,并在LUAD中起致癌作用。
上述结果表明MGLL可以作为LUAD的有价值的预后生物标志物。MGLL可通过多种方式促进癌细胞增殖,例如通过脂肪酸积累,调节细胞周期和抑制细胞凋亡。因此,评估了MGLL在A549和H322细胞中的细胞增殖中的作用,并发现MGLL敲降在体外和体内均抑制癌细胞的增殖。进一步发现,MGLL调节细胞周期过渡所需的细胞周期蛋白B1和细胞周期蛋白D1的表达。有趣的是,MGLL敲降后凋亡相关蛋白BCL-2和BAX的表达未受到明显影响,这表明MGLL可能不会影响LUAD细胞的凋亡。
上述数据表明MGLL可以在体外和体内促进肺癌细胞转移。但是,发现A549和H322细胞中的MGLL敲降后,包括E-钙粘着蛋白和N-钙粘着蛋白在内的EMT标记的表达没有受到明显影响。为了进一步阐明MGLL在LUAD中的致癌作用的潜在机制,进行了RNA测序并鉴定了MGLL调控的基因和途径。结果表明,MGLL主要参与过程例如细胞因子-细胞因子受体相互作用,PI3K-Akt信号通路,神经活性配体-受体相互作用和逆行内源性大麻素信号传导(图4C)。
在通过RNA-seq发现的MGLL调控基因中,发现MGLL敲降后MMP14明显下调。因此,测量了LUAD组织中MMP14的表达,发现该蛋白相对于非肿瘤组织在LUAD中表达上调,并且与MGLL一样,其表达与总体存活率显著相关。更重要的是,使用卡方检验,进一步发现MMP14的表达与MGLL的表达显著相关。
总而言之,研究证明了MGLL在LUAD中起致癌作用。至关重要的是,发现敲降MGLL会抑制Cyclin B1,Cyclin D1和MMP14的表达水平。MGLL和MMP14高表达的LUAD组织与较差的总生存期有关。因此,结果表明,MGLL可以作为LUAD患者的潜在预后标志物和治疗靶标。
以上公开的本发明优选实施例只是用于帮助阐述本发明。优选实施例并没有详尽叙述所有的细节,也不限制该发明仅为所述的具体实施方式。显然,根据本说明书的内容,可作很多的修改和变化。本说明书选取并具体描述这些实施例,是为了更好地解释本发明的原理和实际应用,从而使所属技术领域技术人员能很好地理解和利用本发明。本发明仅受权利要求书及其全部范围和等效物的限制。
- 肺腺癌的预后预测方法、肺腺癌的检测试剂盒以及用于治疗肺腺癌的医药组合物
- 肺腺癌预后的预测方法
