一种椎间盘单细胞的分离方法
文献发布时间:2023-06-19 11:37:30
技术领域:
本发明涉及生物技术领域,具体涉及一种椎间盘单细胞的分离方法。
背景技术:
椎间盘是两个相邻椎骨的椎体之间的软骨连接,由上下软骨终板、外围的纤维环和中心的髓核组成。腰腿痛是临床上高发的疾患之一。研究报道大多数患者腰腿痛均是由于椎间盘退变引起的,40岁以上人群中发病率高达40%-70%,其相关诊疗费用对社会造成巨大的经济负担。目前的椎间盘退行性变的治疗策略,主要包括物理治疗、药物治疗、介入治疗、手术治疗等传统手段,仅可对症治疗,而无法改善椎间盘退变的病理进程,导致无法根除椎间盘退变的发生。最新研究发现,生物治疗策略是椎间盘退行性疾病具有前景的治疗手段,其中基于细胞治疗和组织工程的细胞移植技术目前最受关注,其治疗的重点是修复或替换退变的椎间盘组织,以重建椎间盘功能。然而,目前椎间盘生物治疗的进展,关键在于对椎间盘的生理与病理微环境认识缺乏了解,尤其是对椎间盘内的细胞异质性尚缺乏深入研究。
单细胞RNA测序(scRNA-seq)技术是近年来得到快速发展的高通量测序技术,被认为是解决细胞异质性和解析复杂细胞生态位细胞成分的强大工具。单细胞RNA测序对细胞样本质量的要求极为严格,需具有高活性(≥80%)和高纯度(去除组织碎片和细胞粘连体等)等特殊要求,以确保单个细胞测序信息的准确性和可靠性。而传统技术分离椎间盘原代细胞的方法,由于酶的特异性较差,消化时间长,消化不彻底,导致细胞活力低下,产生的组织碎片和细胞粘连体较多,无法满足单细胞RNA测序的要求。亦有方法通过体外培养后获得P1代细胞,以提高细胞的活率和浓度,但是体外培养后细胞表型常常会产生较大改变,且丢失了不会贴壁、增殖活性较低的细胞亚群,无法代表椎间盘细胞在体内真实表达及分布情况,因此也不适用于单细胞测序。
因此亟需研发一种适用于单细胞RNA测序样本需求的高活性与高纯度椎间盘原代(P0)代细胞的分离方法,所分离的椎间盘细胞可反映体内的真实表达及分布情况,为后续椎间盘的细胞异质性研究提供优质的细胞标本。
发明内容:
本发明的目的在于提供一种椎间盘单细胞样品的分离方法,包括:
1)获得活体椎间盘组织样本,于生物洁净工作台以含青链霉素的PBS洗净组织至无肉眼可见血液沾染,然后,分离终板、纤维环和髓核,并分别保存,得到单一组织样本;
2)将单一组织样本分别充分剪碎,以含青链霉素的PBS重悬,离心,弃上清,得第一沉淀;
3)将所述第一沉淀与0.25%胰蛋白酶溶液混合,于37℃消化30分钟,消化后离心,弃上清,得第二沉淀;
4)将所述第二沉淀与0.2%链酶蛋白酶溶液混合,于37℃消化60分钟,消化后离心,弃上清,得第三沉淀;
5)将所述第三沉淀与Ⅱ型胶原酶溶液混合,于37℃消化至组织消化完全,得组织悬液;
6)将所述组织悬液经40μm细胞滤网过滤,得到细胞悬液,再将所述细胞悬液离心,弃上清,得第四沉淀;
7)将所述第四沉淀以红细胞裂解液重悬细胞,室温下静置5分钟,然后再加入2mL含青链霉素的PBS,离心,弃上清,得第五沉淀;
8)将所述第五沉淀通过磁珠分选法或流式细胞分选仪法获取细胞,即得单细胞样本。
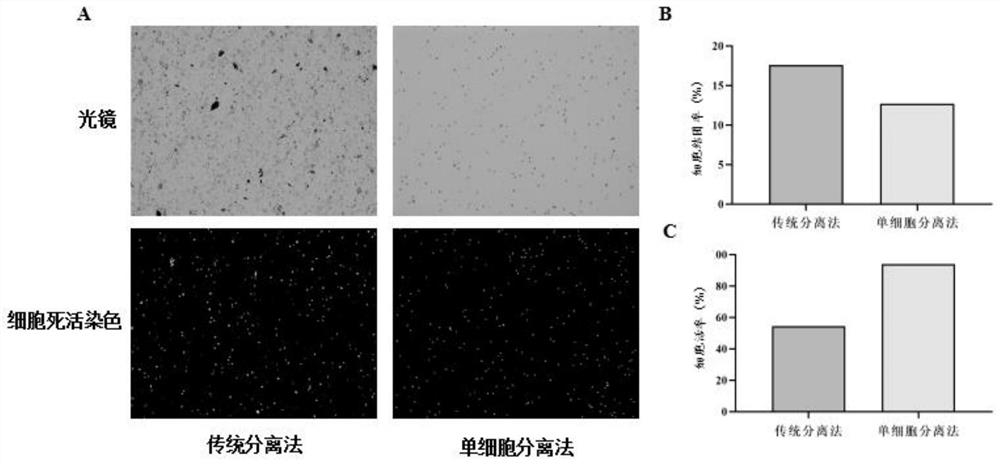
本发明提供的椎间盘单细胞分离法可提高细胞分离活率和纯度,相较于传统的一步消化法(0.2%II型胶原酶2-4h),椎间盘单细胞分离法由于高特异性酶消化及细胞分选策略,充分消化细胞外基质,高效去除消化残留杂质及细胞双倍体,获得高纯度、高活力、满足单细胞测序建库标准的椎间盘单细胞悬液(图3A和3C)。
在根据本发明的一个实施方案中,所述含青链霉素的PBS为含2%青链霉素的PBS。
在根据本发明的一个实施方案中,步骤5)中若单一组织样本为髓核组织时,Ⅱ型胶原酶溶液的浓度为0.1%;若单一组织样本为终板或纤维环时,Ⅱ型胶原酶溶液的浓度为0.2%。
在根据本发明的一个实施方案中,步骤2)、3)、4)、5)、6)或7)中的离心条件为4℃、300g离心5min。
在根据本发明的一个实施方案中,步骤2)中所述充分剪碎是通过圆剪和眼科剪将所述单一组织样本剪碎至1mm
在根据本发明的一个实施方案中,
步骤3)中,以g:ml计第一沉淀与胰蛋白酶溶液的比例为1:5;
步骤4)中,以g:ml计第二沉淀与链酶蛋白酶溶液的比例为1:5;
步骤5)中,以g:ml计第三沉淀与Ⅱ型胶原酶溶液的比例为1:5。
在根据本发明的一个实施方案中,
步骤8)在分选前还包括,吸取适量所述重悬细胞悬液以AO/PI溶液染色计数;
优选地,所述重悬细胞悬液与AO/PI溶液以1:1体积比混匀后立即计数;优选地,所述计数是利用Counter Star计数仪实现的。
AO/PI细胞荧光死活染色法可准确判断细胞样品质量,相较于传统的台盼蓝细胞活率染色,不会产生非特异性染色,运用Countstar Rigel S1细胞计数仪的AO/PI细胞荧光死活染色功能,可以更加准确判断人椎间盘原代(P0)代细胞的活率。
在根据本发明的一个实施方案中,所述磁珠分选法包括:
a)以适量Dead Cell Removal Micro Beads重悬细胞,轻柔混匀后室温孵育15分钟;
b)将MACS Separator分离器吸附于MACS MultiStand支架,并将MS柱吸附于分离器上,并以1×Binding Buffer进行润洗;
c)向孵育好的细胞中加入适量1×Binding Buffer,轻柔混匀,转移至MS柱悬空滴加,活细胞靠重力过柱;
d)待MS柱中液体即将滴完时再悬空加入1×Binding Buffer冲洗数次,离心,弃上清,用适当体积的PBS+0.04%BSA重悬细胞。
利用磁珠分选法去除死细胞可以有效提高细胞活率,减少细胞杂质,相比于磁珠分选前,磁珠分选可以有效减少人类椎间盘原代细胞杂质,降低细胞结团率,提高细胞活率,使细胞样本更加符合单细胞测序的要求。
在根据本发明的一个实施方案中,所述流式细胞分选仪法包括:
Ⅰ)以含有3%BSA的PBS重悬细胞,以7-AAD染色后,离心、弃上清,并以PBS重悬细胞,然后以流式过滤管过滤;
Ⅱ)启动流式细胞分选仪,在流式细胞仪分析软件中依次进行以下操作:
创建FSC-A与SSC-A的点状图,划门以去除杂质;
创建FSC-H与FSC-W的点状图,划门以除粘连体;
创建SSC-H与SSC-W的点状图,再次划门以去除粘连体;
创建SSC-H与PerCP(7-AAD)的点状图,划门去除死细胞;
Ⅲ)连接到流式细胞分选仪并调配适当设置:FSC设置Voltage E-1.Ampgain7.21.Linear mode、SSC设置为Voltage 271to 358.Ampgain 1.00,Linear mode;主要阈值参数:FSC,value 162;
Ⅳ)连接样品,并以最慢的流速运行;优选地,运行条件为Sheet pressure=4.5PSIG,sample pressure=5.0PSIG,12μL/min。
利用流式细胞分选仪分选法可以有效提高细胞活率,减少细胞杂质,相比于流式细胞分选仪分选去除死细胞前,流式细胞分选仪分选法可以有效减少人类椎间盘原代(P0)代细胞杂质。
本发明还提供了根据上述分离方法制备得到的椎间盘单细胞样品在单细胞RNA测序中的应用。
本发明的有益效果是:与传统的椎间盘原代细胞分离方法相比,本发明公开的椎间盘单细胞分离法方法采用高特异性酶消化及细胞分选策略,充分消化细胞外基质,高效去除消化残留杂质及细胞双倍体,无需经过体外扩增培养即可获取高质量的、满足单细胞测序建库标准的椎间盘原代(P0)单细胞悬液,且所获得的细胞群体可以代表椎间盘在人体中真实表达及分布情况。其中,椎间盘P0代细胞存活率≥80%,细胞纯度高,结团率≤10%,杂质少,可用于高质量的椎间盘单细胞RNA测序。
附图说明
图1为流式细胞分选仪分选划门策略示意图:A.去除杂质;B.去除粘连体;C.二次去除粘连体;D.去除死细胞
图2为不同染色方法评估人类椎间盘髓核原代细胞活率的比较图。其中,A为台盼蓝染色法;B为AO/PI荧光染色法;C为流式细胞分选仪分析法(7-AAD染色);
图3为不同细胞分离方法获得椎间盘细胞的质量比较图:其中,A.传统椎间盘细胞分离法和椎间盘单细胞分离法处理的细胞样本质量比较(光镜照片及死活细胞染色照片);B.传统椎间盘细胞分离法和椎间盘单细胞分离法处理的细胞样本的结团率比较;C.传统椎间盘细胞分离法和椎间盘单细胞分离法处理的细胞样本的细胞活率比较图;
图4为人类椎间盘原代细胞悬液样本磁珠分选前后的质量比较图;其中,A.人类椎间盘原代细胞磁珠分选处理前后的质量比较(光镜照片死活细胞染色);B.磁珠分选处理前后人类椎间盘原代细胞的细胞结团率比较;C.磁珠分选处理前后人类椎间盘原代细胞的细胞活率比较;
图5人类椎间盘原代细胞悬液样本流式细胞分选处理前后的质量比较图;其中,A.人类椎间盘原代(P0)代细胞悬液样本经流式细胞分选处理前后的光镜照片及死活细胞染色照片;B.人类椎间盘原代(P0)代细胞悬液样本经流式细胞分选处理前后的细胞结团率比较;C.人类椎间盘原代(P0)代细胞悬液样本经流式细胞分选处理前后的细胞活率比较。
图6运用本专利方法所分离的人类椎间盘样本进行单细胞测序,运用生物信息学分析获得的椎间盘细胞的图谱,反映了椎间盘细胞亚群的异质性。
具体实施方式:
下面对本发明的较佳实施例进行详细阐述,以使本发明的优点和特征能更易被本领域人员理解,从而对本发明的保护范围做出更为清楚明确的界定。
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
试剂、耗材及设备:
(一)试剂
1、0.25%胰蛋白酶-EDTA消化液(美国,HyClone,J200033)
2、Ⅱ型胶原酶(美国,Sigma-Aldrich,C6885-5G)
3、链酶蛋白酶(美国,Sigma-Aldrich,41844620)
4、组织保存液(德国,MiltenyiBiotec,MB17-R0061)
5、PBS磷酸盐缓冲液(中国,Solarbio,1022Q024)
6、青链霉素(美国,HyClone,J190014)
7、AO/PI(中国,Counter Star,A20011)
8、7-AAD(美国,Carlsbad,2115592)
9、红细胞裂解液(德国,MiltenyiBiotec,MB17-R0335)
10、BSA(德国,MiltenyiBiotec,5190527355)
11、0.4%台盼蓝染液(中国,Solarbio,Cat#C0040)
12、DMEM/F12培养基(美国,Gibco,8120305)
13、20x Binding Buffer(德国,MiltenyiBiotec,5191216516)
14、Dead Cell Removal MicroBeads(德国,MiltenyiBiotec,5191216516)
(二)器械及耗材:
1、手术刀,手术剪,镊子×2
2、一次性滤网(70μm:中国,BIOFIL,CSS013070;40μm:中国,BIOFIL,CSS013040)若干
3、22μm滤头(中国,MILLEX GP,R9BA69583)若干
4、50mL,15mL无菌离心管若干(中国,Nest)
5、10cm无菌培养皿(中国,Nest)
6、磁力管(德国,MiltenyiBiotec,5190220010)
7、流式管(美国,FALCON,352235)
8、EP管(美国,Thermo,UH2788641)
9、移液器(1000ul:德国,Eppendorf,K32968B;10ul:德国,Eppendorf,4908112)
10、移液枪头(1000ul:美国,Bioderck,BK-1000-T;10ul:中国,北京金麦克,JX0102)
实验仪器
11、BCM-1300生物洁净工作台(中国,苏州安泰空气计术技术有限公司,A05020262)
12、流式细胞分选仪(BD,AriaII)
13、磁力架(德国,MiltenyiBiotec)
14、转动混匀仪(德国,MiltenyiBiotec,MACSmix)
15、细胞计数仪(中国,Counter Star,Rigel S1)
实施例1溶液配制
1.1×红细胞裂解液:用ddH
2.配置0.2%(w/v)的Pronase:0.1g加入50mL蒸馏水,并用0.22μm的膜滤器过滤溶液,4℃保存。
3.配置0.2%(w/v)胶原酶II:称量0.1g胶原蛋白酶II,加入50mL无血清的DMEM/F12,用0.22μm的膜滤器过滤溶液,现配现用,用于消化纤维环和终板。
4.配置0.1%(w/v)胶原酶II:称量0.05g胶原蛋白酶II,加入50mL无血清的DMEM/F12,用0.22μm的膜滤器过滤溶液,现配现用,用于消化髓核。
5.配置2%青链霉素PBS:用移液枪吸取1mL青链霉素,49mL PBS,混匀,4℃保存。
6.配制含有3%BSA的PBS:吸取1.5mL BSA加入48.5mL PBS中,混匀,4℃保存。
实施例2椎间盘细胞消化
1.样本获取:
在椎间盘手术中避免电凝椎间盘组织,以防组织坏死。用髓核钳和终板刮刀尽可能多的取出椎间盘组织,区分髓核、纤维环及终板组织,随后放置于相应标识的离心管(内置有无菌组织保存液)中;
2.样本分离:
在生物洁净工作台用PBS(添加2%青链霉素)冲洗椎间盘组织,直至组织表面无红色,然后将组织转移至10cm皿中,在体视显微镜下再一次分离椎间盘组织:终板为1mm厚度左右的透明软骨组织;纤维环是一个环状软骨组织,相邻层具有相反的斜度而相互交叉;髓核是乳白色半透明胶状体,富于弹性。
3.组织剪碎:
圆剪和眼科剪充分剪碎组织至1mm
4.胰蛋白酶消化:
加入0.25%胰蛋白酶(每2g组织置于10mL溶液)于37℃转动混匀仪上消化30分钟,300g/5min/4℃,离心,弃上清。
5.链酶蛋白酶消化:
加入0.2%链酶蛋白酶溶液(每2g组织置于10mL溶液)于37℃转动混匀仪上消化组织1小时,300g/5min/4℃离心,弃上清。
6.Ⅱ型胶原酶消化:
①髓核组织:
髓核加入0.1%Ⅱ型胶原酶溶液(每2g组织置于10mL溶液)于37℃转动混匀仪上旋转消化2个小时,在消化过程中每隔半个小时观察消化结果,待组织基本消化完全时即停止消化;
②纤维环组织:
加入0.2%Ⅱ型胶原酶溶液(每2g组织置于10mL溶液)于37℃转动混匀仪上旋转消化2个小时,在消化过程中每隔半个小时观察消化结果,待组织基本消化完全时即停止消化;
③终板组织:
加入0.2%Ⅱ型胶原酶溶液(每2g组织置于10mL溶液)于37℃转动混匀仪上旋转消化2个小时,在消化过程中每隔半个小时观察消化结果,待组织基本消化完全时即停止消化;
7.过滤细胞:
将Ⅱ型胶原酶消化液通过40μm细胞滤网转移至50mL离心管中,得到细胞悬液,300g/5min/4℃离心,弃上清。
8.裂解红细胞:
加入2mL红细胞裂解液,重悬细胞,室温下静置5分钟,之后加入2mL含有2%青链霉素的PBS,300g/5min/4℃离心,弃上清。
上述椎间盘单细胞分离法可提高细胞分离活率和纯度,相较于传统的一步消化法(0.2%II型胶原酶2-4h),本发明的椎间盘单细胞分离法由于采用高特异性酶消化,充分消化细胞外基质,高效去除消化残留杂质,可以提高细胞的纯度、活率(图3中A和C),减少杂质和细胞粘连体(图3中A和B)
实施例3细胞质检
1.AO/PI染色:加入1mL 2%青链霉素溶液PBS重悬细胞,吸取细胞悬液10μl与AO/PI溶液10μl以1:1比例混匀,立即检测。
2.细胞计数:吸取20μl经过染色的细胞悬液,用Counter Star计数仪计数。
利用AO/PI细胞荧光死活染色法可准确判断细胞样品质量,相较于传统的台盼蓝细胞活率染色,不会产生非特异性染色,运用Countstar Rigel S1细胞计数仪的AO/PI细胞荧光死活染色功能,可以更加准确判断人椎间盘原代(P0)代细胞的活率。如图2所示,从患者退变椎间盘髓核中分离提取的原代(P0)代细胞,使用台盼蓝染色法计算活率为32.0%(图2中A),而使用Countstar Rigel S1细胞计数仪的AO/PI细胞荧光死活染色法计算活率为85.2%(图2中B),该细胞样本流式分选测得细胞活率为87.7%(图2中C),与AO/PI细胞荧光死活染色法的结果更接近。
实施例4去除死细胞
方案A:磁珠分选
1.配制试剂
配制含0.04%BSA的1×PBS,4℃存放;
配制1×Binding Buffer,用ddH
2.去除死细胞
1)耗材选择:MiltenyiBiotec MS columns要求总细胞数在2×10
2)取不超过1×10
3)用100μl Dead Cell Removal Micro Beads重悬细胞,轻柔混匀后室温孵育15分钟。
4)将MACS Separator分离器吸附于MACS MultiStand支架,选择合适型号柱子吸附于分离器上,MS柱子下方放置15mL离心管,并用500μl1×Binding Buffer进行润洗。
5)向孵育好的细胞中加入500ul 1×Binding Buffer,轻柔混匀,转移至MS柱悬空滴加,活细胞靠重力过柱。
6)待液体块滴完时悬空加500μl 1×Binding Buffer进行冲洗,一共4次,300g/5min/4℃离心,弃上清,用适当体积的PBS+0.04%BSA重悬细胞。
7)细胞质检,细胞活率≥80%即可用于单细胞RNA测序。
本发明利用磁珠分选法去除死细胞可以有效提高细胞活率,减少细胞杂质,相比于磁珠分选前,磁珠分选可以有效减少人类椎间盘原代(P0)代细胞杂质(图4中A),降低细胞结团率(图4中B),提高细胞活率(图4中C),使细胞样本更加符合单细胞测序的要求。
方法B:流式细胞分选仪分选
1)将提取原代(P0)代细胞第一次质检后,细胞悬液300g/5min/4℃离心,弃去上清液,并加入1mL含有3%BSA的PBS重悬。
2)细胞悬液300g/5min/4℃离心,弃去上清液,再次加入0.5mL含有3%BSA的PBS重悬。
3)流式过滤管过滤。
4)加入10μl 7-AAD,4℃染色5分钟
5)根据制造商的说明打开流式细胞分选仪并执行正常的液体管理设置。
6)启动CellQuest Pro(或其他FCM附属软件)并打开一个新文件(或以前保存的格式化文件,然后切换所有采集图以进行分析)。
7)创建FSC-A与SSC-A的点状图,划门以去除杂质(图1中A)。
8)创建FSC-H与FSC-W的点状图,划门以除粘连体(图1中B)。
9)创建SSC-H与SSC-W的点状图,再次划门以去除粘连体(图1中C)。
10)创建SSC-H与PERCP(7-AAD)的点状图,划门去除死细胞(图1中D)。
11.连接到流式细胞分选仪并调配适当设置:FSC(Voltage E-1.Ampgain7.21.Linear mode)、SSC(Voltage 271to 358.Ampgain 1.00,Linear mode)主要阈值参数:FSC,value 162,辅助阈值参数:无。
12.连接样品,并以最慢的流速运行(Sheet pressure=4.5PSIG,samplepressure=5.0PSIG,12μL/min)。
13.使用相同设置分选所有样品。
14.在分析完所有样品并完成数据存储后,请按照制造商的指示进行流体管理和清洁,然后进行数据分析。
15.最后分选所得细胞进行细胞质检,细胞活率≥80%,细胞结团率≤10%的细胞样本即可用于单细胞RNA测序。
本发明通过利用流式细胞分选法可以有效提高细胞活率,减少细胞杂质,相比于流式分选去除死细胞前,流式细胞分选仪分选法可以有效减少人类椎间盘原代(P0)代细胞杂质(图5中A)、去除双倍体、降低细胞结团率(图5中B)、提高细胞活率(图5中C),使细胞样本符合单细胞测序的要求。运用该样本成功进行单细胞测序,生物信息学分析呈现人类椎间盘细胞亚群的图谱,体现了椎间盘细胞的异质性(图6)。
上述发明内容及具体实施方式意在证明本发明所提供技术方案的实际应用,不应解释为对本发明保护范围的限定。本领域技术人员在本发明的精神和原理内,当可作各种修改、等同替换、或改进。本发明的保护范围以所附权利要求书为准。
- 一种椎间盘单细胞的分离方法
- 一种单细胞克隆分离专用培养膜及单细胞克隆分离方法
