一种蛋白高效回收工艺
文献发布时间:2024-04-18 19:58:21
技术领域
本发明属于蛋白制剂技术领域,具体涉及一种蛋白高效回收工艺。
背景技术
蛋白制剂的制备过程中,特别是抗体的制备,为了满足后续需要,需要对缓冲体系做置换,有时还需要一定浓缩,此时就需要一种置换回收工艺,现有多采用以下三种方法:
1、透析法
透析是利用半透性膜将蛋白溶液包裹,沉浸在透析缓冲液中,由于缓冲液浓度低于膜内部的浓度,因此在半透膜上会发生物质交换;但蛋白不能通过半透膜,只有盐离子等小分子物质可以通过;因此蛋白溶液中的盐杂质就通过半透膜交换到外面了。
透析法置换缓冲液,因周期较长,且需要大量的置换液,使其应用受到很大的限制,工业上用的较少,主要在实验室有部分仍在使用。
2、凝胶过滤层析
凝胶过滤介质广泛应用于生物大分子的脱盐和缓冲液置换,因其过程温和,被广泛应用到生物制药工艺中,特别是在离心交换及亲和后脱盐及缓冲液置换中应用普遍。
3、超滤
超滤法是一种膜滤法,它以多孔薄膜作为分离介质,依靠薄膜两侧压力差作为推动力来分离溶液中不同分子量的物质,从而起到置换、浓缩、提纯等作用的方法。它具有不存在相的转换、不需加热、能量消耗少、不必添加化学试剂、不损坏热敏药物等优点。超滤法从实验室微量处理的超滤管,到小量处理的超滤杯,再到工业上的超滤系统技术。
现有这些方案的主要缺陷在于:
凝胶过滤层析在蛋白回收过程中,如果想要达到较高的回收率,就有上样量的限制,一般限制单次上样量在柱体积的1/5以内。若超过1/5的柱体积则会造成置换不完全,需要舍弃置换不完全的部分产物,对于价值比较高的蛋白,特别是重组单克隆抗体来说,是很大的浪费。另外,凝胶过滤层析还有稀释的效果,如果需要达到浓缩蛋白的目的,则难以适用。
浓缩蛋白常用的方法是超滤,但在蛋白含量高的时候,采用超滤法容易堵膜,需要多次冲洗离心过滤,耗费时间长,若想要节约时间则需要使用更多的超滤管,不管采用哪种方式,最终会造成物料、能源和人力成本上升。另外,还存在一些特殊的蛋白会因为超滤法过后发生不可逆转的变性失活,造成了更严重的浪费。
发明内容
为了解决上述问题中的至少一个问题,本发明提供了一种蛋白高效回收工艺,该工艺对于量大的蛋白回收率高且用时短,效率高,并且成本低,对于一些特殊蛋白,该回收工艺还能够更好地保留蛋白的活性。
为实现上述目的,本发明提供如下技术方案:
本发明提供了一种蛋白高效回收工艺,回收工艺包括如下步骤:待回收样本先进行凝胶过滤层析,收集缓冲液置换完全的层析溶液为第一步回收产物;收集剩余缓冲液置换不完全的层析溶液作为超滤样本进行超滤,将缓冲液置换完全,获得第二步回收产物;第一步回收产物和第二步回收产物混合后得到回收终产物。
在一些具体实施方案中,凝胶过滤层析过程为:纯化仪预清洗后用置换缓冲液冲洗管道至平衡,样本上样层析,层析溶液根据280nm吸光度曲线按照峰前、峰尖以及峰尾分别进行收集;当280nm吸光度读值开始上升时,开始分别收集峰前和峰尖的缓冲液置换完全的层析溶液;当电导率开始变化时开始收集峰尾的缓冲液置换不完全的层析溶液,当280nm吸光度读值下降至曲线接近水平时停止收集,未收集的层析溶液中蛋白含量不大于0.1%。
在一些具体实施方案中,当280nm吸光度读值上升达到40mAU时,开始分别收集峰前和峰尖的缓冲液置换完全的层析溶液,当电导率开始变化时开始收集峰尾的缓冲液置换不完全的层析溶液,当280nm吸光度读值下降达到40mAU时,停止收集。
在一些具体实施方案中,上样流速5ml/min。在一些具体实施方案中,峰前、峰尖以及峰尾的层析溶液分别收集5-15ml。在一些具体实施方案中,所述置换洗脱液为磷酸盐缓冲溶液。
在一些具体实施方案中,超滤过程为:超滤管中加入超滤样本,并加入置换缓冲液补足体积,离心后保证膜上液体1ml左右,用移液器吹打混匀,再向超滤管中加置换缓冲液补足体积;重复离心、吹打过程多次,最后一次离心后,用移液器吹打混匀后吸出所有液体,再向超滤管中加入少量置换缓冲液,吹打混匀后吸出所有液体,混合后即得第二步回收产物。
在一些具体实施方案中,离心条件为4300rpm,离心5min;重复离心、吹打的次数不少于4次。在一些具体实施方案中,超滤管可采用多支,每支超滤管中加入的样品量不超过超滤管的3/5。
在一些具体实施方案中,当峰前的层析溶液混入峰尖的层析溶液,蛋白浓度达不到既定要求,峰前的层析溶液和峰尾的层析溶液混合成超滤样本进行超滤。
在一些实施方案中,待回收样本满足如下特点中的至少一个:
(1)样本量大,样本量不小于10mg;
(2)回收终产物浓度有既定要求,单一浓缩方法达不到既定要求的高浓度;
(3)超滤浓缩后回收终产物活性损失。
在一些实施方案中,所述待回收样本为具有生物活性的蛋白样本。在一些具体实施方案中,具有生物活性的蛋白样本为单克隆抗体。
本发明的有益效果
本发明具有以下有益效果为:本发明工艺采用凝胶过滤层析的通量后和超滤相结合的方式:凝胶过滤层析需要预清洗30min,上样收集8-15min,后面再清洗30min,清洗过程为自动清洗,无需人值守。先回收峰尖大部分蛋白5-15ml,残余部分,一般10-30ml,采用1-2支超滤管每次离心5-8min,至少4次,包括中间冲洗滤膜,半小时左右可完成,此时凝胶过滤层析柱也同时可完成清洗,总体用时约1.5小时,其中预清洗半小时无需值守。一般总体回收率可达到98%以上。其中,峰前的层析溶液中缓冲液已完成置换,如果混入峰尖的层析溶液后蛋白浓度可达到既定要求,则峰前溶液可不进行超滤。
凝胶过滤层析和超滤相结合的方式,凝胶过滤层析中可增加一次上样量,减少了层析的次数,也就减少了层析柱清洗平衡再上样的次数,节省时间。
而单一采用超滤,当样品中蛋白含量大于10mg、特别是大于25mg,此时离心一次需要30min甚至更长时间,置换缓冲液需要至少离心4次,即需要2小时以上,中间还需要取出后冲洗滤膜再进行下一次离心。或采用更多的超滤管,适当缩短离心时间,但耗材使用多,操作麻烦,且需要实验人员一直值守。
总的来说,本发明提供蛋白回收工艺对于量大的蛋白回收率高且用时短,效率高,并且成本低,对于一些特殊蛋白,该回收工艺除能达到高的回收率外,还能够更好地保留蛋白的活性。
附图说明
图1为实施例1中pD-L1兔单克隆抗体280nm吸光度读值和电导率读值曲线图;
图2为实施例2中MSH6兔单克隆抗体280nm吸光度读值和电导率读值曲线图;
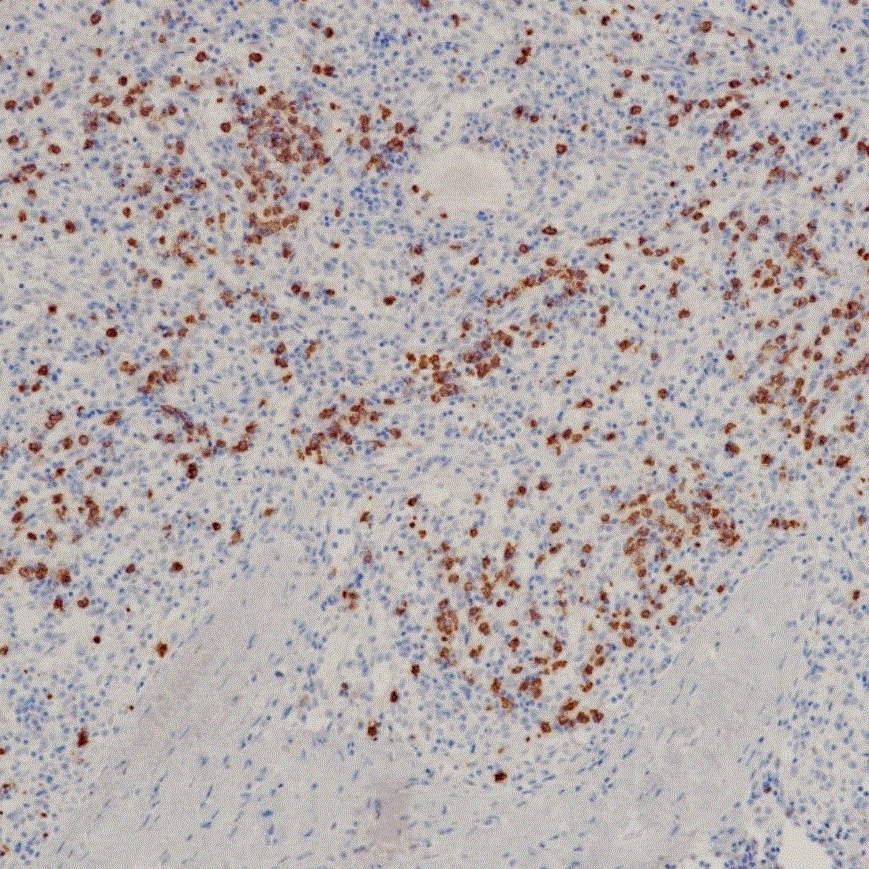
图3为实施例2方案1回收蛋白在常规免疫组织化学检测方法中的验证图;
图4为实施例2方案2回收蛋白在常规免疫组织化学检测方法中的验证图;
图5为实施例3中CD15鼠单克隆抗体280nm吸光度读值和电导率读值曲线图;
图6为实施例3方案1回收蛋白在常规免疫组织化学检测方法中的验证图;
图7为实施例3方案2回收蛋白在常规免疫组织化学检测方法中的验证图;
其中,图3和图4为食管组织切片,图6和图7为脾组织切片。
具体实施方式
除非另有说明、从上下文暗示或属于现有技术的惯例,否则本申请中所有的份数和百分比都基于重量,且所用的测试和表征方法都是与本申请的提交日期同步的。在适用的情况下,本申请中涉及的任何专利、专利申请或公开的内容全部结合于此作为参考,且其等价的同族专利也引入作为参考,特别这些文献所披露的关于本领域中的合成技术、产物和加工设计、聚合物、共聚单体、引发剂或催化剂等的定义。如果现有技术中披露的具体术语的定义与本申请中提供的任何定义不一致,则以本申请中提供的术语定义为准。
本申请中的数字范围是近似值,因此除非另有说明,否则其可包括范围以外的数值。数值范围包括以1个单位增加的从下限值到上限值的所有数值,条件是在任意较低值与任意较高值之间存在至少2个单位的间隔。例如,如果记载组分、物理或其它性质(如分子量,熔体指数等)是100至1000,意味着明确列举了所有的单个数值,例如100,101,102等,以及所有的子范围,例如100到166,155到170,198到200等。对于包含小于1的数值或者包含大于1的分数(例如1.1,1.5等)的范围,则适当地将1个单位看作0.0001,0.001,0.01或者0.1。对于包含小于10(例如1到5)的个位数的范围,通常将1个单位看作0.1。这些仅仅是想要表达的内容的具体示例,并且所列举的最低值与最高值之间的数值的所有可能的组合都被认为清楚记载在本申请中。
关于化学化合物使用时,除非明确地说明,否则单数包括所有的异构形式,反之亦然(例如,“己烷”单独地或共同地包括己烷的全部异构体)。另外,除非明确地说明,否则用“一个”,“一种”或“该”形容的名词也包括其复数形式。
术语“包含”,“包括”,“具有”以及它们的派生词不排除任何其它的组分、步骤或过程的存在,且与这些其它的组分、步骤或过程是否在本申请中披露无关。为消除任何疑问,除非明确说明,否则本申请中所有使用术语“包含”,“包括”,或“具有”的组合物可以包含任何附加的添加剂、辅料或化合物。相反,出来对操作性能所必要的那些,术语“基本上由……组成”将任何其他组分、步骤或过程排除在任何该术语下文叙述的范围之外。术语“由……组成”不包括未具体描述或列出的任何组分、步骤或过程。除非明确说明,否则术语“或”指列出的单独成员或其任何组合。
为了使本发明所解决的技术问题、技术方案及有益效果更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。
实施例
以下例子在此用于示范本发明的优选实施方案。本领域内的技术人员会明白,下述例子中披露的技术代表发明人发现的可以用于实施本发明的技术,因此可以视为实施本发明的优选方案。但是本领域内的技术人员根据本说明书应该明白,这里所公开的特定实施例可以做很多修改,仍然能得到相同的或者类似的结果,而非背离本发明的精神或范围。
除非另有定义,所有在此使用的技术和科学的术语,和本发明所属领域内的技术人员所通常理解的意思相同,在此公开引用及他们引用的材料都将以引用的方式被并入。
那些本领域内的技术人员将意识到或者通过常规试验就能了解许多这里所描述的发明的特定实施方案的许多等同技术。这些等同将被包含在权利要求书中。
实施例1 凝胶过滤层析参数探究
此实施例中,我们加大上样量至25ml,采用每管1ml持续收集层析溶液,来探究最佳的凝胶过滤层析参数,过程如下:
1、样品
pD-L1兔单克隆抗体(杭州百凌生物科技有限公司,克隆号BP6099)蛋白溶液,30.83mg,25 ml,原始缓冲液为常规柠檬酸-柠檬酸钠洗脱缓冲液。
2试剂与耗材
2.1、脱盐柱:EzLoad 26/10 G25 F:EG026,博格隆
2.2、置换缓冲液:DPBS:B210,源培;
2.3、20%乙醇:实验室配制,配制后用0.45μm滤膜抽滤过滤;
2.4、纯化水:实验室常规配备。
3、仪器设备
3.1、纯化仪:AKTA explorer。
实验操作步骤:
(1)预清洗:纯化仪开机,按照说明书操作进行预清洗;采用置换缓冲液冲洗管路至平衡;
(2)上样:25 ml样品管路S1放至样品瓶中,设置流速5ml/min;待样品全部吸干后,立即转移至置换缓冲液中;
(3)收集:设置收集选项:收集280nm吸光度读值大于等于40mAU的溶液,1ml/管,目的蛋白会先于原始缓冲液流出,并置换成置换缓冲液。将凝胶过滤层析的上样量提高到柱体积的1/2,即25ml进行测试,按每管1ml收集置换产物;纯化仪显示曲线如图1所示。
(4)后清洗:按照说明书操作进行后清洗,清洗完后关机。
结果说明:观察曲线图中280nm吸光度读值和电导率读值;计算得到280nm吸光度读值低于40mAU这部分损耗占总蛋白量的0.05%,可以舍弃;计算得到电导率变化幅度小于5%的部分有效置换的蛋白量占总蛋白量的66.5%,可作为凝胶过滤层析的回收产物收集;当电导率发生变化,表示此部分缓冲液未置换完全,计算得到电导率变化幅度大于5%的部分蛋白量占总蛋白量的33.45%,约1/3,由于本实验中加大了上样量,此部分回收产物的样本量明显多于采用常规上样量收集到的样本量,此处置换不完全的回收产物需额外进行超滤。
本发明回收工艺中结合了超滤工艺,那么凝胶过滤层析中置换不完全的量可以适当变大,本发明回收工艺中凝胶过滤层析和超滤两种方法的结合使用能够增大一次凝胶层析的上样量,减少层析的次数,也就减少了层析柱清洗平衡再上样的次数,节省时间。
实施例2 MSH6兔单克隆抗体纯化比较
1、样品
MSH6兔单克隆抗体(杭州百凌生物科技有限公司,克隆号BP6007)蛋白溶液,48.99mg,46 ml,原始缓冲液为常规柠檬酸-柠檬酸钠洗脱缓冲液;分别取13ml(13.85mg)样品进行两种方案实验。
2、试剂与耗材
2.1、超滤管(15ml):Amicon® Ultra-15 Centrifugal Filter device(50KD):UFC905024,millipore;
2.2、脱盐柱:EzLoad 26/10 G25 F:EG026,博格隆;
2.3、置换缓冲液:DPBS:B210,源培;
2.4、20%乙醇:实验室配制,配制后用0.45μm滤膜抽滤过滤;
2.5、纯化水:实验室常规配备。
3、仪器设备
3.1、Thermo台式大容量冷冻离心机:Multifuge X3R,Thermo;
3.2、纯化仪:AKTA explorer。
4、实验过程
实验方案1
I、凝胶过滤层析
(1)预清洗:纯化仪开机,按照说明书操作进行预清洗;采用置换缓冲液冲洗管路至平衡;
(2)上样:13ml样品管路S1放至样品瓶中,设置流速5ml/min;待样品全部吸干后,立即转移至置换缓冲液中;
(3)收集:设置收集选项:收集280nm吸光度读值大于等于40mAU的溶液,5ml/管,目的蛋白会先于原始缓冲液流出,并置换成置换缓冲液,纯化仪显示曲线如图2所示,观察下图280nm吸光度读值和电导率读值,当280nm吸光度读值上升达到40mAU时,曲线变化显著,出现峰,即开始收集;读值下降达到40mAU后停止收集,此时大量原始缓冲液流出,280曲线显著下降直至接近于0;收集A1-A6共6管溶液,5ml/管,A1为峰前,A2、3为峰尖,A4-6为峰尾;
(4)回收:峰尖溶液为第一部分所需产品:A2、A3的2管,10ml。直接保存,峰前、峰尾溶液4管,留存备用;
(5)后清洗:按照说明书操作进行后清洗,清洗完后关机。
II、超滤
(1)加样:峰前、峰尾部分4管溶液混合,约18ml,混合即为超滤样品;取2支超滤管,向超滤管中平均加入上述样品,加入置换缓冲液补足至15ml;
(2)离心:4300rpm,离心5 min,观察超滤管内样品体积,保证膜上液体在1mL左右。
(3)吹打:用移液器将吸头伸至滤芯底部,上下左右吹打两侧滤膜各3-5次,再往超滤管中加入置换缓冲液补足至15ml。
(4)重复离心+吹打过程,总共离心4次;
(5)回收:最后一次离心完成后,用移液器吸头伸至滤膜底部上下左右吹打两侧滤膜各3-5次,吸出大部分液体,每管残余约0.8ml,再向超滤管中加0.5ml置换缓冲液,吸头伸至滤膜底部上下左右吹打两侧滤膜各3-5次,吸出所有液体;所有超滤管回收的液体全部混合,得到第二部分所需产品:2.1ml。
III、混合
将凝胶过滤层析和超滤两步对应得到的两部分产品混合,即得最终产品。
IV、结果
最终产品测得共计13.66mg,12.1ml,回收率为98.63%。
另外,图2中,A4开始电导率曲线明显上升,表示缓冲液成分变化,原始洗脱缓冲液已混入。通过图2峰面积计算可得:A1-3管中含有的蛋白量为6管总量的83.15%,即A4-6管中含有的蛋白量为6管总量的16.85%;A1管中含有的蛋白量为6管总量的11.27%。需要说明的是,从电导率曲线变化可知,从第4管溶液开始,已混入了原始缓冲液,如果单一采用凝胶过滤层析,则回收前3-4管溶液;如果需要尽量多回收蛋白,则取前4管,溶液从上样的15ml变为了20ml,再加上蛋白的损耗,浓度是明显降低的,且缓冲液置换不完全;如果要保证缓冲液的置换完全,则取前3管,那么蛋白损失加大,达到16.85%,而体积不变,浓度也是降低的;如果要保证高浓度,则取峰尖的2管,损失进一步加大,达到近30%。而市售单克隆抗体、特别是免疫组化相关检测用抗体1mg的价格往往在几百甚至上千元。
实验方案2:
(1)加样:取1支超滤管,向超滤管中加入13ml样品,加入置换缓冲液补足至15ml;
(2)离心:4300rpm,离心25min,观察超滤管内样品体积,保证膜上液体在1mL左右。
(3)吹打:用移液器将吸头伸至滤芯底部,上下左右吹打两侧滤膜各3-5次,再往超滤管中加入置换缓冲液补足至15ml。
(4)重复离心+吹打过程,总共离心4次;
(5)回收:最后一次离心完成后,用移液器吸头伸至滤膜底部上下左右吹打两侧滤膜各3-5次,吸出大部分液体,管内残余约1ml,再向超滤管中加10ml置换缓冲液,吸头伸至滤膜底部上下左右吹打两侧滤膜各3-5次,吸出所有液体;所有超滤管回收的液体全部混合,即得最终产品。
结果显示:最终产品测得共计11.98mg,11ml,回收率为86.50%。
由实验方案1和实验方案2的对比可知:实验方案1的蛋白回收率明显高于实验方案2,另外,实验方案1总用时不足1.5小时,实验方案2用时约2小时。
5、抗体活性检测
取食管组织切片,一抗为上述实验方案1和实验方案2获得的抗体,使用终浓度均调整为0.003mg/ml,孵育用量100ul,采用常规免疫组织化学检测试剂及方法进行验证,实验结果如图3和图4所示。
结果显示,实验方案1不仅回收率高,在抗体效价上也略高于实验方案2。
实施例3 CD15鼠单克隆抗体纯化比较
1、样品
CD15鼠单克隆抗体(杭州百凌生物科技有限公司,克隆号MMA)蛋白溶液,11.53mg,29 ml,原始缓冲液为常规柠檬酸-柠檬酸钠洗脱缓冲液。分别取10ml(3.98mg)样品进行两种方案实验。该样品浓度高易沉淀变性,固不能浓缩程度过大。
2、试剂与耗材:
2.1、超滤管(15ml):Amicon® Ultra-15 Centrifugal Filter device(50KD):UFC905024,millipore;
2.2、脱盐柱:EzLoad 26/10 G25 F:EG026,博格隆;
2.3、置换缓冲液:DPBS:B210,源培;
2.4、20%乙醇:实验室配制,配制后用0.45μm滤膜抽滤过滤;
2.5、纯化水:实验室常规配备。
3、仪器设备
3.1、Thermo台式大容量冷冻离心机:Multifuge X3R,Thermo;
3.2、纯化仪:AKTA explorer。
4、实验过程
实验方案1
I、凝胶过滤层析
(1)预清洗:纯化仪开机,按照说明书操作进行预清洗;采用置换缓冲液冲洗管路至平衡;
(2)上样:10ml样品管路S1放至样品瓶中,设置流速5ml/min;待样品全部吸干后,立即转移至置换缓冲液中;
(3)收集:设置收集选项:收集280nm吸光度读值大于等于40mAU的溶液,4ml/管,目的蛋白会先于原始缓冲液流出,并置换成置换缓冲液,纯化仪显示曲线如图5所示,观察下图280nm吸光度读值和电导率读值,当280nm吸光度读值上升达到40mAU时,曲线变化显著,出现峰,即开始收集;读值下降达到40mAU后停止收集,此时大量原始缓冲液流出,280曲线显著下降直至接近于0;收集A1-A5共5管溶液,4ml/管,A1为峰前,A2、3为峰尖,A4、5为峰尾;
(4)回收:峰尖部分溶液为第一部分所需产品:A2、A3的2管共8ml,直接保存,峰前、峰尾部分及A1、A4和A5的3管溶液留存备用;
(5)后清洗:按照说明书操作进行后清洗,清洗完后关机。
II、超滤
(1)加样:峰前、峰尾部分3管溶液,约9 ml,即为超滤样品;取一支超滤管,向超滤管中加入上述样品,加入置换缓冲液补足至15ml;
(2)离心:4300rpm,离心5 min,观察超滤管内样品体积,保证膜上液体在1mL左右。
(3)吹打:用移液器将吸头伸至滤芯底部,上下左右吹打两侧滤膜各3-5次,再往超滤管中加入置换缓冲液补足至15ml。
(4)重复离心+吹打过程,总共离心4次;
(5)回收:最后一次离心完成后,用移液器吸头伸至滤膜底部上下左右吹打两侧滤膜各3-5次,吸出大部分液体,管内残留约0.7ml,再向超滤管中加0.5ml置换缓冲液,吸头伸至滤膜底部上下左右吹打两侧滤膜各3-5次,吸出所有液体,得到第二部分所需产品:1.2ml。
III、混合
将凝胶过滤层析和超滤两步得到的两部分产品混合,即得最终产品。
IV、结果
最终产品测得共计3.19mg,9.2 ml,回收率为80.15%。
另外,图6通过峰面积计算可得:A1-3管中含有的蛋白量为5管总量的94.73%,即A4-5管中含有的蛋白量为5管总量的5.27%;A1管中含有的蛋白量为5管总量的18.53%。需要说明的是,如果单一采用凝胶过滤层析,则将回收前3管溶液;从电导率曲线变化可知,A4开始电导率曲线明显上升,表示缓冲液成分变化,原始洗脱缓冲液已混入;溶液从上样的10ml变为了12ml,再加上蛋白的损耗,浓度是明显降低的;如果要保证高浓度,则取峰尖的2管,损失进一步加大,达到近25%。
实验方案2
(1)加样:取1支超滤管,向超滤管中加入10ml样品,加入置换缓冲液补足至15ml;
(2)离心:4300rpm,离心30min,观察超滤管内样品体积,保证膜上液体在1mL左右;此时可发现膜上有颗粒状沉淀粘附;
(3)吹打:用移液器将吸头伸至滤芯底部,上下左右吹打两侧滤膜各3-5次,再往超滤管中加入置换缓冲液补足至15ml;
(4)重复离心+吹打过程,总共离心4次;
(5)回收:最后一次离心完成后,用移液器吸头伸至滤膜底部上下左右吹打两侧滤膜各3-5次,吸出大部分液体,管内残留约1ml,再向超滤管中加7.5ml置换缓冲液,吸头伸至滤膜底部上下左右吹打两侧滤膜各3-5次,吸出所有液体;所有超滤管回收的液体全部混合,即得最终产品.
结果显示:最终产品测得共计2.25mg,8.5ml,回收率为56.53%。
由实验方案1和实验方案2的对比结果可知,实验方案1的蛋白回收率远高于实验方案2,另外,实验方案1总用时不足1.5小时,实验方案2用时约2.5小时。
5、抗体活性检测
取脾组织切片,一抗为上述实验方案1和实验方案2获得的抗体,使用终浓度均调整为0.0045mg/ml,孵育用量100ul,采用常规免疫组织化学检测试剂及方法进行验证,实验结果如图6和图7所示。
对比结果显示:实验方案1不仅回收率远高于实验方案2,在抗体效价上也明显高于实验方案2,实验方案2抗体除量的损失外,明显存在失活的迹象。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
- 一种高载荷、可整体回收的环保型汽车备胎盖板、制备工艺及可整体回收工艺
- 一种高效回收蛋白质的肝素钠废水处理新工艺
- 一种高效回收蛋白质的肝素钠废水处理工艺
