一种基于微流控芯片的核壳微胶囊的制备方法
文献发布时间:2024-04-18 19:58:26
技术领域
本发明涉及微胶囊生产技术领域,特别涉及一种基于微流控芯片的核壳微胶囊的制备方法。
背景技术
益生菌有许多健康益处,例如调节肠道菌群平衡,降低血清胆固醇水平和心血管疾病的风险。这使得食品行业对含有益生菌的功能性食品的需求日益增多。到目前为止,益生菌通常被添加到乳制品基质中,但对于乳制品过敏以及患有乳糖不耐症的消费者来说乳制品往往不是一个好的选择。相比于乳制品,果汁具有不同的风味且含有多种营养物质,因此可作为益生菌的潜在食品基质。但是果汁的酸性pH可能会影响益生菌在货架期内的贮存稳定性。除此之外,益生菌在递送至肠道过程中还易受到人体胃肠恶劣环境的破坏。因此,需要制定有效的策略以提高益生菌的活力。其中微囊化技术作为最有前途的策略之一,已经被广泛用于提高益生菌在高温,氧气以及极低pH等恶劣环境下的存活率。
先前的一些研究通过同轴共挤压的方法成功制备了以疏水性材料(如虫胶,油等)作为核心的核壳微胶囊。然而,这种共挤压的方法所制备的微胶囊的尺寸往往大于1mm,且粒径分布较广。一般来说,较小的微胶囊因不会影响食用的口感且允许更大的分子扩散而更加被青睐。微流控技术是涉及使用微米级通道操纵流体的技术,它提供了一种强大的方法来快速生产微米级的单分散液滴。此外,通过对微流控系统通道的设计,不仅可以将益生菌更准确地掺入到液滴中,而且还可以掺入其他材料以在恶劣环境下更好地保护它们。与共挤压法通过将海藻酸钠液滴滴入凝胶浴的外凝胶法不同,微流控技术可通过内部凝胶法生产海藻酸钠微胶囊。该方法是将不溶性钙复合物(如CaCO
发明内容
本发明的首要目的在于克服现有技术的缺点与不足,提供一种基于微流控芯片的核壳微胶囊的制备方法,该方法简便易行并可获得单分散性极好,尺寸可控且具有pH响应特性的微胶囊。该核壳微胶囊可应用于益生菌封装递送领域,并显著提高其在恶劣环境下的存活率。
本发明提供一种核壳微胶囊的制备方法,包括以下制备步骤:
(1)水凝胶前体溶液的制备:将CaCl
(2)核壳微胶囊芯层材料的制备:将蛋白在水中搅拌制成蛋白溶液,将蛋白溶液与海藻酸钠溶液混合均质制备含混合溶液,随后将混合溶液的pH值调至中性,再将植物油加入到混合溶液中均质,得到核壳微胶囊芯层材料;
(3)核壳微胶囊壳层材料的制备:将纳米纤维素溶于水中,搅拌得到纳米纤维素溶液,然后将海带纳米纤维素溶液和步骤(1)制备的水凝胶前体溶液混合,得到核壳微胶囊壳层材料;
(4)生产核壳微胶囊:将Tween 80、乙酸和植物油混合制备外相油相,然后将步骤(3)制备的核壳微胶囊芯层材料作为内相,将步骤(4)制备的核壳微胶囊壳层材料作为中间相,与外相油相分别泵入微流控芯片中,在芯片内进行内凝胶的液滴,随后收集在CaCl
进一步的,步骤(1)中CaCl
进一步的,步骤(1)中Na
进一步的,步骤(1)中CaCl
进一步的,步骤(1)中NaOH水溶液的浓度为0.8~1.2mol/L。
进一步的,步骤(1)中海藻酸钠在水凝胶前体溶液中的质量占比为0.5~4%。
进一步的,步骤(2)中蛋白包括可食用的鱼副产物蛋白,可食用的鱼蛋白以及其他可用于稳定Pickering的商业蛋白。
具体可选的,步骤(2)中蛋白包括三文鱼蛋白、鳕鱼蛋白的一种或多种。
进一步的,步骤(2)中蛋白溶液中的蛋白质量浓度为1~5%。
进一步的,步骤(2)中海藻酸钠溶液中海藻酸钠质量浓度为0.5~4%。
进一步的,步骤(2)中蛋白溶液和海藻酸钠溶液的体积比为1:0.8~1.2。
进一步的,步骤(2)中均质的条件为7000~8000rpm的速度均质20~30s。
进一步的,步骤(2)中植物油为玉米油、大豆油、菜籽油、花生油、藻油、棕榈油的一种或多种。
进一步的,步骤(2)中植物油和混合溶液的体积比为1:0.8~1.2。
进一步的,步骤(2)中加入油后的均质条件为8000~15000rpm的速度均质0.5~3min。
具体可选的,步骤(3)中纳米纤维素为海带纳米纤维素。
进一步的,步骤(3)中纳米纤维素溶液中纳米纤维素的质量浓度为0.1~0.5%。
进一步的,步骤(3)中海带纳米纤维素溶液和水凝胶前体溶液的体积比为1:0.8~1.2。
进一步的,步骤(4)中植物油为玉米油、大豆油、菜籽油、花生油、藻油、棕榈油的一种或多种。
进一步的,步骤(4)中外相油相中Tween 80的体积占比为0.5%-2%。
进一步的,步骤(4)中外相油相中乙酸的体积占比为0.02%-0.5%。
进一步的,步骤(4)中内相流速为200~700μL/h。
优选的,步骤(4)中内相流速为500μL/h。
进一步的,步骤(4)中中间相流速为200~900μL/h。
优选的,步骤(4)中中间相流速为800μL/h。
进一步的,步骤(4)中外相流速为3000~4000μL/h。
优选的,步骤(4)中外相流速为3600μL/h。
进一步的,步骤(4)中离心条件为在2000~4000rpm条件下离心1~5min。
进一步的,步骤(4)中所述微流控芯片的制备过程包括以下步骤:
首先制作用于光刻的掩膜,接着,将光刻胶SU-8均匀涂覆在清洁的硅片表面,并在60℃和90℃分别烘烤1分钟和5分钟,随后紫外曝光,制造出有微通道的阳膜,并再次进行90℃的热处理5分钟;
接着按照比例10:1(v/v),混合聚二甲基硅氧烷和固化剂,将混合物倾倒在阳性光刻胶图案上,随后,利用真空处理30分钟,并在90℃条件下加热30分钟,之后切割和打孔,获得带有微通道结构的芯片基片;
然后,运用相同方法制备不带微通道的盖片,通过等离子体封接将盖片和芯片基片结合,在65℃下热处理30分钟,得到微流控芯片。
进一步的,步骤(4)中CaCl
本发明提供根据上述方法制备得到的核壳微胶囊。
本发明所述的方法在制备核壳微胶囊领域的应用。
本发明提供一种载菌核壳微胶囊的制备方法,包括以下步骤:
(1)水凝胶前体溶液的制备:将CaCl
(2)植物乳杆菌粉油的制备:通过将益生菌接种在MRS肉汤中,并在35~38℃下孵育15~18h以活化益生菌,在经两次传代培养后,离心收集益生菌沉淀,益生菌沉淀在用无菌生理盐水清洗两次后,加入冷冻干燥保护液,然后冷冻干燥,得到益生菌粉,然后益生菌粉加入到植物油中,制得益生菌植物油;
(3)核壳微胶囊芯层材料的制备:将蛋白在水中搅拌制成蛋白溶液,将蛋白溶液与海藻酸钠溶液混合均质制备含混合溶液,随后将混合溶液的pH值调至中性,再将益生菌植物油加入到混合溶液中均质,得到核壳微胶囊芯层材料;
(4)核壳微胶囊壳层材料的制备:将纳米纤维素溶于水中,搅拌得到纳米纤维素溶液,然后将海带纳米纤维素溶液和步骤(1)制备的水凝胶前体溶液混合,得到核壳微胶囊壳层材料;
(5)生产核壳微胶囊:将Tween 80、乙酸和植物油混合制备外相油相,然后将步骤(3)制备的核壳微胶囊芯层材料作为内相,将步骤(4)制备的核壳微胶囊壳层材料作为中间相,与外相油相分别泵入微流控芯片中,在芯片内进行内凝胶的液滴,随后收集在CaCl
进一步的,步骤(1)中CaCl
进一步的,步骤(1)中Na
进一步的,步骤(1)中CaCl
进一步的,步骤(1)中NaOH水溶液的浓度为0.8~1.2mol/L。
进一步的,步骤(1)中海藻酸钠在水凝胶前体溶液中的质量占比为0.5~4%。
进一步的,步骤(2)中所述益生菌益生菌包括但不限于双歧杆菌,副干酪乳杆菌,干酪乳杆菌,植物乳杆菌,鼠李糖乳杆菌,嗜热链球菌,发酵乳杆菌,瑞士乳杆菌中的一种或多种。
进一步的,步骤(2)中冷冻干燥保护液为糖类和蛋白质的混合水溶液。
进一步的,步骤(2)中所述糖类包括但不限于蔗糖,菊糖,海藻糖,乳糖中的一种或多种。
进一步的,步骤(2)中所述糖类在冷冻干燥保护液中的质量浓度为5-10%。
进一步的,步骤(2)中所述蛋白质包括但不限于蛋白胨,乳清蛋白,酪蛋白酸钠,明胶,脱脂奶粉的一种或多种。
进一步的,步骤(2)中所述蛋白质在冷冻干燥保护液中的质量浓度为5-15%。
优选的,所述糖类为菊糖。
优选的,所述糖类蛋白质为脱脂奶粉。
优选的,菊糖在保护剂溶液中浓度为5-10wt%,脱脂奶粉在保护剂溶液中浓度为5-15wt%。
进一步的,步骤(2)中益生菌粉和冷冻干燥保护液的的质量体积比为1g:5~20mL。
进一步的,步骤(2)中益生菌粉和植物油的质量体积比为1g:10~30mL。
进一步的,步骤(3)中蛋白包括可食用的鱼副产物蛋白,可食用的鱼蛋白以及其他可用于稳定Pickering的商业蛋白。
具体可选的,步骤(3)中蛋白包括三文鱼蛋白、鳕鱼蛋白的一种或多种。
进一步的,步骤(3)中蛋白溶液中的蛋白质量浓度为1~5%。
进一步的,步骤(3)中海藻酸钠溶液中海藻酸钠质量浓度为0.5~4%。
进一步的,步骤(3)中蛋白溶液和海藻酸钠溶液的体积比为1:0.8~1.2。
进一步的,步骤(3)中均质的条件为7000~8000rpm的速度均质20~30s。
进一步的,步骤(3)中植物油为玉米油、大豆油、菜籽油、花生油、藻油、棕榈油的一种或多种。
进一步的,步骤(3)中植物油和混合溶液的体积比为1:0.8~1.2。
进一步的,步骤(3)中加入油后的均质条件为8000~15000rpm的速度均质0.5~3min。
具体可选的,步骤(4)中纳米纤维素为海带纳米纤维素。
进一步的,步骤(4)中纳米纤维素溶液中纳米纤维素的质量浓度为0.1~0.5%。
进一步的,步骤(4)中海带纳米纤维素溶液和水凝胶前体溶液的体积比为1:0.8~1.2。
进一步的,步骤(5)中植物油为玉米油、大豆油、菜籽油、花生油、藻油、棕榈油的一种或多种。
进一步的,步骤(5)中外相油相中Tween 80的体积占比为0.5%-2%。
进一步的,步骤(5)中外相油相中乙酸的体积占比为0.02%-0.5%。
进一步的,步骤(5)中内相流速为200~700μL/h。
优选的,步骤(5)中内相流速为500μL/h。
进一步的,步骤(5)中中间相流速为200~900μL/h。
优选的,步骤(5)中中间相流速为800μL/h。
进一步的,步骤(5)中外相流速为3000~4000μL/h。
优选的,步骤(5)中外相流速为3600μL/h。
进一步的,步骤(5)中离心条件为在2000~4000rpm条件下离心1~5min。
进一步的,步骤(5)中所述微流控芯片的制备过程包括以下步骤:
首先制作用于光刻的掩膜,接着,将光刻胶SU-8均匀涂覆在清洁的硅片表面,并在60℃和90℃分别烘烤1分钟和5分钟,随后紫外曝光,制造出有微通道的阳膜,并再次进行90℃的热处理5分钟;
接着按照比例10:1(v/v),混合聚二甲基硅氧烷和固化剂,将混合物倾倒在阳性光刻胶图案上,随后,利用真空处理30分钟,并在90℃条件下加热30分钟,之后切割和打孔,获得带有微通道结构的芯片基片;
然后,运用相同方法制备不带微通道的盖片,通过等离子体封接将盖片和芯片基片结合,在65℃下热处理30分钟,得到微流控芯片。
进一步的,步骤(5)中CaCl
本发明提供根据上述方法制备得到的载菌核壳微胶囊。
本发明所得到的载菌核壳微胶囊在食品领域、药物制备、保健品制备领域的应用。
进一步的,所述药物和保健品为含有益生菌的药物和保健品。
与现有技术相比,本发明具有如下有益效果:
(1)本发明采用微流控芯片可控,快速,温和地制备单分散性好,尺寸为微米级的核壳微胶囊。
(2)本发明将益生菌封装在核壳微胶囊地核心乳液中,有效避免了益生菌与外界恶劣环境的直接接触,从而显著提高益生菌在胃肠道消化以及果汁贮存期间的存活率。
(3)本发明制备的核壳微胶囊具有pH响应特性,可以在胃部酸性pH下保持原有的形状,且在肠道中性pH下裂解并释放益生菌,起到良好的胃肠缓释功能。
附图说明
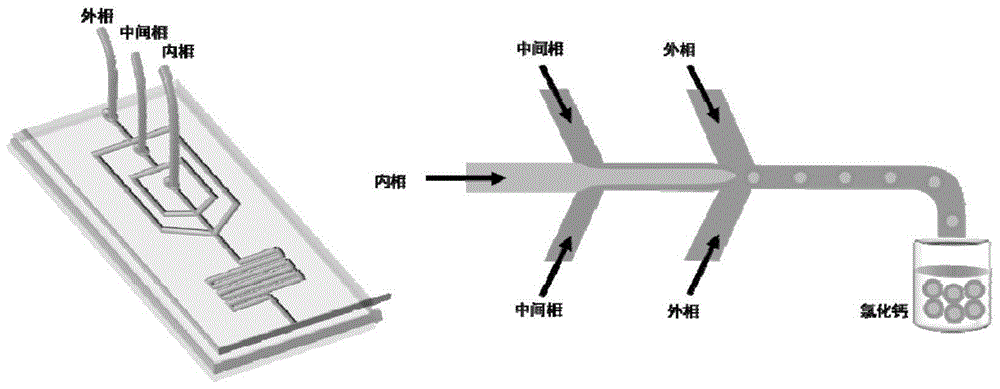
图1为用于生成载菌海藻酸钠微胶囊的PDMS微流控装置示意图以及在芯片上制备核壳微胶囊的过程示意图。
图2基于微流控芯片的核壳微胶囊的制备。仅将外相(A),中间相(B),内相(C),内相与中间相(D)通入微流控芯片时的明场图像以及核壳微胶囊(E1-E4),单壳微胶囊(F1-F4)和单核微胶囊(G1-G4)形成的过程图像。
图3为通过内外凝胶法固化后的核壳微胶囊(A),单壳微胶囊(B)以及单核微胶囊(C)的明场图像。比例尺代表1000μm。
图4为不同流体参数对微胶囊直径和多分散性的影响。在不同外相流速(A)下微胶囊的粒径分布与大小以及在不同内相流速下由100μL内相制备的微胶囊的个数(B)。
图5为载菌微胶囊在模拟胃肠消化过程中的活细胞计数(A)以及在模拟消化不同时间点下的形态(B)。
图6为载菌微胶囊在25℃(A)与4℃(B)下贮存在果汁中四周内的活细胞计数。
具体实施方式
为了更好地理解本发明所解决的技术问题、技术方案及技术效果,以下结合实施例和附图,对本发明的内容进一步详细说明,但不应理解为对本发明的限制。
原料来源
下述实施例中所用植物乳杆菌来源是:植物乳杆菌Lp90购自镇江天一生物科技有限公司;
下列实施例中所用三文鱼副产物蛋白的制备方法是按照CN116349867A中实施例1中S1的步骤(1)~(3)进行制备的;
下列实施例中所用海带纳米纤维素的制备方法是按照CN202210480195中具体实施方式中公开的方法进行制备的;
游离益生菌的制备是通过将植物乳杆菌接种在MRS肉汤中,并在37℃下孵育16h以活化益生菌。在经两次传代培养后,通过在4℃,8000rpm下离心8min收集益生菌沉淀。
下述实施例描述中,wt%是指质量百分比,例如“2wt%海藻酸钠”是指100mL水溶液中含有2g的海藻酸钠。
测量方法
(一)为了量化外相流速对微胶囊性质的影响。在收集微胶囊后,通过光学显微镜进行拍摄并上传到imageJ软件上。每组处理均测量了100个微胶囊的尺寸求其平均值,并作它们的柱形散点图以观察它们的粒径分布范围。在不同内相流速下,通过检查由100μl内相制备微胶囊的个数以量化内相流速对微胶囊性质的影响。
(二)微囊化益生菌在模拟胃液以及肠液的活性测定方法:每100ml模拟胃液含有1g胃蛋白酶和0.9g NaCl,并用1.0M HCl将pH值调至1.2。每100ml模拟肠液含有1g胰酶,0.68g KH2PO4和1g胆汁盐,并用1.0M NaOH将pH值调至7.0。模拟胃液与模拟肠液均通过0.22μm膜过滤灭菌,并在使用前置于37℃的水浴中预热。将由1mL内相制备的核壳微胶囊或单核微胶囊或由1mL中间相制备的单壳微胶囊与10mL模拟胃液混合并在37℃的水浴中搅拌120min。在模拟胃液结束后,立即将模拟胃液的pH调至7.0,并加入10mL模拟肠液。微胶囊在37℃的水浴中以150rpm的速度继续搅拌360min。分别在模拟胃液消化0min,120min与模拟肠液消化10min,30min,60min,120min,180min与360min时拍摄微胶囊的形态。在体外模拟消化结束后向消化液中加入10mL PBS并匀浆5min以释放所有益生菌。释放的益生菌用生理盐水连续稀释后置于MRS琼脂培养基上,并在37℃培养箱中培养48h并计数,并将结果以logCFU/g表示。游离益生菌作为对照组也被研究。
(三)微囊化益生菌在果汁中贮存4周后活力的测定:将由1mL内相制备的核壳微胶囊或单核微胶囊或由1mL中间相制备的单壳微胶囊分别加入到20mL商业巴氏灭菌橙汁中。在4℃和25℃贮存1,2,3和4周后,与20mL PBS(pH=7.4)混合,然后使用高速匀浆器匀浆5min以裂解微胶囊。用生理盐水连续稀释释放的益生菌并置于MRS琼脂培养基上。在37℃培养箱中培养48h后计数,并将结果以log CFU/g表示。游离益生菌作为对照组也被研究。
实施例1
本实施例是制备核壳微胶囊的过程。
(1)微流控芯片的制备:首先,使用CAD软件绘制出微流控芯片的微通道结构,然后将设计图案制作成适用于光刻的掩膜,具体的芯片设计图案可参见图1。接着,利用匀胶旋涂仪将光刻胶SU-8均匀涂覆在清洁的硅片表面,并在60℃和90℃分别烘烤1分钟和5分钟,以确保光刻胶的均匀性与稳定性。随后,运用紫外曝光技术,制造出有微通道的阳膜,并再次进行90℃的热处理5分钟,以确保结构的稳定性。紧接着,按照比例10:1(v/v),混合聚二甲基硅氧烷和固化剂,在充分混合后,将混合物倾倒在阳性光刻胶图案上。随后,利用真空泵抽真空30分钟,以消除潜在气泡,并在90℃条件下加热30分钟,完成固化过程。一旦固化完成,通过切割和打孔的方式,在特定位置获得带有微通道结构的芯片基片。与此同时,运用相同方法制备不带微通道的盖片,然后通过等离子体封接的方法将两者紧密结合。最后,将封装好的微流控芯片在65℃下热处理30分钟,以确保各部分稳定可靠地连接。
(2)EDTA-Ca复合物与海藻酸钠溶液的均匀水凝胶前体溶液的制备:EDTA-Ca复合物的制备是通过将100mM CaCl
(3)核壳微胶囊芯层材料的制备:将三文鱼蛋白粉溶解在无菌水中并搅拌,制成4wt%的三文鱼蛋白溶液,将4wt%的三文鱼蛋白溶液与2wt%的海藻酸钠溶液以体积比1:1混合并以8000rpm的速度均质30s制备含混合溶液,随后将混合溶液的pH值调至7,再将玉米油加入到混合溶液中(油相和水相的体积比为1:1,v/v),之后以12000rpm的速度均质2min制备成稳定的Pickering乳液,即核壳微胶囊芯层材料。
(4)核壳微胶囊壳层材料的制备:将0.02g海带纳米纤维素溶于10mL去离子水中,在55℃下搅拌3h,得到含有0.2wt%的海带纳米纤维素溶液,然后将海带纳米纤维素溶液和10mL的水凝胶前体溶液混合,充分振荡,得到核壳微胶囊壳层材料。
(5)在芯片上生产核壳微胶囊:核壳微胶囊是在微流控芯片上通过内部-外部凝胶法制备的。含有1%(v/v)Tween 80和含有0.05%(v/v)乙酸的玉米油作为外相用以形成核壳液滴并诱导钙离子的释放。将由步骤(3)制备的核壳微胶囊芯层材料(内相),由步骤(4)制备的核壳微胶囊壳层材料(中间相)与外相分别装入3个1mL注射器中并与注射泵相连。内相,中间相与外相流体分别以500μL/h,800μL/h和3600μL/h的速度泵入微流控芯片中。在芯片内进行内凝胶的液滴随后收集在CaCl
对比例1
本对比例为制备的单壳微胶囊,制备过程参照实施例1,仅将步骤(3)省去,即省去核壳微胶囊制备中的内相,将原本的步骤(5)改为如下操作:
在芯片上生产单壳微胶囊:单壳微胶囊是在微流控芯片上通过内部-外部凝胶法制备的。含有1%(v/v)Tween 80和含有0.05%(v/v)乙酸的玉米油作为外相用以形成单壳液滴并诱导钙离子的释放。将由步骤(3)制备的单壳微胶囊壳层材料(中间相)与外相分别装入2个1mL注射器中并与注射泵相连。中间相与外相流体分别以800μL/h和3600μL/h的速度泵入微流控芯片中。在芯片内进行内凝胶的液滴随后收集在CaCl
对比例2
本对比例为制备的单核微胶囊,制备过程参照实施例1,仅将步骤(4)省去,即省去核壳微胶囊制备中的中间相,将原本的步骤(5)改为如下操作:
在芯片上生产单核微胶囊:单核微胶囊是在微流控芯片上通过内部-外部凝胶法制备的。含有1%(v/v)Tween 80和含有0.05%(v/v)乙酸的玉米油作为外相用以形成单核液滴并诱导钙离子的释放。将由步骤(3)制备的单核微胶囊芯层材料(内相)与外相分别装入2个1mL注射器中并与注射泵相连。内相与外相流体分别以500μL/h和3600μL/h的速度泵入微流控芯片中。在芯片内进行内凝胶的液滴随后收集在CaCl
对比例3
本对比例制备的核壳微胶囊,制备过程参照实施例1,仅将步骤(5)中的外相流体流速改为7200μL/h。
对比例4
本对比例制备的核壳微胶囊,制备过程参照实施例1,仅将步骤(5)中的外相流体流速改为2400μL/h。
对比例5
本对比例制备的核壳微胶囊,制备过程参照实施例1,仅将步骤(5)中的内相流体流速改为200μL/h。
对比例6
本对比例制备的核壳微胶囊,制备过程参照实施例1,仅将步骤(5)中的内相流体流速改为600μL/h。
实施例1与对比例1,2在芯片上制备的过程如图2所示,当只有外相或中间相注入芯片时,因海藻酸钠和玉米油是透明的,所以芯片内无明显现象(图2A,图2B)。相反,当仅有内相注入芯片时,由于内相的非透明,芯片中出现明显的黑色流体(图2C)。此时,当中间相以更高的流速同时注入芯片时,内相会被中间相挤压从而产生明显的同轴流体(图2D)。如图2E所示,同轴流体在第二个连接处被玉米油一次一个地剪切以生成单分散性好的核壳微胶囊(实施例1)。在外相中加入了表面活性剂Span80用以稳定并防止液滴聚集,从而提升了微胶囊的单分散性。此外,仅由中间相或内相制备的单壳微胶囊(对比例1)与单核微胶囊(对比例2),与核壳微胶囊相比,单壳微胶囊呈现完全的透明状,而单核微胶囊则呈现非透明状(图2F,图2G)。
实施例1与对比例1,2凝胶化后的明场图像分别如图3A图3B和图3C所示,在合适的流体流速下,可观察到凝胶化后的微胶囊形状完整,尺寸均一。有趣的是,本发明发现核壳微胶囊内部核芯的形状是不规律的,这可能是因为在液滴固化前,内部的核心溶液是自由流动的。其次由于壳层先于核心接触到含有乙酸的玉米油,因此会先于核心固化,这使得核心与壳层在固化前很难融合在一起。随着钙离子的释放,在核心完全固化后就保留了它们在固化前自由变化的形状。总之,相较于对比例1和对比例2,通过芯片的方法成功制备了具有多层结构的核壳微胶囊(实施例1),这种多层结构不仅在微观尺度上呈现出引人入胜的视觉效果,还赋予微胶囊以独特的物理和化学特性。
此外,微胶囊的尺寸不仅影响到食用的口感,而且对益生菌的封装与保护起到关键作用。本发明进一步讨论了影响微胶囊特性的关键参数,包括外相和内相的流速。如图4所示,当外相流速由7200μl/h降低到2400μl/h时,微胶囊的平均粒径从565.24μm显著增加到924.27μm(图4A)。其中,对比例3因外相流速过大而形成较小的微胶囊,然而这导致了中间相与内相大范围的融合。另外,对比例4因外相流速过小而形成椭圆状的微胶囊。相比之下,实施例1的微胶囊单分散性更好且核壳结构更为明显。因为核壳微胶囊核的形状各异,所以无法用直径直接去衡量核的大小。但在相同流速下,我们认为核的体积相似,因此在不同内相流速下,通过固定内相的量,用生产的核壳微胶囊数量来优化内相流速。当内相流速由200μl/h增加到600μl/h时,生产微胶囊的数量由1537个显著减少到511个,这反映在了内相体积的增大(图4B)。其中对比例5因内相流速过小而导致核壳微胶囊内相体积较小,这必然导致核壳微胶囊负载量的下降,而对比例6中内相流速过大则导致核壳结构的消失,这不利于后续微胶囊对益生菌的保护。
综上,本发明通过实施例1和对比例1~2的比较,展示了本发明中具有多层结构的核壳微胶囊的成功制备。同时,实施例1和对比例3~4的对比,以及实施例1和对比例5~6的对比,发现了外相和内相的流速对最终微胶囊的平均粒径和体积大小的影响,结合本发明最终要载菌的目的,将外相和内相的流速优选为实施例1中的流速,即内相流速为500μL/h,外相流速为3600μL/h。
实施例2
本实施例为制备载菌核壳微胶囊的过程,核壳微胶囊的制备过程参考实施例1的步骤,其中其它的制备不变,仅变化内相的制备,即实施例1中步骤(3)过程变为如下两步:
1、植物乳杆菌粉油的制备:通过将植物乳杆菌接种在MRS肉汤中,并在37℃下孵育16h以活化益生菌。在经两次传代培养后,通过在4℃,8000rpm下离心8min收集益生菌沉淀。益生菌沉淀在用无菌生理盐水清洗两次后,加入10倍用量(g/mL)含有脱脂奶粉(7.5wt%)和菊粉(7.5wt%)的冷冻干燥保护液,然后冷冻干燥,得到植物乳杆菌粉,其活量可达10logCFU/g,然后植物乳杆菌粉以1:15(g/mL)的比例加入到玉米油中,并漩涡震荡使其均匀悬浮在玉米油中,制得植物乳杆菌玉米油。
2、核壳微胶囊芯层材料的制备:将三文鱼蛋白粉溶解在无菌水中并搅拌,制成4wt%的三文鱼蛋白溶液,将4wt%的三文鱼蛋白溶液与2wt%的海藻酸钠溶液以体积比1:1混合并以8000rpm的速度均质30s制备含混合溶液,随后将混合溶液的pH值调至7,再将植物乳杆菌玉米油加入到混合溶液中(油相和水相的体积比为1:1,v/v),之后以12000rpm的速度均质2min制备成稳定的Pickering乳液,即核壳微胶囊芯层材料。
剩余的步骤均参照实施例1中的进行制备,随后按照步骤(5)制备负载益生菌的核壳微胶囊。
对比例7
本对比例为制备的载菌单壳微胶囊,参照对比例1,外相油相不变,中间相的制备操作如下:
负载益生菌的单壳微胶囊的制备:通过将植物乳杆菌接种在MRS肉汤中,并在37℃下孵育16h以活化益生菌。在经两次传代培养后,通过在4℃,8000rpm下离心8min收集益生菌沉淀。益生菌沉淀在用无菌生理盐水清洗两次后加入10倍体积含有脱脂奶粉(7.5wt%)和菊粉(7.5wt%)的冷冻干燥保护剂。植物乳杆菌粉是通过冷冻干燥后得到的,其活量可达10logCFU/g。植物乳杆菌粉以1:30(w/v)的比例加入到水凝胶前体溶液中,制备中间相溶液;
然后按照对比例1的所述相关制备参数,制备负载益生菌的单壳微胶囊。
对比例8
本对比例为制备的载菌单核微胶囊,参照对比例2,外相油相不变,内相的操作如下:
1、植物乳杆菌粉油的制备:通过将植物乳杆菌接种在MRS肉汤中,并在37℃下孵育16h以活化益生菌。在经两次传代培养后,通过在4℃,8000rpm下离心8min收集益生菌沉淀。益生菌沉淀在用无菌生理盐水清洗两次后,加入10倍用量含有脱脂奶粉(7.5wt%)和菊粉(7.5wt%)的冷冻干燥保护液,然后冷冻干燥,得到植物乳杆菌粉,其活量可达10logCFU/g,然后植物乳杆菌粉以1:15(w/v)的比例加入到玉米油中,并漩涡震荡使其均匀悬浮在玉米油中,制得植物乳杆菌玉米油。
2、核壳微胶囊芯层材料的制备:将三文鱼蛋白粉溶解在无菌水中并搅拌,制成4wt%的三文鱼蛋白溶液,将4wt%的三文鱼蛋白溶液与2wt%的海藻酸钠溶液以体积比1:1混合并以8000rpm的速度均质30s制备含混合溶液,随后将混合溶液的pH值调至7,再将植物乳杆菌玉米油加入到混合溶液中(油相和水相的体积比为1:1,v/v),之后以12000rpm的速度均质2min制备成稳定的Pickering乳液,即核壳微胶囊芯层材料(内相);
然后按照对比例2所述相关制备参数,制备负载益生菌的单核微胶囊。
以游离益生菌作为对照组,测定了益生菌封装在核壳微胶囊(实施例2),单壳微胶囊(对比例3)以及单核微胶囊(对比例4)中,在胃肠消化后的存活量。如图4a所示,在模拟消化结束后检测到游离益生菌完全失活。这是由于极低的胃酸pH会损伤益生菌的细胞膜进而破坏其DNA与蛋白质。微囊化技术可显著提升益生菌在模拟消化后的活性。其中植物乳杆菌封装在核壳微胶囊、单壳微胶囊与单核微胶囊的活量分别由最初的8.48,8.12和8.19logCFU/g下降到了6.84,6.20和5.70log CFU/g。与对比例3,4相比相比,实施例2可通过将益生菌固定在核心乳液中在最大程度上隔绝胃肠道的恶劣条件以延缓益生菌接触消化液的时间。进一步对微胶囊在模拟消化的不同时间点拍照以研究微胶囊对益生菌的保护机制。如图4b所示,观察到三组微胶囊均可在模拟胃液结束后保持最初的形状,这是由于海藻酸钙的pH响应能力,在低pH环境下海藻酸钙的羧基处于非电离状态。在模拟肠液中单层微胶囊与核壳微胶囊的形态呈现了不同的变化趋势。单层微胶囊首先迅速膨胀随后逐渐溶解,这是因为在中性环境中,海藻酸钙的羧基发生电离而导致彼此间静电斥力增加,从而加速崩解。而核壳微胶囊则首先壳层发生溶解,随后核层发生膨胀。在模拟肠液结束时,仍保持一定的结构。这是由于壳层海藻酸钙与海带纳米纤维素的相互交联与核层油滴的填充的双重影响而显著增加了核壳微胶囊的崩解时间。因此也可以推断,核壳微胶囊可通过缓解微胶囊的崩解时间以阻碍益生菌与胃酸和胆盐的直接接触,从而显著提高益生菌的存活率。
表1载菌微胶囊在模拟胃肠消化过程中的活细胞计数
以游离益生菌作为对照组,测定了益生菌封装在核壳微胶囊(实施例2),单壳微胶囊(对比例3)以及单核微胶囊(对比例4)中,分别在4℃,25℃下在果汁中贮存4周后的存活量。具体结果如图5所示。在25℃贮存时,所有情况下益生菌的存活率都低于在4℃贮存时,这说明植物乳杆菌对贮存温度的敏感性。因为较高的温度往往导致更高的代谢活性。此外观察到,所有处理组的益生菌在第一个星期都表现更快的活力丧失,且在随后的贮存期内活力丧失变得缓慢,这可归因于一种酸适应机制。在贮存结束后,无论是在4℃还是在25℃时,相比于游离益生菌,单核与单壳微囊化益生菌,核壳微囊化益生菌均可显著提高益生菌的活性。这表明多层微囊化可以更好的隔绝橙汁中的柠檬酸,维生素C等抗菌剂以保持细胞的完整性。
表2在25℃下贮存在果汁中四周内的活细胞计数
表3在4℃下贮存在果汁中四周内的活细胞计数
应说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围,其均应涵盖在本发明的权利要求范围当中。
- 一种微流控组件、微流控芯片及其制备方法
- 微流控芯片、干细胞分离方法及微流控芯片的制备方法
- 一种微流控芯片、微流控检测装置及微流控检测方法
- 一种微流控芯片及基于微流控芯片的电泳微胶囊制造方法
- 一种微流控芯片及基于微流控芯片的电泳微胶囊制造方法
