一种对叶大戟果实中大环二萜类化合物组分纯化部位的用途
文献发布时间:2024-04-18 19:58:53
技术领域
本发明属于医药技术领域,涉及一种对叶大戟果实中大环二萜类化合物组分的纯化部位的用途,具体涉及大环二萜类化合物组分在制备多药耐药逆转药物或抗肿瘤药物组合用药中的用途。通过对HCT-8/Taxol人结直肠腺癌-紫杉醇耐药细胞的实验证实它具有逆转肿瘤多药耐药的作用。
背景技术
对叶大戟(Euphorbia sororia A.Schrenk)是大戟科(Euphorbiaceae)大戟属(Euphorbia)一年生草本植物,产于亚洲大陆中部,在我国主要分布于新疆和田、昌吉等地,其成熟果实为民族药的常用药材,应用于临床治疗多种风湿性疾病。
一种用于多药耐药的逆转药物和抗肿瘤组合用药的组分;以对叶大戟果实为原料,破碎后用5-10倍体积的浓度为50-99%的乙醇水溶液、无水乙醇、丙酮、体积浓度为50-99%的甲醇水溶液或无水甲醇在室温下进行渗漉、冷浸或加热回流提取并浓缩;得到的对叶大戟果实的提取用3-10倍体积的水分散,加入3-10倍体积的正己烷、乙酸乙酯或正己烷与乙酸乙酯的混合溶剂萃取3-10次,或将提取物用3-10倍体积的正己烷、乙酸乙酯或正己烷与乙酸乙酯的混合溶剂分散,再加入3-10体积的水萃取3-10次,合并萃取液,减压浓缩;将得到的萃取物浸膏用3-10倍体积的乙腈或50%的甲醇水溶液分散,用3-10倍体积的正己烷、石油醚或环己烷进行萃取3-10次,或将萃取浸膏用3-10倍体积的正己烷、石油醚或环己烷分散,再加入用3-10倍体积的乙腈或50%甲醇水溶液萃取3-10次、浓缩;将得到的乙腈或50%甲醇水溶液萃取物浸膏用正向硅胶柱分离,用体积比100:1-0:1的石油醚-乙酸乙酯或正己烷-丙酮进行梯度洗脱,各流分经硅胶波层层析分析,合并相同流分,得到3个流分Fr.1-Fr.3;将流分Fr.2在温度38-40℃减压蒸干,得到的黄棕色粘稠液体在温度50℃水浴条件下烘干至恒重,即得到大环二萜类化合物组分。该组分在制备多药耐药逆转药物或抗肿瘤药物组合用药中的用途,进行了体外细胞毒性和肿瘤耐药逆转活性测定,结果表明:所述大环二萜类化合物组分对人乳腺癌细胞株MCF-7及人乳腺癌阿霉素耐药细胞株MCF-7/ADR有较弱的细胞毒性,并且该组分具有不同程度的肿瘤多药耐药逆转活性。
肿瘤多药耐药是多因素介导的复杂现象,以结构不同,靶点各异的化疗药物对肿瘤细胞产生不同程度的治疗耐药性为特征,一旦抗癌药物出现耐药性,癌细胞会迅速扩散并转移,这会影响患者生存质量和周期。肿瘤多药耐药的产生是目前肿瘤的临床治疗和预后中最大的挑战,虽然已经开发三代多药耐药小分子逆转剂,但是因为不明原因的毒性、药物相互作用等原因,没有一种逆转药物批准上市。因此,发掘新的毒性低,逆转效率高的肿瘤多药耐药逆转剂,以克服多种肿瘤多药耐药性,恢复机体对化疗药物,靶向药物和免疫制剂的敏感性,对癌症的治疗至关重要。
发明内容
本发明的目的在于,提供一种对叶大戟果实中大环二萜类化合物组分纯化部位的用途,是基于发明专利202110094019.7名称《一种对叶大戟果实中大环二萜类化合物组分的提取分离方法和用途》中获得的对叶大戟大环二萜类组分,在此基础上,对所得组分进行进一步纯化,得到对叶大戟果实中大环二萜类化合物组分纯化部位,并对得到的纯化部位的毒性和肿瘤多药耐药逆转作用进行评价。通过本发明所述方法获得的纯化部位,经过对HCT-8/Taxol人结直肠癌-紫杉醇耐药细胞的逆转活性试验证明:对叶大戟果实中大环二萜类化合物组分纯化部位具有对逆转HCT-8/Taxol细胞多药耐药的作用。
本发明所述的一种对叶大戟果实中大环二萜类组分纯化部位的用途,纯化部位在制备多药耐药逆转药物或抗肿瘤药物组合用药中的用途,所述纯化部位按下列步骤进行:
a.将叶大戟果实中大环二萜类化合物组分选择反相硅胶作为填料,填料样品比为1:5-1:10,柱体积40 -80mL,用体积比100:1-0:1的甲醇-水进行梯度洗脱,洗脱流速为5-10mL/min;
b、再将每1BV洗脱液进行HPLC色谱分析,旋转蒸干或温度50-70℃烘干,即得对叶大戟大环二萜类组分纯化部位。
所述的纯化部位在制备抗细胞株HCT-8/Taxol人结直肠癌-紫杉醇耐药中的用途。
本发明所述的一种对叶大戟果实中大环二萜类组分纯化部位的用途,是基于发明专利202110094019.7《一种对叶大戟果实中大环二萜类化合物组分的提取分离方法和用途》中获得的对叶大戟组分的制备方法,按下列步骤进行:
a.以对叶大戟的果实为原料,自然晾干,破碎后用5-10倍体积的浓度为50-99%的乙醇水溶液、无水乙醇、丙酮、体积浓度为50-99%的甲醇水溶液或无水甲醇在室温下进行渗漉、冷浸或加热回流提取,浓缩,得到对叶大戟果实的提取物;
b.将步骤a所得到的提取物用3-10倍体积的水分散,加入3-10倍体积的正己烷、乙酸乙酯或正己烷与乙酸乙酯的混合溶剂萃取3-10次,或将提取物用3-10倍体积的正己烷、乙酸乙酯或正己烷与乙酸乙酯的混合溶剂分散,再加入3-10倍体积的水萃取3-10次,合并萃取液,减压浓缩,得到萃取物浸膏;
c.将步骤b所得到的萃取物浸膏用3-10倍体积的乙腈或50%的甲醇水溶液分散,加入用3-10倍体积的正己烷、石油醚或环己烷进行萃取3-10次,或将萃取物浸膏用3-10倍体积的正己烷、石油醚或环己烷分散,再加入用3-10倍体积的乙腈或50%甲醇水溶液萃取3-10次,浓缩,得到萃取物浸膏;
d.将步骤c得到的乙腈或50%甲醇水溶液萃取物浸膏用正相硅胶柱分离,用体积比100:1-0:1的石油醚-乙酸乙酯或正己烷-丙酮进行梯度洗脱,各流分经硅胶薄层层析分析,合并相同流分,得到3个流分Fr.1-Fr.3;将流分Fr.2在温度38-40℃减压蒸干,得到黄棕色粘稠液体,再将黄棕色粘稠液体在温度50℃水浴条件下干燥烘干至恒重,即得到大环二萜类化合物组分为:化合物1:(2R,3R,4S,5R,7S,8S,9S,13S,14S,15R)-5-苯甲酰氧基-15-羟基-7-异丁酰氧基-2,3,8,9,14-四乙酰氧基-假白榄烷-6(17),11E-二烯;化合物2:(2R,3R,4S,5R,7S,8S,9S,13S,14S,15R)-2,3,8,9-四乙酰氧基-5,14-二苯甲酰氧基-15-羟基-7-异丁酰氧基-假白榄烷-6(17),11E-二烯;化合物3:14α-苯甲酰氧基-15β-羟基-5α,7β-二异丁酰氧基-2α,3β,8α,9α-四乙酰氧基-假白榄烷-6(17),11E-二烯四;化合物4:14α-苯甲酰氧基-15β-羟基-5α-异丁酰氧基-7β-丙酰氧基-2α,3β,8α,9α-四乙酰氧基-假白榄烷-6(17),11E-二烯;化合物5:14α-苯甲酰氧基-15β-羟基-7β-异丁酰氧基-5α-丙酰氧基-2α,3β,8α,9α-四乙酰氧基-假白榄烷-6(17),11E-二烯;化合物6:(2S,3S,4R,5R,7S,8R,13S,15R)-3,5,8,15-四乙酰氧基-7-异丁酰氧基-假白榄烷-6(17),11E-二烯-9,14-二酮;化合物7:(2R,3R,4S,5R,7S,8S,9S,13S,14S,15R)-2,3,8,9-四乙酰氧基-14-苯甲酰氧基-15-羟基-7-异丁酰氧基-5-(2-甲基-丁酰氧基)-假白榄烷-6(17),11E-二烯;化合物8:泰拉齐纳大戟素A。
本发明对所得到的发明专利202110094019.7一种对叶大戟果实中大环二萜类化合物组分进行纯化,具体操作按下列步骤进行:
a.将叶大戟果实中大环二萜类化合物组分选择反相硅胶作为填料,填料样品比为1:5-1:10,柱体积40 -80mL,用体积比100:1-0:1的甲醇-水进行梯度洗脱,洗脱流速为5-10mL/min;
b.再将每1BV洗脱液进行HPLC色谱分析,旋转蒸干或温度50-70℃烘干,即得对叶大戟大环二萜类组分纯化部位。
得到的大环二萜纯化部位经HPLC分析,得其中主要含8种大环二萜类化合物,含量为92.4%。
通过所述方法获得的对叶大戟大环二萜类组分纯化部位(简称I)逆转HCT-8/Taxol细胞耐药性,所采取的技术方案如下:
通过MTT法,流式细胞术等实验方法研究对叶大戟大环二萜类组分纯化部位对HCT-8/Taxol人结直肠腺癌-紫杉醇耐药细胞上的逆转活性、药物外排抑制作用、活性氧释放抑制作用和肿瘤药物组合治疗对耐药细胞凋亡的影响。
本发明首次进行将对叶大戟果实中大环二萜类化合物组分纯化部位对HCT-8/Taxol人结直肠腺癌-紫杉醇耐药细胞的耐药逆转活性,表明组分纯化部位较低浓度下,在HCT-8/Taxol人结直肠腺癌-紫杉醇细胞上对多种抗肿瘤药物有逆转活性,并能有效抑制该细胞中罗丹明Rho123和阿霉素DOX的外排作用,能抑制细胞内活性氧ROS水平,进一步联合紫杉醇促进耐药细胞凋亡;揭示该组分纯化部位在HCT-8/Taxol人结直肠腺癌-紫杉醇细胞上的新的应用,对多药耐药逆转药物和肿瘤的组合药物治疗中具有重要的意义和开发价值。
本发明所述的一种对叶大戟果实中大环二萜类化合物组分纯化部位的用途,该纯化部位是一种肿瘤逆转药物,通过先前专利202110094019.7制备的样品经反相硅胶柱层析纯化而获得,并评价其在HCT-8/Taxol人结直肠腺癌-紫杉醇耐药细胞中的逆转活性。本发明的重点之处对叶大戟组分纯化部位可以有效逆转HCT-8/Taxol细胞耐药性。内容包括:(1)对叶大戟组分纯化部位在HCT-8/Taxol细胞上可逆转化疗药物DOC、VCR、PTX和DOX的耐药性;(2)对叶大戟组分纯化部位能抑制HCT-8/Taxol细胞中罗丹明Rho123和阿霉素DOX的外排作用,可明显抑制活性氧ROS的释放,进一步联合紫杉醇促进HCT-8/Taxol细胞凋亡。研究结果显示:对叶大戟大环二萜类组分具备抗肿瘤逆转药物或肿瘤治疗中组合用药的应用。
附图说明
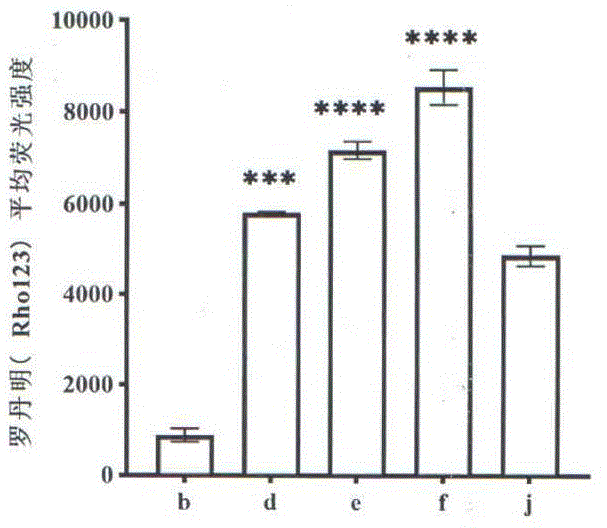
图1为本发明对HCT-8/Taxol细胞中罗丹明Rho123外排抑制作用;
图2为本发明对HCT-8/Taxol细胞中阿霉素DOX外排抑制作用;
图3为本发明对HCT-8/Taxol细胞中活性氧ROS释放的影响;
图4为本发明对HCT-8/Taxol细胞凋亡的影响;其中b:耐药细胞对照组(HCT-8/Taxol人结肠腺癌-紫杉醇耐药细胞)、d:5μg/mL、g:Taxol(700nM)、h:Taxol(700nM)+5μg/mL组分j:VRP 10μM(阳性对照组)。
具体实施方式
实施例1
a.将叶大戟果实中大环二萜类化合物组分100g,选择反相C18硅胶作为填料,填料样品比为1:5,柱体积40mL,用体积比100:1-0:1的甲醇-水进行梯度洗脱,洗脱流速为5mL/min;
b、再将每1BV的洗脱液进行HPLC色谱分析,温度50℃烘干,即得对叶大戟大环二萜类组分纯化部位79.8g;
所得到的纯化部位为化合物1:(2R,3R,4S,5R,7S,8S,9S,13S,14S,15R)-5-苯甲酰氧基-15-羟基-7-异丁酰氧基-2,3,8,9,14-四乙酰氧基-假白榄烷-6(17),11E-二烯;化合物2:(2R,3R,4S,5R,7S,8S,9S,13S,14S,15R)-2,3,8,9-四乙酰氧基-5,14-二苯甲酰氧基-15-羟基-7-异丁酰氧基-假白榄烷-6(17),11E-二烯;化合物3:14α-苯甲酰氧基-15β-羟基-5α,7β-二异丁酰氧基-2α,3β,8α,9α-四乙酰氧基-假白榄烷-6(17),11E-二烯四;化合物4:14α-苯甲酰氧基-15β-羟基-5α-异丁酰氧基-7β-丙酰氧基-2α,3β,8α,9α-四乙酰氧基-假白榄烷-6(17),11E-二烯;化合物5:14α-苯甲酰氧基-15β-羟基-7β-异丁酰氧基-5α-丙酰氧基-2α,3β,8α,9α-四乙酰氧基-假白榄烷-6(17),11E-二烯;化合物6:(2S,3S,4R,5R,7S,8R,13S,15R)-3,5,8,15-四乙酰氧基-7-异丁酰氧基-假白榄烷-6(17),11E-二烯-9,14-二酮;化合物7:(2R,3R,4S,5R,7S,8S,9S,13S,14S,15R)-2,3,8,9-四乙酰氧基-14-苯甲酰氧基-15-羟基-7-异丁酰氧基-5-(2-甲基-丁酰氧基)-假白榄烷-6(17),11E-二烯;化合物8:泰拉齐纳大戟素A。
实施例2
a.将叶大戟果实中大环二萜类化合物组分100g选择反相C18硅胶作为填料,填料样品比为1:10,柱体积为60mL,用体积比100:1-0:1的甲醇-水进行梯度洗脱,洗脱流速为8mL/min;
b、再将每1BV的洗脱液进行HPLC色谱分析,温度70℃烘干,即得对叶大戟大环二萜类组分纯化部位80.3g。
所得到的纯化部位与实施例1相同。
实施例3
a.将叶大戟果实中大环二萜类化合物组分100g,选择反相C18硅胶作为填料,填料样品比为1:7,柱体积为80mL,用体积比100:1-0:1的甲醇-水进行梯度洗脱,洗脱流速为10mL/min;
b、再将每1BV洗脱液进行HPLC色谱分析,旋转蒸干,即得对叶大戟大环二萜类组分纯化部位80.9g。
所得到的纯化部位与实施例1相同。
实施例4
将实施例1-3得到的大环二萜类化合物组分纯化部位I,利用高效液相色谱分析组分纯化部位中各大环二萜的总含量达92.4%,实验结果见表1,对照品为本实验室分离制得:
表1 1g大环二萜类化合物组分中各化合物含量
按实施例1-3方法连续制备大环二萜类化合物组分纯化部位(I1-5),利用高效液相色谱分析组分纯化部位中,8个化合物的含量变化,考察5批大环二萜类化合物组分纯化部位(I1-5)纯化方法的稳定性,结果见表2:
表2 5批大环二萜类化合物组分纯化部位中8个化合物含量
连续5批纯化部位I中8个目标大环二萜的总和相对偏差为0.769%,说明富集工艺稳定性较强;综上,对叶大戟中大环二萜有效组分富集工艺整体上较稳定、可靠,具有推广应用价值。
实施例5
将实施例1-3得到的任意一种对叶大戟大环二萜类组分纯化部位在HCT-8/Taxol细胞中抗肿瘤药物多药耐药逆转作用:
将处于对数生长期的HCT-8/Taxol细胞正常消化后,计数,以每孔1500个细胞接种于96孔板,在37℃、5%CO
表3大环二萜类组分对不同的化疗药物逆转作用
10μM维拉帕米VRP作为阳性对照;纯化部位I在25、15、10、5μg/mL的浓度下,增强化疗药物VCR敏感性的能力优于维拉帕米VRP(10μM)更强,纯化部位I还不同程度地增强了抗癌药物PTX和DOX和VCR在HCT-8/T耐药细胞中敏化作用。
实施例6
对叶大戟大环二萜类组分纯化部位在HCT-8/Taxol细胞中罗丹明(Rho123)和阿霉素(DOX)外排抑制作用:
将处于对数生长期的HCT-8、HCT-8/T细胞正常消化后,计数,分别以每孔4×10
实验结果表明:随着组分I浓度升高2.5、5和10μg/mL,曲线往右移,以浓度依赖性的方式增强了HCT-8/Taxol细胞中Rho123和DOX的细胞内积累(图1和图2),在浓度为5μg/mL时,在HCT-8/T细胞中;组分I对DOX和Rho123的细胞内浓度高于阳性药VRP,可判断在HCT-8/T细胞中,更低的浓度下组分I对DOX和RH123的胞内蓄积量比VRP有更强(
实施例7
对叶大戟大环二萜类组分在HCT-8/Taxol细胞中活性氧(ROS)释放的影响:
将处于对数生长期的HCT-8,HCT-8/Taxol细胞正常消化后,计数,分别以每孔1×10
实验结果表明:不同浓度的纯化部位I(2.5、5、10μg/mL)对细胞内ROS水平有显著影响,如图3所示;跟亲本细胞组相比,HCT-8/Taxol耐药株中ROS含量明显增加,纯化部位I处理后,耐药细胞系的ROS水平显著降低。跟对照组相比,联合用药组HCT-8/Taxol细胞中ROS水平显著降低(
实施例8
对叶大戟大环二萜类组分在HCT-8/Taxol细胞凋亡的影响:
将处于对数生长期的HCT-8/Taxol细胞正常消化后,计数,分别以每孔1×10
实验结果表明:纯化部位I单独处理耐药细胞或与PTX联合处理耐药细胞48h后,通过FITC-annexinⅤ/PI染色,使用流式细胞术分析HCT-8/T细胞中纯化部位I诱导的细胞凋亡。
如图4和表4所示;
表4大环二萜类组分对HCT-8/Taxol细胞凋亡的影响
给药后48h后联合给药组的凋亡细胞(晚期和早期凋亡)比例显著增加,分别由对照组2.3%增加到了43.4%(p<0.001),相当于18.9倍,单独用PTX处理组几乎没有产生细胞毒性;阳性药VRP联合给药组细胞凋亡比例分别增加了29.2%。单独用纯化部位I处理的细胞凋亡并没有受到影响;可判断更低的浓度下的纯化部位I与PTX联合促进HCT-8/T细胞的凋亡,活性强于VRP 5μM(*P<0.05,**P<0.01,***P<0.001VS模型)。
- 大戟二萜类化合物合成基因CYP71D452、其编码的蛋白质与应用
- 大戟二萜类化合物合成基因CYP726A33、其编码的蛋白质与应用
- 一种对叶大戟果实中大环二萜类化合物组分的提取分离方法和用途
- 一种对叶大戟果实中大环二萜类化合物组分的提取分离方法和用途
