一种紫花苜蓿植物铁蛋白的表达纯化方法及其应用
文献发布时间:2023-06-19 10:10:17
技术领域
本发明涉及一种紫花苜蓿植物铁蛋白的表达纯化方法及其应用,属于植物铁蛋白技术领域。
背景技术
铁蛋白在生物体内具有维持体内铁的代谢平衡、清除铁介导的自由基反应、以及保护细胞免受氧化性损伤的作用。铁蛋白广泛存在于动物、植物和微生物中,每个铁蛋白内部最多可储存约4500个铁原子。铁蛋白通常由24个亚基自组装形成高度对称的笼状结构,内径和外径分别为8nm和12nm,厚度约为2nm。每分子的铁蛋白可以形成12个二重轴通道,8个三重轴通道,4个六重轴通道,这些通道控制着离子或小分子进出铁蛋白,联系内部空腔与外部环境。
动物铁蛋白纳米载体在癌症治疗、免疫检测、医学成像领域已取得了突破性进展。然而,目前对植物铁蛋白的研究尚未深入,植物铁蛋白分布广泛,主要存在质体中,与动物铁蛋白具有相同的起源,但植物铁蛋白的24个亚基均为H型,每个亚基都含有一个亚铁氧化中心,其中的H-1和H-2型亚基具有80%的氨基酸序列同源性。成熟植物铁蛋白的 N端有一段由约30个氨基酸组成的延伸肽,参与铁的氧化沉淀,诱导蛋白质的聚合,提高蛋白质的稳定性。若能将植物铁蛋白表达纯化,则具有广阔的应用前景,然而由于不同植物铁蛋白个体性能上的差异,导致表达纯化的条件上存在根本性差异。
发明内容
本发明提供一种紫花苜蓿植物铁蛋白的表达纯化方法,紫花苜蓿植物铁蛋白呈球形笼状结构,水溶性好,热稳定好,是一种可用于生物活性物质及药物递送的新型纳米载体。
为解决上述技术问题,本发明所采用的技术方案如下:
一种紫花苜蓿植物铁蛋白的表达纯化方法,包括重组表达质粒、重组蛋白的表达和蛋白的纯化;重组表达质粒时,所用质粒为pET-20b(+)质粒,将紫花苜蓿植物铁蛋白基因序列克隆至pET-20b(+)质粒的NdeI和XhoI酶切位点之间,得含目的基因的重组质粒。
紫花苜蓿植物铁蛋白来源于紫花苜蓿。
紫花苜蓿植物铁蛋白的编码基因序列为SEQ ID No.1所示的核苷酸序列;紫花苜蓿植物铁蛋白的编码蛋白为SEQ ID No.2所示的氨基酸序列。
为了提高产品的得率和效率,重组蛋白的表达为,在42±2℃的条件下,将重组质粒热激转化至大肠杆菌宿主细胞BL21(DE3)中,从平板上挑取单菌落于TB培养基中扩大培养OD600=1.8,经IPTG诱导后,离心收集菌体沉淀,再将菌体沉淀用缓冲液重悬、超声破碎、离心后,得到的上清液即为紫花苜蓿植物铁蛋白的粗产品,其中,重悬所用缓冲液 pH=8,组成为:20mM Tris(三羟甲基氨基甲烷),500mM NaCl,0.5%Triton X-100(聚乙二醇辛苯基醚),2mM DTT(二硫苏糖醇)。
本申请%,没有特别说明的情况下,指体积百分比。
为了提高产品的得率,扩大培养于含氨苄青霉素的TB培养基中培养,其中,菌液按照1%的比例接种于TB培养基中,扩大培养时的温度为37±2℃,转速为210±10r/min。
优选,IPTG的诱导终浓度为1±0.02mM,诱导温度为25±2℃,转速为200±10r/min,诱导终时间为16±1h。当诱导温度更换为30℃,诱导终浓度为5mM时,表达出的蛋白为包涵体,不可溶。
为了提高产品的得率,超声破碎的条件为:在功率为960W的条件下,每超声5±1s,停5±1s,总时长为30±2min;超声破碎后的离心条件为:8000×g,离心30min。
为了提高产品的纯度和得率,蛋白的纯化时,采用镍柱亲和层析对目的蛋白进行纯化。进一步优选,上述蛋白的纯化,包括如下步骤:
A、将预装镍柱用10±1倍柱体积的无菌水清洗两次,再用10±1倍柱体积的结合缓冲液(20mM Tris,500mM NaCl,pH=8)平衡镍柱;
B、将蛋白粗品过0.45μm滤膜后,与Ni-NTA树脂结合,置于旋转培养器中,在4 ±1℃环境中孵育55~65min,使目的蛋白与镍柱充分结合;
C、用5±0.1mM咪唑(pH=6.3)洗除杂蛋白,接着用洗脱液(20mM Tris,500mMNaCl, 250mM咪唑,pH=8)洗脱目的蛋白,再用体积排阻色谱纯化,得到纯紫花苜蓿重组植物铁蛋白。
上述所得紫花苜蓿重组植物蛋白可作为生物活性物质及药物递送的新型纳米载体。尤其可用于二氢黄酮类化合物的装载。
紫花苜蓿重组植物铁蛋白对二氢黄酮类化合物装载的方法,包括如下步骤:
A、将二氢黄酮类化合物溶于无水乙醇制备成母液;
B、在步骤8得到的紫花苜蓿植物蛋白中添加尿素避光孵育2±0.3h,得蛋白溶液;
C、步骤A的母液加入到步骤B所得的蛋白溶液中,4℃条件下避光搅拌搅拌约30 ±5min,然后将溶液转移至透析袋中,透析除去尿素和未结合的二氢黄酮化合物分子,离心后,得到的澄清透明溶液为紫花苜蓿重组植物蛋白-黄酮类复合物。
本发明未提及的技术均参照现有技术。
本发明紫花苜蓿植物铁蛋白的表达纯化方法,得到的紫花苜蓿植物铁蛋白呈球形笼状结构,分子量约为28kDa,直径约为12±0.5nm,水溶性好、热力学稳定性高,分散均一;作为一种新型的植物铁蛋白,为生物活性物水溶性、稳定性和生物利用度等的提高,提供了一种新型纳米载体,在食品、医疗、保健等方面有良好的应用前景,具有很高的应用价值。
附图说明
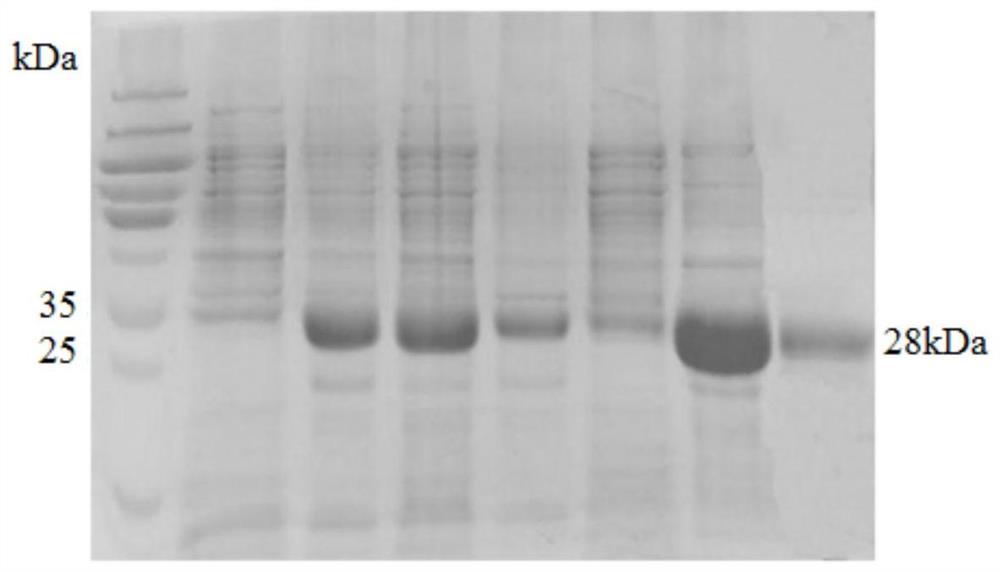
图1为紫花苜蓿植物铁蛋白的聚丙烯酰胺凝胶电泳图(SDS-PAGE)(泳道1为Protein Marker,泳道2为IPTG诱导前,泳道3为IPTG诱导后,泳道4为破碎上清液,泳道5 为破碎沉淀;泳道6为5mM咪唑洗脱液,泳道7为250mM洗脱液,泳道8为体积排阻色谱纯化后的纯蛋白);
图2为紫花苜蓿铁蛋白的透射电镜图(TEM);
图3为通过圆二色谱测得的紫花苜蓿铁蛋白的温度变化曲线图;
图4为紫花苜蓿铁蛋白包封柚皮素的液相色谱图;
图5为柚皮素被包封前后的水溶性比较图(左图为柚皮素的水溶液,右图为紫花苜蓿铁蛋白装载柚皮素的水溶液)。
具体实施方式
为了更好地理解本发明,下面结合实施例进一步阐明本发明的内容,但本发明的内容不仅仅局限于下面的实施例。
实施例1
紫花苜蓿的植物铁蛋白具有SEQ ID.NO.1所示的核苷酸序列,具有SEQ ID.NO.2所示的氨基酸序列。
上述紫花苜蓿铁蛋白的表达纯化方法,包括以下步骤:
(1)构建重组表达质粒:
从Gene Bank中找到来源于紫花苜蓿植物的铁蛋白基因编码序列(CAA65771),并将该基因序列插入到pET-20b(+)质粒的NdeI和XhoI酶切位点之间(由上海捷瑞生物工程有限公司合成),获得含目的基因的质粒,将其42℃热激转化至大肠杆菌宿主细胞 BL21(DE3)中,获得重组蛋白的基因工程菌。
(2)重组蛋白的表达:
挑取单菌落按照1%的比例接种于5mL LB培养基中,加入5μL 100mg/mL氨苄青霉素,210r/min,37℃,振荡12h;将所得菌液按照1%的比例接种于200mL的TB培养基中,加入200μL的氨苄青霉素,37℃,210r/min下培养,当菌液的OD
(3)蛋白粗品的制备和可溶性鉴定:
将步骤(2)所得菌液8000×g离心5min后,收集菌体沉淀,沉淀用缓冲液(20mMTris,500mM NaCl,0.5%Triton X-100,2mM DTT,pH=8)重悬,接着进行超声破碎(超声条件:功率960W,超声5s,间隔5s,时长30min),然后8000×g离心30min分离上清和沉淀,分离出的上清即为紫花苜蓿铁蛋白的粗品,分别取上清和沉淀经SDS-PAGE 电泳检测,结果如图1所示,破碎上清中出现目标条带,说明紫花苜蓿植物铁蛋白为可溶性。
(4)蛋白的纯化:
由于目的重组蛋白含有组氨酸标签,采用镍柱亲和层析法对目的蛋白进行纯化。将 2mL的预装镍柱用10倍柱体积的无菌水清洗两次,再用10倍柱体积的结合缓冲液(20mMTris,500mMNaCl,pH=8)平衡镍柱,将离心后的上清液过0.45μm滤膜后与 Ni-NTA树脂结合,置于旋转培养器中,在4℃环境中孵育1h使目的蛋白与镍柱充分结合;分别用5mM咪唑、10mM咪唑(pH=6.3)洗除杂蛋白,接着用洗脱液(20mM Tris,500mM NaCl,250mM咪唑,pH=8)洗脱目的蛋白。收集不同咪唑洗脱液,用聚丙烯酰胺凝胶电泳(SDS-PAGE)验证,结果如图1所示,5mM咪唑可有效去除杂蛋白,目的蛋白可以在 250mM咪唑下被洗脱。选取蛋白胶上目的条带最多的样品,3000×g超滤置换至Tris-NaCl 溶液中,接着用体积排阻纯化得到纯紫花苜蓿植物铁蛋白,结果如图1所示,根据 SDS-PAGE确定其分子量约为28kDa,与理论分子量一致;图2的透射电镜图可以证明紫花苜蓿铁蛋白为球形笼状结构,直径为12±0.5nm;图3为通过圆二色谱测试蛋白样品熔点T
根据计算称取0.4mg柚皮素溶于40μL无水乙醇中制备成母液。将步骤(4)所得的紫花苜蓿铁蛋白的溶液(1μM,pH=8,5mL)置于10mL离心管中,加入60μL的1M尿素至尿素终浓度为14.9mM,4℃避光孵育2h,得蛋白溶液。接着,将制备的母液缓慢到滴加蛋白溶液中,边滴边搅拌,4℃条件下避光搅拌约30min。将溶液转移至透析袋(10kDa) 中,用0.1M PBS缓冲液4℃条件下透析24h,隔6h更换一次缓冲液,充分除去尿素和未结合的柚皮素分子。最后,将溶液离心5min,转速5000×g除去残余的未结合分子,过 0.22μm滤膜后得到澄清透明的溶液(柚皮素-铁蛋白复合物),图4为液相色谱图,出峰时间为5.07min,与柚皮素分子的出峰位置相同,根据柚皮素标准曲线方程计算,紫花苜蓿铁蛋白装载了253个柚皮素分子;图5对柚皮素和柚皮素-铁蛋白复合物的水溶性进行比较,可以看出左图柚皮素在水溶液中几乎不溶,而被装载进入铁蛋白笼内后,得到澄清透明的溶液(图5右图所示),因此,紫花苜蓿铁蛋白提高了柚皮素的水溶性。
SEQUENCE LISTING
<110> 南京林业大学
<120> 一种紫花苜蓿植物铁蛋白的表达纯化方法
<130> 2020
<160> 2
<170> PatentIn version 3.5
<210> 1
<211> 750
<212> DNA
<213> 人工序列
<400> 1
atggccctga gcgcctctaa agtgagtatt tttagtccca gcccgattgt gggtcatttt 60
agcaaaaata ccacctttag tagcttaaat ctgccgatgg atggtgataa acgcaaaaat 120
gttaaagttc atgcagccgc agccaatgcc ccgaccgccc tgaccggcgt tatttttgaa 180
ccgtttgaag aagttaaaaa agatgtgctg gccgttccga ttgcacataa tgtgtcttta 240
gcacgtcaga attatcagga tgaagtggaa tcagccatta atgaacagat taatgtggaa 300
tataatgtga gctatgtgta tcattctctg tttgcctatt ttgatcgtga taatgttgcc 360
ctgaaaggct tagccaaatt ttttaaagaa tctagcgaag aagaacgcga acatgccgaa 420
aaactgatga aatatcagaa tattcgcggc ggtcgcgtgg tgctgcatcc gattgtgtca 480
ccgccgagcg aatttgatca tgcagaaaaa ggtgatgcac tgtatgcgat ggaactggca 540
ctgtctctgg aaaaactggt taatgaaaaa ctgctgaatg ttcatagtgt tgcagatcgt 600
aataatgatc cgcagctggc caattttatt gaaagcgaat ttctggtgga acaggttgaa 660
tctattaaaa aaattagcga atatgttacc cagttacgct tagtgggcaa aggtcatggc 720
gtttggcatt ttgatcagac cttattacat 750
<210> 2
<211> 250
<212> PRT
<213> 人工序列
<400> 2
Met Ala Leu Ser Ala Ser Lys Val Ser Ile Phe Ser Pro Ser Pro Ile
1 5 10 15
Val Gly His Phe Ser Lys Asn Thr Thr Phe Ser Ser Leu Asn Leu Pro
20 25 30
Met Asp Gly Asp Lys Arg Lys Asn Val Lys Val His Ala Ala Ala Ala
35 40 45
Asn Ala Pro Thr Ala Leu Thr Gly Val Ile Phe Glu Pro Phe Glu Glu
50 55 60
Val Lys Lys Asp Val Leu Ala Val Pro Ile Ala His Asn Val Ser Leu
65 70 75 80
Ala Arg Gln Asn Tyr Gln Asp Glu Val Glu Ser Ala Ile Asn Glu Gln
85 90 95
Ile Asn Val Glu Tyr Asn Val Ser Tyr Val Tyr His Ser Leu Phe Ala
100 105 110
Tyr Phe Asp Arg Asp Asn Val Ala Leu Lys Gly Leu Ala Lys Phe Phe
115 120 125
Lys Glu Ser Ser Glu Glu Glu Arg Glu His Ala Glu Lys Leu Met Lys
130 135 140
Tyr Gln Asn Ile Arg Gly Gly Arg Val Val Leu His Pro Ile Val Ser
145 150 155 160
Pro Pro Ser Glu Phe Asp His Ala Glu Lys Gly Asp Ala Leu Tyr Ala
165 170 175
Met Glu Leu Ala Leu Ser Leu Glu Lys Leu Val Asn Glu Lys Leu Leu
180 185 190
Asn Val His Ser Val Ala Asp Arg Asn Asn Asp Pro Gln Leu Ala Asn
195 200 205
Phe Ile Glu Ser Glu Phe Leu Val Glu Gln Val Glu Ser Ile Lys Lys
210 215 220
Ile Ser Glu Tyr Val Thr Gln Leu Arg Leu Val Gly Lys Gly His Gly
225 230 235 240
Val Trp His Phe Asp Gln Thr Leu Leu His
245 250
- 一种紫花苜蓿植物铁蛋白的表达纯化方法及其应用
- 一种绿藻植物铁蛋白的表达纯化方法及其应用
