中性粒细胞驱动的炎症性病理的治疗方法
文献发布时间:2024-04-18 19:52:40
相关申请的交叉引用
本申请要求于2020年7月28日提交的美国临时专利申请第63/057,741号的权益,其内容通过引用整体并入本文。
通过引用并入以电子方式提交的材料
与本文同时提交的计算机可读核苷酸/氨基酸序列表通过引用整体并入本文,并标识如下:名称为“Seq_List”的3655字节的ASCII(文本)文件,创建于2021年6月23日。
技术领域
本发明涉及用治疗肽治疗由中性粒细胞过度浸润引起的上皮组织炎症性疾病,如特应性皮炎(湿疹)、银屑病和哮喘。
背景技术
本文档描述了中性粒细胞驱动的炎症性疾病(例如特应性皮炎(AD,其涵盖湿疹和寻常型鱼鳞病)、银屑病和哮喘)的独特而有效的治疗。
特应性皮炎(AD,湿疹)是最常见的炎症性疾患之一,影响多达20%的儿童,发病年龄为3至5个月,并影响10%的成人(Langan等人,2020;Bitton等人,2020)。国家之间发病率不同,美国为4.9%,日本为2.1%,但瑞典为20%(Urban等人,2021)。全世界有超过2.3亿人经历湿疹。大约2%的世界人口(>1.25亿人)受到银屑病的影响,银屑病是一种免疫原性疾病,在重度病例中影响身体超过10%(Lowes等人,2014;Chiang等人,2019)。AD中最强的遗传风险因素是编码丝聚蛋白的基因突变,尽管只有20%至40%的患者具有FLG功能缺失突变(Smith等人,2006)。其它遗传因素和环境因素导致大多数病例。与AD相反,银屑病在生命中出现较晚,通常是成年早期,并且不会随着年龄的增长而改善(Guttman-Yassky等人,2011)。这些疾病对患者及其家庭的生活质量的影响是深远的和多方面的。
AD的一线治疗(特别是用于儿童)包括局部皮质类固醇和保湿剂以减轻炎症。以IL-4和IL-13为主导因子的2型免疫反应是炎症的主要驱动因素。皮下注射单克隆抗体(度普利尤单抗(dupilumab))对每隔一周接受一次剂量的患者有效(Hamilton等人,2015;Harb和Chatila,2020)。该抗体与IL-4Rα结合,IL-4Rα是IL-4和IL-13受体的共同亚基,其介导T
目前为实现有效治疗而开展的活动表明,需要特异性针对AD和银屑病的疗法,这将减轻这种疾病造成的全球医疗保健费用负担和发病率。因此,需要更有效的AD治疗方法。
发明内容
本发明涉及一种治疗患有中性粒细胞驱动的炎症性疾病的患者的方法,所述方法包括:向患者施用包含至少两个拷贝的治疗肽的多价结构多肽;其中所述治疗肽的序列由序列X
在一些方面,治疗肽作为谷氨酰胺转移酶的底物以诱导角质层的交联,恢复表皮屏障,并保护患者免受环境病原体和过敏原的侵害。
在其它方面,所述方法进一步包括将患者鉴定为患有中性粒细胞驱动的炎症性疾病。在一方面,中性粒细胞驱动的炎症性疾病是特应性皮炎(AD)、银屑病或哮喘。在另一方面,中性粒细胞驱动的炎症性疾病是AD。
在一些方面,X
在又其它方面,多价结构多肽具有中心框架、接头序列和至少两个臂,其中每个臂包含治疗肽,并且每个臂通过接头序列连接至中心框架。在某些方面,接头序列选自:GGGS(SEQ ID NO:3)、GGGSGGGS(SEQ ID NO:4)、SSSS(SEQ ID NO:5)和SSSSSSSS(SEQ ID NO:6)。在一方面,多价结构多肽是四价的。在另一方面,多价结构多肽包含svL4(SEQ ID NO:7)或由其组成。
在一些方面,多价结构多肽包含至少两个包含VQATQSNQHTPR(SEQ ID NO:1)的治疗肽和至少一个包含NPSHPLSG(SEQ ID NO:2)的治疗肽。
在其它方面,局部施用治疗肽。在一些方面,将多价结构多肽施用于存在皮炎的区域。
在又其它方面,所述方法进一步包括向患者施用至少一种局部皮质类固醇和/或至少一种单克隆抗体。在一方面,至少一种局部皮质类固醇选自曲安奈德、氢化可的松及其组合。在另一方面,至少一种单克隆抗体选自度普利尤单抗、奈莫利珠单抗(nemolizumab)、苏金单抗(secukinumab)及其组合。
在某些方面,本发明涉及一种试剂盒,其包含:包含至少两个拷贝的治疗肽的多价结构多肽;其中所述治疗肽的序列由序列X
在一些方面,X
在一些方面,试剂盒进一步包含至少一种局部皮质类固醇和/或至少一种单克隆抗体。在一方面,至少一种局部皮质类固醇选自曲安奈德、氢化可的松及其组合;和/或至少一种单克隆抗体选自度普利尤单抗、奈莫利珠单抗、苏金单抗及其组合。
在其它方面,本发明涉及一种药物组合物,其包含:包含至少两个拷贝的治疗肽的多价结构多肽;其中所述治疗肽的序列由序列X
在一方面,多价结构多肽包含svL4(SEQ ID NO:7)或由其组成。
在一些方面,第二药物干预包括选自曲安奈德、氢化可的松及其组合的局部皮质类固醇。
在其它方面,第二药物干预包括选自度普利尤单抗、奈莫利珠单抗、苏金单抗及其组合的可注射单克隆抗体。
附图说明
本专利或申请文件含有至少一幅彩色附图。根据要求及支付必要的费用,官方将提供带有彩色附图的本专利或专利申请公布的副本。
图1A、图1B和图1C描绘了原始态
图2A-图2F描绘了用svL4处理期间皮肤的形态变化。在为期14天的研究结束时获得图像。脱毛导致(图2A)厚表皮和(图2B)病变下方真皮中有丰富的中性粒细胞。每3天用1% SDS处理2h,随后将LPS添加至每日PBS敷料中,导致(图2C)厚表皮内频繁的坏死性病变和(图2D)中性粒细胞的频率非常高。含LPS的敷料中包含1μM svL4导致(图2E)形态正常,薄表皮,真皮中的胶原蛋白更强烈染色,真皮(图2F)基本上没有中性粒细胞。标尺代表100μm。
图3A和图3B描绘了图2A-图2F所示图像的图形表示。图3A描绘了沿每只动物皮肤切片的10个部位测量的表皮厚度(每组n=4)。图3B描绘了如图3A所分析的每只动物的真皮切片的5个独立划界的区域内中性粒细胞的计数。误差棒表示±S.E.M.。
图4A-图2H描绘了用葡萄球菌肠毒素B(SEB)和屋尘螨提取物(HDM)诱导皮炎后用2μM svL4处理5天的皮肤切片。图4A、图4C、图4E和图4G描绘了用抗Ly6G染色的切片以揭示中性粒细胞的数量。图4B、图4D、图4F和图4H描绘了用抗CD301b染色的切片。图4A和图4B描绘了来自诱导皮炎后用PBS处理的同一动物的切片,揭示了表皮和下层真皮中广泛的坏死和密集的中性粒细胞群体。图4C和图4D描绘了来自用svL4处理的同一动物的切片,显示表皮略微增厚,真皮中有许多CD301b
图5描绘了SDS以及SDS加svL4对脱毛动物皮肤提取物中细胞因子的量的影响。在第0天、第2天和第5天制备对照提取物(方形)。在第0天和第3天用1% SDS处理皮肤2h。在第一次用SDS处理后4h以及第2天和第5天制备提取物(三角形),或在除了SDS以外还用PBS中的1μM svL4处理后制备提取物(圆形)。
图6描绘了大鼠中svL4的毒代动力学曲线。以12.5μmol/kg体重的剂量静脉内注射肽svL4后,svL4血清浓度的变化显示于线性轴(顶部)和基于对数的曲线(底部)上。
图7A和图7B描绘了与较短的(5-mer)肽sv6B(圆形)相比,以12.5μmol/kg体重的剂量静脉内注射肽svH1C(方形)后血清浓度的变化。图7A描绘了线性标度的曲线。图7B描绘了基于对数的轴上的曲线。
图8A和图8B描绘了svL4作为谷氨酰胺转移酶(TGase2)底物的测定。使用猪肝脏谷氨酰胺转移酶和作为受体(acceptor)的聚赖氨酸在微量滴定孔中进行反应。在略有不同的条件下进行了4次测定,但结果相同。图8A描绘了反应程度作为含有0.1M Tris HCl(pH7.5)缓冲液和10mM CaCl
图9A至图9C描绘了四价肽svH1C(SEQ ID NO:9)(图9A)、sv6D(SEQ ID NO:8)(图9B)和svL4(SEQ ID NO:7)(图9C)的结构。
图10描绘了四价肽svL4的臂的空间填充模型,其中两个暴露的谷氨酰胺残基用圆圈标识。
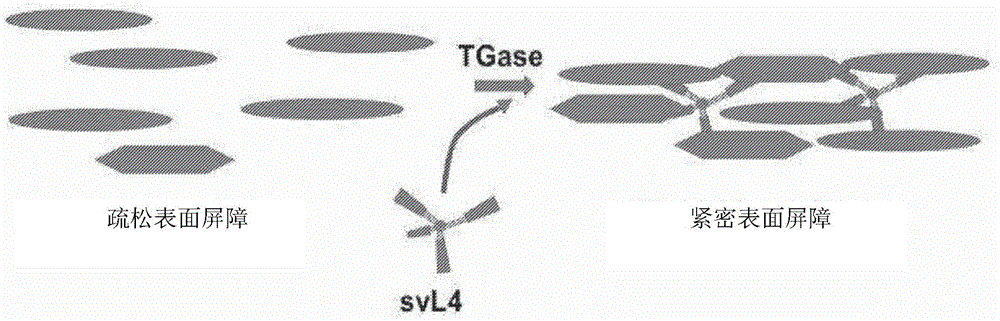
图11描绘了在谷氨酰胺转移酶的催化下,将多价肽与多种蛋白质和/或细胞交联以形成紧密的表皮表面屏障的效果,所述表皮表面屏障的功能是保护个体免受环境病原体和过敏原的侵害。
具体实施方式
在本发明的某些方面,我们描述了通过应用多价肽svL4作为谷氨酰胺转移酶(TGase)的功能底物来局部治疗特应性皮炎。svL4提供的额外交联能力允许闭合病变并修复表皮表面屏障。在每三天用1% SDS作为渗透增强剂处理2小时后用脂多糖(LPS)在脱毛小鼠皮肤上诱导皮炎。刺激物导致表皮增厚、许多坏死性病变以及病变下方真皮中丰富的中性粒细胞。当局部治疗中包含svL4时,真皮中的中性粒细胞基本上不存在,并且在治疗14天后皮肤恢复正常形态。用屋尘螨提取物和葡萄球菌肠毒素B诱导皮炎后,用svL4处理5天导致部分消退,大部分为薄表皮,只有少数小病变,真皮基底或皮下中性粒细胞的频率低。svL4是N-乙酰半乳糖胺的模拟物,潜在地与鼠C型凝集素受体MGL2(CD301b)结合,所述鼠C型凝集素受体MGL2是人CLEC10A的直系同源物,由真皮中的树突状细胞(DC)和巨噬细胞表达。然而,表明消退机制的svL4的唯一特征是四价肽每个臂的N-末端半部中的两个谷氨酰胺残基(见图10)。这些谷氨酰胺残基是TGase的底物。因此,在一些方面,通过多功能底物svL4提供的激活TGase活性来恢复表皮屏障功能,恢复表皮形态并减少真皮中的中性粒细胞。这些数据支持svL4是一种适合于临床用途的小分子药物。
小鼠皮肤广泛用于模拟AD的治疗(Jin等人,2009;Martel等人,2017)。小鼠表达两种C型巨噬细胞半乳糖型凝集素同系物(Higashi等人,2002),半乳糖(Gal)特异性CD301a(MGL1)在巨噬细胞中表达最强烈,CD301b(MGL2)是人N-乙酰半乳糖胺(GalNAc)特异性C型凝集素受体CLEC10A(CD301)的小鼠直系同源物,CLEC10A是CD1c
我们启动了研究以确定CD301b的小分子配体是否会实现AD的消退。我们测试了肽svL4和sv6D是否有效减少LPS诱导的小鼠皮肤炎症。我们发现局部应用1μM svL4比0.1μMsvL4或1μM sv6D更有效。两者都是碱性肽,在角质层的酸性表面带10至12的正电荷(Behne等人,2002;Hanson等人,2002)。一个可能的区别因素是亲水性指数(Hopp和Woods,1981),sv6D为0.4,但svL4为0.1。svL4的高正电荷和降低的亲水性可以促进易位至具有净负电荷的皮肤中(Nguyen和Soulika,2019)。然而,这项研究中出现的特别重要的特征是存在于肽每个臂的N-末端附近的两个谷氨酰胺残基的作用。
在一些方面,本发明涉及一种在患者中治疗中性粒细胞驱动的炎症性疾病的方法。中性粒细胞驱动的炎症性疾病可以是呼吸系统病症或皮肤病症。
在一些实施方案中,向患者施用包含治疗肽的多价结构多肽。在一些方面,多价结构多肽包含至少两个拷贝的治疗肽。在一些实施方案中,多价结构多肽包含至少两种不同的治疗肽。在某些实施方案中,多价结构多肽具有中心框架、接头序列和至少两个臂。每个臂包含一个治疗肽,每个臂通过接头序列连接至中心框架。在某些实施方案中,多价结构多肽的每个臂包含相同的治疗肽。在其它实施方案中,多价结构多肽的臂不包含相同的治疗肽。在具体的实施方案中,多价结构多肽具有四个臂,因此是四价的。在一些方面,接头序列具有包含GGGS(SEQ ID NO:3)、GGGSGGGS(SEQ ID NO:4)、SSSS(SEQ ID NO:5)或SSSSSSSS(SEQ ID NO:6)的序列。
在某些实施方案中,多价结构多肽是四价的。在一个示例性实施方案中,多价结构多肽是svL4(SEQ ID NO:7),其包含四个臂,每个臂包含由VQATQSNQHTPR(SEQ ID NO:1)组成的治疗肽。
所述方法可以进一步包括向患者施用用于治疗中性粒细胞驱动的炎症性疾病的第二药物干预,例如类固醇或单克隆抗体。在一些方面,单克隆抗体靶向炎性细胞因子以减少炎症性途径的激活。
还描述了用于在患者中治疗中性粒细胞驱动的炎症性疾病的组合物和试剂盒。组合物包含本文所述的治疗肽或多价结构多肽。在一些实施方案中,组合物进一步包含用于治疗中性粒细胞驱动的炎症性疾病的第二药物干预。例如,第二药物干预是类固醇或单克隆抗体。在一些方面,单克隆抗体靶向炎性细胞因子以减少炎症性途径的激活。试剂盒包含教导施用治疗肽或多价结构多肽的说明书。
特别令人痛苦的炎症性疾病影响肺部,从而影响患者有效呼吸的能力。不幸地,呼吸系统的持续炎症频繁地导致一些不良疾病,如哮喘、COPD和肺纤维化。事实上,认为发炎的肺中的中性粒细胞浸润是急性呼吸窘迫综合征(ARDS)的标志。
哮喘、ARDS、COPD和冠状病毒引起的病毒感染具有严重后果,这一直是鉴定用于治疗的药物的重大努力的动机。在这些病症中,已经将中性粒细胞浸润至肺组织中鉴定为炎症的主要原因。已经针对ARDS测试了大量药物,其中许多被批准用于临床,其它则正在开发中。已经批准将一些用于治疗炎症性呼吸系统病症的单克隆抗体用于其它用途,如AD和银屑病。因此,在某些实施方案中,在患者中治疗中性粒细胞驱动的炎症性疾病的方法进一步包括向受试者施用第二药物干预。在一些方面,第二药物干预是靶向炎症性途径的单克隆抗体或白三烯调节剂。有趣地,皮质类固醇在这些病症中是促炎的,不适合作为治疗剂。为了改善患者的呼吸容易性,第二药物干预可以是β受体激动剂、白三烯调节剂、色甘酸钠或茶碱。
在具体的实施方案中,通过吸入向患者施用治疗肽或所描述的组合物。因此,包含施用于患者的治疗肽的组合物可以被雾化或是干粉的形式。当组合物包含液体形式的治疗肽时,通过雾化器递送组合物,使得可以通过吸入施用治疗肽。
Sanofi开发了一种针对IL-4和IL-13受体的单克隆抗体度普利尤单抗(Dupixent),其成功治疗皮疹、哮喘和重度特应性湿疹。度普利尤单抗已成为过敏性疾病(包括湿疹)的最成功的疗法。该抗体与IL-4Rα结合,IL-4Rα是IL-4和IL-13受体的共同亚基,其介导T
FDA批准用于治疗皮炎的另一种药物是克立硼罗,它也降低IL-4的作用。克立硼罗是磷酸二酯酶-4的小分子抑制剂,其降低环AMP的水平,从而减少IL-2、IL-4和IL-31的释放,因此减少T细胞的增殖。其它用于治疗皮炎的小分子治疗药物包括基于大环内酯的钙调磷酸酶抑制剂,如吡美莫司和他克莫司。尽管广泛的全身性免疫抑制剂环孢菌素有效治疗AD,但尚未在美国或欧洲获得用于该目的的许可。
已经研究了将数种肽用于治疗AD。奥米加南(Omiganan)是一种12-mer抗菌肽,其减少皮肤上的金黄色葡萄球菌(Staphylococcus aureus)群体,但没有观察到临床改善。CXCR4是SDF-1(基质细胞衍生因子-1,CXCL12)的受体,在特应性皮炎中过表达。发现一种血清白蛋白的降解片段的12-mer衍生物结合CXCR4,是一种局部应用于小鼠皮肤的有效治疗剂。该肽有望破坏参与癌症和炎症性疾病的CXCR4/CXCL12信号传导。一些绿色蔬菜中色氨酸代谢的小分子产物3,3’-二吲哚甲烷通过转录因子NF-κB抑制信号传导并促进调节性T细胞的分化。数项研究报告了JAK1和JAK2抑制剂(如乌帕替尼(upadacitinib)和芦可替尼(ruxolitinib))减少炎症。然而,JAK1和Tyk2响应IL-10与其受体的结合而激活STAT3,这导致NF-κB的抑制和促炎基因的相关表达。因此,抑制JAK1和JAK2似乎与抗炎目标相反。IL-10对JAK1的激活也通过抑制STAT6的激活来抑制响应IL-4和IL-13的基因的表达。特别令人感兴趣的是,发现将非致病性革兰氏阴性线状透明颤菌(Vitreoscilla filiformis)应用于小鼠皮肤会激活DC以产生IL-10,并抑制NC/Nga小鼠特应性皮炎中T
在一些方面,将第二治疗剂与本文公开的肽组合(即同时或随后施用于受试者)。这些第二治疗剂包括皮质类固醇、倍他米松、他克莫司、吡美莫司、窄谱UVB、PDE4抑制剂、托法替尼(tofacitinib)、度普利尤单抗和奈莫利珠单抗。在非常具体的实施方案中,第二治疗剂是倍他米松、吡美莫司或度普利尤单抗。
银屑病皮肤表征为高表达IL-17A和IL-17F,它们参与中性粒细胞的积累。针对IL-17A的单克隆抗体在约50%的银屑病患者中显示出令人印象深刻的临床疗效。使用中和IL-17C的抗体(指定为MOR106)的临床研究由于治疗AD无效而被放弃。然而,抗IL-17抗体(如苏金单抗(Cosentyx,Novartis)、依奇珠单抗(ixekizumab)(Taltz,Lilly)和柏达鲁单抗(brodalumab)(Siliq,Ortho Dermatologics)在大约一半的受治疗患者中显示出疗效。在过去几年中已经开发了针对IL-23的抗体来治疗银屑病。古塞库单抗(Guselkumab)(Janssen)和替曲吉珠单抗(tildrakizumab)(Ilumetri,Sun Pharmaceuticals)已被FDA批准。其它抗体(如乌司奴单抗(ustekinumab)(Janssen)、瑞莎珠单抗(risankizumab)(Abbvie)和米吉珠单抗(minkizumab)(Lilly))正在临床试验中。这些抗体中的大多数结合IL-23复合物的亚基p19。类似的抗体正在开发中,这些抗体具有引起显著的免疫失衡或对危险信号的反应受损的可能性。
为了治疗皮肤病症,优选将治疗肽或多价结构多肽局部施用于据信存在皮肤病症的区域。在一些方面,通过皮下注射施用治疗肽或多价结构多肽。在其它方面,通过局部应用来局部施用治疗肽或多价结构多肽。在局部应用治疗肽或多价结构多肽的某些方面,将肽掺入乳膏、软膏或洗剂中。在其它方面,将治疗肽溶解至用于局部应用的载体溶剂中。在某些方面,将肽应用于放置在据信存在皮肤病症的区域上的纱布或绷带。
在一些方面,治疗与中性粒细胞浸润相关的皮肤病症(例如AD、湿疹或银屑病)的方法进一步包括向患者施用第二药物干预。第二药物干预可以是类固醇、喹啉衍生物、大环内酯类、硫唑嘌呤、环磷酰胺、环孢菌素A、或三环麻醉化合物、或靶向炎症性途径的药物(如单克隆抗体),其用作皮肤病症的现有治疗方法。在一些方面,类固醇是局部皮质类固醇,例如氢化可的松、曲安西龙、地塞米松、泼尼松及其衍生物、曲安奈德、倍他米松、氯倍他索、氟轻松、fluocinoline。一些第二药物干预是使用类固醇组合(例如曲安西龙和氢化可的松)的外用乳膏。靶向药物包括:减少IL-2产生的基于大环内酯的钙调磷酸酶抑制剂(吡美莫司,Eidel;和他克莫司,Protopic)、磷酸二酯酶-4抑制剂(克立硼罗,Eucrisa)和单克隆抗体(度普利尤单抗,Dupixent,抗IL-4受体单克隆抗体(mAb);和曲罗芦单抗(tralokinumab),抗IL-13mAb)。Dupixent与IL-4Rα亚基结合,抑制IL-4和IL-13的作用。抗体通过皮下注射递送,因此也作用于身体的其它组织,包括肺内膜。在一方面,同时施用治疗肽和一种或多种局部皮质类固醇。在其它方面,依次施用治疗肽和一种或多种局部皮质类固醇。
用于包含与中性粒细胞浸润相关的皮肤病症的组合物和试剂盒包含如本文所述的治疗肽或多价结构多肽。在一些实施方案中,组合物进一步包含用于治疗中性粒细胞驱动的炎症性疾病的第二药物干预。例如,第二药物干预是类固醇或单克隆抗体。在一些方面,单克隆抗体靶向炎性细胞因子以减少炎症性途径的激活。
通过以下实施例进一步说明本发明,这些实施例不应被解释为限制性的。本申请全文中引用的所有参考文献、专利和公开的专利申请的内容以及附图通过引用整体并入本文并用于所有目的。
实施例
实施例1.实验材料和方法
肽
先前描述了内毒素阴性的svL4和sv6D的合成和纯化(Eggink等人,2018)。
动物
研究在位于Watertown,MA的AAALAC认证设施Biomodels LLC进行。这项工作已经获得Biomodels IACUC的批准(方案号17-0613-4)。10周龄雌性C57BL/6J小鼠获自TheJackson Laboratory(Bar Harbor,ME)并饲养于Biomodels。在第-1天,用异氟烷麻醉小鼠,用电动剪刀并用Nair化学处理以对背部皮肤进行脱毛。然后用70%乙醇和PBS清洗皮肤。在第0天,再次麻醉小鼠,并用生物封闭敷料(Tegaderm)固定的1cm
用葡萄球菌肠毒素B(100μg,Toxin Technology,Inc.,Sarasota FL)和屋尘螨提取物(10μg,Greer Laboratories,Inc.,Lenoir,NC)进行了类似的实验,在用SDS处理2小时后将其应用于皮肤两天。进行第二次2天时间的SDS/过敏原处理。然后用PBS清洗皮肤,并继续SDS处理,在SDS处理之间应用2μM svL4,再持续5天。
组织学分析
在处理期结束时,通过吸入CO
皮肤处理和细胞因子分析
在冷冻后粉碎每只动物的一个皮肤样品,然后进行均质化以制成100mg/mL匀浆,离心以除去不溶性物质,并等分至96孔板中用于下游测定。使用小鼠TNFRSF14ELISA试剂盒(HVEM)(AbCam,货号:ab213892)评估HVEM。使用小鼠Periostin/OSF-2DuoSet ELISA(R&DSystems,货号:DY2955)评估periostin。使用小鼠PDGF-C ELISA试剂盒(MyBioSource,货号:MBS165969)评估PDGFc。使用小鼠/大鼠IGF-I/IGF-1DuoSet ELISA(R&D Systems,货号:DY791)评估IGF1。使用小鼠IL-24DuoSet ELISA(R&D Systems,货号:DY2786-05)评估IL-24。使用多重ProcartaPlex测定(ThermoFisher Scientific,货号:PPX-03)评估IL-10、IL-13和IL27。
谷氨酰胺转移酶测定
在聚赖氨酸包被的微量滴定孔中测试两种反应混合物(50μL)。第一种含有100mMTris HCl,pH 7.5、10mM CaCl
诱导皮炎
对Kanemaru等人(2019)描述的模型的修改旨在测试肽用于治疗AD的活性。在原始态且健康的小鼠皮肤中,表皮是薄的(图1A),存在非常少的Ly6G
我们发现,如Kanemura等人(2019)所述,每三天用4% SDS处理2小时对皮肤造成广泛损害。因此,将破坏人皮肤屏障功能的1% SDS(
实施例2.svL4或svH1C处理缓解特应性皮炎
由于真皮中的CD301b
病理报告表明,局部应用1μM svL4是克服对刺激物反应的唯一治疗(表1)。局部0.1μM svL4不如1μM svL4有效,表皮增厚,坏死性病变频繁(未显示)。有趣地,局部应用或皮下注射1μM sv6D(svL4的C-末端半部分)(Eggink等人,2018)是无效的。除了svL4以外的每种处理均观察到中性粒细胞的广泛浸润。尽管在皮下注射1μM svH1C后观察到皮炎水平有一些降低,真皮中性粒细胞丰度显著降低,但局部应用无效。
对于表1,对背部皮肤区域进行脱毛以提供1cm
表1.每种处理后皮肤的组织病理学参数
为了深入了解处理过程,在4天期间不用svL4而用200μL的常遇到的过敏原屋尘螨提取物(HDM,10μg)和葡萄球菌肠毒素B(SEB,100μg)的组合诱导皮炎(Kawakami等人,2007)。如先前实验中的那样,在每次用这些过敏原处理2天之前先用1%SDS处理2小时。用过敏原处理4天后,再用2μM svL4±1μM地塞米松处理皮肤5天,预计这将提供消退的中期阶段。与图3A和图3B中所示结果类似,在用HDM和SEB处理的动物的组织中,明显出现增厚的表皮和广泛的坏死性病变,并且下层具有密集的中性粒细胞群体(图4A)。用svL4处理使表皮厚度降低至接近正常,有表皮增厚的以及薄的区域,但只有少数小病变(图4C和图4D)。中性粒细胞在真皮中(特别是在病变下层)几乎不存在,或者在真皮基底或皮下区域以低频率存在(图4C)。用svL4加地塞米松处理的动物样品也获得了类似的结果(图4E和图4F)。与PBS相比,单独用地塞米松处理几乎没有改善,具有数个坏死性病变,侧边区域几乎没有中性粒细胞(图4G和图4H)。
在中性粒细胞的密度高的病变下层真皮中没有检测到CD301b
实施例3.svL4处理的细胞因子响应
为了确定其它因素是否可能在表皮炎症的消退中发挥作用,我们对被鉴定为在特应性皮炎和伤口愈合中很重要的数种关键细胞因子进行了调查。对于这项研究,将svL4局部应用于脱毛皮肤并用SDS处理,但没有LPS。在第一次用SDS处理2 h后4小时、2天后和5天后测量皮肤提取物中的细胞因子,并在第3天重复SDS处理。
IL-13在特应性皮炎的病变皮肤中发挥主导作用(Furue等人,2019;Bitton等人,2020)并上调periostin和IL-24(Mitamura等人,2020)。
在对照样品中,IL-13水平在对皮肤进行脱毛后2天增加,并在第5天保持高水平。在第0天和第2天,SDS暂时增加IL-13水平,但在第5天,SDS和svL4/SDS抑制IL-13水平,低于脱毛皮肤对照组的水平。Periostin介导IL-13对IL-24的诱导,IL-24是IL-10细胞因子家族的亚组IL-20家族的成员(Mitamura等人,2020)。虽然在第5天IL-13水平较低,但在SDS的作用的同时svL4/SDS处理继续增加periostin,这可能是IL-24增加的原因。IL-24水平在伤口中上调,并通过periostin介导IL-13的促炎和增殖作用,但在病毒感染中也具有免疫抑制作用(Mitamura等人,2020)。IL-20家族(包括IL-24)抑制IL-1β和IL-17A的产生(Mitamura等人,2020;Myles等人,2013),并且可能是抑制角质形成细胞增殖和伤口愈合的关键因子(Kolumam等人,2017;Menezes等人,2018),从而减少表皮厚度。在第2天的峰值后,IL-10的释放受到抑制(图5)。
肌成纤维细胞的脂肪细胞前体亚群的增殖是伤口愈合的基本过程,由CD301b
实施例4.急性毒性研究
10只雄性Hsd:Sprague
没有观察到与测试品相关的临床体征、体重或体重变化差异或食物消耗改变。在第9天,给予12.5μmol/kg/剂的雄性的血液学、凝血或临床化学测试结果中没有与测试品相关的作用。预定尸检时没有明显的肉眼病变。肽对终末体重没有作用,没有可明确归因于测试品的器官重量变化。
该初步毒性研究在与Covance Laboratories,Inc.的合同下进行,旨在证明安全边际。由于与静脉注射相比,皮下施用的肽的生物利用度较低,因此该研究应当提供提议的标准治疗剂量的至少1000倍的安全边际。使用2.5mL/kg的体积以12.5μmol/kg/剂将悬浮于载体对照品(在无菌无热原水中制备的标准PBS)中的肽svL4或svH1C施用于雄性大鼠具有良好的耐受性。没有表明与测试品相关的发现。
实施例5.肽的稳定性/强制降解分析
制造商报告肽的纯度为>95%,并得到独立确认。肽以干燥形式无限期稳定。纯化后,制备PBS或150mM NaCl中的肽溶液。当溶解于PBS中并在-20℃储存三年并偶尔解冻时,肽的质谱没有发生显著变化。与纯化后不久获得的谱图相比,svH1C在4℃储存1年后获得的质谱没有显示出显著劣化。svH1C的分子量为4594Da。发现svL4(分子量6826Da)也具有类似的稳定性。
在经过一组特定的严格条件后,通过质谱法评估合成产物的稳定性。由BlueStream Laboratories进行的强制降解研究的总结示于表2中。
关于svL4在血浆中的稳定性的研究表明,在室温经过48h在大鼠血浆中发生55%的损失,而在狗血浆中仅发生15%的损失。svH1C在大鼠和狗血浆中的稳定性表明,在室温经过48h在大鼠血浆中发生完全降解,而在狗血浆中发生92%的损失。对于生物分析样品,通过添加草酸钾、NaF和甲酸(2%)来防止血浆中肽的损失。
表2.最初溶解于PBS,pH 7.4中的肽在压力条件下的稳定性。
实施例6.谷氨酰胺转移酶(TGase)参与svL4皮炎消退
虽然svL4和sv6D是由DC和巨噬细胞表达的CD301b配体,并且CD301b
svL4提供TGase底物以增强角质层的交联从而恢复表皮屏障并缓解特应性皮炎
这些数据表明,svL4在AD恢复中的作用机制是提供TGase底物以增强角质层的交联并恢复表皮屏障功能。
已经鉴定了谷氨酰胺转氨酶同工酶1至6中每一种的序列特异性肽底物(Sugimura等人,2008;Fukui等人,2013;Tanabe等人,2019)。这些研究人员通过单个肽和蛋白质之间的共价异肽连接证明了酶的反应(Tanabe等人,2019)。然而,“单个”单价肽不会提供蛋白质的交联,而只会将肽附接至一个蛋白质。本文公开的多价结构多肽(例如svL4)的臂提供附接至多个蛋白质(即潜在地为四价结构的四个蛋白质)并使其交联。只有用作TGase底物的所公开的多价肽才能实现交联网状结构。因此,本发明提供了一种多价肽,其作为TGase交联活性的底物以恢复紧密的、功能性的表皮表面屏障。本技术的该重要特征示于图11中。
在鼠AD研究中,svL4恢复正常表皮形态的能力完全由四价肽每个臂的N-末端半部分的氨基酸提供,其中含有两个谷氨酰胺残基。谷氨酰胺残基提供了TGase的底物,我们提出肽的多臂结构允许在角质层蛋白质之间形成额外的交联。因此,我们提出这些事件描述了肽在恢复皮肤紧密屏障功能方面的作用机制。
我们探讨了CD301b的配体是否将提供有效的AD治疗。CD301a
表皮屏障的恢复有助于形成Ca
Ca
虽然具有低Ca
除非另有定义,否则本文中的所有技术和科学术语具有与本公开所属领域的普通技术人员通常理解的相同含义。尽管在本公开的实践或测试中可以使用与本文描述的那些相似或等效的任何方法和材料,但本文中描述了优选的方法和材料。引用的所有公布、专利和专利公布均出于所有目的通过引用整体并入本文。
所有标题都是为了方便读者,不应用于限制标题之后的文本的含义,除非如此说明。
提供本文讨论的公布仅用于在本申请提交日期之前进行公开。本文中的任何内容均不得解释为承认本发明无权根据在先发明提前进行此类公布。
虽然已经结合其具体实施例描述了本发明,但将理解的是,本发明能够进一步修改,并且本申请旨在涵盖一般地遵循本公开的原理的本发明的任何变化、使用或改编,并且包括在本发明所属领域内的已知或惯常实践范围内、并且可以应用上文列出的和遵循所附权利要求的范围的基本特征的对本发明的偏离。
参考文献
Behne MJ,Meyer JW,Hanson KM,Barry NP,Murata S,Crumrine D,et al.NHE1regulates the stratum comeum permeability barrierhomeostasis.Microenvironment acidification assessed with fluorescencelifetime imagine.J Biol Chem 2002;277:47399-406.
Behne MJ,Sanchez S,Barry NP,Kirschner N,Meyer W,Mauro TM,et al.Majortranslocation of calcium upon epidermal barrier insult:imaging andquantification via FLIM/Fourier vector analysis.Arch Dermatol Res 2011;303:103-15.
Bikle DD,Xie Z,Tu C-L.Calcium regulation of keratinocytedifferentiation.Expert Rev Endocrinol Metab 2012;7:461-72.
Bitton A,Avlas S,Reichman H,Itan M,Karo-Atar D,Azouz NP,et al.A keyrole for IL-13signaling via the type 2IL-4receptor in experimental atopicdermatitis.Sci Immunol 2020;5:eaaw2938.
Brown CC,Gudjonson H,Pritykin Y,Deep D,Lavallée V-P,Mendoza A,etal.Transcriptional basis of mouse and human dendritic cell heterogeneity.Cell2019;179:846-63.
Celli A,Sanchez S,Behne M,Hazlett T,Gratton E,Mauro.The epidermal Ca
Chiang C-C,Cheng W-J,Korinek M,Lin C-Y,Hwang T-L.Neutrophils inpsoriasis.Front Immunol 2019;10:2376
Dupasquier M,Stoitzner P,van Oudenaren A,Romani N,LeenenPJM.Macrophages and dendritic cells constitute a major subpopulation of cellsin the mouse dermis.J Invest Dermatol 2004;123:876-9.
Eckert RL,Sturniolo MT,Broome A-M,Ruse M,Rorke EA.Transglutaminasefunction in epidermis.J Invest Dermatol 2005;124:481-92.
Eggink LL,Roby KF,Cote R,Hoober JK.An innovative immunotherapeuticstrategy for ovarian cancer:CLEC10A and glycomimetic peptides.J ImmunoTherCancer 2018;6:28.
Eggink LL,Spyroulias GA,Jones NG,Hanson CV,Hoober JK.A peptidemimetic of 5-acetylneuraminic acid-galactose binds with high avidity tosiglecs and NKG2D.PloS One 2015;10:e0130532.
Elias PM,Ahn SK,Brown BE,Crumrine D,Feingold KR.Origin of theepidermal calcium gradient:regulation by barrier status and role of active vspassive mechanisms.J Invest Dermatol 2002;119:1269-74.
Elsholz F,Harteneck C,Muller W,Friedland K.Calcium-a centralregulator of keratinocyte differentiation in health and disease.Eur JDermatol 2014;24:650-61.
Fukui M,Kuramoto K,Yamasaki R,Shimizu Y,Itoh M,Kawamoto T,HitomiK.Identifiation of a highly reactive substrate peptide for transglutaminase 6and its use in detecting transglutaminase activity in the skin epidermis FEBSJ 2013;280:1420-9.
Furue K,Ito T,Tsuji G,Ulzii D,Vu YH,Kido-Nakahara M,et al.The IL-13-OVOL1-FLG axis in atopic dermatitis.Immunology 2019;158:281-6.
Greenlee-Wacker MC.Clearance of apopotic neutrophils and resolutionof inflammation.Immunol Rev 2016;273∶357-70.
Griffin M,Casadio R,Bergamini CM.Transglutaminases:natures biologicalglues.Biochem J 2002;368∶377-96.
Guttman-Yassky E,Nograles KE,Krueger JG.Contrasting pathogenesis ofatopic dermatitis and psoriasis--Part 1∶Clinical and pathologic concepts.JAllergy Clin Immunol 2011;127∶1110-8.
Hamilton JD,Ungar B,Guttman-Yassky E.Drug evaluation review:dupilumabin atopic dermatitis.Immunotherapy 2015;7∶1043-58.
Hanson KM,Behne MJ,Barry NP,Mauro TM,Gratton E,Clegg RM.Two-photonfluorescence lifetime imaging of the skin stratum comeum pH gradient.BiophysJ 2002;83∶1682-90.
Harb H,Chatila TA.Mechanisms ofdupilumab.Clin Exp Allergy 2020;50∶5-14.
Heger L,Balk S,Lühr JJ,Heidkamp GF,Lehmann CHK,Hatscher L,etal.CLEC10A is a specific marker for human CD1c
Higashi N,Fujioka K,Denda-Nagai K,Hashimoto S,Nagai S,Sato T,etal.The macrophage C-type lectin specific for galactose/N-acetylgalactosamineis an endocytic receptor expressed on monocyte-derived immature dendriticcells.J Biol Chem 2002;277∶20686-93.
Hopp TP,Woods KR.Prediction of protein antigenic determinants fromamino acid sequences.Proc Natl Acad Sci USA 1981;78∶3824-8.
Jin H,He R,Oyoshil M,Geha RS.Animal models of atopic dermatitis.JInvest Dermatol 2009;129∶31-40.
Johannessen BR,Skov LK,Kastrup JS,Kristensen O,Bolwig C,Larsen JN,etal.Structure of the house dust mite allergen Der f 2:implications forfunction and molecular basis of IgE cross-reactivity.FEBS Lett 2005;579∶1208-12.
Kalinin A,Marekov LN,Steinert PM.Assembly of the epidermal cornifiedcell envelope.J Cell Sci 2001;114∶3069-70.
Kanemaru K,Noguchi E,Tahara-Hanaoka S,Mizuno S,Tateno H,Denda-NagaiK,et al.Clec10a regulates mite-induced dermatitis.Sci Immunol 2019;4:eaax6908.
Karande P,Jain A,Mitragotri S.Discovery of transdermal penetrationenhancers by high-throughput screening.Nat Biotech 2004;22∶192-7.
Kawakami Y,Yumoto K,Kawakami T.An improved mouse model of atopicdermatitis and suppression of skin lesions by an inhibitor of Tec familykinases.Allergol Internatl 2007;56∶403-9.
Kim T-G,Kim SH,Park J,Choi W,Sohn M,Na HY,et al.Skin-specific CD301b
Kolumam G,Wu X,Lee WP,Hackney JA,Zavala-Solorio J,Gandham V,et al.IL-22R ligands IL-20,IL-22,and IL-24 promote wound healing in diabetic db/dbmice.PLOS One 2017;12∶e0170639.
Langan S,Irvine AD,Weidinger.Atopic dermatitis.Lancet 2020;396∶345-60.
Lee SE,Lee SH.Skin barrier and calcium.Ann Dermatol 2018;30∶265-75.
Lee A-Y.Molecular mechanism of epidermal barrier dysfunction asprimary abnormalities.Int JMol Sci 2020;21∶1194.
Liedén A,Winge MCG,
Liu T,Zhang L,Joo D,Sun S-C.NF-κB signaling in inflammation.SignalTrans Targ Thcrapy 2017;2:e17023.
Lowes MA,Suárez-
Lu Y-C,Yeh W-C,Ohashi PS.LPS/TLR4 signal transductionpathway.Cytokine 2008;42∶145-51.
Martel BC,Lovato P,Baumer W,Olivry T.Translational animal modelsofatopic dermatitis for preclinical studies.Yale J Biol Med 2017;90∶389-402.
Mauro T,Bench G,Sidderas-Haddad E,Feingold K,Elias P,CullanderC.Acute barrier perturbation abolishes the Ca
Menezes ME,Bhoopathi P,Pradhan AK,Emdad L,Das SK,Guo C,et al.Roles ofMDA-7/IL-24a multifunction protein in human diseases.Adv Cancer Res 2018;138∶143-82.
Mitamura Y,Nunomura S,Furue M,Izuhara K.IL-24:a new player in thepathogenesis of pro-inflammatory and allergic skin diseases.Allergol Intematl2020;69∶405-11.
Myles IA,Fontecilla NM,Valdez PA,Vithayathil PJ,Naik S,Belkaid Y,etal.Signaling via the IL-20 receptor inhibits cutaneous production of IL-1βand IL-17A to promote infection with methicillin-resistant Staphylococccusaureus.Nat Immunol 2013;14∶804-13.
Munera-Campos M,Carrascosa JM.Innovation in atopic dermatitis:frompathogenesis to treatment.Actas Dermasifiliogr 2020;111∶205-21.
Nguyen AV,Soulika AM.The dynamics of the skin’s immune system.Int JMolec Sci 2019;20∶1811.
Osawa R,Akiyama M,Shimizu H.Filaggrin gene defects and the risk ofdeveloping allergic disorders.Allergol Intematl 2011;60∶1-9.
Saini S,Pansare M.New insights and treatments in atopicdermatitis.Ped Clin North Am 2019;66∶1021-33.
Shook BA,Wasko RR,Rivera-Gonzalez GC,Salazar-Gatzimas E,L6pez-Giráldez F,Dash BC,et al.Myofibroblast proliferation and heterogeneity aresupported by macrophages during skin repair.Science 2018;362∶909.
Singh SK,Streng-Ouwehand I,Litjens M,Weelij DR,Garcia-Vallejo,vanVliet SJ,et al.Characterization of murine MGL1 and MGL2 C-type lectins:distinct glycan specificities and tumor binding properties.Molec Immunol2009;46∶1240-9.
Smith FJD,Irvinc AD,Tcrron-Kwiatkowski A,Sandilands A,Campbell LE,Zhao Y,ct al.Los-of-function mutations in the gene encoding filaggrin causeichthyosis vulgaris.Nat Genet 2006;38:337-341.
Su H,Luo Y,Sun J,Liu X,Ling S,Xu B,et al.Transglutaminase 3 promotesskin inflammation in atopic dermatitis by activating monocyte-deriveddendritic cells via DC-SIGN.J Invest Dermatol 2020;140∶170-9
Sugimura Y,Hosono M,Kitamura M,Tsuda T,Yamanishi K,Maki M,HitomiK.Identification of preferred substrate sequences for transglutaminase 1--development of a novel peptide that an efficiently detect cross-linkingenzuyme activity in the skin.FEBS J 2008;275∶5667-77.
Tanabe Y,Yamane M,Karo M,Teshima H,Kuribayashi M,Tatsukawa H,etal.Studies on differentiation-dependent expresión and activity of distincttransglutaminases by specific substrate peptides using three-dimensionalreconstructed epidermis.FEBS J 2019;286∶2536-48.
Teshima H,Kato M,Tatsukawa H,Hitomi K.Analysis of the expression oftransglutaminases in the reconstructed human epidermis using a three-dimensional cell culture.Anal Biochem 2020;603∶113606.
H,Lindberg M,Berne B.Skin barrier disruption by sodium laurylsulfateexposure alters the expression of involucrin,transglutamnase 1,profilaggrin,and kallikreins during the repair phase in human skin in vivo.JInvest Dermatol 2008;128∶1212-19.
Urban,K,Chu S,Giesey RL,Mehrmal S,Uppal P,Nedley N,Delost GR.Theglobal,regional,and national burden ofatopic dermatitis in 195 countries andterritories:an ecological study from the Global Burden of Disease Study2017.JAAD Intemat 2021;2∶12-18.
van Kooyk Y,Ilarregui JM,van Vliet SJ.Novel insights into theimmunomodulatory role of the dendritic cell and macrophage-expressed C-typelectin MGL.Immunobiology 2015;220∶185-92van Vliet SJ,van Liempt E,GeijtenbeekTBH,van Kooyk Y.Differential regulation of C-type lectin expression ontolerogenic dendritic cell subsets.Immunobiology 2006;211∶577-585.
Villani A-C,Saija R,Reynolds G,Sarkizova S,Shekhar K,Fletcher J,etal.Single-cell RNA-seq reveals new types of human blood dendritic cells,monocytes,and progenitors.Science 2017;356:eaah4573.
Wei JCJ,Edwards GA,Martin DJ,Huang H,Crichton ML,KendallMAF.Allometric scaling of skin thickness,elasticity,viscoelasticity to massfor micro-medical device translation:from mice,rats,rabbits,pigs tohumans.Sci Rep 2017;7∶15885.
Yang B,Suwanpradid J,Sanchez-Lagunes R,Choi HW,Hoang P,Wang D,etal.IL-27 facilitates skin wound healing through induction of epidermalproliferation and host defense.J Invest Dermatol 2017;137∶1166-75.
序列表
<110>苏萨维恩生物科学公司
<120>中性粒细胞驱动的炎症性病理的治疗方法
<130>24667.047PCT2
<150>63/057,741
<151>2020-07-28
<160>10
<170>PatentIn version 3.5
<210>1
<211>12
<212>PRT
<213>人工序列
<220>
<223>合成序列
<400>1
Val Gln Ala Thr Gln Ser Asn Gln His Thr Pro Arg
1 5 10
<210>2
<211>8
<212>PRT
<213>人工序列
<220>
<223>合成序列
<400>2
Asn Pro Ser His Pro Leu Ser Gly
1 5
<210>3
<211>4
<212>PRT
<213>人工序列
<220>
<223>合成序列
<400>3
Gly Gly Gly Ser
1
<210>4
<211>8
<212>PRT
<213>人工序列
<220>
<223>合成序列
<400>4
Gly Gly Gly Ser Gly Gly Gly Ser
1 5
<210>5
<211>4
<212>PRT
<213>人工序列
<220>
<223>合成序列
<400>5
Ser Ser Ser Ser
1
<210>6
<211>8
<212>PRT
<213>人工序列
<220>
<223>合成序列
<400>6
Ser Ser Ser Ser Ser Ser Ser Ser
1 5
<210>7
<211>3
<212>PRT
<213>人工序列
<220>
<223>合成序列
<220>
<221>MISC_FEATURE
<222>(1)..(1)
<223>VQATQSNQHTPRGGGS连接至N末端
<220>
<221>MISC_FEATURE
<222>(1)..(1)
<223>VQATQSNQHTPRGGGS连接至侧链赖氨酰基的末端
<220>
<221>MOD_RES
<222>(2)..(2)
<223>AMIDATION
<220>
<221>MISC_FEATURE
<222>(3)..(3)
<223>VQATQSNQHTPRGGGS连接至N末端
<220>
<221>MISC_FEATURE
<222>(3)..(3)
<223>VQATQSNQHTPRGGGS连接至侧链赖氨酰基的末端
<400>7
Lys Lys Lys
1
<210>8
<211>3
<212>PRT
<213>人工序列
<220>
<223>合成序列
<220>
<221>MISC_FEATURE
<222>(1)..(1)
<223>NQHTPRGGGS连接至N末端
<220>
<221>MISC_FEATURE
<222>(1)..(1)
<223>NQHTPRGGGS连接至侧链赖氨酰基的末端
<220>
<221>MOD_RES
<222>(2)..(2)
<223>AMIDATION
<220>
<221>MISC_FEATURE
<222>(3)..(3)
<223>NQHTPRGGGS连接至N末端
<220>
<221>MISC_FEATURE
<222>(3)..(3)
<223>NQHTPRGGGS连接至侧链赖氨酰基的末端
<400>8
Lys Lys Lys
1
<210>9
<211>3
<212>PRT
<213>人工序列
<220>
<223>合成序列
<220>
<221>MISC_FEATURE
<222>(1)..(1)
<223>NPSHPLSGGGGS连接至N末端
<220>
<221>MISC_FEATURE
<222>(1)..(1)
<223>NPSHPLSGGGGS连接至侧链赖氨酰基的末端
<220>
<221>MOD_RES
<222>(2)..(2)
<223>AMIDATION
<220>
<221>MISC_FEATURE
<222>(3)..(3)
<223>NPSHPLSGGGGS连接至N末端
<220>
<221>MISC_FEATURE
<222>(3)..(3)
<223>NPSHPLSGGGGS连接至侧链赖氨酰基的末端
<400>9
Lys Lys Lys
1
<210>10
<211>14
<212>PRT
<213>人工序列
<220>
<223>合成序列
<220>
<221>X
<222>(1)..(8)
<223>X等于任何氨基酸残基或不存在,只要序列包含
至少7个氨基酸残基并且天冬酰胺之前的至少一
个氨基酸残基是谷氨酰胺即可。
<400>10
Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Asn Gln His Thr Pro Arg
1 5 10
- 用于治疗炎症性和过敏性病理学的脂肪酸和十六酰胺乙醇的混合物
- 包含粘土矿物复合物的用于预防、改善及治疗炎症性结肠炎的组合物、组合物的制备方法及改善及治疗炎症性结肠炎的方法
