杨梅苷在治疗血小板减少症药物制备中的应用
文献发布时间:2024-04-18 19:58:21
技术领域
本发明涉及生物医药领域,属于小分子化合物制药新用途,具体涉及杨梅苷制药用途,特别是治疗血小板减少症药物中的应用。
背景技术
恶性肿瘤已经成为世界范围内的公共问题之一,严重威胁着人类健康。恶性肿瘤的治疗手段包括手术治疗、放疗、化疗和生物基因工程治疗等手段,为了减小恶性肿瘤对病人生命健康的危害,科学家开发了多种不同的治疗方法。但除了手术治疗、放疗、化疗外,技术发展都较为缓慢。放疗仍然是治疗癌症的主要方法之一,虽然科技在进步,但是放疗的毒副作用依然严重制约着恶性肿瘤的治疗。
血小板减少症是放疗最常见的并发症,目前临床尚无针对放疗所致血小板减少症的特效药物,通常采用小剂量的重组人白细胞介素-11(rh IL-11)、重组人血小板生成素(rhTPO)或者血小板输注。一般建议输入促血小板生长因子需要在化疗后开始应用,每日一次皮下注射,连续应用7-10天。但是,促血小板生长因子效果通常不是很理想,而且存在时间的滞后性,而血小板减少的严重危害发生几率较小,通常只持续较短时间出现严重风险,治疗的针对性不是很好。
还有一种治疗方法是,给患者进行血小板输注,通过直接给患者输注血小板来快速地改善患者血小板减少的问题。但血小板输注医源性感染问题突出,且血小板的获得只能是通过志愿者献血,受限于献血站日常能够获得的血小板总量。
对于上述药物疗效不佳的,通常选用血小板生成素受体激动剂(TPO-RA)。TPO-RA是美国血液协会推荐的促血小板生成药物,但价格昂贵、副反应多,且不能持续作用,限制了其临床使用。
所以,目前对于血小板减少症的治疗尚未稳定可靠的方法,亟需一种能够有效对抗血小板减少症的治疗方案或能够防止血小板减少的药物化合物。
发明内容
本发明的目的在于克服现有技术中放疗并发症血小板减少症治疗药物昂贵,缺乏稳定可靠的治疗手段的不足,提供一种杨梅苷(Myricetrin,MYR)的新用途,为治疗放疗所致血小板减少症提供成本低,副作用小的全新药物。
为了实现上述发明目的,本发明提供了以下技术方案:
杨梅苷在药物制备中的应用,所述药物是用于治疗血小板减少症的药物。
杨梅苷,全称为五羟基黄酮-3-鼠李糖苷,广泛存在于杨梅的根皮中,是一种类黄酮类化合物。主要用于治疗糖尿病、心血管疾病等,迄今尚未有文献报道杨梅苷对放疗致血小板减少症具有治疗作用及其作用机制的研究。
通过发明人大量实验探究,发现杨梅苷在体外对巨核细胞的细胞活力没有影响,在体外对巨核细胞有一定的促进分化成熟与前血小板生成的活性。同时,研究发现杨梅苷在体内对血小板生成具有促进作用,能够恢复血小板减少症患者的血小板水平,促进主要造血组织骨髓中的巨核细胞分化成熟和多倍体的生成。
体外实验证明,杨梅苷给药组(10μM,20μM,40μM)的大细胞明显呈现增多的趋势,表明10μM,20μM,40μM浓度下的杨梅苷有促进巨核细胞分化的活性,并且呈现浓度依赖的趋势,杨梅苷(10μM,20μM,40μM)干预K562和Meg-01细胞第5天时,巨核细胞标记物CD41/CD42b表达率显著升高,具有统计学意义(*与对照组相比,*P<.05,**P<.01,***P<.001),表明杨梅苷可以显著刺激K562和Meg-01细胞表面抗原CD41/CD42b的表达;阳性药物PMA(PKC激活剂,佛波肉豆蔻醋酸)组与杨梅苷给药组(10μM,20μM,40μM)的细胞核分叶状态存在显著差异,细胞都呈现多个核分叶的状态,并且杨梅苷给药组(10μM,20μM,40μM)的核分叶状态与阳性药物PMA组的核分叶状态相似,多核细胞的数目显著增加,表明杨梅苷能够促进巨核细胞分化过程中多倍体的生成与成熟。
进一步的,所述药物是用于治疗放疗所致血小板减少症的药物。
进一步的,所述药物是用于治疗化疗所致血小板减少症的药物。
进一步的,所述药物还含有药学上可接受的辅料和/或载体。
进一步的,所述杨梅苷每日用药剂量在10-200mg范围。优选10-100mg。
或者,所述药物中杨梅苷的含量为10-200mg。优选10-100mg。
进一步的,所述杨梅苷每日用药剂量在12-50mg范围。
或者,所述药物中杨梅苷的含量为12-50mg。
小鼠的体内实验证明,杨梅苷给药组(2.5mg/kg,5mg/kg,10mg/kg)与阳性药物rhTPO组小鼠的血小板水平在造模第10天以后显著增加,虽然没有恢复到阳性药物TPO组的水平,但杨梅苷给药组(10μM,20μM,40μM)已经表现出显著恢复血小板水平的效果,表明杨梅苷对于辐照致血小板减少症小鼠有一定的治疗作用、对恢复血小板水平的作用显著。
通过小鼠用药剂量,换算得出人体用杨梅苷的每日用药剂量为14-60mg。可以扩大药物制剂中的范围至10-100mg,并可以根据后续人体试验研究情况调整药物制剂中的活性成分含量。
与模型组相比,杨梅苷体内给药第12天时血小板水平明显回升,骨髓细胞中CD41/CD61和CD41/CD1117表达率显著升高,同时杨梅苷能显著提升脾脏细胞中CD41/CD61的表达,已经接近对照组小鼠的骨髓巨核细胞分化情况,具有统计学意义,说明杨梅苷的体内给药不仅能够恢复血小板水平,还可以显著刺激骨髓和脾脏巨核细胞表面抗原CD41/CD61和巨核祖细胞CD41/CD1117表达的表达,因此,杨梅苷对骨髓中巨核细胞分化有显著促进作用,表明杨梅苷的造血作用主要不仅存在与骨髓,还可以促进脾脏造血。由此可见,杨梅苷可用于制备治疗放疗所致血小板减少症的药物,杨梅苷在治疗放疗所致血小板减少症上有一定效果。够恢复放疗所致血小板减少症患者的血小板水平。
细胞毒性实验表明,杨梅苷干预K562和Meg-01细胞第5天时,10μM,20μM,40μM杨梅苷给药组与对照组细胞在各个时间点细胞活力相当,对细胞没有毒性,副作用小。且杨梅苷广泛存在于天然中药材中,成本较低,具有较大的治疗血小板减少症的应用潜力,可用于开发新型治疗放疗所致血小板减少症的药物。
进一步的,杨梅苷通过促进巨核细胞分化成熟和多倍体的生成,达到恢复血小板数量的作用。
进一步,杨梅苷通过促进PI3K、Akt、GSK3β蛋白的磷酸化,激活了IGF1R/PI3K/AKT/GSK3β通路,发挥促进血小板生成作用。
进一步的,所述药物的剂型是片剂、胶囊、丸剂中的一种。
进一步的,所述药物缓释制剂或控释制剂。
进一步的,药物中还包括其他促进血小板生成的活性成分。
进一步的,杨梅苷药物制备中的应用,所述药物中还包括血小板生成素受体激动剂。
进一步的,所述血小板生成素受体激动剂是TPO-RA。
进一步的,所述药物中还包括重组人血小板生成素。
进一步的,所述药物中还包括重组人白细胞介素-11。
与现有技术相比,本发明的有益效果:
通过大量实验研究表明,杨梅苷在体外对细胞活力没有影响,在体外对巨核细胞有一定的促进分化成熟与前血小板生成的活性;同时研究发现杨梅苷在体内对血小板生成具有促进作用,能够恢复辐照致血小板减少症小鼠的血小板水平,促进主要造血组织骨髓和脾脏中的巨核细胞分化成熟和巨核祖细胞的生成,由此可见,杨梅苷在治疗血小板减少症上有一定的效果,且杨梅苷广泛存在于天然中药材中,成本较低,副作用小。
附图说明
图1为杨梅苷对细胞活力的影响图。
图2为杨梅苷对细胞镜下形态的拍照图。
图3为杨梅苷对细胞核多倍体的结果图。
图4A为杨梅苷对K562细胞DMS膜形成的F-actin表达影响的结果图。
图4B为杨梅苷对Meg-01细胞DMS膜形成的F-actin表达影响的结果图。
图5为杨梅苷对细胞CD41-CD42b表达的影响图。
图6为杨梅苷对辐照致血小板减少症小鼠的血小板水平的影响图(与模型组相比,*P<.05,**P<.01,***P<.001)。
图7为杨梅苷骨髓细胞CD41-CD61表达的影响图(与模型组相比,*P<.05,**P<.01,***P<.001)。
图8为杨梅苷骨髓细胞CD41-CD117表达的影响图(与模型组相比,*P<.05,**P<.01,***P<.001)。
图9为杨梅苷脾脏细胞CD41-CD61表达的影响图(与模型组相比,*P<.05,**P<.01,***P<.001)。
图10是杨梅苷对PI3K/AKT信号通路相关蛋白的影响检测结果照片和分析图。
具体实施方式
下面结合试验例及具体实施方式对本发明作进一步的详细描述。但不应将此理解为本发明上述主题的范围仅限于以下的实施例,凡基于本发明内容所实现的技术均属于本发明的范围。
术语说明
CD41识别血小板膜糖蛋白GPIIb(即整合素αIIb链,它与GpIIIa「整合素β3链」非共价结合以形成GpIIb/IIIa复合物);CD61识别血小板膜糖蛋白GpIIIa(整合素β3链);CD42b与巨核细胞和血小板上的GPIb反应。以上三个抗体均表达在原始巨核细胞的胞膜和胞浆。通过检测血小板标志物CD41,可以反应血小板的含量。
本发明提供了杨梅苷的新用途,即杨梅苷在制备治疗血小板减少症药物中的应用。具体研究过程中实验记录资料如以下实施例所述。
实施例1
杨梅苷(Myricetrin,MYR)对细胞活力的研究
用含10%胎牛血清培养基(FBS)、1wt.%青霉素-链霉素混合物和RPMI-1640基础培养基(Roswell Park Memorial Institute 1640培养基)。在37℃、5% CO
取对数生长期的Meg-01细胞以及K562细胞进行计数,接种数量为5000个/孔,每个孔的体系为100μL。
实验设置空白对照组、MYR给药组(10μM,20μM,40μM),每个组别设置五个复孔。接着在96孔板中,加入含不同浓度杨梅苷的完全培养基溶液,空白对照组加入100μL不含杨梅苷的完全培养基溶液,最后用磷酸缓冲盐溶液(PBS)封边,避免边缘效应,轻轻摇匀孔板,放入细胞培养箱中培养72h。
干预结束后,在每孔加入20μL CCK-8溶液(Cell Counting Kit-8细胞活性检测试剂盒药液),轻摇混匀后放入培养箱中培养2小时。
培养结束后,将96孔板取出,将酶标仪的波长设置为450nm,上机检测吸光度OD值。细胞活力计算公式如下:
细胞活力(%)=(药物组吸光度OD值)/(空白对照组吸光度OD值)×100%。
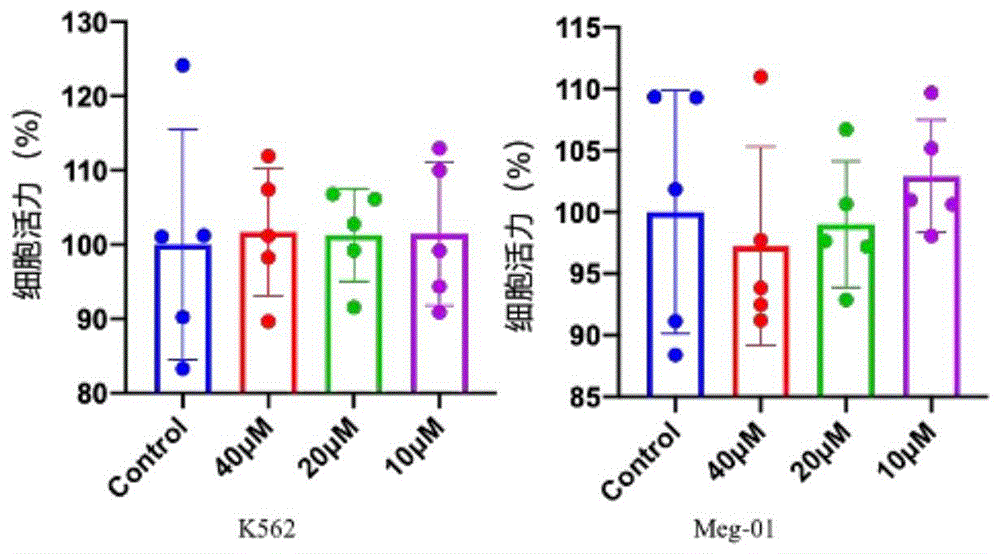
实验结果如图1所示。
根据图1可知,与对照组(Control组)相比,杨梅苷(10μM,20μM,40μM)干预K562细胞和Meg-01细胞第3天时,杨梅苷给药组与Control组细胞在各个时间点存活率相当,表明10μM,20μM,40μM浓度的杨梅苷对细胞没有毒性,可以选择这三个安全浓度,进行后续实验。
实施例2
杨梅苷(Myricetrin,MYR)体外促巨核细胞分化实验
用含10%胎牛血清培养基(FBS)、1wt.%青霉素-链霉素混合物和RPMI-1640基础培养基在37℃、5% CO
取对数生长期的Meg-01细胞以及K562细胞进行计数,接种于12孔板中,接种数量为2万个/孔,每孔500μL。
将实验设置:
对照组(有细胞,不含杨梅苷,含培养基,3个复孔);
阳性药物PMA组(有细胞,含阳性药物PMA组加入含PMA的基培500μL,PMA的终浓度为2.5nM,含培养基,3个复孔);
杨梅苷给药组(含细胞,给药:10μM,20μM,含有培养基,3个复孔)。
杨梅苷给药组加入含药基培500μL,对照组加入等量的基培500μL,于37℃、5%CO
1.倒置显微镜白光拍照细胞形态变化
将细胞静置于孔板中,使用倒置显微镜将细胞放大100倍采集干预5天的图片,以观察给药后细胞形态变化,统计大细胞的数量。
结果如图2所示,可知杨梅苷对细胞形态的影响。与对照组相比,杨梅苷干预第5天后,杨梅苷(10μM,20μM,40μM)都呈现出同样的促进巨核细胞分化的作用,具体表现为巨核样大细胞显著增多(箭头),表明杨梅苷促进巨核细胞分化的潜在活性。
2.Giemsa染色观察杨梅苷对巨核细胞形态的影响
收集杨梅苷干预后的细胞,1500rpm离心5min,重悬于预冷的PBS溶液中,加入等体积的0.075mol/L的KCl溶液进行溶胀,1500rpm离心2min,用固定液(甲醇∶冰醋酸=3∶1,v/v)固定细胞,然后进行Giemsa染色观察杨梅苷干预后细胞形态学变化。
结果如图3所示,可知杨梅苷对巨核细胞多倍体的影响。Giemsa染色结果显示,在第5天时,对照组可见明显的单核细胞(其中淡色为细胞膜,深色为细胞核),杨梅苷给药组(10μM,20μM,40μM)的细胞核分叶状态存在显著差异,细胞都呈现多个核分叶的状态,并且多核细胞的数目显著增加,表明杨梅苷促进巨核细胞分化过程中多倍体的生成。
3.鬼笔环肽染色观察杨梅苷细胞DMS膜形成的F-actin表达影响
收集杨梅苷干预后的细胞,离心机以1500rpm离心细胞5min,弃上清液,保留细胞沉淀,PBS洗一次,4%多聚甲醛固定10min,甩片。0.5% TritonX-100溶液透化5min,PBS洗三次;稀释后的鬼笔环肽工作液覆盖细胞,室温避光孵育1h,PBS洗三次;DAPI复染细胞核20s,PBS洗三次;封片后使用倒置显微镜将细胞放大100倍采集图片。
结果如图4A和图4B所示,可知杨梅苷细胞DMS膜形成的F-actin表达影响。鬼笔环肽可以对细胞中的纤维状激动蛋白(F-actin)进行染色,颜色为红色。F-actin在巨核细胞的分化和血小板的形成过程中起着重要作用。鬼笔环肽染色结果(图4A和图4B)显示,在第5天时,与对照组相比,杨梅苷给药组(10μM,20μM,40μM)可以显著促进巨核细胞多核荧光的表达(红光TRITC Phalloidin定位于细胞膜微丝结构,蓝光DAPI定位于细胞核结构),并且对照组的细胞核DAPI染色多呈现单核状态,给药组的细胞核DAPI染色呈现明显的多核分叶的状态,表明杨梅苷能够促进巨核细胞分化过程中多倍体的生成与成熟。
4.流式细胞术检测杨梅苷对巨核细胞表面抗的原表达
收集细胞,离心机以1500rpm离心5min,PBS(预冷)洗2遍,加100μL的PBS混匀,离心机以1500rpm离心5min后吸出上清,加入3μLCD41抗体和3μLCD42b抗体,放置冰上避光15min,进样前加入200-400μLPBS,488nm的激发光波长检测,从而检测巨核细胞分化过程中表面标记物CD41/CD42b的表达。
实验结果如图5所示,流式细胞术检测CD41-CD42b的结果可见巨核细胞倾向于分化成熟。FITC-CD41(+)-PE-CD42b(+)阳性区域代表巨核细胞分化成熟的表面标记物CD41、CD42b双阳区域(CD41是巨核细胞的特异性表面抗原,表达于巨核细胞分化全过程;CD42b是巨核细胞特异性表面抗原,其表达倾向于分化程度更高,更成熟的巨核细胞,它的表达预示着巨核系的终端成熟)。
与对照组相比,杨梅苷给药组(10μM,20μM,40μM)干预第5天时,可以显著促进巨核细胞分化过程中表面抗原CD41-CD42b的表达,具有统计学意义。表明杨梅苷可以显著刺激K562细胞和Meg-01细胞表面抗原CD41-CD42b的表达。
实施例3
杨梅苷((Myricetrin,MYR)对辐照致血小板减少症小鼠的体内药效学研究
1.1小鼠造模以及分组
将KM小鼠(昆明小鼠)适应性喂养一周,期间自由饮水饮食。一周后,将除空白组外的小鼠运往西南医科大学附属医院进行X射线辐射,辐射剂量4Gy。辐射后,因为骨髓抑制小鼠的血小板数目减少。造模后第一天,进行小鼠眼眶静脉丛采血,利用血细胞分析仪检测其血象水平。综合参考白细胞、血小板和红细胞的水平,将造模损伤程度相近的小鼠随机分为模型对照组、MYR高剂量组(10mg/kg)、MYR中剂量组(5mg/kg)、MYR低剂量组(2.5mg/kg)、rhTPO(3000U/kg)组。将未进行辐射的小鼠设置为正常对照组,每组8只,雌雄各半。
1.2小鼠给药方式
分组完成后,开始对小鼠进行给药,具体给药方案见表1,给药周期为12天。分别在给药第4天、7天、10天、12天进行眼底静脉丛采血40μL,用血细胞稀释液进行稀释,上机检测。给药期间,每天观察小鼠状态和进食情况,每隔2天对小鼠进行体重统计。实验完成后,摘眼球取血,剥离小鼠肝脏、脾脏、肾脏、胸腺、股骨。脏器及时称重,然后将部分脏器和股骨固定在4%多聚甲醛中,剩下的脏器用于流式检测。
表1小鼠给药方案
1.3小鼠外周血象的检测
在给药期间,分别于第4、7、10、12天进行外周血象的检测,具体方法为:用毛细管取眼底静脉丛血40μL,迅速加到装有160μL血细胞稀释液的EP管中,轻轻混匀,利用全自动血细胞分析仪对小鼠外周血象进行检测。
1.4流式检测骨髓细胞CD41-CD61和CD41-CD117表达
小鼠造模成功后,进行杨梅苷R给药,连续12天,给药结束后,将小鼠脱颈椎处死,解剖取出小鼠双侧股骨,用2mL生理盐水冲出股骨内部的骨髓细胞,冲出的骨髓细胞用200目尼龙网过滤即为小鼠骨髓细胞悬液,再加入流式保存液,保存在4℃。临用时,将上述细胞进行计数,吸取细胞数量为1×10
按上述方法制备同样的样品,加入FITC-anti-Mouse-CD41抗体0.5μL,PE-anti-Mouse-CD117抗体0.625μL,混匀,避光,冰上孵育15min。最后将其转移至流式管中,混匀,上机检测。
1.5流式检测脾脏细胞CD41-CD61表达
小鼠造模成功后,进行杨梅苷给药,连续12天,给药结束后,将小鼠脱颈椎处死,解剖取出小鼠脾脏,剪约1/3的长度,在尼龙网上轻轻研磨脾脏组织,并用生理盐水进行冲洗,提取收集脾脏细胞,装到1.5mL离心管(EP管)中,1200rpm离心5min,倾出上清,加入红细胞裂解液1mL,冰上裂解10min,1200rpm离心5min。临用时,对脾细胞进行计数,吸取1×10
1、实验结果
2.1杨梅苷对血小板减少症小鼠的外周血象的影响
造模后,每天进行给药,特定时间进行血象的检测,图6是血小板数目的检测结果,造模后第一天时,小鼠的血小板数目还相对均匀;小鼠造模后第4天,由于射线的辐射,血小板数目代偿性升高;在第7天时,模型组小鼠血小板降至最低,但是,rhTPO组小鼠血小板数目减缓下降(P<0.01)。此时,杨梅苷各剂量组对血小板的作用明显(P>0.05);在第10天时,杨梅苷各剂量组和rhTPO组均能显著提高血小板的数目(P<0.001),但与空白对照组小鼠相比,还有差异;在第12天时,杨梅苷高、低剂量组和rhTPO组血小板的数目基本与空白对照组小鼠持平(P<0.001)。表2是记录血小板数目的变化值。
表2杨梅苷对于小鼠血小板生成影响
表中,*与模型组相比,*P<.05,**P<.01,***P<.001。
2.2杨梅苷对小鼠骨髓细胞CD41-CD61和CD41-CD117表达的影响
小鼠给药结束后,剥离小鼠股骨冲洗出骨髓细胞,采用流式细胞术检测骨髓细胞CD41-CD61的表达和CD41-CD117的表达。结果如图7所示,与正常对照组小鼠相比,模型组小鼠骨髓细胞中CD41-CD61的表达显著减少(P<0.001),杨梅苷各剂量组和rhTPO组相对于模型对照组,CD41-CD61的表达明显上升,差异具有统计学意义(P<0.001)。如图8所示,与正常对照组小鼠相比,模型组小鼠骨髓细胞CD41-CD117的表达显著减少(P<0.001),杨梅苷各剂量组和rhTPO组相对于模型对照组,CD41-CD117的表达明显上升(P<0.001)。以上结果表明,杨梅苷可以恢复辐射造模致血小板减少症小鼠的骨髓抑制和促进巨核细胞生成。
2.3杨梅苷对小鼠脾脏细胞CD41-CD61表达的影响
脾脏是除骨髓和肺脏之外的另一个重要的造血部位,当骨髓的造血功能受到损害或丧失,脾脏会发挥髓外造血功能,以弥补骨髓造血功能的不足。小鼠给药结束后,取出小鼠脾脏,剪一部分提取脾脏细胞,采用流式细胞术检测脾脏细胞CD41-CD61的表达。结果如图9所示,与正常对照组小鼠相比,模型组小鼠脾脏细胞中CD41-CD61的表达显著减少(P<0.001),杨梅苷各剂量组和rhTPO组相对于模型对照组,CD41-CD61的表达明显上升(P<0.001,P<0.01)。结果提示,杨梅苷能促进脾脏细胞的分化。
通过上述实施例1-3的细胞实验和动物实验,可以杨梅苷具有促进血小板生成的新用途,即杨梅苷可以应用于制备治疗血小板减少症的药物。
在实验探究中,细胞实验证明杨梅苷在体外对巨核细胞的细胞活力没有影响,在体外对巨核细胞有一定的促进分化成熟与前血小板生成的活性。动物实验证明,杨梅苷在体内对血小板生成具有促进作用,能够恢复血小板减少症患者的血小板水平,促进主要造血组织骨髓中的巨核细胞分化成熟和多倍体的生成。故细胞实验和动物实验,确认了杨梅苷在治疗血小板减少症上有一定的效果。
实施例4
采用蛋白质印迹法(Western Blot)检测Meg-01细胞蛋白的表达。
实验设置:空白对照组、杨梅苷10μmol/L组、杨梅苷20μmol/L组、杨梅苷40μmol/L组。
蛋白质印迹法试剂盒:市售产品,品牌为Cell Signaling
取杨梅苷储液(50μmol/L),用10%完全培养基稀释到工作液,加入12孔板中,500μL/孔。另取状态良好、背景颜色干净、处于对数生长期的K562细胞,600r/min,离心5min,移出上清,用10%完全培养基重悬细胞并计数。将K562细胞细胞接种于上述12孔板中,种板密度1×10
置于相对湿度95%;CO
样品的蛋白浓度=[(样品OD值-空白本底OD值)/2-0.0168]/0.1127。
确定上样量,制胶,上样,电泳,转膜。转膜结束后,用快速封闭液对膜进行封闭,然后用PBST(含吐温-20的磷酸盐缓冲液)洗涤三次,每次10min。将膜放入对应的一抗(按1∶1000倍数稀释)中,过夜,回收一抗,进行二抗(按1∶2000倍数稀释)孵育,显影。
最后用ImageJ软件分析和计算磷酸化蛋白与总蛋白灰度值的比值。
实验结果,PI3K/Akt信号通路在促巨核细胞分化和血小板生成的作用已被广泛报道,基于课题组前期对MYR促巨核细胞分化的研究,同时结合网络药理学对MYR治疗血小板减少症的通路预测,我们初步判定MYR作用机制与PI3K/Akt信号通路有关。IGF-1R是网络药理学预测的关键靶点,同时也可以作为造血因子,同时它的下游是PI3K/AKT,因此我们预测MYR激活了IGF-1R/PI3K/AKT/GSK3β信号通路。结果如图10所示,与空白对照组比较,MYR干预Meg-01细胞后,明显促进了PI3K、Akt、GSK3β蛋白的磷酸化,激活了IGF1R/PI3K/AKT/GSK3β通路。表明MYR通过激活上述通路发挥促进血小板生成作用。
实施例5
一种药物片剂,含有杨梅苷作为活性成分和常用压片制剂辅料成分。其中,杨梅苷的剂量为10μM、20μM、40μM、50μM、100μM。
实施例6
一种胶囊制剂,含有杨梅苷作为活性成分和常用胶囊制剂辅料成分。其中,杨梅苷的剂量为10μM、20μM、40μM、50μM、100μM。
实施例7
一种混悬液制剂,含有杨梅苷作为活性成分和常用混悬液制剂辅料成分。其中,杨梅苷的剂量为10μM、20μM、40μM、50μM、100μM。
实施例8
一种冻干注射剂,含杨梅苷和血小板生成素受体激动剂作为活性成分。
实施例9
一种冻干注射剂,含杨梅苷和重组人白细胞介素-11作为活性成分。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 一种杨梅CAPS标记在检测杨梅花青苷相关MrMYB1等位基因中的应用
- 杨梅苷在制备治疗糖尿病视网膜病变药物中的应用
- 杨梅果实花色苷提取物在制备治疗腹泻的药物中的应用
