地西他滨在制备治疗急性肾损伤药物中的应用
文献发布时间:2023-06-19 10:51:07
技术领域
本发明属于急性肾损伤药物领域,具体涉及地西他滨(Decitabine)在制备治疗急性肾损伤药物中的应用。
背景技术
急性肾损伤(AKI)是一种以肾脏排泄功能快速丧失为特征的综合症,临床上通常以氮代谢终末产物(尿素氮和血肌酐)积聚并在短时间内迅速升高或一定时间内尿量减少或两者兼有为诊断依据。除此以外,酸类代谢物堆积、钾和磷酸盐浓度升高也是临床和实验中AKI的常见特点。AKI波及范围达到约1,330万病人/年,已然成为全球公共卫生领域的负担之一。目前,AKI的诊断及定义已经有了明显的改进和发展。AKI的定义为48小时内血肌酐升高值≥0.3mg/dL(≥26.5 μmol/L);或血肌酐值大于正常基线的1.5倍;或6小时尿量<0.5mL/kg/h。
急性肾损伤(AKI)传统治疗手段主要是围绕着通过体积和血流动力学的管理让肾脏获得充足的血流灌注,同时避免肾毒性的发生展开的。肾脏替代疗法也可在等待肾脏恢复功能的同时进行。尽管临床上对于主要的肾脏生物标记有了较为统一的认识和定义,并且应用到临床治疗之中,但目前药物治疗仍然不能满足 AKI的治疗需求。因此,对AKI的内在机制研究及潜在治疗靶点的寻找仍是当务之急。
Csiplatin(顺铂)属于无机铂类化疗药物,广泛用于头颈部癌症、肺癌、睾丸癌、卵巢癌和膀胱癌等多种实体肿瘤的治疗。顺铂的副作用如骨髓移植、周围神经病变、耳毒性、过敏性反应和肾毒性显著,导致在临床治疗中受限。顺铂引起的AKI的病理生理学特征和脓毒症及缺血/再灌注损伤导致的AKI不同,主要包括(1)近端小管损伤、(2)氧化应激反应、(3)炎症反应和(4)肾脏血管损伤。这些病理过程涉及不同的机制,其中炎症反应和白细胞的募集参与了内皮细胞和肾小管细胞损伤过程,被认为在AKI起始和维持阶段中发挥重要作用。
在顺铂引起的AKI中,机体会分泌各种炎症因子诸如IL-1β、IL-6、IL-18,同时调节免疫系统激活正常T细胞表达和分泌趋化因子、巨噬细胞炎症蛋白-2 (MIP-2)和细胞间粘附分子-1(ICAM-1)。此外,转化生长因子β(TGF-β)的表达也大幅度升高。尽管顺铂引起的AKI与细胞因子IL-1β,IL-6和IL-18增多有关,但是研究发现抑制这些炎症因子不能有效遏制肾毒性相关的AKI发生。
发明内容
本发明的目的在于克服现有技术的不足,提供一种地西他滨和/或阿扎胞苷的新用途,具体是该用途是将地西他滨应用于制备治疗急性肾损伤药物。
进一步的,所述的急性肾损伤为顺铂引起的急性肾损伤。
进一步的,所述的对象为哺乳动物或人。
进一步的,所述药物为片剂、分散片、含片、口崩片、缓释片、胶囊剂、软胶囊剂、滴丸、颗粒剂、注射剂、粉针剂或气雾剂。
炎症反应在顺铂引起的AKI中有重要作用,多条炎症信号通路活化并产生诸如IL-1β、IL-6、IL-18等多种炎症因子,导致肾脏结构破坏并加剧肾损伤。同时,抗炎因子如IL-10也在AKI中发挥作用。
地西他滨通过抑制DNA甲基转移酶起到减少CpG岛的甲基化;DNA甲基转移酶是与DNA去甲基化酶起到相反作用,可以使CpG二核苷酸5'端的胞嘧啶转变为5'甲基胞嘧啶,起到基因DNA的甲基化作用。我们的研究发现地西他滨的运用能有效抑制cisplatin导致的AKI,与Tet2基因在cisplatin导致的AKI作用机制是相同的。地西他滨的使用可以明显减少cisplatin使用引起的小鼠肌酐和尿素氮的升高,抑制肾小管病理上的表型,同时明显抑制AKI的生物标志物 KIM-1和NGAL的表达。为了进一步明确和阐明地西他滨在抑制顺铂引起AKI 的作用及其机制,本发明利用Tet2敲除小鼠进行深入研究。
本发明研究发现,在不同的AKI模型中均发现Tet2表达降低。Tet2是DNA 去甲基化酶,起到基因DNA的CpG二核苷酸5'端的5'甲基胞嘧啶转变为胞嘧啶。 Tet2基因敲除会导致cisplain诱导的AKI损伤程度加重,出现显著的血肌酐水平升高;而过表达Tet2基因则起到缓解肾损伤和保护肾功能的作用。测序结果及后续验证实验表明Tet2可能通过参与调控PPAR信号通路及其相关基因,在AKI 中调节下游炎症因子表达从而起到抗炎作用。
在cisplatin导致的AKI中,Tet2可能通过参与调控PPAR信号通路及其相关基因,从而调节下游炎症因子的表达,起到抗炎和保护肾脏功能的作用。因此,我们推测地西他滨抑制顺铂引起的AKI作用主要通过激活PPAR信号通路及其相关基因,同时抑制炎症相关因子的表达。
附图说明
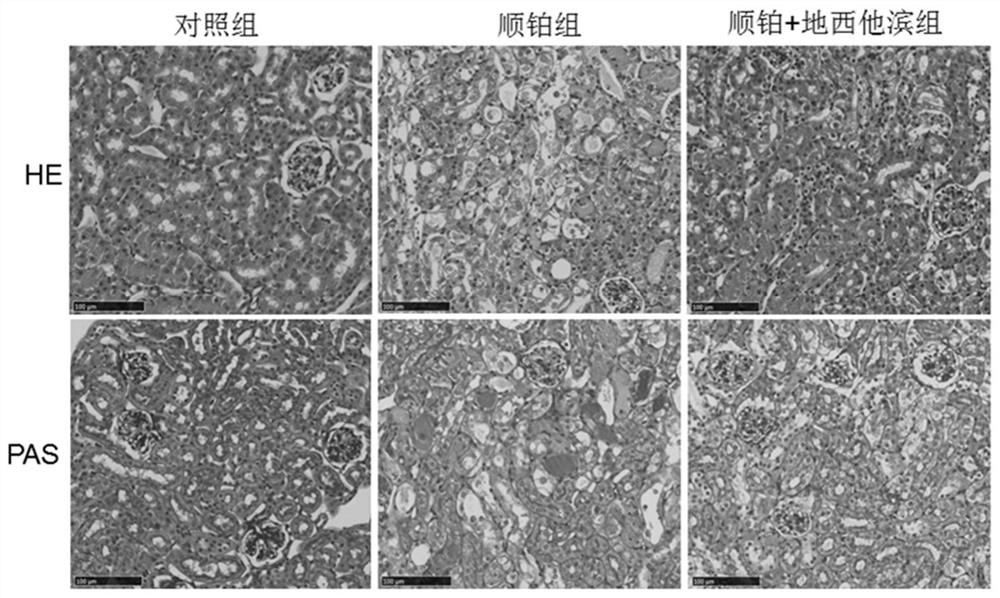
图1为地西他滨的使用显著抑制顺铂引起的AKI肾脏病理表型。正常小鼠、注射cisplatin的WT小鼠、以及注射cisplatin和地西他滨小鼠的肾脏皮层HE和 PAS染色结果(200×)。
图2为地西他滨的使用显著缓解顺铂引起的AKI肾功能下降。(A,B)正常小鼠、注射cisplatin的WT小鼠、以及注射cisplatin和地西他滨的小鼠不同时间点血清肌酐(Scr)和尿素氮(BUN)变化情况;(C,D)急性肾损伤生物标记基因KIM-1,NGAL基因在不同处理组小鼠肾脏中mRNA表达水平情况;(E) 不同处理组小鼠肾脏病理的打分。
图3为Tet2在正常机体内的表达情况。(A)荧光显微镜(200X)观察Tet2 蛋白在正常野生小鼠肾脏中的表达情况。AQP1:水通道蛋白1(B)正常小鼠肾脏Tet1/2/3基因mRNA表达水平。(C)正常HK2细胞Tet1/2/3基因mRNA表达水平。
图4为Tet2在AKI过程中表达情况。(A-D)免疫组化染色结果显示Tet2 蛋白在不同的AKI模型中的表达情况。IR:缺血/再灌注模型(E)cisplatin处理正常HK2细胞后在不同时间点检测Tet2 mRNA表达水平。(F)cisplatin处理正常HK2细胞后在不同时间点Westernblot检测Tet2蛋白表达水平结果。
图5为Tet2基因敲除对cisplatin引起的AKI的影响。(A,B)正常WT、Tet2 KO小鼠和注射cisplatin的WT、Tet2 KO小鼠不同时间点血清肌酐(Scr)和尿素氮(BUN)变化情况。(C)正常WT、Tet2 KO小鼠及注射cisplatin的WT、 Tet2 KO小鼠肾脏皮质/髓质损伤HE染色结果(200×)。(D)不同组小鼠肾脏组织HE片子镜下(200×)选取10个不同的位置观察肾皮质组织损伤,肾小管损伤分数通过计算发生坏死、管型、扩张的肾小管所占百分比。(E,F)急性肾损伤生物标记基因KIM-1,NGAL基因在不同处理组小鼠肾脏中mRNA表达水平情况。
图6为过表达Tet2对AKI的影响。(A,B)不同质粒注射组小鼠在cisplatin 注射0、24、48、72小时血肌酐和尿素氮数值变化折线图。(C)不同组小鼠肾脏皮质/髓质损伤HE染色结果(200×)。(D)每组小鼠肾脏组织HE片子镜下(200 X)选取10个不同的位置观察肾皮质组织损伤。(E,F)急性肾损伤生物Marker KIM-1,NGAL基因在不同处理组小鼠肾脏中mRNA表达水平情况。
图7为Tet2基因敲除对注射顺铂小鼠肾脏内凋亡现象的影响。(A)BAX蛋白免疫组化结果图(200×)。(B)Bcl2蛋白免疫组化结果图(200×)。(C)TUNEL 检测不同处理组小鼠凋亡情况(200×)。(D)C图中不同组中每个小鼠肾脏切片随机选取10个视野(200×),对TUNEL阳性细胞进行计数。
图8为测序差异表达基因检测。(A,C)正常WT和Tet2 KO小鼠,注射cisplatin WT和Tet2 KO小鼠肾脏炎症基因和PPAR相关基因检测。(B,D)正常小鼠及 cisplatin注射后的空载/Tet2正常质粒/Tet2突变质粒过表达小鼠炎症及PPAR信号通路相关基因检测。
具体实施方式
一、地西他滨显著抑制顺铂引起的肾脏病理损伤
通过腹腔注射顺铂,建立小鼠AKI模型。顺铂注射72h后,对不同小鼠组的肾脏分别进行甲醛固定,之后分别进行HE和PAS常规的病理检测。结果显示顺铂明显诱导肾小管结构破坏以及小管代谢物的积累;地西他滨组:顺铂注射前2 天和之后3天连续注射地西他滨(0.5mg/kg),地西他滨的连续使用能明显减轻肾脏病理损伤(图1)。
二、地西他滨显著抑制顺铂引起的肾功能下降
通过腹腔注射顺铂后,在不同的时间点通过眼球取血获得血清,检测血肌酐和尿素氮变化。结果显示,在cisplatin刺激下,WT小鼠的血肌酐和尿素氮水平较对照组小鼠均明显升高,但地西他滨的使用能使两个肾功能指标明显减少(图 2A,B)。同时,地西他滨组AKI的生物标志物KIM-1和NGAL基因表达水平和病理损伤打分明显低于顺铂处理组(图2C-E)。
三、Tet2在AKI中的表达情况
正常状态下,Tet2在人肾近曲小管上皮细胞(HK2)和野生型小鼠肾组织中的表达情况如图3所示。正常小鼠肾组织的Tet2免疫荧光检测显示,Tet2蛋白高度富集在肾小管周围(图3A)。正常培养的HK2细胞和小鼠肾脏定量检测结果也证明Tet2 mRNA表达水平明显高于Tet1和Tet3(图3B,C)。
免疫组化染色结果显示,在缺血/再灌注损伤、脓毒症和肾移植小鼠模型中,肾组织中Tet2表达水平随着时间的变化逐渐降低(图4A-C)。通过腹腔注射 cisplatin诱导建立稳定的小鼠AKI模型,肾组织免疫组化染色和Q-PCR结果显示Tet2表达水平随着时间延长而降低(图4D,E)。使用浓度为20μM的cisplatin 处理HK2细胞模拟急性损伤环境,在不同时间点取细胞进行WB和Q-PCR检测,结果也验证了Tet2在AKI过程中表达下调(图4F)。实验结果提示在肾脏发生急性损伤时,Tet2表达水平随病程进展逐渐降低。
四、Tet2基因在顺铂引起的AKI中的作用
4.1Tet2基因敲除加剧cisplatin引起的AKI
通过腹腔注射cisplatin,建立WT小鼠和Tet2基因敲除小鼠AKI模型,并在不同的时间点通过眼球取血获得血清,检测血肌酐和尿素氮变化。结果显示,在 cisplatin刺激下,WT小鼠和Tet2基因敲除小鼠的血肌酐和尿素氮水平均明显升高,表明两者的肾脏功能均出现了损伤,但相较于WT小鼠,Tet2基因敲除小鼠在cisplatin刺激下,血肌酐和尿素氮数值升高更加明显,提示肾脏受到更严重的急性损伤(图5A,B)。注射cisplatin 72h后,终止实验并获取小鼠肾脏,进行组织HE染色,镜下选取不同视野并根据规则对各组小鼠肾脏HE片子进行肾小管损伤评分,结果显示注射cisplatin的Tet2基因敲除小鼠肾脏较其他组小鼠肾小管结构破坏更严重并伴有大量损伤产物堆积(图5C,D)。此外,Tet2基因敲除小鼠在注射cisplatin后,AKI的生物标志物KIM-1和NGAL基因表达水平明显高于其他组别(图5E,F)。实验结果表明Tet2基因敲除会加剧cisplatin引起的肾小管损伤并导致严重的肾功能障碍。
4.2过表达Tet2缓解cisplatin引起的AKI
WT小鼠尾静脉注射空载/Tet2正常/突变质粒用以实现Tet2基因过表达,检测结果显示相较于其他组别,Tet2正常及突变质粒注射组小鼠肾脏内Tet2基因表达明显增加。在质粒注射24h后通过腹腔注射cisplatin用以诱导AKI,并在不同时间点进行眼球取血检测小鼠血肌酐和尿素氮水平,在72h时终止实验。数据显示注射cisplatin后的不同时间点,Tet2正常质粒组小鼠血肌酐和尿素氮升高数值低于空载质粒组和Tet2突变质粒组(图6A,B)。小鼠肾组织HE染色结果及肾小管评分表明Tet2正常质粒组小鼠在注射cisplatin后,较空载质粒组和Tet2 突变质粒组小鼠,肾小管损伤得到缓解(图6C,D)。在Tet2正常质粒组小鼠肾脏组织中,急性损伤标志产物KIM-1和NGAL基因表达明显降低(6E,F)。以上结果表明过表达Tet2基因可以缓解WT小鼠因cisplatin注射引起的急性肾损伤。
五、Tet2在AKI中的抗炎作用
5.1小鼠肾脏转录组测序结果
选取了正常WT小鼠/Tet2基因敲除小鼠及药物处理的WT小鼠/Tet2基因敲除小鼠的肾脏进行转录组测序。测序结果表明大量与代谢相关的基因表达下降,将表达有差异的基因进行归纳总结,数据表明正常小鼠组和cisplatin注射组小鼠, PPAR信号通路内的基因均存在表达差异。此外,在cisplatin注射小鼠组,Tet2 KO 小鼠相较于WT小鼠,有许多炎症基因表达上调。提示炎症反应和PPAR信号通路可能在cisplatin引起的AKI中发挥重要作用。
5.2Tet2在AKI中通过抑制炎症反应保护肾脏功能
Tunel检测和BAX、Bcl2蛋白免疫组化实验对凋亡在cisplatin引起的AKI 中作用的研究证实了Tet2基因不是通过凋亡在cisplatin引起的AKI中发挥作用 (图7)。BAX,Bcl2蛋白的免疫组化实验结果表明,相较于正常WT和Tet KO 小鼠,注射cisplatin的WT和Tet2KO小鼠肾脏内BAX蛋白表达增加,Bcl2表达降低,但两组之间的蛋白表达差异并不明显(图7A,B)。Tunel检测结果显示注射cisplatin的WT和Tet2 KO小鼠肾脏,凋亡信号相较于正常WT、Tet2 KO 小鼠有明显增加,但数量仍然较少,并且两组之间并没有显著性差异(图7C,D)。
排除了凋亡在cisplatin引起的AKI中的影响,随后本发明对PPAR信号通路和炎症基因的q-PCR结果证明cisplatin注射的Tet2 KO小鼠相较于其他三组小鼠,肾脏内炎症基因表达明显增加(图8A),与PPAR信号通路相关的基因表达则明显降低(图8B)。在注射cisplatin的Tet2基因过表达小鼠中,注射了Tet2正常质粒的小鼠肾脏内炎症基因相较于注射空载质粒和Tet2突变质粒组小鼠表达明显下降(图8C),与PPAR信号通路相关基因表达明显回复(图8D)。研究结果提示在cisplatin诱导引起的AKI中,Tet2基因可能参与调控PPAR信号通路内的CYP4a14,APOC3,ACOX2,ACOX3等基因表达,进而抑制下游炎症因子的表达。
- 地西他滨在制备治疗急性肾损伤药物中的应用
- 地西他滨和奥沙利铂在制备治疗肾细胞癌组合药物中应用
