小分子化合物NSC48160在制备治疗非酒精性脂肪性肝病的药物中的应用
文献发布时间:2023-06-19 19:05:50
技术领域
本发明涉及医药技术领域,尤其涉及小分子化合物NSC48160在制备治疗非酒精性脂肪性肝病的药物中的应用。
背景技术
非酒精性脂肪性肝病(Non-alcohol fatty liver disease,NAFLD)是目前临床上较为常见的肝病之一,其发病起因及发病机制十分复杂,是一种在非过量饮酒的基础上,脂肪在肝脏中大量累积所导致的代谢应激性肝损伤。基于城市人口的抽样调查表明,我国成人脂肪肝发病率在12.5%~35.4%,并逐渐趋于年轻化。我国脂肪肝人群已达到2亿之多,且约有10%的患者会发展为肝硬化,12.8%的患者在三年后会发展为肝癌,所以非酒精性脂肪性肝病已经成为危害人类健康的重大疾病之一。
然而,目前临床上仍没有研制出针对这个疾病的特效药物。大多数通过保肝药以及降血脂的药物或者适应健康的生活方式例如锻炼身体、健康饮食来防治。并且目前的药物在不同程度上有一定的副作用,反而加重了肝脏的负担。因此,创新研发相关安全有效的药物对于防止非酒精性脂肪性肝病的发生发展具有重要的意义。
发明内容
本发明的目的在于提供小分子化合物NSC48160在制备治疗非酒精性脂肪性肝病的药物中的应用,表明NSC48160能够通过多种途径实现对于非酒精性脂肪性肝病、肥胖及对脂代谢紊乱等代谢综合症的改善。
为了实现上述发明目的,本发明提供以下技术方案:
本发明提供了小分子化合物NSC48160在制备治疗非酒精性脂肪性肝病的药物中的应用,小分子化合物NSC48160的分子结构式为:
优选的,所述小分子化合物NSC48160能够减少肝细胞中脂质堆积。
优选的,所述小分子化合物NSC48160重编程脂肪变性能量代谢表型从而改善脂质代谢紊乱。
优选的,所述小分子化合物NSC48160降低非酒精性脂肪性肝病动物体重和肝重。
优选的,所述小分子化合物NSC48160提高高密度脂蛋白胆固醇水平和/或降低肝脏总胆固醇、甘油三酯、低密度脂蛋白胆固醇的水平。
优选的,所述小分子化合物NSC48160提高脂质氧化标志蛋白p-ACC和/或PPARα水平以及降低脂肪酸合成酶蛋白FAS和/或固醇类调节元件结合蛋白SREBP-1C水平。
优选的,所述非酒精性脂肪性肝病为高脂饮食导致的非酒精性脂肪性肝病。
本发明还提供了所述小分子化合物NSC48160在制备腺苷酸活化蛋白激酶AMPK激活剂中的应用。
本发明还提供了所述小分子化合物NSC48160在制备谷草转氨酶和/或谷丙转氨酶抑制剂中的应用。
本发明提供了小分子化合物NSC48160在制备治疗非酒精性脂肪性肝病的药物中的应用,小分子化合物NSC48160是4-叔丁基-2-环己基氨基邻甲苯酚,其结构式如式Ⅰ:
它具有抗肿瘤、降脂的药理活性,截至目前,国内外均未报道过本专利涉及的化合物治疗脂肪性肝病的疗效,因此对于该化合物投入了深入研究;采用体外动物模型和体外细胞模型以NSC48160进行实验,通过高脂饮食(High-fat diet,HFD)诱导建立小鼠NAFLD模型,证明了该药物显著降低肝脏中脂肪堆积,减轻NAFLD小鼠肝重及体重;经血清生化指标检测,证明了NSC48160可以降低高脂饮食小鼠的血清甘油三酯(triglyceride,TG)、总胆固醇(Total cholesterol,T-CHO)和低密度脂蛋白胆固醇(Low-density lipoproteincholesterol,LDL-C)的水平,同时可提高高密度脂蛋白胆固醇(High-densitylipoprotein cholesterol,HDL-C)水平;此外,NSC48160可恢复由高脂饮食造成的肝功能损伤指标谷草转氨酶(Aspartate aminotransferase,AST)和谷丙转氨酶(Alanineaminotransferase,ALT)异常状况,进而改善肝脏功能。同时,NSC48160可通过激活AMPK表达来调节肝脏脂质代谢,降低FAS以及SREBP-1C的表达减少脂肪合成,从而达到治疗NAFLD的目的。在体外模型中,采用游离脂肪酸(Free fatty acids,FFAs)诱导人肝癌HepG2和BEL-7402细胞构建NAFLD细胞模型,结果发现NSC48160能够显著促进磷酸化AMPK的表达,同时明显抑制由FFAs造成的脂肪酸合成酶蛋白FAS及固醇类调节元件结合蛋白SREBP-1C的表达,提高AMPK的表达以及脂质氧化蛋白p-ACC和PPARα的表达,此外重编程脂肪变性能量代谢表型来改善脂质代谢紊乱,从而分别抑制脂质从头合成途径和促进脂质氧化途径。综上所述,NSC48160在制备治疗非酒精性脂肪性肝病的药物中具有重要作用。
附图说明
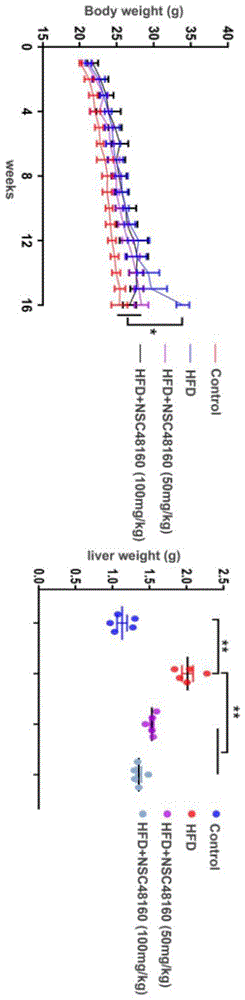
图1为小分子化合物NSC48160治疗4周后HFD小鼠的体重和肝重情况(Control:为正常饲料喂养;HFD:高脂饲料喂养);
图2为小分子化合物NSC48160治疗4周后HFD小鼠肝脏内脂质沉积情况;
图3为小分子化合物NSC48160治疗4周后HFD小鼠肝脏甘油三酯(T G)、总胆固醇(T-CHO)、低密度脂蛋白胆固醇(LDL-C)和高密度脂蛋白胆固醇(HDL-C)含量图;
图4为小分子化合物NSC48160治疗4周后HFD小鼠肝脏肝功能损伤指标-谷草转氨酶(AST)和谷丙转氨酶(ALT)变化图;
图5为小分子化合物NSC48160治疗4周后肝、心、脾、肺、肾脏器情况图;
图6为小分子化合物NSC48160治疗4周后HFD小鼠脂肪酸合成酶蛋白FAS及固醇类调节元件结合蛋白SREBP-1C表达情况,细胞活性中心腺苷酸活化蛋白激酶AMPK的表达情况、脂质氧化蛋白p-ACC、PPARα表达情况图;
图7为小分子化合物NSC48160显著降低脂质堆积图;
图8为小分子化合物NSC48160重编程脂肪变性能量代谢表型改善脂质代谢紊乱图;
图9为小分子化合物NSC48160治疗油酸、棕榈酸(OA/PA)构成的高脂细胞模型中脂肪酸合成酶蛋白FAS及固醇类调节元件结合蛋白SREBP-1C表达情况,细胞活性中心腺苷酸活化蛋白激酶AMPK的表达情况、脂质氧化蛋白p-ACC、PPARα表达情况图。
具体实施方式
本发明提供了小分子化合物NSC48160在制备治疗非酒精性脂肪性肝病的药物中的应用,本领域技术人员可以借鉴本文内容,适当改进参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过尚好的实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径购买得到。
下面结合实施例对本发明提供的技术方案进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
实施例1
一、建立高脂饲料(HFD)饮食诱导的小鼠非酒精性脂肪肝模型
1.1试验分组
采用C57BL/6小鼠给予高脂饲料(HFD)12周的方法建立非酒精性脂肪肝动物模型,通过腹腔注射的方式给予NSC48160验证其疗效。
1.2具体过程
采用高脂饲料(HFD)喂养小鼠,HFD饲料由74%基础饲料、15%猪油、10%蛋黄粉等构成,喂养小鼠构建模型时间为4个月。HFD诱导的脂肪肝被公认为是NAFLD的经典模型之一,长期喂食HFD的啮齿类动物将自然进展为肝脏脂肪变性,并会伴有肥胖、高脂血症的发生。选取32只C57BL/6J雄性小鼠,经适应环境7天后,随机分入正常饲养(ND)组、高脂饲料(HFD)组、高脂饲料+NSC48160(HFD+NSC48160)组,每组8只小鼠。连续16周给予ND组小鼠正常饲料、HFD组小鼠高脂饲料。HFD+NSC48160组小鼠在喂养基础上进行NSC48160腹腔注射给药;小鼠分为两个实验组,注射量分别为50mg/kg/2days、100mg/kg/2days。
1.3动物处死取材
实验结束后(实验前禁食12h,自由饮水),称完体重后进行眼部取血,随后采用脱颈椎法处死小鼠。
肝脏采摘,取最大肝叶部位组织约300mg,放入RNase free冻存管,投入液氮中,再转入-80℃冰箱保存备用。取相同部位中间组织约400mg,大小约1cm×1cm×0.5cm,用10%甲醛溶液固定,备用。再取肝右叶组织若干块,每块300mg,分别置于10mL EP管中,保存于-80℃备用。
二、作用研究
2.1对于非酒精性脂肪肝的肝重及体重的影响
a)处死前测定小鼠体重,解剖小鼠剥离肝脏进行称量;
b)结果分析:如图1所示,NSC48160治疗可以显著降低HFD小鼠的肝重及体重,提示其具有减重的效果。
2.2对于非酒精性脂肪性肝病的肝脏中甘油三酯(TG)、总胆固醇(T-CHO)和低密度脂蛋白胆固醇(LDL-C)及高密度脂蛋白胆固醇(HDL-C)含量的影响
a)按照南京建成公司TG、T-CHO、LDL-C及HDL-C测定商品试剂盒说明书进行测定小鼠肝脏组织中以上生化指标的含量;
b)结果分析:如图3所示,NSC48160治疗4周可以显著降低小鼠的肝脏甘油三酯(TG)、总胆固醇(T-CHO)和低密度脂蛋白胆固醇(LDL-C)并提高高密度脂蛋白胆固醇(HDL-C)含量。
2.3对于非酒精性脂肪性肝病小鼠的肝、心、脾、肺、肾等脏器形态及病理组织切片结果的观察
a)通过HE染色和油红O染色测定NSC48160治疗对于非酒精性脂肪肝的影响;
b)测定方法:
苏木素伊红(hematoxylin and eosin,H&E)染色:(1)制备肝脏石蜡切片:统一取小鼠肝中叶中间2/3,置于包埋盒后浸入10%中性福尔马林,过夜固定,继续脱水、透明,制备肝脏石蜡包埋块后,制备厚度5μm的肝脏石蜡切片,75℃温箱烘烤1h后,室温保存备用;(2)取出待染肝脏石蜡切片,切片入苏木素染液染5min,自来水洗,分化液分化,自来水洗,返蓝液返蓝,流水冲洗;(3)切片依次入85%、95%的梯度酒精脱水各5min,入伊红染液中染色5min;(4)切片依次放入无水乙醇I 5min-无水乙醇II 5min-无水乙醇Ⅲ5min-二甲Ⅰ5min-二甲苯Ⅱ5min透明,中性树胶封片;(5)显微镜镜检,图像采集分析。
油红O染色:(1)实验前准备工作:统一取小鼠肝中叶下1/3,将其完全浸入包埋剂,于液氮-空气交界面急速冷冻至OCT完全凝固,制备肝脏冰冻组织包埋块,-20℃保存备用;切片当日,于-20℃冰冻切片机进行肝脏切片,厚度8μm,肝脏冰冻切片于-80℃冰箱保存备用;(2)将冰冻切片复温干燥,固定液中固定5min,自来水洗,晾干;(3)切片入油红染液浸染10min,加盖避光;(4)取出切片,停留3s后依次浸入两缸60%异丙醇分化,各3s、5s,切片依次浸入2缸纯水中浸洗,各10s;(5)取出切片,停留3s后浸入苏木素复染5min,3缸纯水浸洗,各5s、10s、30s,分化液(以60%酒精为溶剂)分化5s,2缸蒸馏水洗各10s,返蓝液返蓝1s,将切片轻轻浸入2缸自来水中浸洗,各5s、10s,镜检染色效果;(6)甘油明胶封片剂封片;(7)白光显微镜下观察并拍照,随机不连续采集视野。
c)结果分析:如图5肝脏H&E染色结果所示,HFD组喂养小鼠肝细胞出现较为明显的气球样变,脂肪变性面积明显高于ND喂养小鼠;经NSC48160治疗后,肝细胞气球样变性程度减弱、脂肪变性面积明显减小;同时,给药治疗后,NSC48160未对心、脾、肺、肾等脏器造成损伤。与肝脏H&E染色结果一致,油红O染色结果如图2显示,HFD喂养小鼠肝细胞内红色脂滴阳性面积明显高于ND组喂养的小鼠,肝细胞脂滴红色阳性面积明显减少;经过4周NSC48160治疗,并且肝脏大体形态显示,ND组喂养小鼠肝脏形态正常,色泽红润,质地柔软,HFD喂养小鼠肝脏体积偏大,色泽土黄,质地较硬,表面油腻感较明显,提示该组小鼠产生脂肪囤积的现象;在给予NSC48160治疗后,肝脏体积相比高脂饮食组减小,色泽、质地均有改善,触及表面无油腻感。
2.4NSC48160对于非酒精性脂肪性肝病的肝功能损伤指标-谷草转氨酶(AST)和谷丙转氨酶(ALT)含量的影响
a)测定方法:按照小鼠肝脏AST及ALT测定商品试剂盒说明书进行测定;
b)结果分析:如图4所示,NSC48160治疗4周后显著降低HFD小鼠肝脏肝功能损伤指标-谷草转氨酶(AST)和谷丙转氨酶(ALT)。
2.5对于非酒精性脂肪性肝病的FAS、SREBP-1C、p-ACC、AMPK和PPARα蛋白表达的观察
a)通过Westernblot测定NSC48160治疗对于非酒精性脂肪性肝病蛋白表达的影响;
b)测定方法:
(1)总蛋白提取:取保存在4%多聚甲醛溶液中肝组织大约100mg,使用组织匀浆器将各组肝组织研磨成匀浆,另加入适量IP组织裂解液(含磷酸酶抑制剂、蛋白酶抑制剂和PMSF),冰上裂解30min,超声破碎后,在4℃条件下,12000rpm离心8min,转移上清至新EP管;
(2)使用BCA法测定总蛋白浓度:标准品准备:将蛋白标准(30mg BSA)配制成25mg/mL的蛋白标准溶液;取40μL蛋白标准溶液,加入1960μL去离子水,稀释至终浓度为0.5mg/mL,配制后可立即使用,也可以放-20℃冰箱保存备用;BCA工作液配制及蛋白浓度测定:将BCA试剂A和B按50:1比例配制适量的BCA工作液,两者充分混匀,将蛋白标准溶液浓度分别稀释成0、0.025、0.05、0.1、0.2、0.3、0.4、0.5mg/mL,每个样品取2μL加入到标记好的96孔板中,补加18μL去离子水至20μL。加入200μL/孔制备好的BCA工作液至每个待处理样品中,在无CO
(3)①配胶、上样及电泳:利用PAGE凝胶快速制备试剂盒配制方法:取等体积4.0mL的下层胶缓冲液和下层胶溶液,充分吹打混匀;向上述步骤的下层胶混合溶液中加入改良型促凝剂80μL,充分吹打混匀;将上述步骤中的混合溶液注入配胶厚、薄玻璃板中,使混合溶液的液面和薄玻璃板上沿之间的距离比梳齿长50mm即可,随后注入1mL去离子水覆盖在下层胶溶液上层;室温下,10min后下层胶可凝固,去除上层覆盖的去离子水;取等体积1.0mL的彩色上层胶缓冲液和上层胶溶液,充分吹打混匀;向上述步骤的上层胶混合溶液中加入改良型促凝剂20μL,充分吹打混匀;将上述步骤的上层胶混合溶液注入厚、薄玻璃板中,插入制胶梳子;室温下,15min后,上层胶可凝固后,拔去梳子即可进行蛋白电泳;在凝胶加样孔加入25μg/孔蛋白样品开始电泳,上层胶时采用80V电泳,电泳至下层胶中时转换为120V继续电泳,当样品前端的溴酌蓝电泳至下层胶下边缘时,可停止电泳;②转膜:将PVDF膜提前浸泡到甲醇溶液中,然后转入膜转缓冲液中;在转膜仪上提前铺好湿润过的转膜滤纸,随后将PVDF膜铺在转膜滤纸上,在制胶玻璃板之间取出凝胶,将其放在已铺好的PVDF膜上,最后将另外的转膜滤纸覆盖在凝胶上;采用15V,40min进行电转膜;③封闭:使用质量浓度为5%(W/V)脱脂奶粉的1×TBST封闭液室温封闭不少于3h,水平摇床50rpm;④抗体孵育及洗膜:用封闭液将抗FAS、SREBP-1C、p-ACC、CPT-1A和PPARα一抗稀释为1:1000,然后将抗体与封闭完毕的PVDF膜4℃孵育过夜;抗体孵育结束后,水平摇床100rpm,1×TBST洗PVDF膜5次,每次洗膜6min;用封闭液稀释对应种属的二抗(1:1000),室温静置放置PVDF膜,孵育40min;二抗孵育结束后,水平摇床100rpm,1×TBST洗PVDF膜5次,每次洗膜6min;⑤显影及曝光:采用超敏ECL化学发光溶液进行显影,使用DNRBio-Imaging Systems化学发光成像仪进行曝光。
c)结果分析:如图6所示,NSC48160治疗4周后显著降低HFD小鼠由HFD造成的脂肪酸合成酶蛋白FAS及固醇类调节元件结合蛋白SREBP-1C表达,激活乙酰辅酶羧化酶p-ACC的表达,提高脂质氧化蛋白PPARα表达以及调控细胞代谢的关键激酶AMPK。
实施例2
一、建立体外细胞模型
选用HepG2及BEL-7402肝癌细胞系和原代分离的小鼠肝细胞,以10%FBS的DMEM培养基中同时含200μM的油酸和100μM的棕榈酸来培养HepG2细胞24h,成功建立HepG2细胞脂肪变性模型后,再加入NSC48160作用达24h,同时设置对照组(以含DMEM高糖培养基培养HepG2细胞)。
二、作用研究
2.1药物对于脂滴消散的作用
a)测定方法:脂滴染色:(1)HepG2与BEL-7402细胞培养24h后,弃掉HepG2与BEL-7402细胞对应细胞培养基,用PBS清洗2次,加ORO Fixative细胞固定液固定30min;(2)弃掉HepG2与BEL-7402细胞对应孔的ORO Fixative细胞固定液,用Mill-Q水清洗SMMC-7721与BEL-7402细胞3次;(3)每个细胞培养孔中加入已配置好的60%异丙醇溶液,室温将HepG2与BEL-7402细胞放置5min;(4)用移液枪将每孔的60%异丙醇溶液吸掉,加入已配制好的OROStain染色液(现用现配)至HepG2与BEL-7402细胞中,室温浸染15min;(5)弃掉HepG2与BEL-7402细胞中的ORO Stain染色液,使用Mill-Q水清洗3次,直到每个培养孔中无多余OROStain染色液;(6)接下来向HepG2与BEL-7402细胞中加入Mayer苏木素染色液,在室温条件下,复染细胞核2min,弃去HepG2与BEL-7402细胞中Mayer苏木素染液后,使用Mill-Q水清洗各个细胞培养孔4次;(7)随后向每孔HepG2与BEL-7402细胞中入ORO Buffer,室温放置1min,弃掉;(8)加Mill-Q水覆盖细胞并在光学或荧光显微镜下观察HepG2与BEL-7402细胞中脂滴情况。
b)结果分析:如图7所示,NSC48160干预可以明显降低造模情况下肝细胞的脂质沉积。
2.2检测NSC48160对BEL-7402模型细胞能量代谢
a)通过体外流量分析系统测定NSC48160对HepG2与BEL-7402模型细胞能量代谢的影响;
b)测定方法:
线粒体有氧呼吸压力测试实验:
(1)采用常规细胞培养操作,将细胞悬液接种于对应培养基中,并将细胞数目调整到所适合数量;将游离脂肪酸FFAs加入细胞悬液中,DMEM培养基定容至50μL,过夜培养;
(2)枪头贴壁倾斜缓慢加入50μL细胞悬浮液于Mini-plate细胞培养板的微孔中(空白背景孔只添加培养基)边孔每孔添加400μLPBS(防止蒸干),然后37℃,5%CO
(3)水化探针:在探针板每孔中加入200μL水化平衡液,边孔每孔加400μL水化平衡液,然后置于37℃无CO
(4)准备分析用培养基:称取葡萄糖0.45g,加入2000μL超纯水,充分混匀溶解,使其终浓度为2.5M;称取谷氨酰胺0.1461g,加入5000μL超纯水,充分混匀溶解,使其终浓度为0.2M;称取丙酮酸钠0.11g,加入10000μL超纯水,充分混匀溶解,使其终浓度为0.1M;取200μL葡萄糖,200μL谷氨酰胺,100μL丙酮酸钠加入到9500μL不含血清、碳酸氢盐的细胞基础培养基中,待分析培养基温度达到37℃时,用1mM NaOH溶液调整其pH至7.3;
(5)Seahorse体外流量分析仪机器开机预热至37℃方可使用;
(6)代谢调节药物配制:Oligomycin加入252μL分析培养基,使其终浓度为1μM;FCCP加入288μL分析培养基0.5μM;Rotenone/antimycinA加入216μL分析培养基0.5μM,注:FCCP浓度需根据细胞种类而定;
(7)手动换液:取前一天培养的细胞,用移液器吸取培养基使其保留为20μL体积;每孔分别加入200μL已配制好的分析培养基进行清洗并全部吸掉,重复本步骤一次;每孔分别加入160μL分析培养基,最终使每孔分析培养基的终体积为180μL,放置无CO
(8)上机:选择线粒体程序,探针板进入程序自动校正,校正好后探针板底板自行退出程序,取出探针板底板换上已经制备好的样品细胞板培养板,确认程序进行;待分析完成后,用Wave软件打开原始数据处理数据糖酵解测试实验:糖酵解测试实验(1)~(3)步骤同线粒体有氧呼吸压力测试实验(1)~(3)步骤;(4)准备分析用培养基:称取谷氨酰胺0.1461g,加入5000μL超纯水,充分混匀溶解,使其终浓度为0.2M;取200μL谷氨酰胺加入到9800μL不含血清、碳酸氢盐的细胞基础培养基中,待分析培养基温度达到37℃时,用1mMNaOH溶液调整其pH至7.4;(5)同线粒体有氧呼吸压力测试实验步骤(5);(6)代谢调节药物配制:Glucose加入300μL分析培养基,使其终浓度为10mM;Oligomycin加入288μL分析培养基10mM;2-DG加入300μl分析培养基50mM;(7)手动换液:取前一天培养的细胞,用移液器吸取培养基使其保留为20μL体积;每孔分别加入200μL已配制好的分析培养基进行清洗并全部吸掉,重复本步骤一次;每孔分别加入160μL分析培养基,最终使每孔分析培养基的终体积为180μL,放置无CO
c)结果分析:如图8所示,NSC48160治疗脂肪变性模型后重编程脂肪变性能量代谢表型来改善脂质代谢紊乱。
综上,结果发现NSC48160对正常饲料(ND)喂养小鼠和HFD小鼠的摄食量正常情况下,可以明显减缓HFD小鼠的体重的上升,以及降低肝重、肝脏甘油三酯(TG)含量,总胆固醇(T-CHO)和低密度脂蛋白胆固醇(LDL-C)并提高高密度脂蛋白胆固醇(HDL-C)含量改善了肝脏的脂质沉积,同时,改善肝功能损伤指标-谷草转氨酶(AST)和谷丙转氨酶(ALT),并未对其他脏器造成明显的损伤。根据肝脏蛋白表达情况发现,NSC48160可明显改善脂质相关合成及氧化蛋白的表达,进而改善脂代谢紊乱。除体内动物模型以外,还建立了2种肝细胞脂质沉积的体外细胞模型(包括肝癌细胞HepG2+FFAs模型和肝癌细胞BEL-7402+FFAs模型),发现NSC48160在具有细胞保护作用的情况下可降低肝模型细胞的脂质堆积。此外,NSC48160可利用重编程脂肪变性细胞模型能量代谢表型来改善脂质代谢紊乱。最终达到治疗非酒精性脂肪性肝病的目的。
2.3对于高脂模型细胞及加药后细胞的FAS、SREBP-1C、p-ACC、AMPK和PPARα蛋白表达的观察
a)测定方法:与测定动物蛋白的方法类似。
b)结果分析:如图9所示,在NSC48160加入后显著降低高脂细胞模型中脂肪酸合成酶蛋白FAS及固醇类调节元件结合蛋白SREBP-1C表达,提高乙酰辅酶羧化酶p-ACC的表达,提高脂质氧化蛋白PPARα表达以及调控细胞代谢的关键激酶AMPK。与动物蛋白检测结果类似。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 小分子化合物双水杨酸酯在制备治疗非酒精性脂肪肝病药物中的应用
- 苦蘵中睡茄内酯提取物在制备预防或治疗非酒精性脂肪性肝病的药物中应用
