遗传性耳聋基因分型试剂盒
文献发布时间:2024-01-17 01:26:37
技术领域
本申请属于分子检测技术领域,具体涉及一种遗传性耳聋基因分型试剂盒。
背景技术
耳聋是一种常见感觉障碍性疾病,耳聋病因复杂,目前研究认为约60%重度耳聋的发病与遗传有关。遗传性耳聋主要涉及四种遗传方式:常染色体隐性、常染色体显性、线粒体遗传、性染色体连锁遗传。
耳聋具有显著的遗传异质性,不同的种族中常见的致聋基因不同,进化过程造成了人种间遗传差异、人群迁徙和血源融合又导致了局部地区人群遗传背景的复杂化。遗传性耳聋中约有30%为综合征型耳聋,70%为非综合征型耳聋。其中,非综合征型常染色体隐性耳聋最常见,约占80%。在我国,约70%的遗传性耳聋变异来自于GJB2、SLC26A4、GJB3及线粒体DNA 12SrRNA等4个常见致聋基因。
遗传性耳聋基因突变检测在遗传性耳聋的辅助诊断以及新生儿遗传性耳聋基因突变筛查等领域有重要意义。目前,用于检测基因多态性的方法很多,近年来市场上建立了许多新的SNP分型方法和技术,如sanger测序、变性高压液相色谱分析(DHPLC),引物延伸结合飞行时间质谱分析(MALDI-TOF MS),动态等位基因特异性杂交(dynamic allelespecific hybridization)和基因芯片法、TaqMan探针技术、焦磷酸测序技术等。这些技术虽然能完成对SNP的检测,但应用上也有些不足。有些检测过程繁琐,需要限制性内切酶消化;有些需两步PCR扩增反应:有些新技术虽具有通量高、易于自动化等优点,但要求成本昂贵的仪器设备;还有些技术重复性差、结果不易判读、检测位点少、检测通量低、检测周期长、检测费用高等。
相对于上述这些基因多态性技术的局限性,建立一种多重荧光PCR结合毛细管电泳平台的基因分型扩增检测技术,不仅能够结合了以上技术的多种优势,并且还有操作简单、成本低、通量高、周期短、特异性好、灵敏度高、易于判型等特点。虽然现有技术中有个别类似耳聋检测体系,比如专利CN102534031A,但其不足明显。比如,该专利技术检测位点不全面,仅包含12个位点;该专利技术无法准确区分位点是杂合还是纯合突变,尤其是点突变,而实践中明确位点的准确分型(野生/杂合/突变纯合),在临床诊断中是极为重要的,该专利复合Indel类型突变判读繁琐,甚至需要推断;另外,该专利技术个别位点是基于一对引物进行区分,无法直接靶向特定位点,体现的非直接性的检测证据,故对于结果的判断存在一定不可信情况。为解决以上相关判读不够直接,检测不够明确等问题,提出本申请。
发明内容
为克服上述现有技术中的问题,本申请提出一种基于毛细管电泳的遗传性耳聋基因分型扩增检测体系及其试剂盒。该试剂盒较市面已有的检测试剂盒具有操作简单、便捷、特异性强、灵敏度高、通量高、可靠性强、可拓展性和成本低等特点,并且还具有一定的指示性作用。
具体的,本申请通过以下技术方案进行实现:
本申请首先提供一种基于毛细管电泳的遗传性耳聋基因分型扩增的引物组合物,所述引物组合针对GJB2、GJB3、SLC26A4和12S rRNA 4个基因的SNP位点。
进一步的,所述SNP位点包括如下:
rs80338939、rs72474224、rs750188782、rs80338943、rs1291519904、rs111033204、rs80338948、rs773528125、rs74315319、rs74315318、rs1057516953、rs111033380、rs768245266、rs111033313、rs201562855、rs111033305、rs111033220、rs192366176、rs200455203、rs111033318、rs121908363、rs121908362、rs267606619和rs267606617。
详细如下:
进一步的,所述引物序列如下:
GJB2基因c.35delG/c.35insG位点:
正向野生型引物:
正向突变型引物(c.35delG):
正向突变型引物(c.35insG):
GJB2基因c.109G>A位点:
正向野生型引物:
正向突变型引物:
GJB2基因c.176_191del16位点:
正向野生型引物:5’-GATCGTAGCACACGTTCTTG
正向突变型引物:
GJB2基因c.235delC位点:
正向野生型引物:5’-ACACGAAGATCAGCTGCAG
正向突变型引物:
GJB2基因c.257C>G位点:
正向野生型引物:
正向突变型引物:
GJB2基因c.35delG/c.35insG、c.109G>A、c.176_191del16、c.235delC、c.257C>G位点反向共用引物:
GJB2基因c.299_300delAT位点:
正向野生型引物:5’-ATGCACGTGGCCTACCGGAGA
正向突变型引物:5’-
GJB2基因c.427C>T位点:
正向野生型引物:
正向突变型引物:
GJB2基因c.511_512insAACG位点:
正向野生型引物:5’-GCTGGTGAAGTGCAACGCCT-3’,
正向突变型引物:5’-GCTGGTGAAGTGCAAC
GJB2基因c.299_300delAT、c.427C>T、c.511_512insAACG位点反向共用引物:5’-AGTGACATTCAGCAGGATGCAAAT-3’;
GJB3基因c.538C>T位点:
正向野生型引物:5’-ACATCGTGGA
正向突变型引物:
GJB3基因c.547G>A位点:
正向野生型引物:5’-
正向突变型引物:
GJB3基因c.538C>T、c.547G>A位点反向共用引物:5’-GCAACCCCCTCGAGGCTTGTCC-3’;
SLC26A4基因c.281C>T位点:
正向野生型引物:5’-
正向突变型引物:
反向共用引物:5’-AGCACTTCAGGGTTATTATTTTCC-3’;
SLC26A4基因c.589G>A位点:
正向野生型引物:5’-GCCAGTGCCCTGACTCTGCTGG
正向突变型引物:
反向共用引物:5’-GATGATAAGTGAGCCTTAATAAGTG-3’;
SLC26A4基因c.917insG位点:
正向野生型引物:
正向突变型引物:
SLC26A4基因c.IVS7-2 A>G位点:
正向野生型引物:
正向突变型引物:
SLC26A4基因c.917insG、c.IVS7-2 A>G位点反向共用引物:5’-ATTGGTGATACCAATCTTGCTGAT-3’;
SLC26A4基因c.1174A>T位点:
正向野生型引物:5’-ATTCATTGCCTTTGGGATCA
正向突变型引物:
SLC26A4基因c.1226G>A位点:
正向野生型引物:
正向突变型引物:
SLC26A4基因c.1229C>T位点:
正向野生型引物:
正向突变型引物:
SLC26A4基因c.1174A>T、c.1226G>A、c.1229C>T位点反向共用引物:5’-AGGGAGTGGAACAAGAGGAATAG-3’;
SLC26A4基因c.IVS15+5G>A位点:
正向野生型引物:
正向突变型引物:
反向共用引物:
SLC26A4基因c.1975G>C位点:
正向野生型引物:
正向突变型引物:
SLC26A4基因c.2027T>A位点:
正向野生型引物:
正向突变型引物:
SLC26A4基因c.1975G>C、c.2027T>A位点反向共用引物:5’-TACAAAGCCCATGTATTTGCCC-3’;
SLC26A4基因c.2162C>T位点:
正向野生型引物:
正向突变型引物:
SLC26A4基因c.2168A>G位点:
正向野生型引物:
正向突变型引物:
SLC26A4基因c.2162C>T、c.2168A>G位点反向共用引物:5’-ATTCAGTACTGGGTACTACCAGGT-3’;
12SrRNA基因m.1494C>T位点:
正向野生型引物:5’-GTCCTTTGAAGTATACTTGAG
正向突变型引物:
反向共用引物:5’-CAAACCCTGATGAAGGCTACAAAG-3’;
12SrRNA基因m.1555A>G位点:
正向野生型引物:
正向突变型引物:
反向共用引物:5’-ATGGTTTGGCTAAGGTTGTCTGGT-3’;
优选的,还包括:
内参基因位点:
正向引物:
反向引物:5’-ACCTACTGTGCACCTACTTAATACAC-3’;
其中,其中:所述“-”单下划线表示在初始引物序列上的错配碱基;所述“=”双下划线表示在初始引物序列上增加的碱基;所述“▂”粗下划线代表各引物在相应位置进行锁核酸修饰。
进一步的,所述引物中,正向野生型引物:正向突变型引物:反向共用荧光引物=0.5~2.0:0.5~2.0:1.0~3.0。
进一步的,上述引物上添加有修饰或以修饰碱基取代正常碱基,所述修饰为荧光集团修饰、磷酸化修饰、硫代磷酸化修饰、锁核酸修饰或肽核酸修饰,以及包括但不限于上述修饰。
优选的,所述引物被荧光标记;
更优选的,所述荧光标记位于反向共用引物的5’端,或内参基因正向引物的5’端。
进一步优选的,所述荧光标记为FAM荧光标记和HEX荧光标记;
比如,所述FAM荧光标记针对如下位点:GJB2基因9个位点:c.35delG、c.35insG、c.109G>A、c.176_191del16、c.235delC、c.257C>G、c.299_300delAT、c.427C>T、c.511_512insAACG,GJB3基因2个位点:c.538C>T、c.547G>A,和mt 12SrRNA基因2个位点:m.1494C>T、m.1555A>G;
所述HEX荧光标记针对如下位点:SLC26A4基因12个位点:c.281C>T、c.589G>A、c.917insG、c.IVS7-2 A>G、c.1174A>T、c.1226G>A、c.1229C>T、c.IVS15+5G>A、c.1975G>C、c.2027T>A、c.2162C>T、c.2168A>G,和内参位点。
本申请还提供一种遗传性耳聋基因分型的复合扩增体系,包括上述任一所述的引物组合物。
本申请还提供一种遗传性耳聋基因分型的试剂盒,包括上述任一所述的引物组合物
进一步的,所述试剂盒进一步包括:热启动Taq DNA聚合酶、PCR扩增缓冲液、质控品和内标等。
本申请还提供上述任一所述的引物组合物在遗传性耳聋基因分型中的应用。
本申请还提供上述任一所述的引物组合物在制备遗传性耳聋基因分型试剂盒中的应用。
本申请还提供一种遗传性耳聋基因分型的方法,包括如下步骤:
利用上述任一引物组合物进行扩增的步骤;或,利用任一所述试剂盒进行检测的步骤。
进一步的,所述方法还包括毛细管电泳、数据分析和结果判读的步骤等。
与现有技术相比,本申请至少具有如下优势:
本申请从检测位点组合探索开始,经过引物序列和组合的大量优化工作,最终确立一套检测灵敏度高、特异性好、分辨率高的复合扩增检测体系。
本申请基于一代测序平台进行产物的检测,整体上具有检测灵敏度高、分辨率高、通量高、简单易于操作、便于自动化以及有专业的软件对结果进行判读等特点;同时,本申请还具有其它众多特点:涵盖位点较为全面,包括了25个与遗传性耳聋相关的SNP位点,加入了内参位点,并且,体系本身还加入了UDG-dUTP防污染措施;此外,该发明试剂盒支持血液和血卡的直扩,无需任何处理,免除了提取DNA的步骤;以及该发明还能够针对检测位点之外可能出现的突变给予提示性的说明,便于医生对患者病因的排查。
附图说明
为了更清楚地说明本申请具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本申请的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
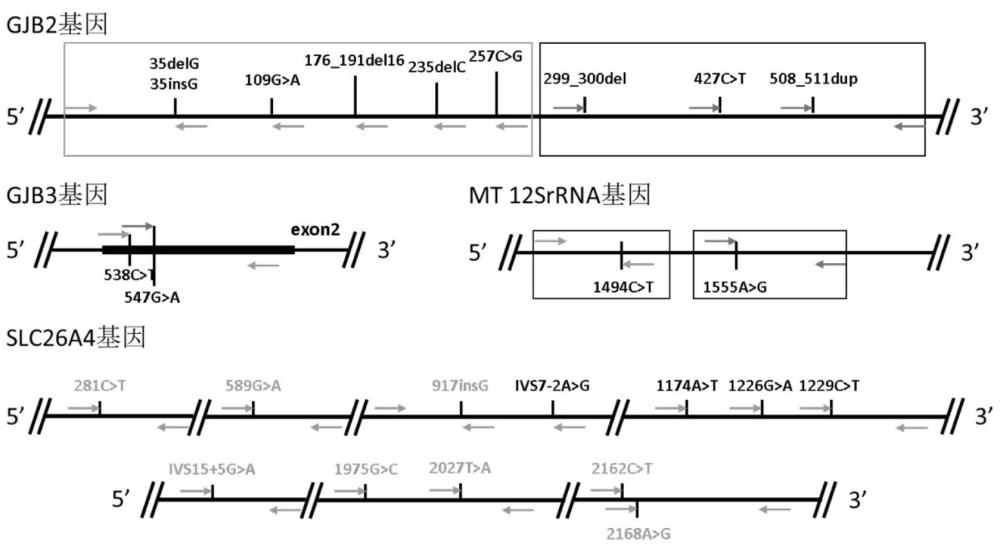
图1、GJB2、GJB3、SLC26A4和mt 12SrRNA四个基因各位点或区域引物设计方案。
图2、GJB2基因c.35delG和c.35insG位点引物测试结果;其中A为35位点野生型引物测试结果,B为35位点三种分型引物组合测试结果。
图3、试剂盒质控品图;其中,上图为质控品1,下图为质控品2。
图4、最低检出限结果图——预估最低检出限单次测试结果,
图5、最低检出限结果图——mt 12SrRNA基因1494位点和1555位点异质性样本20次峰高比值,R1-R20表示重复次数。
具体实施方式
下面将结合附图对本申请的技术方案进行清楚、完整地描述,显然,所描述的实施例是本申请一部分实施例,而不是全部的实施例。基于本申请中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本申请保护的范围。
实施例1:遗传性耳聋基因位点选择、引物组合的优化设计及筛选
本申请首先考虑遗传性耳聋基因筛查相关的指南性规范,临床上意义比较明确的基因位点。其次,还综合考虑到位点本身特性,包括位点在中国人群的基因频率,和位点所处的位置情况,是否支持一管式设计引物扩增,各位点排布如图1,显示部分位点较为集中,而对于多重PCR的难点有,一是位点多,二是位点较为集中。故此,本申请能够综合考虑设计难度、开发难度、生产周期等方面最终确定了检测下述的4个基因25个位点:
GJB2(c.35delG、c.35insG、c.109G>A、c.176_191del16、c.235delC、c.257C>G、c.299_300delAT、c.427C>T、c.511_512insAACG)、GJB3(c.538C>T、c.547G>A)、SLC26A4(c.281C>T、c.589G>A、c.917insG、c.IVS7-2 A>G、c.1174A>T、c.1226G>A、c.1229C>T、c.IVS15+5G>A、c.1975G>C、c.2027T>A、c.2162C>T、c.2168A>G)和mt 12SrRNA(m.1494C>T、m.1555A>G)四个基因共25个位点。
本实施例针对选取的遗传性耳聋相关基因位点进行试剂盒的开发,根据检测靶标基因的特点:位点较为集中,最大限度的选择了上位点,并制定如图1所示的引物设计方案。根据设计方案,等位基因特异性PCR原理,每条特异引物只能与对应基因型的DNA模板结合并进行扩增。而为了避免引物之间的相互扩增、协调扩增效率、改进产物峰型、便于毛细管电泳检测,本申请基于这一引物设计原理,进一步对所有引物进行一系列特定的改动或修饰,包括错配碱基位置的变动、错配碱基的更换、5’碱基尾巴的添加、引物中间碱基的替换以及其他碱基类似物的替换或修饰。
为了进一步的说明本申请的独特性,本实施例继续以示例性的形式来说明引物及其组合的筛选过程。
1)优化例1、引物序列的优化示例
以GJB2基因c.35delG/c.35insG位点区域引物筛选为例,该区域位点引物分别对野生型引物和突变型引物进行了5’端和3’端引入了不同强度的错配(测试引物序列见下表,展示部分,以作说明)。
备注:所述“-”单下划线表示在初始引物序列上的错配碱基;所述“=”双下划线表示在初始引物序列上增加的序列。
上述引物均于生工生物进行合成。引物筛选时,先针对GJB2基因c.35位点单独进行上下游引物混合,进行三种分型进行交叉测试筛选,模板选用10
确定GJB2基因c.35位点各引物后,将该位点各分型检测引物进行混合优化测试(c.35位点的四条引物以1:1:1:1.5比例混合),结果见图2B,其中35W3+35DelG+35insG3组合1扩增各单一模板时,存在较弱的非特异性情况,故此基础上进一步修改优化引物,得到35W+35DelG+35insG组合2,扩增结果最优,确定为该位点目前的最优引物组合。
2)优化例2、反向公用引物设计示例
反向公用引物在设计时,需要考虑扩增效率、同源性、引物结合区是否存在高频SNP;多位点区域共用一个反向公用引物时,由于该区域位点较为固定,只能通过调整公用引物进行片段大小的条件,根据设计方案,在设计时,考虑将GJB2基因位点设计在同一通道,因此还需要避免位点间片段大小的重叠。最终确定GJB2基因c.35delG/c.35insG、c.109G>A、c.176_191del16、c.235delC、c.257C>G位点公用一条反向共用引物,GJB2基因c.299_300delAT、c.427C>T、c.511_512insAACG位点公用一条反向共用引物,GJB3基因c.538C>T、c.547G>A位点公用一条反向共用引物,SLC26A4基因c.917insG、c.IVS7-2 A>G位点公用一条反向共用引物,SLC26A4基因c.1174A>T、c.1226G>A、c.1229C>T位点公用一条反向共用引物,SLC26A4基因c.1975G>C、c.2027T>A位点公用一条反向共用引物,SLC26A4基因c.2162C>T、c.2168A>G位点公用一条反向共用引物。
3)优化例3、多重体系优化示例
为验证多重扩增体系下的引物效果,同时考虑耳聋基因位点较为集中特性,本申请进行了区域位点的多重引物组合调整和优化,具体包括引物序列和引物比例的优化。以GJB2基因c.299_300delAT、c.427C>T、c.511_512insAACG三个位点区域引物筛选后的调整优化为例,如下拟筛选引物序列和位点组合。
该区域引物组合仅在本实施例中展示两组引物组合的测试筛选,组合一:299_300W1+299_300M+427W+427M1+511_512W+511_512M+FAM引物组合mix,引物比例为1.5:1.5:1:1:1:1:2和2.0:1.5:1:1.5:0.8:0.8:2.5;组合二:299_300W+299_300M+427W+427M+511_512W+511_512M+FAM引物组合mix,引物比例为2.0:1.5:1:1.5:0.8:0.8:2.5和1.5:1.2:1:1.2:0.5:0.5:2.5,测试结果见下表:
据上述结果可知,在使用组合1(引物比例1.5:1.5:1:1:1:1:2)时,各位点均出峰,但均衡性不佳,且299_300位点野生峰、427位点突变峰效率低,511_512位点出峰过高,后进行引物组合一(引物比例2.0:1.5:1:1.5:0.8:0.8:2.5)比例的调整,尝试提高组合一中各位点峰高均衡性,但从结果可知,未达到预期目的。后对效率过低,但通过提高引物用量,达不到效果的位点进行引物的修改,按照组合2(引物比例2.0:1.5:1:1.5:0.8:0.8:2.5)测试,结果达到预期,但均衡性仍然存在调整的空间。针对此均衡性,调整为组合2引物比例1.5:1.2:1:1.2:0.5:0.5:2.5,通过样本的单独测试和混合测试,出峰效果均较佳,均衡性在70%以上(混合样本中最低峰/最高峰),便于保证后续体系调整的均衡性(位点越多,均衡性越低)。
因此,确定了如下位点组合的最优的引物序列:
同时,基于上述类似的优化实验,本申请也最终确定了三种类型引物的较优比例范围,即:野生型引物:突变型引物:共用荧光引物=0.5~2.0:0.5~2.0:1.0~3.0。
综上,针对各位点引物的单独筛选,以及各基因区域各位点引物的组合筛选优化,确定了本实施例所采用的经过改进优化的最终引物序列如下:
GJB2基因c.35delG/c.35insG位点:
正向野生型引物:
正向突变型引物(c.35delG):
正向突变型引物(c.35insG):
GJB2基因c.109G>A位点:
正向野生型引物:
正向突变型引物:
GJB2基因c.176_191del16位点:
正向野生型引物:5’-GATCGTAGCACACGTTCTTG
正向突变型引物:
GJB2基因c.235delC位点:
正向野生型引物:5’-ACACGAAGATCAGCTGCAG
正向突变型引物:
GJB2基因c.257C>G位点:
正向野生型引物:
正向突变型引物:
GJB2基因c.35delG/c.35insG、c.109G>A、c.176_191del16、c.235delC、c.257
C>G位点反向共用引物:
GJB2基因c.299_300delAT位点:
正向野生型引物:5’-ATGCACGTGGCCTACCGGAGA
正向突变型引物:
GJB2基因c.427C>T位点:
正向野生型引物:
正向突变型引物:
GJB2基因c.511_512insAACG位点:
正向野生型引物:5’-GCTGGTGAAGTGCAACGCCT-3’,
正向突变型引物:5’-GCTGGTGAAGTGCAAC
GJB2基因c.299_300delAT、c.427C>T、c.511_512insAACG位点反向共用引物:5’-AGTGACATTCAGCAGGATGCAAAT-3’,
GJB3基因c.538C>T位点:
正向野生型引物:5’-ACATCGTGGA
正向突变型引物:
GJB3基因c.547G>A位点:
正向野生型引物:
正向突变型引物:
GJB3基因c.538C>T、c.547G>A位点反向共用引物:5’-GCAACCCCCTCGAGGCTTGTCC-3’,
SLC26A4基因c.281C>T位点:
正向野生型引物:
正向突变型引物:
反向共用引物:5’-AGCACTTCAGGGTTATTATTTTCC-3’,
SLC26A4基因c.589G>A位点:
正向野生型引物:5’-GCCAGTGCCCTGACTCTGCTGG
正向突变型引物:
反向共用引物:5’-GATGATAAGTGAGCCTTAATAAGTG-3’,
SLC26A4基因c.917insG位点:
正向野生型引物:
正向突变型引物:
SLC26A4基因c.IVS7-2 A>G位点:
正向野生型引物:
正向突变型引物:
SLC26A4基因c.917insG、c.IVS7-2 A>G位点反向共用引物:5’-ATTGGTGATACCAATCTTGCTGAT-3’,
SLC26A4基因c.1174A>T位点:
正向野生型引物:5’-ATTCATTGCCTTTGGGATCA
正向突变型引物:
SLC26A4基因c.1226G>A位点:
正向野生型引物:
正向突变型引物:
SLC26A4基因c.1229C>T位点:
正向野生型引物:
正向突变型引物:
SLC26A4基因c.1174A>T、c.1226G>A、c.1229C>T位点反向共用引物:5’-AGGGAGTGGAACAAGAGGAATAG-3’,
SLC26A4基因c.IVS15+5G>A位点:
正向野生型引物:
正向突变型引物:
反向共用引物:
SLC26A4基因c.1975G>C位点:
正向野生型引物:
正向突变型引物:
SLC26A4基因c.2027T>A位点:
正向野生型引物:
正向突变型引物:
SLC26A4基因c.1975G>C、c.2027T>A位点反向共用引物:5’-TACAAAGCCCATGTATTTGCCC-3’,
SLC26A4基因c.2162C>T位点:
正向野生型引物:
正向突变型引物:
SLC26A4基因c.2168A>G位点:
正向野生型引物:
正向突变型引物:
SLC26A4基因c.2162C>T、c.2168A>G位点反向共用引物:5’
-ATTCAGTACTGGGTACTACCAGGT-3’,
12SrRNA基因m.1494C>T位点:
正向野生型引物:5’-GTCCTTTGAAGTATACTTGAG
正向突变型引物:
反向共用引物:5’-CAAACCCTGATGAAGGCTACAAAG-3’,
12SrRNA基因m.1555A>G位点:
正向野生型引物:
正向突变型引物:
反向共用引物:5’-ATGGTTTGGCTAAGGTTGTCTGGT-3’,
内参基因位点:
正向引物:
反向引物:5’-ACCTACTGTGCACCTACTTAATACAC-3’;
其中,1)所述“-”单下划线表示在初始引物序列上的错配碱基;所述“=”双下划线表示在初始引物序列上增加的序列;所述“▂”粗下划线代表各引物在相应位置进行锁核酸修饰。2)所有检测位点共用引物均在5’端进行FAM或HEX荧光标记。3)内参位点正向引物均在5’端进行FAM或HEX荧光标记。
在筛选好引物后,对引物组合中各引物的浓度又进行了优化调整,确立各位点引物比例情况为野生型引物:突变型引物:共用荧光引物=0.5~2.0:0.5~2.0:1.0~3.0。
实施例2:遗传性耳聋基因突变检测试剂盒的制备和应用
1、试剂盒的制备:
本实施例提供了一种遗传性耳聋基因突变检测试剂盒,所述试剂盒包括引物Mix、扩增缓冲液、酶混合液、质控品1和质控品2、分子内标QD550和无核酸酶纯水。
所述试剂盒包含的引物组合如实施例1确定引物部分,引物在生工生物工程(上海)有限公司进行合成,并且所有引物按照实验摸索的比例进行混合,配制成10×引物Mix。
所述试剂盒还包含酶混合液,其中有Taq DNA聚合酶和UDG酶。
此外,所述试剂盒所包含PCR扩增缓冲液,其中有dATP、dTTP、dCTP、dGTP、dUTP,Mg
2、试剂盒的使用如下:
步骤1:PCR扩增体系的配制/分装(在试剂准备区完成)
按照下表各组分进行PCR扩增体系的配制,振荡混匀后,根据样本数量进行分装,每管19ul。
步骤2:加入模板(在标本制备区完成)
向对应PCR反应管中,加入各准备好的待检测样本1ul,同时,设置质控对照(质控:1ul质控品,阴性对照:1ul无核酸纯水)。
步骤3:PCR扩增(在扩增区完成)
将各反应管放入PCR扩增仪反应槽内,设置反应体系为20μL。
按以下反应程序进行PCR扩增:
步骤4、扩增产物的检测(产物检测室)
配制混有分子量内标和甲酰胺的上样混合液:(0.3μL分子量内标+8.7μL甲酰胺)×检测样品数,涡旋振荡混匀10-15秒;用移液器给每个检测孔分装9μL的甲酰胺和内标混合物;取1ul扩增产物(稀释1-20倍)加入甲酰胺和内标混合物里,盖上封板胶盖。按照遗传分析仪用户使用手册步骤进行检测(可选用ABI各种机型进行检测)。
步骤5、数据分析
向GeneMapper软件中导入相关文件,输入检测仪下机的原始数据(.fsa文件),分析数据。
步骤6、结果的判读:
以无核酸酶纯水为模板进行扩增,无任何扩增产物;
各检测样本质控位点峰高≥175rfu,各检测位点峰高不超阈值(ABI 3500series,3730series,SeqStudio峰高不超过30000rfu;3130series不超过8000rfu);
根据片段大小,对出峰位点进行峰的标注,质控品出峰情况如图3;
按照标注的峰,进行各检测位点野生型产物峰高/突变型产物峰高比值的计算,其中针对GJB2、GJB3和SLC26A4基因23个位点比值≥7时,判为野生型,比值>0.2且<7时,判为杂合型,比值≤0.2时,判为突变型;而针对线粒体12SrRNA基因2个位点比值≥5时,判为野生型,比值>0.2且<5时,判为异质突变型,比值≤0.2时,判为均质突变型。
实施例3遗传性耳聋基因突变检测试剂盒性能评价
与市面已有试剂盒或者方法相比,本申请检测试剂盒的一个显著特点是能够一管式检测GJB2、GJB3、SLC26A4、mt12SrRNA四个基因共25种热点突变,且针对线粒体异质性的检测能够达到至少15%(sanger测序为20%)。另外,本申请的另一个特点,则是试剂盒扩增样本需求总量较低,具有较高的灵敏度。
本实施中为体现上述显著性的特点,选取经过sanger测序验证的常见突变类型(GJB2 235delC、299_300delAT,mt 12SrRNA 1555A>G、SLC26A4 IVS7-2A>G、2168A>G)的临床样本5例,使用DNA提取试剂盒对选取的临床样本进行浓度测定,并将样本进行如下梯度稀释:0.5ng/ul、1ng/ul、2ng/ul、3ng/ul、5ng/ul,每个浓度梯度重复扩增检测5次,以100%可检出的最低浓度作为估计检测限。然后,在估计检测限附近制备若干浓度梯度样本,每个浓度重复扩增检测20次,确定100%检出率水平下的最低DNA浓度。最后,在最低DNA浓度条件下,针对各位点阳性样本设置mt 12SrRNA 1494和1555不同丰度(15%、20%、25%)的样本,进行各位点检测丰度的确认,并选取本体系检测范围内的所有位点阳性样本和自制丰度的阳性样本对最低样本需求量进行验证。
选用了5例常见突变的阳性样本,浓度设置为0.5ng/ul、1ng/ul、2ng/ul、3ng/ul、5ng/ul五个梯度(扩增结果如图4,展示一次重复的检测结果),将上述各浓度样本重复扩增检测5次,结果显示如下表:
当样本量为0.5ng时,各样本分别重复检测5次时,出现效率较低(低于100rfu)、丢点或判型异常情况;而1ng时,不影响结果稳定性,但出现效率较低,峰高高于100,但多低于1000rfu的情况;2ng时,却能够稳定大于1000rfu,且不存在丢峰等问题,故将2ng作为初步的估计检测限。为进一步确定本体系的最低样本需求量,选取上述突变类型样本,并稀释成1.5ng/μL、2ng/μL、2.5ng/μL,对扩增检测20次的结果进行分析,扩增检测结果如下表:
结果显示,2ng符合最低检出样本需求量的标准和要求(峰高大于1000rfu,无丢点,结果明确,与金标准结果一致)。为确定本申请体系能够检测的线粒体位点(mt12SrRNA1494、1555)的异质比例情况,在确定的最低样本需求量的基础上,选取2个位点的阳性样本,并制备丰度为15%、20%、25%的样本(扩增结果如图5,mt 12SrRNA基因1494位点和1555位点异质性样本20次峰高比值),每个样本各重复扩增检测20次,结果分析如下表:
结果显示,虽然10%异质性比例条件下,能够稳定有效的检测出产物峰,与ddPCR结果一致,但CE结果的峰高比值>5,不符合筛选标准(实施例二结果判读部分),且考虑到临床上对于线粒体异质性的判断不低于20%时才有意义,故综合考虑选择20%作为该试剂盒的最低异质性比例,但峰高比值>5的结果(异质性低于20%情况)仍可用于提示,供医生对患者的病情判读提供参考。
综上,该试剂盒在检测样本量不低于2ng、线粒体异质性比例不低于20%时,能够扩增检测出各目的位点的基因型,定为本申请试剂盒的最低检出限,该试剂盒具有优秀的检测灵敏度。
实施例4:临床样本检测和验证
本实施例使用所述发明体系制备成的试剂盒,按照实施例2对采集的临床样本(包括血液、血卡两种类型样本,均已签署知情同意书)进行扩增检测,同时,使用测序的方法或数字PCR对本申请试剂盒的扩增检测结果进行验证,前50例检测结果如下表:
根据129例临床样本检测情况的统计结果,见下表:
根据统计结果可知,本试剂盒检测出突变型(杂合或纯合突变)样本48例,野生型样本81例,与金标准(sanger测序或数字PCR(购买自新羿生物))的检测结果完全一致,说明本试剂盒的总符合率为100%,检测敏感性100%,检测特异性100%。本申请试剂盒具有极高准确性,能够准确的对临床样本进行检测,并明确样本基因分型。
最后说明,以上各实施例仅用以说明本申请技术方案,而非限制;尽管参照前述各实施例对本申请进行了详细的说明,但本领域应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本申请各实施例技术方案的范围。
