一种过表达CXCR7的间充质干细胞及其构建方法与应用
文献发布时间:2024-04-18 19:58:26
技术领域
本发明涉及一种药物制备技术领域,尤其涉及过表达CXCR7的间充质干细胞制备技术。
背景技术
ARDS是一种常见的以进行性呼吸窘迫和难治性低氧血症为特征的急危重症。COVID-19大流行数据显示,SARS-CoV-2感染引起的ARDS可导致严重的肺纤维化。肺纤维化的发生、发展与ARDS的病死率、预后及生活质量密切相关。目前治疗仅限于器官支持水平,尚无治疗ARDS肺纤维化的有效药物。间充质干细胞(MSCs)是一种来源于中胚层的干细胞,可以从骨髓、脂肪、脐带等组织中分离。与骨髓间充质干细胞(BMSCs)相比,脐带间充质干细胞(UCMSCs)相对其他的间充质干细胞容易获取,免疫原性更低。研究表明,MSCs可向肺损伤部位迁移,分化为肺泡上皮细胞和肺血管内皮细胞,减少胶原沉积和结构重塑,减轻肺纤维化进程,参与肺损伤的修复。研究证实UCMSCs对ARDS等急性肺部炎症性疾病也有良好的治疗作用。MSCs的治疗效果取决于其归巢能力。研究表明,基质细胞衍生因子1(SDF-1)及其受体趋化因子受体4(CXCR4)和趋化因子受体7(CXCR7)在MSCs归巢中发挥关键作用。在ARDS肺损伤大鼠模型中,损伤肺组织中SDF-1含量显著增加。过表达CXCR4的MSCs可以增强损伤部位的归巢效应,具有治疗ARDS的作用。已有研究证实,CXCR7与SDF-1的亲和力比CXCR4高10倍,且能更强地促进MSCs归巢。肝细胞中CXCR7的激活可消除纤维化并促进肝再生。在肺损伤疾病中,肺损伤后给予CXCR7激动剂或靶向Jag1shRNA的PCEC可促进肺泡修复并减少纤维化。血小板源性的SDF-1受体通过与CXCR4/7配体结合可诱导肺组织再生。在之前的研究中,UCMSCs被注射到ARDS肺纤维化小鼠的尾静脉。结果发现脐带间充质干细胞可以归巢到肺损伤部位,从而逆转小鼠肺上皮细胞的MLE12上皮-间充质转化(EMT),并抑制高表达血管平滑肌肌动蛋白(α-SMA)的肌成纤维细胞的产生。肌成纤维细胞可以持续分泌细胞外基质并引起纤维化。提高UCMSCs的归巢能力或许是预防、有效治疗ARDS肺纤维化的重要突破点。
发明内容
本发明的目的在于提供一种过表达CXCR7的间充质干细胞及其构建方法与应用,以解决现有技术中无有效治疗ARDS肺纤维化药物的问题。
为了达到上述目的本发明采用如下技术方案:
本发明提供一种过表达CXCR7的间充质干细胞。
本发明还提供一种所述的过表达CXCR7的间充质干细胞的构建方法,步骤包括:构建过表达CXCR7的慢病毒载体pHBLV-CMVIE-CXCR7-ZsGreen-T2A-puromycin;制备CXCR7慢病毒;CXCR7慢病毒转染间充质干细胞。
进一步地,详细步骤包括:将CXCR7的全长编码序列克隆到慢病毒表达载体的CMVIE启动子和ZsGreen之间,再克隆T2A-puromycin到慢病毒表达载体上,得到过表达CXCR7的慢病毒载体pHBLV-CMVIE-CXCR7-ZsGreen-T2A-puromycin;
将慢病毒载体pHBLV-CMVIE-CXCR7-ZsGreen-T2A-puromycin与包装质粒pSPAX2、pMD2G共转染293FT细胞,收集得到CXCR7慢病毒;
将脐带间充质干细胞接种于MEM-最小必需培养基培养过夜,将CXCR7慢病毒转染到脐带间充质干细胞中,转染后的脐带间充质干细胞中过表达目的基因CXCR72 d后,用2μg/ml嘌呤霉素筛选已成功转染CXCR7慢病毒的稳定细胞株,当所有未转染的细胞消失,分离的克隆开始出现时,选择细胞数量最多的克隆进行扩增,然后用有限稀释法获得表达ZsGreen的细胞克隆OE-CXCR7-UCMSCs。
进一步地,所述间充质干细胞是脐带间充质干细胞。
本发明还提供一种过表达CXCR7的间充质干细胞在制备治疗急性呼吸窘迫综合征药物中的应用。
本发明还提供一种过表达CXCR7的间充质干细胞在制备治疗修复ARDS引起的肺损伤部位的纤维化药物中的应用。
本发明的优点包括:利用慢病毒(Lv)构建稳定持续过表达CXCR7的UCMSCs(OE-CXCR7-UCMSCs),增强其归巢效应,促进增殖和迁移,OE-CXCR7-UCMSCs治疗肺损伤的效果与治疗剂量和治疗时间成正比,能提高脐带间充质干细胞对急性呼吸窘迫综合征、肺纤维的治疗效果。
附图说明
此处所说明的附图用来提供对本发明的进一步理解,构成本申请的一部分,并不构成对本发明的不当限定,在附图中:
图1脐带间充质干细胞(UCMSCs)细胞分离培养及分化鉴定实验图;
图2是OE-CXCR7-UCMSCs20代、OE-CXCR4-UCMSCs20代、OE-NC-UCMSCs20代在明场(上)和暗场(下)观察图;
图3是流式细胞术检测OE-CXCR7-UCMSCs表面标志物CD73、CD29、CD105、CD166、CD11b、CD34、CD45、HLA-DR的分析结果图;
图3-1是流式细胞术检测OE-CXCR7-UCMSCs表面标志物CD29的分析结果图;
图3-2是流式细胞术检测OE-CXCR7-UCMSCs表面标志物CD73的分析结果图;
图3-3是流式细胞术检测OE-CXCR7-UCMSCs表面标志物CD105的分析结果图;
图3-4是流式细胞术检测OE-CXCR7-UCMSCs表面标志物CD166的分析结果图;
图3-5是流式细胞术检测OE-CXCR7-UCMSCs表面标志物CD11b的分析结果图;
图3-6是流式细胞术检测OE-CXCR7-UCMSCs表面标志物CD34的分析结果图;
图3-7是流式细胞术检测OE-CXCR7-UCMSCs表面标志物CD45的分析结果图;
图3-8是流式细胞术检测OE-CXCR7-UCMSCs表面标志物HLA-DR的分析结果图;
图4是qRT-PCR检测慢病毒转染后UCMSCs中CXCR4/7的mRNA的表达情况;
图5是WB检测慢病毒构建的CXCR4/7-UCMSCs载体在细胞中成功过表达CXCR4/7图;
图6是MTT法检测转染后CXCR4/7对UCMSCs的增殖效率影响;
图7是细胞体外划痕试验检测OE-CXCR4/7-UCMSCs细胞迁移率统计图;
图8是Transwell迁移实验检测OE-CXCR4/7-UCMSCs迁移率统计图;
图9是过表达CXCR4/7影响UCMSCs中的粘附糖蛋白(CD44),细胞粘附分子-1(VCAM-1),基质金属-2(MMP-2)的表达变化统计图;
图10是LPS气管滴注法构建ARDS小鼠模型的流程及肺损伤评分图;
图11是用1×10
图12是qPCR、WB和CCK8检测在肺上皮细胞Base-2b中的干扰/过表达CXCR7的效率及分组处理后分别与SDF-1结合对细胞增殖的影响;
图13是体外划痕、Transwell迁移实验检测base2b细胞的横纵迁移率及免疫荧光检测在SDF-1作用下过表达/干扰CXCR7对肺上皮细胞Base-2b纤维化指标α-SMA的影响;
图14是CCK8、体外划痕和Transwell迁移分别检测CXCR7通过Wnt细胞信号通路的影响肺上皮细胞base2b增殖及横纵迁移率;
图15是WB检测CXCR7通过Wnt及Notch细胞信号通路的关键蛋白表达半定量图。
具体实施方式
下面将结合附图以及具体实施例来详细说明本发明,在此以本发明的示意性实施例及说明用来解释本发明,但并不作为对本发明的限定。
1、材料与方法:
(1)细胞培养及分化鉴定
将脐带组织碎片(约1.0mm)重悬在等体积的DMEM/F12培养基(bioindustries,Beit Haemek,Israel)中,接种到T175瓶中,并在37℃饱和湿度和5%CO
(2)利用依赖于CMVIE启动子的慢病毒表达载体构建高表达小鼠CXCR7的重组慢病毒载体
将CXCR7(NM_001271607,1088bp)的全长编码序列克隆到慢病毒表达载体的CMVIE启动子和ZsGreen之间,再克隆T2A-puromycin到慢病毒表达载体上。最终获得过表达CXCR7的慢病毒载体pHBLV-CMVIE-CXCR7-ZsGreen-T2A-puromycin。
将CXCR7替换为CXCR4,同样方法获得过表达CXCR4的慢病毒载体pHBLV-CMVIE-CXCR4-ZsGreen-T2A-puromycin。
将T2A-puromycin克隆到慢病毒表达载体,获得空载体pHBLV-CMVIE-ZsGreen-T2A-puromycin,其命名为NC(正常对照)。
将慢病毒载体pHBLV-CMVIE-CXCR7-ZsGreen-T2A-puromycin与包装质粒pSPAX2、pMD2G共转染293FT细胞,收集得到CXCR7慢病毒。
将慢病毒载体pHBLV-CMVIE-CXCR7-ZsGreen-T2A-puromycin替换为慢病毒载体pHBLV-CMVIE-CXCR4-ZsGreen-T2A-puromycin,同样方法获得CXCR4慢病毒。
将慢病毒载体pHBLV-CMVIE-CXCR7-ZsGreen-T2A-puromycin替换为空载体pHBLV-CMVIE-ZsGreen-T2A-puromycin,同样方法获得空慢病毒。
将脐带间充质干细胞(2×10
将CXCR4慢病毒替换CXCR7慢病毒,同样方法获得OE-CXCR4-UCMSCs。
将空慢病毒质粒替换CXCR7慢病毒,同样方法获得OE-NC-UCMSCs。
采用荧光显微镜检测慢病毒对第20代转染UCMSCs的转染效率,采用BectonDickinsonFACSCalibur流式细胞术(FACSCalibur,Becton-Dickinson,FranklinLake,NJ,USA)检测ZsGreen阳性细胞百分比,反映目的基因在UCMSCs中的转染效率。如图2所示,在荧光显微镜下明场100倍(上)和暗场250倍(下)中能观察到对应的绿色荧光蛋白。
(3)流式细胞术检测OE-CXCR7-UCMSCs表面标志物的表达;
如图3所示,流式细胞术检测OE-CXCR7-UCMSCs表面标志物CD73、CD29、CD105、CD166、CD11b、CD34、CD45、HLA-DR的表达情况,其中CD73、CD29、CD105、CD166呈阳性表达,CD11b、CD34、CD45、HLA-DR呈阴性表达。证明转染过表达CXCR7载体的UCMSCs维持原有细胞特性。
(4)RNA提取和实时定量PCR
TRIzol试剂(MRC)提取UCMSCs、OE-NC-UCMSCs、OE-CXCR4-UCMSCs、OE-CXCR7-UCMSCs的细胞总RNA。通过测定260/280nm的吸光度来验证RNA的纯度和浓度。RNA的纯度和浓度达到要求后,反转录获得cDNA,然后以cDNA为模板,表1所示的引物为扩增引物,使用
表1
qRT-PCR扩增实验体系:
qRT-PCR扩增反应条件:
(5)免疫印迹法分别检测转染后脐带间充质干细胞(UCMSCs)中CXCR4/7的表达情况
提取转染后UCMSCs的总蛋白,在含有抗蛋白酶混合物RIPA裂解缓冲液中溶解产物,使用BCA蛋白检测试剂盒定量。使用10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳蛋白分离后转移到PVDF膜上。在Tris-1缓冲液中阻断膜,在pH 7.4下含有0.1%吐温20分别与5%牛血清白蛋白在室温温度下孵育1h,然后与CXCR4/7一抗(1:10000稀释)或β-actin(1:3000稀释;)在4℃过夜。印迹用TBST洗涤并孵育,用辣根过氧化物酶标记的山羊抗兔IgG(1:10000稀释),室温1h。使用化学发光试剂可见免疫反应性复合物。
如图5所示,以Actin为内参,Westernblot检测CXCR4/7蛋白的表达情况。
(2)-(5)的这些结果表明,已成功构建能稳定过表达CXCR4/7的UCMSCs。
(6)细胞增殖评估
取对数生长期的OE-CXCR7-UCMSCs和OE-CXCR4-UCMSCs,计数细胞后以1×10
(7)体外划痕试验和Transwell迁移实验
本实验通过划痕试验和Transwell迁移实验检测UCMSCs在转染后的水平和垂直迁移能力。
将UCMSCs、OE-CXCR4-UCMSCs、OE-CXCR7-UCMSCs接种于6孔培养板,每种细胞设置5个平行实验组,待细胞接近100%融合时,用10μl无菌移液管尖端在每个实验组的细胞划痕,然后在无血清DEAM/F12培养基中培养24h。划痕后24h即刻采用光学显微镜记录创面图像。采用Image-J分析软件测量每种细胞5个不同创面的宽度,并定量细胞的水平迁移能力。分别于0、24h时,观察创面部位(划痕区中心细胞清除的区域),并用光学显微镜100倍放大拍照。结果如图7所示,24h后,划痕区明显变小,如图7所示,OE-CXCR4-UCMSCs、OE-CXCR7-UCMSCs的划痕愈合率均比UCMSCs高,OE-CXCR4-UCMSCs、OE-CXCR7-UCMSCs的划痕愈合率各自与UCMSCs之间差异均有统计学意义,OE-CXCR7-UCMSCs的划痕愈合率比OE-CXCR4-UCMSCs高,OE-CXCR7-UCMSCs、OE-CXCR4-UCMSCs划痕愈合率差异无统计学意义。实验重复三次。结果表明,过表达CXCR7可促进UCMSCs的横向的迁移。
Transwell迁移实验检测UCMSCs的垂直迁移能力。将1×10
采用ELISA法检测UCMSCs、OE-CXCR4-UCMSCs、OE-CXCR7-UCMSCs中VCAM-1(血管细胞黏附分子-1)、CD-44和MMP2蛋白的表达,以明确CXCR7调控UCMSCs增殖和迁移的具体机制。如图9所示,OE-CXCR7-UCMSCs组VCAM-1、CD-44和MMP2的表达水平高于OE-CXCR4-UCMSCs组VCAM-1、CD-44和MMP2的表达水平(p<0.05)。OE-CXCR4-UCMSCs组VCAM-1、CD-44和MMP2的表达水平高于UCMSCs组VCAM-1、CD-44和MMP2的表达水平(p<0.05)。过表达CXCR7可增加UCMSCs表达血管细胞黏附分子-1(VCAM-1)、CD-44和MMP2。
上述结果可推测出,CXCR7过表达促进UCMSCs分泌的VCAM-1、CD44和MMP2的增加可能是CXCR7促进UCMSCs迁移的主要机制之一。
(8)LPS诱导的肺纤维化和OE-CXCR7-UCMSCs治疗
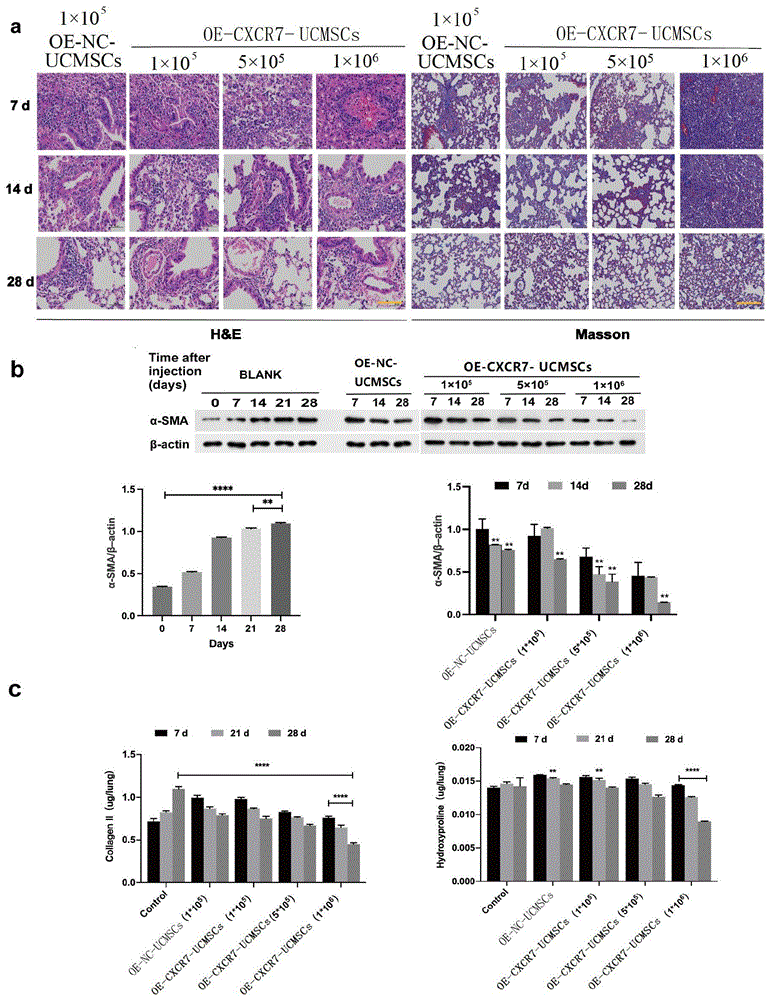
选取51只C57BL/6小鼠接受脂多糖(LPS)诱导的肺纤维化,将纯化的内毒素(含脂多糖)5mg/kg加入50μl无菌生理盐水中,然后如图10a所示经气管滴注给药造模。对给药造模后0、7、14、21、28d肺组织切片进行HE和Masson染色,如图10b所示,肺病理切片染色结果显示,肺间质和肺泡弥漫性水肿,肺泡壁增厚,Masson染色显示,第28天肺纤维化程度较0天增高;如图10c所示,肺损伤评分(LIS)显示,LPS处理后第14天损伤值达到最大值;Westernblot检测α-SMA表达情况如图10d所示,肺纤维化程度与给药造模后时间成正比。结果表明,LPS造模成功。
将小鼠随机分为对照组(n=15)和实验组(n=36)。对照组给予50μl生理盐水,再将实验组的小鼠随机分为4组(每组9只),按照表4分别给予1×10
表4
4个实验组分别于给药治疗后7、14、28d取肺组织。36例小鼠肺组织样本均用于组织病理学,免疫印迹分析,和ELISA测定肺组织中羟脯氨酸和Ⅱ型胶原的含量。
为了验证CXCR7是否增强UCMSCs对肺损伤及纤维化的预防及修复,我们用不同浓度的OE-CXCR7-UCMSCs给药治疗ARDS小鼠,给药治疗7、14、28d后取肺组织进行He和Masson染色,如图11a所示,显示UCMSCs的治疗效果与浓度和治疗时间成正比。与OE-NC-UCMSCs处理的ARDS小鼠相比,1×10
此外,经OE-CXCR7-UCMSCs治疗处理后进行免疫印迹检测α-平滑肌肌动蛋白(α-SMA)表达,结果如图11b所示,OE-CXCR7-UCMSCs治疗后肺组织中α-SMA的表达显著降低。
ELISA测定肺组织中羟脯氨酸和Ⅱ型胶原的含量的结果如图11c所示,经过OE-CXCR7-UCMSCs治疗的羟脯氨酸和Ⅱ型胶原的含量随着时间及浓度增加下降更明显。
这些数据表明UCMSCs中CXCR7的激活可以保护肺,有效降低ARDS肺的促纤维化反应。
(9)转染CXCR7-siRNA和过表达CXCR7质粒载体对Base-2b迁移的影响
为达到理想的干扰效率,我们针对CXCR7设计三种不同的干扰其在细胞中表达的片段CXCR7-siRNA,分别命名si-CXCR7-1、si-CXCR7-2、si-CXCR7-3,如表5所示。
Base-2b中分别检测干扰及过表达的转染效率:si-CXCR7-1、si-CXCR7-2、si-CXCR7-3、si-NC(无意义片段)、OE-CXCR7(过表达CXCR7质粒载体)和OE-NC(空载体)。设si-CXCR7-1、si-CXCR7-2、si-CXCR7-3、si-NC(无意义片段)转染的浓度梯度:25pm、50pm、75pm。转染后,参考上文(3)RNA提取和实时定量PCR的操作,提取各细胞总RNA,逆转录获得cDNA,以cDNA为模板,表1为引物,通过qRT-PCR分析转染不同CXCR7-siRNA及si-NC(无意义片段)的Base-2b中CXCR7的表达水平。结果如图12a所示,干扰效果最好的为转染75pm的si-CXCR7-3,后续实验在细胞中沿用该实验体系。
表5
以cDNA为模板,以表1为引物,通过qRT-PCR分析转染过表达CXCR7质粒载体及空载体的Base-2b中CXCR7的表达水平。如图12b所示,转染后过表达CXCR7质粒载体的细胞CXCR7表达水平显著较高。
免疫印迹检测上述各转染Base-2b中CXCR7的表达水平,结果如图12c所示。
为了研究CXCR7对SDF-1诱导的Base-2b细胞迁移的贡献,我们设置6个实验组进行了transwell迁移实验和划痕实验。6个实验组分别是不经任何处理的Base-2b细胞(Control)、SDF-1诱导的Base-2b细胞(SDF-1)、SDF-1诱导的转染无意义片段Base-2b细胞(si-NC+SDF-1)、SDF-1诱导的转染干扰片段Base-2b细胞(si-CXCR7+SDF-1)、SDF-1诱导的转染过表达CXCR7的Base-2b细胞(OE-CXCR7+SDF-1)、SDF-1诱导的转染空载体Base-2b细胞(OE-NC+SDF-1),6个实验组增殖结果如图12d所示,过表达CXCR7可以增加SDF-1诱导的Base-2b细胞增殖。
transwell迁移实验和划痕实验结果如图13a-d所示,与Control相比,SDF-1诱导的Base-2b细胞增殖和迁移能力增强;SDF-1诱导的前提下,干扰CXCR7表达可抑制Base-2b细胞迁移,过表达CXCR7可增强Base-2b细胞迁移。因此,过表达CXCR7增强了SDF-1诱导的Base-2b增殖和迁移能力。
在不同处理的Base-2b中,用α-SMA Ab进行细胞免疫荧光染色,免疫荧光检测在SDF-1作用下过表达/干扰CXCR7对肺上皮细胞base2b纤维化指标α-SMA的影响,结果如图13f所示,与Control相比,SDF-1作用下会提高α-SMA表达水平,干扰CXCR7时α-SMA表达水平达到最高,过表达CXCR7时α-SMA表达水平相比其他SDF-1作用的细胞出现大幅度降低的情况。
(10)CXCR7通过激活Wnt/β-Catenin通路抑制Base-2b细胞的横向迁移和垂直迁移
用Wnt抑制剂(ICG001)预处理干扰CXCR7的肺上皮细胞,用CCK-8检测各组细胞的增殖效率。结果如图14a所示,siCXCR7+SDF-1+ICG001组水平与SDF-1组相当,在siCXCR7+SDF-1的情况下,Wnt/β-Catenin抑制剂(ICG001)可促进细胞增殖效率。
将不同处理后的Base-2b划痕后加入SDF-1(100ng/ml)处理18h,通过划痕愈合实验检测不同处理后的Base-2b迁移细胞数量。分别于0、24h观察创面部位(划痕区中心细胞清除的区域)并100×拍照。条形图显示划痕愈合的定量结果,结果如图13b-c所示(n=3)。transwell迁移实验结果如图13d、13f所示。说明ICG001增强Base-2b细胞横向迁移和垂直迁移。
(11)CXCR7通过Wnt通路和Notch通路影响肺上皮纤维化
趋化因子受体7(CXCR7)通过Wnt/β-catenin通路抑制Jag1影响肺上皮纤维化。我们设置转染干扰片段的Base-2b细胞和转染CXCR7的Base-2b细胞实验组,并用SDF-1处理,通过Western blotting和免疫荧光染色检测敲低和过表达CXCR7处理的Base-2b中α-SMA的表达。我们观察到,如图15a所示,在Base-2b细胞中,随着CXCR7的过表达,α-SMA、Notch和Jag1的表达水平降低,而CXCR7下调后,α-SMA、Notch和Jag1的表达水平显著升高,与此相反,如图14b所示,ICG001处理后α-SMA和β-catenin蛋白表达水平降低。此外,Jag1和Notch的表达水平也显著降低。在Base-2b细胞中过表达CXCR7通过调节Wnt/β-catenin通路抑制Notch1/Jag1,抑制Base-2b纤维化。
从上述(4)-(11)实验中总结:CXCR7属于7跨膜g蛋白偶联受体超家族,但不能刺激典型的g蛋白依赖性通路。作为趋化因子是一类对细胞具有趋化吸引作用的蛋白质,它需和相对应的受体(SDF-1)结合发挥生物学作用,从而调控细胞的生长和迁移,但调控的具体机制不明。
旁分泌黏附分子被认为是间充质干细胞迁移的主要机制。为了探讨CXCR7过表达促进UCMSCs迁移的具体机制,我们检测了间充质干细胞调控UCMSCs血管黏附的重要旁分泌因子VCAM-1、CD44、MMP2的水平。过表达CXCR7后,VCAM-1、CD44和MMP2分别显著升高。CXCR7过表达促进UCMSC迁移的主要机制之一是增加VCAM-1、CD44和MMP2的分泌。
在发现CXCR7之前,CXCR4被认为是SDF-1的唯一受体。激活CXCR4/SDF-1可通过MAPK/ERK、PI3K/AKT和Wnt/β-catenin通路改善炎症和修复损伤。这表明CXCR4和CXCR7通过ERK和AKT信号通路参与了这一生理功能。而CXCR4和CXCR7对UCMSC的Wnt信号通路具有相反的作用。CXCR7与SDF-1的结合亲和力高于CXCR4,并作为SDF-1的清除剂调控CXCR4信号通路。因此,我们推测CXCR7持续过表达可能通过Wnt/β-catenin通路抑制体内肺纤维化。
以上对本发明实施例所提供的技术方案进行了详细介绍,本文中应用了具体个例对本发明实施例的原理以及实施方式进行了阐述,以上实施例的说明只适用于帮助理解本发明实施例的原理;同时,对于本领域的一般技术人员,依据本发明实施例,在具体实施方式以及应用范围上均会有改变之处,综上所述,本说明书内容不应理解为对本发明的限制。
- 一种过表达PD-L1基因的间充质干细胞株及其构建方法和应用
- 一种过表达miR-21骨髓间充质干细胞的外泌体及其构建方法
