菟丝子提取物、药物制剂、它们的制备方法和医药用途、菟丝子原药材中成分的分析方法
文献发布时间:2024-04-18 19:58:21
技术领域
本发明属于医药领域,具体涉及一种制备菟丝子提取物的方法,还涉及制得的菟丝子提取物、药物制剂、制备药物制剂的方法、医药用途以及分析菟丝子原药材中的成分的方法。
背景技术
黄褐斑是临床上常见的色素障碍性皮肤病,其主要表现为皮肤色素过度沉积,但病因复杂,目前尚未明确。黑色素细胞活性异常是黄褐斑的主要特征,人类肤色主要受黑色素影响。黑色素是一类生物色素,主要分为真黑素(eumelanin)、褐黑素(pheomelanin)、神经黑色素(neuromelanin)。黑色素的合成场所主要在黑色素细胞的黑素小体内。黑色素合成起始底物为酪氨酸,由小眼畸形相关转录因子(Microphthalmia-associatedtranscription factor,MITF)调控,经酪氨酸酶(TYR)等一系列酶催化反应合成。
目前常用的黄褐斑治疗方案主要为局部药物治疗、口服药物治疗和激光治疗等。局部合成药物治疗可采用氢醌、糖皮质激素、维甲酸、化学剥脱剂等,但合成药物的刺激性和副作用较大;口服药物起效较慢,有些会产生不良反应;激光治疗存在治疗不便,费用较高,易造成皮肤过角化及复发率高等缺点,且多为对症治疗,局限性较大。中医药以其多靶点、多层次的治疗作用,在复杂疾病的治疗中具有独特优势。
菟丝子(Cuscutae semen)为旋花科植物菟丝子Cuscuta chinensis Lam.或南方菟丝子Cuscuta australis R.Br.干燥成熟种子。其安全性较高,可用于保健食品。菟丝子性味辛、甘、平(温)。归肝、肾、脾经。功能补益肝肾,固精缩尿,安胎,明目,止泻,外用消风祛斑。
因此,目前亟需开发一种可有效治疗黄褐斑的药物。
发明内容
本发明目的之一在于提供一种制备菟丝子提取物的方法及制得的菟丝子提取物;本发明又一目的在于提供一种药物制剂及其制备方法;本发明的菟丝子提取物、药物制剂能有效预防和/或治疗黄褐斑疾病,并且,本发明药物制剂的稳定性高,细腻,无颗粒感,黏度和pH值适中,安全性高;本发明又一目的在于提供菟丝子提取物、药物制剂的医药用途;本发明又一目的在于提供一种分析菟丝子原药材中的成分的方法,以全面分析出菟丝子原药材中的物质成分,且方法的精密度高、重复性好。
为实现上述目的,本发明第一方面提供一种制备菟丝子提取物的方法,包括如下步骤:
(1)采用甲醇(水)溶液提取菟丝子原药材,固液分离,收集液相物;
(2)采用甲醇(水)溶液稀释所述液相物,固液分离,收集液相物作为菟丝子提取物。
本发明中,根据《中国植物志》和指纹图谱比对,菟丝子原药材被鉴定为旋花科植物菟丝子Cuscuta chinensis Lam.。
本发明第一方面的任意实施方式中,步骤(1)和步骤(2)中,通过离心处理进行固液分离;优选地,步骤(1)和步骤(2)中离心处理的时间各自独立地为5-20分钟,例如5、10、15、20分钟。
本发明第一方面的任意实施方式中,步骤(1)中,离心处理采用的相对离心力为3000×g至4000×g,例如3100×g、3129×g、3200×g、3400×g、3800×g。
本发明第一方面的任意实施方式中,步骤(2)中,离心处理采用的相对离心力为11000×g至12000×g,例如11200×g、11481×g、11800×g。
本发明第一方面的任意实施方式中,相对离心力(RCF,relative centrifugalforce)“×g”和每分钟转速“rpm”的换算为:RCF=r×11.18×10
本发明第一方面的任意实施方式中,方法包括如下的一项或多项:
(A)步骤(1)中,在提取前,将菟丝子原药材破碎,过筛,优选为过50目筛;
(B)步骤(1)中,甲醇(水)溶液与菟丝子原药材的比例为10:1-30:1mL/g,例如15:1mL/g、20:1mL/g、25:1mL/g;
(C)步骤(1)中,提取的时间为10-60分钟,例如20、30、40、50、60分钟;
(D)步骤(1)中,在超声条件下提取;
(E)步骤(1)和步骤(2)中,甲醇(水)溶液的浓度各自独立地为60%V/V-90%V/V,例如70%V/V、80%V/V、90%V/V;
(F)步骤(2)中稀释后的体积等于步骤(1)中甲醇(水)溶液的体积;
(G)还包括将步骤(2)收集的液相物稀释,作为菟丝子提取物;
优选地,步骤(2)收集的液相物稀释后的体积等于步骤(1)中甲醇溶液的体积。
本发明第一方面的任意实施方式中,方法还包括:
(3)采用液相色谱-质谱联用仪对步骤(2)收集的液相物或其稀释物进行分离,分别得到保留时间为2-10分钟且质量数为100-800范围的第一分离物、保留时间为10-25分钟且质量数为200-1000范围的第二分离物、保留时间为25-34分钟且质量数为500-1000范围的第三分离物和保留时间为34-44分钟且质量数为200-500范围的第四分离物,作为菟丝子提取物。
上述“保留时间为2-10分钟且质量数为100-800范围的第一分离物”为从保留时间的第2分钟开始时刻至第10分钟结束时刻且质量数为100-800范围的分离物。
上述“保留时间为10-25分钟且质量数为200-1000范围的第二分离物”为从保留时间的第10分钟结束时刻至第25分钟结束时刻且质量数为200-1000范围的分离物。
上述“保留时间为25-34分钟且质量数为500-1000范围的第三分离物”为从保留时间的第25分钟结束时刻至第34分钟结束时刻且质量数为500-1000范围的分离物。
上述“保留时间为34-44分钟且质量数为200-500范围的第四分离物”为从保留时间的第34分钟结束时刻至第44分钟结束时刻且质量数为200-500范围的分离物。
本发明第一方面的任意实施方式中,步骤(3)还包括将第一分离物、第二分离物、第三分离物和第四分离物分别浓缩,干燥,低温保存;可选地通过旋蒸进行浓缩;可选为在-20℃保存。
本发明第一方面的任意实施方式中,液相色谱-质谱联用仪的操作条件包括如下的一项或多项:
(a)液相色谱-质谱联用仪为Agilent 1260Infinity II制备型LC/MSD系统;
(b)液相色谱采用Waters SB-C18色谱柱;
(c)液相色谱的柱温为25℃-40℃,例如30℃、35℃;
(d)液相色谱采用0.1%V/V甲酸水溶液作为流动相A,采用乙腈作为流动相B;
(e)液相色谱的流动相洗脱程序为:0-8分钟,98%V/V-85%V/V流动相A;8-20分钟,85%V/V-70%V/V流动相A;20-27分钟,70%V/V-51%V/V流动相A;27-33分钟,51%V/V-40%V/V流动相A;33-38分钟,40%V/V-0%V/V流动相A;38-41分钟,0%V/V流动相A;41-42分钟,0%V/V-98%V/V流动相A;42-45分钟,98%V/V流动相A;
(f)液相色谱的流动相流速为2-5mL/min,例如2.5、3、3.5、4、4.5、5mL/min;
(g)液相色谱的进样量为100μL;
(h)液相色谱采用DAD探测器监测287、325、327、360nm波长的信号;
(i)质谱采用API-ES离子源;
(j)质谱采用负离子模式;
(k)质谱的循环时间为0.95s;
(l)质谱的扫描范围100-1700m/z;
(m)质谱的碰撞诱导解离能量为60eV;
(n)质谱的速度为1733u/sec;
(o)质谱的干燥气流速为12.0L/min;
(p)质谱的干燥气温度为350℃;
(q)质谱的雾化气压力为35psig;
(r)质谱的毛细管电压为3kV;
(s)质谱采用InfinityLab LC/MSD质量选择检测器。
本发明第二方面提供另一种制备菟丝子提取物的方法,包括如下步骤:
采用水或乙醇溶液对菟丝子原药材进行至少一次提取,固液分离,收集液相物;
采用有机溶剂萃取所述液相物,分离得到水相物和有机相物;
采用大孔吸附树脂对所述水相物进行纯化,将纯化后的物质干燥,得到菟丝子提取物Ⅱ;
去除所述有机相物中的有机溶剂,得到菟丝子提取物Ⅳ。
本发明第二方面的任意实施方式中,采用大孔吸附树脂通过如下的操作对所述水相物进行纯化:
将水相物在装有大孔吸附树脂的柱子中进行上样吸附,用水洗涤柱子,然后用洗脱剂对柱子进行洗脱处理,收集洗脱液,即为纯化后的物质。
本发明第二方面的任意实施方式中,上样吸附的时间为1-3小时,例如1.5、2、2.5小时;和/或,洗脱剂为40%W/W-70%W/W乙醇溶液,例如50%W/W、60%W/W;和/或,洗脱剂和水的用量独立地为100-400mL,例如150、200、250、300、350mL;和/或,洗脱剂的洗脱速度为100-300mL/h,例如150、200、250mL/h;和/或,水的流速为100-400mL/h,例如200、300、350mL/h。
本发明第二方面的任意实施方式中,所述方法包括如下的一项或多项:
(i)采用水或乙醇溶液对菟丝子原药材进行回流提取;
优选为进行两次回流提取,合并两次收集的液相物;
更优选地,第一次回流提取采用的料液比为1:12-1:6g/mL,例如1:11g/mL、1:10g/mL、1:9g/mL、1:8g/mL、1:7g/mL;
更优选地,第二次回流提取采用的料液比为1:8-1:1g/mL,例如1:7g/mL、1:6g/mL、1:5g/mL、1:4g/mL、1:3g/mL、1:2g/mL;
更优选地,第一次回流提取的时间和第二回流提取的时间各自独立地为0.5-4小时,例如1、2、3小时;
(ii)采用乙醇溶液对菟丝子原药材进行渗漉提取;
优选地,渗漉提取采用的料液比为1:15-1:7g/mL,例如1:14g/mL、1:13g/mL、1:12g/mL、1:10g/mL、1:9g/mL、1:8g/mL;
优选地,渗漉提取的流速为200-300mL/h,例如220、250、270、280mL/h;
优选地,渗漉提取前,将菟丝子原药材在乙醇溶液中浸泡0.5-3h,例如1、2、3h;
更优选地,浸泡采用的料液比为1:5-1:1g/mL,例如1:4g/mL、1:3g/mL、1:2g/mL、1:1g/mL;
(iii)在萃取前,将所述液相物浓缩;
优选地,在50℃-70℃(例如55℃、60℃、65℃)及减压条件下浓缩;
(iv)有机溶剂为石油醚和/或氯仿;
(v)有机溶剂与菟丝子原药材的比例为1:1-5:1mL/g,例如2:1mL/g、3:1mL/g、4:1mL/g;
(vi)萃取的时间为0.5-2小时,例如1、1.5小时;
(vii)所述大孔吸附树脂选自D101、AB-8、HPD-100、X-5和ADS-8中的一种或多种大孔吸附树脂;
(viii)在50℃-70℃(例如55℃、60℃、65℃)及真空条件下干燥;
(ix)在减压条件下去除所述有机相物中的有机溶剂。
本发明第二方面的任意实施方式中,第(i)项和第(ii)项中的乙醇溶液的浓度各自独立地为50%W/W-90%W/W,例如55%W/W、60%W/W、65%W/W、70%W/W、75%W/W、80%W/W、85%W/W。
本发明第三方面提供一种菟丝子提取物,其由本发明第一方面或第二方面的方法制得。
本发明第三方面的任意实施方式中,所述菟丝子提取物包含选自有机酸类化合物、黄酮类化合物、木脂素类化合物、树脂糖苷类化合物和脂肪酸类化合物中的一种或多种。
本发明第三方面的任意实施方式中,所述第一分离物包含有机酸类化合物;和/或,所述第二分离物和所述菟丝子提取物Ⅱ独立地包含黄酮类化合物和木脂素类化合物;和/或,所述第三分离物包含树脂糖苷类化合物;和/或,所述第四分离物和所述菟丝子提取物Ⅳ独立地包含脂肪酸类化合物。
本发明第四方面提供了一种药物制剂,包含本发明第三方面的菟丝子提取物。
本发明第四方面的任意实施方式中,菟丝子提取物在药物制剂中的质量含量为0.1%-5%,优选为0.5%-3%,例如0.2%、0.4%、0.5%、1%、1.5%、2%、2.5%、3%、3.5%、4%、4.5%、5%。
本发明第四方面的任意实施方式中,菟丝子提取物为本发明第一方面的方法制得的第二分离物和第四分离物或者为本发明第二方面的方法制得的菟丝子提取物Ⅱ和菟丝子提取物Ⅳ,并且,所述第二分离物与第四分离物的质量比或者所述菟丝子提取物Ⅱ与菟丝子提取物Ⅳ的质量比为1:1-10:1,例如3:1、5:1、7:1、8:1、9:1。
本发明第四方面的任意实施方式中,药物制剂还包含选自凝胶基质、保湿剂、pH调节剂、增溶剂、防腐剂和溶剂中的一种或多种。
本发明第四方面的任意实施方式中,药物制剂包括如下的任意一项或多项:
A)所述凝胶基质选自卡波姆(Carbomer)和纤维素类,例如卡波姆940;
B)所述保湿剂选自甘油和丙二醇,例如甘油;
C)所述pH调节剂选自氢氧化钠和有机胺,例如氢氧化钠;
D)所述增溶剂选自吐温、聚氧乙烯脂肪醇醚和十二烷基硫酸钠,例如吐温80;
E)所述防腐剂选自尼泊金类、硫柳汞和山梨酸钾,例如山梨酸钾;
F)所述溶剂选自乙醇和水;
G)所述凝胶基质在药物制剂中的质量百分含量为0.5%-1%,例如0.6%、0.7%、0.8%、0.86%、0.9%;
H)所述保湿剂在药物制剂中的质量百分含量为10%-20%,例如11%、12%、12.83%、13%、14%、15%、16%、17%、18%、19%;
I)所述pH调节剂在药物制剂中的质量百分含量为0.1%-0.6%,例如0.1%、0.2%、0.3%、0.33%、0.4%、0.5%、0.6%;
J)所述增溶剂在药物制剂中的质量百分含量为0.1%-0.5%,例如0.1%、0.2%、0.3%、0.33%、0.4%、0.5%;
K)所述防腐剂在药物制剂中的质量百分含量为0.2%-0.9%,例如0.2%、0.3%、0.4%、0.5%、0.6%、0.7%、0.8%、0.9%;
L)所述药物制剂为凝胶制剂。
本发明第四方面的任意实施方式中,其余为溶剂。
本发明第四方面的任意实施方式中,以质量百分含量计,药物制剂包含:
其中,所述菟丝子提取物为本发明第一方面的方法制得的第二分离物和第四分离物或者为本发明第二方面的方法制得的菟丝子提取物Ⅱ和菟丝子提取物Ⅳ,并且,所述第二分离物与第四分离物的质量比或者所述菟丝子提取物Ⅱ与菟丝子提取物Ⅳ的质量比为1:1-10:1,例如3:1、5:1、7:1、8:1、9:1。
本发明第四方面的任意实施方式中,药物制剂采用64号转子在室温和转速100rpm条件下测定的黏度值为2000-3000mPa·s,例如2200、2300、2400、2500、2600、2700、2800、2900mPa·s。
本发明第四方面的任意实施方式中,药物制剂的pH值为6-7。
本发明第五方面提供了一种制备本发明第四方面的药物制剂的方法,包括如下步骤:
将凝胶基质在溶剂(例如水)中溶胀;
将菟丝子提取物、保湿剂、增溶剂、防腐剂与溶剂(例如乙醇和水)混合,得到混合物;
向溶胀后的凝胶基质中缓慢加入所述混合物并混合,加入pH调节剂和溶剂继续混合即可。
本发明第五方面的任意实施方式中,菟丝子提取物为本发明第一方面的方法制得的第二分离物和第四分离物或者为本发明第二方面的方法制得的菟丝子提取物Ⅱ和菟丝子提取物Ⅳ,并且,所述第二分离物与第四分离物的质量比或者所述菟丝子提取物Ⅱ与菟丝子提取物Ⅳ的质量比为1:1-10:1,例如3:1、5:1、7:1、8:1、9:1。
本发明第五方面的任意实施方式中,菟丝子提取物、保湿剂、增溶剂、防腐剂、凝胶基质、pH调节剂在药物制剂中的质量百分含量如本发明第四方面中所述。
本发明第五方面的任意实施方式中,在4℃静置24小时进行溶胀。
本发明第五方面的任意实施方式中,在搅拌条件下混合。
本发明第五方面的任意实施方式中,缓慢加入混合物并混合2小时。
本发明第五方面的任意实施方式中,继续混合1小时。
本发明第六方面提供了本发明第三方面的菟丝子提取物或本发明第四方面的药物制剂在制备用于预防和/或治疗黄褐斑的药物中的用途。
本发明第七方面提供了一种分析菟丝子原药材中的成分的方法,包括如下步骤:
1)按照本申请第一方面的方法得到菟丝子提取物;
2)采用第一维液相色谱对菟丝子提取物进行分离,收集到多个分离物;其中,第一维液相色谱的操作条件包括:采用Waters XBridge Amide色谱柱;采用0.1%V/V甲酸水溶液作为流动相A,乙腈作为流动相B;洗脱程序为:0-8分钟,95%V/V-85%V/V流动相B;8-13分钟,85%V/V-83%V/V流动相B;13-23分钟,83%V/V-78%V/V流动相B;23-27分钟,78%V/V-65%V/V流动相B;27-30分钟,65%V/V-50%V/V流动相B;30-33分钟,50%V/V流动相B;33-34分钟,50%V/V-95%V/V流动相B;34-39分钟,95%V/V流动相B;
3)将多个分离物干燥,然后分别与甲醇(水)溶液混合,固液分离,收集液相物;
4)采用第二维液相色谱-质谱联用仪检测所述液相物,根据检测谱图分析出菟丝子原药材中的成分;其中,
第二维液相色谱的操作条件包括:采用Agilent Zorbax SB-Aq色谱柱;采用0.1%V/V甲酸水溶液作为流动相A,乙腈作为流动相B;洗脱程序:0-2分钟,2%V/V流动相B;2-8分钟,2%V/V-13%V/V流动相B;8-25分钟,13%V/V-30%V/V流动相B;25-32分钟,30%V/V-43%V/V流动相B;32-42分钟,43%V/V-70%V/V流动相B;42-47分钟,70%V/V-90%V/V流动相B;47-48分钟,90%V/V-100%V/V流动相B;48-53分钟,100%V/V流动相B;
质谱的操作条件包括:采用ESI源;离子源温度为120℃;负离子扫描模式;扫描质量范围100-1700Da。
本发明第七方面的任意实施方式中,方法包括如下的一项或多项:
a)第一维液相色谱的柱温为30℃;
b)第一维液相色谱的流动相流速为1.0mL/min;
c)第一维液相色谱的进样量为40μL;
d)第一维液相色谱采用PDA探测器监测287nm波长处的信号;
e)第二维液相色谱的柱温为25℃;
f)第二维液相色谱的流动相流速为0.3mL/min;
g)第二维液相色谱的进样量为3μL;
h)质谱的毛细管电压为1.5kV;
i)质谱的锥孔电压为60V;
j)质谱的补充离子源电压为80V;
k)质谱的脱溶剂温度为500℃;
l)质谱的锥孔气流速为50L/h;
m)质谱的脱溶气流速为800L/h;
n)质谱的扫描间隔0.3s;
o)质谱的低碰撞能量为6eV;
p)质谱的阶梯碰撞能量为10-40eV。
本发明第七方面的任意实施方式中,第一维液相色谱为Agilent1260HPLC系统。
本发明第七方面的任意实施方式中,步骤2)中,每分钟收集一个分离物;优选地,从0分钟开始至35分钟结束,每分钟收集一个分离物,共收集到35个分离物。
本发明第七方面的任意实施方式中,步骤3)中,甲醇(水)溶液的浓度为60%V/V-90%V/V,例如70%V/V、80%V/V、90%V/V。
本发明第七方面的任意实施方式中,步骤3)中,甲醇(水)溶液的体积为200μL.。
本发明第七方面的任意实施方式中,步骤3)中,通过离心处理进行固液分离;优选地,离心处理采用的离心力为11000×g至12000×g,例如11200×g、11481×g、11800×g;优选地,离心处理的时间为5-20分钟,例如5、10、15、20分钟。
本发明第七方面的任意实施方式中,第二维液相色谱-质谱联用仪为ACQUITYUPLC I-Class/Vion IM-QTOF系统。
本发明第七方面的任意实施方式中,步骤4)中,通过非数据依赖高分辨全信息串联质谱采集数据。
本发明第七方面的任意实施方式中,步骤4)中,通过混合校准剂进行数据校正和CCS值校正。
本发明第七方面的任意实施方式中,根据检测谱图通过如下的步骤分析出菟丝子原药材中的成分:
将由检测谱图获得的数据进行校正,得到校正后的数据;
通过UNIFI
将校正后的数据通过UNIFI
利用全球天然产物社交分子网络平台(GNPS)处理菟丝子原药材中的未知成分的校正后数据,以注释出菟丝子原药材中的未知成分;
通过ALLCCS数据库(www.ALLCCS.zhulab.cn)预测同分异构体的理论CCS值,与UNIFI
本发明第七方面的任意实施方式中,通过如下操作对由检测谱图获得的数据进行校正:
将由检测谱图获得的数据通过LockMass在负离子模式m/z554.2620下,采用应用加合离子过滤、二级质谱数据分析和质量误差排除来去除假阳性结果并进行验证。
本发明第七方面的任意实施方式中,通过UNIFI
高能量阈值(High energy intensity)为500counts;
低能量阈值(Low energy intensity)为1000counts;
目标匹配公差(Target match tolerance)为10.0ppm;
筛选候选同位素中的所有同位素;
根据结构生成预测片段;
片段匹配公差(fragment match tolerance)为10.0ppm;
加合物选择负加合物,包括+CH
Lock Mass设置联合宽度,3次扫描;
质量窗(mass window)为0.5m/z;
参考质量(reference mass)为554.2620;
参考电荷(reference charge)为-1。
本发明第七方面的任意实施方式中,利用全球天然产物社交分子网络平台(GNPS)通过如下的操作处理菟丝子原药材中的未知成分的校正后数据:
采用基于特征的分子网络(Feature-Based Molecular Networking,FBMN)工作流程和MS-DIAL 4.70软件(日本理化学研究所,日本)对未知成分的校正后数据进行反卷积和对齐处理,生成特征量化表(.txt文件)和MS/MS光谱摘要文件(.MGF文件);
将两个文件上传至GNPS网站,执行FBMN工作流程,将结果导入Cytoscape 3.82软件(National Institute of General Medical Sciences,美国),对结果进行可视化分析。
本发明第七方面的任意实施方式中,反卷积和对齐处理具体为:
将UNIFI
将校正后的文件通过GNPS网站提供的Proteowizard软件及“Double-Click_To-Convert_waters.bat”批处理文件将.raw格式转换为.mzML格式;
将.mzML文件导入MS-DIAL中进行反卷积和对齐处理。
本发明第七方面的任意实施方式中,通过如下的操作预测同分异构体的理论CCS值:使用ChemDraw 19.0软件绘制化学成分的结构并转化为SMILES格式,导入ALLCCS数据库,记录结构对应的CCS预测值。
本发明中,上述洗脱程序中的“t
本发明取得的有益效果:
本发明的菟丝子提取物、药物制剂能明显抑制B16F10细胞黑色素合成及酪氨酸酶活性,明显抑制雌二醇诱导的黑色素合成和酪氨酸酶活性,可减少豚鼠黄褐斑模型的表皮黑色素沉积,减少多巴阳性细胞数量,降低表皮黑色素含量,从而有效预防和/或治疗黄褐斑疾病。
本发明药物制剂的稳定性高、细腻、无颗粒感、黏度和pH值适中、安全性高。
本发明方法能分析出菟丝子原药材中的五大类约302个化合物,全面鉴定了菟丝子原药材中的物质成分,并且方法的精密度高、重复性好。
附图说明
为了使本发明的内容更容易被清楚的理解,下面根据本发明的具体实施例并结合附图,对本发明作进一步详细的说明,其中:
图1为本发明实施例2中的四种菟丝子提取物的分析结果;
图2为本发明实施例3中的29个对照品;
图3-1为本发明实验例1中的雌二醇组(E2)细胞活力的测定结果;
图3-2为本发明实验例1中的熊果苷组(Arbutin)细胞活力的测定结果;
图3-3为本发明实验例1中的菟丝子总提物组(TEC)细胞活力的测定结果;
图3-4为本发明实验例1中的菟丝子提取物1组(EC1)细胞活力的测定结果;
图3-5为本发明实验例1中的菟丝子提取物2组(EC2)细胞活力的测定结果;
图3-6为本发明实验例1中的菟丝子提取物3组(EC3)细胞活力的测定结果;
图3-7为本发明实验例1中的菟丝子提取物4组(EC4)细胞活力的测定结果;
图4-1为本发明实验例1中的雌二醇组(E2)黑色素相对含量的测定结果;
图4-2为本发明实验例1中的熊果苷组(Arbutin)黑色素相对含量的测定结果;
图4-3为本发明实验例1中的菟丝子总提物组(TEC)黑色素相对含量的测定结果;
图4-4为本发明实验例1中的菟丝子提取物1组(EC1)黑色素相对含量的测定结果;
图4-5为本发明实验例1中的菟丝子提取物2组(EC2)黑色素相对含量的测定结果;
图4-6为本发明实验例1中的菟丝子提取物3组(EC3)黑色素相对含量的测定结果;
图4-7为本发明实验例1中的菟丝子提取物4组(EC4)黑色素相对含量的测定结果;
图5-1为本发明实验例1中的雌二醇组(E2)酪氨酸酶相对活性的测定结果;
图5-2为本发明实验例1中的熊果苷组(Arbutin)酪氨酸酶相对活性的测定结果;
图5-3为本发明实验例1中的菟丝子总提物组(TEC)酪氨酸酶相对活性的测定结果;
图5-4为本发明实验例1中的菟丝子提取物1组(EC1)酪氨酸酶相对活性的测定结果;
图5-5为本发明实验例1中的菟丝子提取物2组(EC2)酪氨酸酶相对活性的测定结果;
图5-6为本发明实验例1中的菟丝子提取物3组(EC3)酪氨酸酶相对活性的测定结果;
图5-7为本发明实验例1中的菟丝子提取物4组(EC4)酪氨酸酶相对活性的测定结果;
图6-1为本发明实验例1中的熊果苷(Arbutin)、菟丝子总提物(TEC)、菟丝子提取物1-4(EC1-4)对雌二醇(E2)诱导的黑色素合成能力的影响结果;
图6-2为本发明实验例1中的熊果苷(Arbutin)、菟丝子总提物(TEC)、菟丝子提取物1-4(EC1-4)对雌二醇(E2)诱导的酪氨酸酶相对活性的影响结果;
图7-1为本发明实验例3中的生理盐水组的皮肤组织HE染色图;
图7-2为本发明实验例3中的空白基质组的皮肤组织HE染色图;
图7-3为本发明实验例3中的菟丝子水凝胶制剂1组的皮肤组织HE染色图;
图7-4为本发明实验例3中的菟丝子水凝胶制剂2组的皮肤组织HE染色图;
图7-5为本发明实验例3中的菟丝子水凝胶制剂3组的皮肤组织HE染色图;
图8-1为本发明实验例4中试验前各组所建立的豚鼠黄褐斑模型的图示;
图8-2为本发明实验例4中的各组给药15天后的色素沉着图示;
图9为本发明实验例4中各组给药15天后的豚鼠表皮黑色素相对含量的测定结果;
图10-1为本发明实验例4中空白组(Control)的Masson-Fontana染色结果图;
图10-2为本发明实验例4中空白基质组(Sham)给药15天后的Masson-Fontana染色结果图;
图10-3为本发明实验例4中模型组(Model)给药15天后的Masson-Fontana染色结果图;
图10-4为本发明实验例4中熊果苷(Arbutin)组给药15天后的Masson-Fontana染色结果图;
图10-5为本发明实验例4中菟丝子水凝胶制剂1(0.5%ECH)组给药15天后的Masson-Fontana染色结果图;
图10-6为本发明实验例4中菟丝子水凝胶制剂2(1%ECH)组给药15天后的Masson-Fontana染色结果图;
图10-7为本发明实验例4中菟丝子水凝胶制剂3(3%ECH)组给药15天后的Masson-Fontana染色结果图;
图10-8为本发明实验例4中各组给药15天后的Masson-Fontana染色结果图中的黑色素颗粒面积百分比;
图11-1为本发明实验例4中空白组(Control)的Imokawa染色结果图;
图11-2为本发明实验例4中空白基质组(Sham)给药15天后的Imokawa染色结果图;
图11-3为本发明实验例4中模型组(Model)给药15天后的Imokawa染色结果图;
图11-4为本发明实验例4中熊果苷(Arbutin)组给药15天后的Imokawa染色结果图;
图11-5为本发明实验例4中菟丝子水凝胶制剂1(0.5%ECH)组给药15天后的Imokawa染色结果图;
图11-6为本发明实验例4中菟丝子水凝胶制剂2(1%ECH)组给药15天后的Imokawa染色结果图;
图11-7为本发明实验例4中菟丝子水凝胶制剂3(3%ECH)组给药15天后的Imokawa染色结果图;
图11-8为本发明实验例4中各组给药15天后的Imokawa染色结果图中的多巴阳性细胞面积百分比;
图12-1为本发明实验例4中空白组(Control)的MITF免疫组化染色结果图;
图12-2为本发明实验例4中模型组(Model)给药15天后的MITF免疫组化染色结果图;
图12-3为本发明实验例4中熊果苷(Arbutin)组给药15天后的MITF免疫组化染色结果图;
图12-4为本发明实验例4中菟丝子水凝胶制剂1(0.5%ECH)组给药15天后的MITF免疫组化染色结果图;
图12-5为本发明实验例4中菟丝子水凝胶制剂2(1%ECH)组给药15天后的MITF免疫组化染色结果图;
图12-6为本发明实验例4中菟丝子水凝胶制剂3(3%ECH)组给药15天后的MITF免疫组化染色结果图;
图12-7为本发明实验例4中各组给药15天后的MITF免疫组化染色结果图中的阳性面积百分比;
图13-1为本发明实验例4中空白组(Control)的TYR免疫组化染色结果图;
图13-2为本发明实验例4中模型组(Model)给药15天后的TYR免疫组化染色结果图;
图13-3为本发明实验例4中熊果苷(Arbutin)组给药15天后的TYR免疫组化染色结果图;
图13-4为本发明实验例4中菟丝子水凝胶制剂1(0.5%ECH)组给药15天后的TYR免疫组化染色结果图;
图13-5为本发明实验例4中菟丝子水凝胶制剂2(1%ECH)组给药15天后的TYR免疫组化染色结果图;
图13-6为本发明实验例4中菟丝子水凝胶制剂3(3%ECH)组给药15天后的TYR免疫组化染色结果图;
图13-7为本发明实验例4中各组给药15天后的TYR免疫组化染色结果图中的阳性面积百分比;
图14-1为本发明实验例5中实施例2的菟丝子提取物EC2的谱图;
图14-2为本发明实验例5中实施例5的菟丝子提取物A2的谱图;
图14-3为本发明实验例5中实施例6的菟丝子提取物B2的谱图;
图14-4为本发明实验例5中实施例7的菟丝子提取物C2的谱图;
图15-1为本发明实验例5中实施例2的菟丝子提取物EC4的谱图;
图15-2为本发明实验例5中实施例5的菟丝子提取物A4的谱图;
图15-3为本发明实验例5中实施例6的菟丝子提取物B4的谱图;
图15-4为本发明实验例5中实施例7的菟丝子提取物C4的谱图。
具体实施方式
下面将结合实施例对本发明的实施方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。以下对至少一个示例性实施例的描述实际上仅仅是说明性的,决不作为对本发明及其应用或使用的任何限制。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
表1
/>
实施例所用实验材料如下:
乙腈(LC-MS级,Fisher,Fair lawn,NJ,USA);
甲醇(LC-MS级,Fisher,Fair lawn,NJ,USA);
甲酸(LC-MS级,ACS,Wilmington,USA);
超纯水(实验室自制);
Leucine-enkephalin溶液(Sigma-Aldrich,St.Louis,MO,USA);
菟丝子药材购于白山林村中药开发有限公司,根据《中国植物志》和指纹图谱比对,鉴定为旋花科植物菟丝子Cuscuta chinensis Lam.;
卡波姆940(药用级,批号20210302,西安泰华医药科技有限公司,中国);
甘油(药用级,批号20210701,江西益普生药业有限公司,中国);
吐温80(药用级,批号20210502,江西益普生药业有限公司,中国);
山梨酸钾(药用级,批号20210526,南京化学试剂股份有限公司,中国);
氢氧化钠(纯度>99.9%,上海阿拉丁生化科技股份有限公司,中国);
其余试剂均为市售分析纯。
实施例1菟丝子总提物(TEC)的制备
将适量菟丝子药材粉碎过三号筛(50目),取粉末0.5g,精密称定,用70%(V/V)甲醇10mL超声提取20min,3129×g离心10min后,取上清液用70%(V/V)甲醇定容至10mL,再以11481×g离心10min,取上清液定容至10mL作为供试品溶液,浓度为50mg/mL(以原药质量计),即菟丝子总提取物。
实施例2菟丝子提取物1-4(EC1-EC4)的制备
采用高效液相色谱-质谱法分离实施例1的供试品溶液,使用Agilent1260Infinity II制备型LC/MSD系统(Agilent Technologies,德国)。
液相色谱的操作条件:Waters SB-C18色谱柱(9.4×150mm,5μm);柱温30℃;由0.1%V/V甲酸水溶液(A)和乙腈(B)组成二元流动相,流速为2.5mL/min;梯度洗脱程序为:0-8min,98%-85%(A);8-20min,85%-70%(A);20-27min,70%-51%(A);27-33min,51%-40%(A);33-38min,40%-0%(A);38-41min,0%(A);41-42min,0%-98%(A);42-45min,98%(A)(%表示体积百分含量);进样量100μL;采用DAD探测器监测287、325、327、360nm波长处紫外信号,以确认黄酮类化合物是否流出;
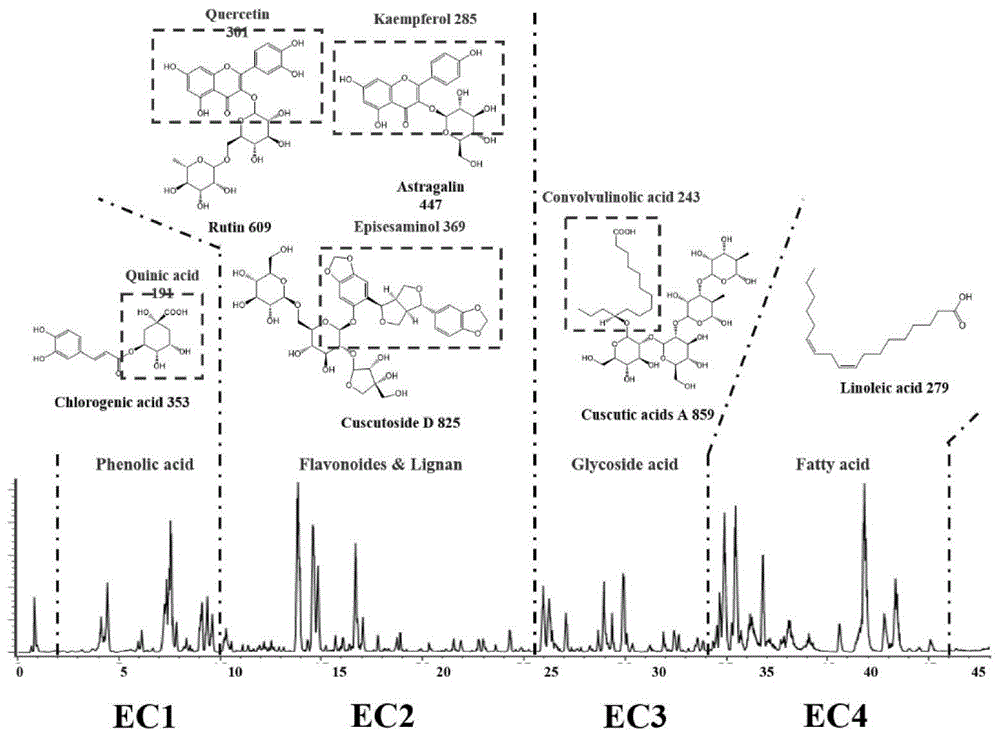
质谱的操作条件:离子源API-ES;采用负离子模式;循环时间为0.95s;扫描范围100-1700m/z;碰撞诱导解离能量为60eV;速度为1733u/sec;干燥气流速为12.0L/min;雾化气压力为35psig;干燥气温度为350℃;毛细管电压为3kV;采用InfinityLab LC/MSD质量选择检测器监测质量数,收集保留时间为2-10min且质量数为100-800范围的馏分作为菟丝子提取物1,收集保留时间为10-25min且质量数为200-1000范围的馏分作为菟丝子提取物2,收集保留时间为25-34min且质量数为500-1000范围的馏分作为菟丝子提取物3,收集保留时间为34-44min且质量数为200-500范围的馏分收集作为菟丝子提取物4。
各提取物旋蒸浓缩后转移至氮吹仪上吹干,-20℃保存,作为后续活性筛选样品。菟丝子提取物2的干物质含量为0.5mg/mL,菟丝子提取物4的干物质含量为0.07mg/mL。
得到的总离子流图如图1所示。将四种菟丝子提取物按照实施例3中的检测方法进行分析,得出提取物1(EC1)以有机酸类为主,提取物2(EC2)以黄酮和木脂素类为主,提取物3(EC3)以树脂糖苷类为主,提取物4(EC4)以脂肪酸类为主,各类的主要成分已标示在图1中。
实施例3菟丝子的化学成分分析
1实验部分
1.1实验材料
29个对照品如图2所示,包括12种黄酮类化合物(1-12)、10种有机酸(13-22)、6种脂肪酸(23-28)和1种木脂素(29),分别由上海诗丹德生物技术有限公司及成都德斯特生物技术有限公司提供。
1.2实验仪器
Agilent 1260高效液相色谱系统(Agilent Technologies,德国);
Agilent 1260Infinity II制备型LC/MSD系统(Agilent Technologies,德国);
ACQUITY UPLC I-Class/Vion IM-QTOF离子淌度四级杆飞行时间质谱系统(Waters Corporation,英国);
Centrifuge 5424R低温高速离心机(Eppendorf,德国);
Integral 5净水系统(Millipore,美国);
KQ-250E超声波清洗仪(昆山市超声仪器有限公司,中国);
中草药粉碎机(天津市泰斯特仪器有限公司,中国);
AX205十万分之一天平(Mettler Toledo,瑞典);
BP121S万分之一天平(Sartorius,德国);
XW-80A涡旋混合仪(上海泸西分析仪器厂,中国);
RE-52A小型旋转蒸发仪(上海亚荣生化仪器厂,中国)。
1.3实验样品的制备
同实施例1。
1.4检测方法
1.4.1二维色谱分析
通过亲水相互作用色谱法(HILIC)和反相色谱法(RPC)联用,建立菟丝子化学成分分离的离线2D-LC系统。
第一维(
各馏分分别用200μL的70%(V/V)甲醇复溶,11481×g离心10min,取上清液作为第二维(
第二维(
1.4.2质谱分析
使用Waters Vion
1.4.3菟丝子自建数据库的构建
通过对Web of Science(www.webofknowledge.com),CNKI(www.CNKI.net),ChemSpider(www.ChemSpider.com),PubChem(http://PubChem.ncbi.nlm.nih.gov)和Chemicalbook(www.Chemicalbook.com)等数据库中菟丝子植物化学分离的相关文献进行检索,全面总结从菟丝子中分离出的已报道化合物,构建菟丝子化学成分自建数据库。首先,根据UNIFI
1.4.4菟丝子化学成分表征
利用UNIFI
为了注释未知化合物,通过全球天然产物社交分子网络平台(Global NaturalProducts Social Molecular Networking,GNPS,http://GNPS.ucsd.edu)进一步处理了菟丝子总提取物的MS
对于同分异构体的鉴别,采用ALLCCS数据库(www.ALLCCS.zhulab.cn)对异构体的理论CCS值进行预测,使用ChemDraw 19.0软件绘制化学成分的结构并转化为SMILES格式,导入ALLCCS数据库,记录结构对应的CCS预测值,与UNIFI
2结果
初步鉴定了五大类302个化合物,主要为绿原酸及其衍生物、黄酮(山奈酚、槲皮素及其糖苷)、木脂素(6-羟基-芝麻素及其糖苷)、树脂糖苷(旋花醇酸多糖苷及其衍生物)、不饱和脂肪酸(亚油酸、油酸、亚麻酸等)。
3方法验证
作为一种定性分析方法,进一步验证了建立的离线2D-LC/MS系统的精密度和重复性。选择了
实施例4菟丝子水凝胶制剂1-3的制备
菟丝子提取物2和菟丝子提取物4以重量比7:1混合作为主药。
按照表2-4的处方,称取处方量的卡波姆940,加入适量去离子水中,磁力搅拌混合均匀后放入冰箱4℃静置24h使充分溶胀;称取处方量的主药、吐温80、乙醇、甘油、山梨酸钾,加入适量去离子水磁力搅拌混合均匀后,将其缓慢加入溶胀的卡波姆基质中,继续磁力搅拌两小时,得到含药基质;将处方量的氢氧化钠溶于适量去离子水,在搅拌状态下加入含药基质中并用去离子水补重至1000g,继续搅拌一小时,即得菟丝子水凝胶制剂1-3。
表2菟丝子水凝胶制剂1的处方
/>
表3菟丝子水凝胶制剂2的处方
表4菟丝子水凝胶制剂3的处方
实施例5菟丝子提取物A2、A4的制备
称取100g菟丝子药材,加入800mL蒸馏水回流提取2h,再加入400mL蒸馏水回流提取1h,合并提取液,在60℃下减压浓缩至200mL;向浓缩物中加入200mL石油醚,轻轻振摇5min后静置1h进行萃取,将有机溶剂层和水层分离开。
将水层采用D101大孔吸附树脂(购买自沧州宝恩吸附材料科技有限公司)纯化,上样吸附后先用蒸馏水洗掉杂质,再用洗脱剂洗脱并收集洗脱液,上样吸附的时间为2h,水洗体积为300mL,水洗流速为300mL/h,洗脱剂采用60%W/W乙醇水溶液,洗脱剂的洗脱量为300mL,洗脱剂的洗脱速度为200mL/h;将收集的洗脱液在60℃下真空干燥,得到菟丝子提取物A2,干物质含量为0.7mg/mL。
将有机溶剂层减压回收溶剂至干,得到菟丝子提取物A4,干物质含量为0.1mg/mL。
实施例6菟丝子提取物B2、B4的制备
称取100g菟丝子药材,加入800mL的70%W/W乙醇水溶液回流提取2h,再加入400mL的70%W/W乙醇水溶液回流提取1h,合并提取液,在60℃下减压浓缩至无醇味;向浓缩物中加入200mL石油醚,轻轻振摇5min后静置1h进行萃取,将有机溶剂层和水层分离开。
将水层采用D101大孔吸附树脂(购买自沧州宝恩吸附材料科技有限公司)纯化,上样吸附后先用蒸馏水洗掉杂质,再用洗脱剂洗脱并收集洗脱液,上样吸附的时间为2h,水洗体积为300mL,水洗流速为300mL/h,洗脱剂采用60%W/W乙醇水溶液,洗脱剂的洗脱量为300mL,洗脱剂的洗脱速度为200mL/h;将收集的洗脱液在60℃下真空干燥,得到菟丝子提取物B2,干物质含量为0.7mg/mL。
将有机溶剂层减压回收溶剂至干,得到菟丝子提取物B4,干物质含量为0.1mg/mL。
实施例7菟丝子提取物C2、C4的制备
称取100g菟丝子药材,加入100mL的70%W/W乙醇水溶液浸泡0.5h,再加入900mL的70%W/W乙醇水溶液,以250mL/h流速渗漉提取,收集滤液,在60℃下减压浓缩至无醇味;向浓缩物中加入200mL石油醚,轻轻振摇5min后静置1h进行萃取,将有机溶剂层和水层分离开。
将水层采用D101大孔吸附树脂(购买自沧州宝恩吸附材料科技有限公司)纯化,上样吸附后先用蒸馏水洗掉杂质,再用洗脱剂洗脱并收集洗脱液,上样吸附的时间为2h,水洗体积为300mL,水洗流速为300mL/h,洗脱剂采用60%W/W乙醇水溶液,洗脱剂的洗脱量为300mL,洗脱剂的洗脱速度为200mL/h;将收集的洗脱液在60℃下真空干燥,得到菟丝子提取物C2,干物质含量为0.7mg/mL。
将有机溶剂层减压回收溶剂至干,得到菟丝子提取物C4,干物质含量为0.1mg/mL。
实验例1治疗黄褐斑药效的体外评价
1实验部分
1.1实验材料
菟丝子提取物1-4(EC1-EC4)、菟丝子总提物(TEC);
熊果苷(Arbutin,纯度>98.0%,上海阿拉丁生化科技股份有限公司,中国);
左旋多巴(L-DOPA,纯度>98.0%,上海阿拉丁生化科技股份有限公司,中国);
雌二醇(E2,纯度>99.0%,Sigma,美国);
DMEM高糖培养基(Biological Industries,以色列);
胎牛血清(Biological Industries,以色列);
胰蛋白酶(Biological Industries,以色列);
青-链霉素双抗(Biological Industries,以色列);
DMSO(二甲基亚砜,细胞培养级,北京索莱宝科技有限公司,中国);
氢氧化钠(纯度>99.0%,上海阿拉丁生化科技股份有限公司,中国);
Triton X-100(北京索莱宝科技有限公司,中国);
小鼠黑色素瘤B16F10细胞(上海中乔新舟生物科技有限公司,中国);
PBS(磷酸盐缓冲溶液,北京索莱宝科技有限公司,中国)
MTS的化学名称为3-(4,5-二甲基噻唑-2-基)-5-(3-羧基甲氧基苯基)-2-(4-磺基苯基)-2H-四唑鎓,艾博抗公司生产,货号为ab197010。
1.2实验仪器
PTX-FA110S电子天平(福州华志科学仪器有限公司,中国)
Spark 20M多功能酶标仪(TECAN,瑞士)
1300Series A2超净工作台(Thermo Fisher,美国)
Centrifuge 5430R低温高速离心机(Eppendorf,德国)
Centrifuge 5427R低温高速离心机(Eppendorf,德国)
Eclipse Ts2倒置显微镜(Nikon,日本)
Heracell
1.3实验方法
1.3.1试液的配制
1%Triton X-100裂解液:取100μL Triton X-100,加入10mL PBS(磷酸盐缓冲液,0.1M,pH 7.2-7.4),涡旋混匀,即得。
10%DMSO 1M NaOH裂解液:取10mL超纯水,缓缓加入NaOH 0.4g,涡旋混匀,静置冷却后加入1ml DMSO,涡旋混匀,即得。
0.1%L-Dopa溶液:取10mg左旋多巴,加入10mL PBS(磷酸盐缓冲液,0.1M,pH 7.2-7.4),涡旋混匀,即得。
1.3.2样品制备
分别取菟丝子提取物1-4、菟丝子总提物、雌二醇(E2)、熊果苷适量,用DMSO配制成100mg/mL母液,-20℃保存,临用前用DMEM高糖培养基稀释至所需浓度。
1.3.3细胞培养
小鼠黑色素瘤B16F10细胞的培养基为DMEM高糖培养基,向培养基中加入相当于培养基质量10%的胎牛血清和相当于培养基质量1%的青链霉素双抗,5%CO
1.3.4细胞活力测定
将1.3.3节培养得到的B16F10细胞接种于DMEM高糖培养基,培养到对数生长期时采用胰蛋白酶消化;将细胞的浓度调整至2×10
1.3.5黑色素含量测定
将1.3.3节培养得到的B16F10细胞接种于DMEM高糖培养基,培养到对数生长期时采用胰蛋白酶消化;将细胞的浓度调整至1×10
1.3.6酪氨酸酶活性测定
将1.3.3节培养得到的B16F10细胞接种于DMEM高糖培养基,培养到对数生长期时采用胰蛋白酶消化;将细胞的浓度调整至2×10
1.3.7统计分析
采用GraphPad Prism 9软件对数据进行统计分析并作图,计量资料釆用均数±标准差(Mean±SD)表示,两组数据间比较采用t检验;多组数据先进行方差齐性检验,若p>0.05表示样本符合正态分布,用单因素方差分析(One-way ANOVA)比较样本均值差异;若p<0.05表示数据不符合正态分布,用非参数检验比较样本均值差异。当p<0.05,表示存在显著差异,当p<0.01,表示存在极显著差异,两者均提示样本间差异具有统计学意义;当p>0.05,提示样本间差异无统计学意义。所有实验均至少重复三次(n=3)。
2实验结果
2.1细胞活力的测定结果(图3-1至3-7)
由图3-1至3-7可知,与空白组(Control组)比较,10
2.2黑色素含量的测定结果(图4-1至4-7)
由图4-1至4-7可知,与空白组(Control组)比较,雌二醇在1×10
图中:*表示与Control组比较,p<0.05;**表示与Control组比较,p<0.01;#表示有显著性差异,p<0.05;n.s.表示无显著差别,p>0.05。
2.3酪氨酸酶活性的测定结果(图5-1至5-7)
酪氨酸酶是黑色素合成反应过程的限速酶,也是黑素细胞成熟分化的标志。由图5-1至5-7可知,与空白组(Control组)比较,雌二醇在1×10
图中:*表示与Control组比较,p<0.05;**表示与Control组比较,p<0.01;n.s.表示无显著差别,p>0.05。
2.4菟丝子提取物对E2诱导的黑色素合成和酪氨酸酶活性的影响
根据以上研究,菟丝子提取物的明显起效浓度约为50μg/mL,采用10
图中:##表示与Control组比较,p<0.01;**表示与E2组比较,p<0.01;*表示与E2组比较,p<0.05。
3结果分析
采用小鼠黑色素瘤B16F10细胞模型对菟丝子治疗黄褐斑的药效进行了体外评价,菟丝子提取物1-4及总提物对B16F10细胞活力无明显影响,表明菟丝子不是通过抑制黑色素细胞增殖发挥治疗黄褐斑作用。菟丝子提取物2(EC2)和菟丝子提取物4(EC4)对B16F10细胞黑色素合成和酪氨酸酶活性有明显抑制作用,EC2和EC4能显著抑制雌二醇诱导的黑色素合成增加和酪氨酸酶活性升高。菟丝子总提物对B16F10细胞黑色素合成和酪氨酸酶活性有抑制作用,对雌二醇诱导的酪氨酸酶活性有抑制作用。而菟丝子提取物1(EC1)和菟丝子提取物3(EC3)无明显作用。由实施例2可知,EC2主要含有黄酮类化合物(槲皮素、山奈酚及其衍生物)和木脂素类化合物(芝麻素衍生物);EC4主要含有不饱和脂肪酸类化合物(亚油酸、油酸、α-亚麻酸等)。
实验例2制剂的稳定性、涂展性、黏度值和pH值的测定
1.稳定性
取制剂适量,置于15mL离心管中,以2000r/min离心30min,观察是否有分层现象发生。
2.涂展性
取制剂适量,涂抹在专业评测人员的皮肤上,由专业评测人员对制剂的涂展性进行评价,取平均结果。
3.黏度值
取制剂适量,采用DV-Ⅲ型数显粘度计(Brookfield,美国)测定黏度值,采用64号转子,转速100rpm,室温测定,黏度值稳定后间隔30s读取三次黏度值,结果以均值±标准偏差(Mean±SD)表示。
4.pH值
采用PHS-3C型pH计(上海仪电科学仪器股份有限公司,上海,中国)测定制剂的pH值。
5.结果
表5
实验例3制剂的刺激性评价
1.皮肤刺激反应评分
参照国家食品药品监督管理总局发布的《药物刺激性、过敏性和溶血性研究技术指导原则》进行实验,采用豚鼠作为刺激性评价的模型动物。取10只豚鼠,脱去背部毛发,以自身阴性为对照,划定1×1cm
表6皮肤刺激反应评分标准
/>
2.组织学观察
(1)固定:处死动物,取合适大小皮肤标本,4%多聚甲醛固定过夜。
(2)脱水:取出固定好的标本,放入脱水机,依次梯度脱水:75%乙醇4h,85%乙醇2h,90%乙醇1h,无水乙醇Ⅰ30min,无水乙醇Ⅱ30min,无水乙醇/二甲苯1:1 30min,二甲苯Ⅰ20min,二甲苯Ⅱ20min,石蜡Ⅰ1h,石蜡Ⅱ1h,石蜡Ⅲ1h。
(3)包埋:将浸好蜡的标本放入包埋机内进行包埋,-20°冷冻,待蜡凝固后将蜡块从包埋机中取出,修整蜡块。
(4)切片:将修整好的蜡块置于切片机上切片,切片厚度4μm。切片放入摊片机展平,置于载玻片上并放入烘箱内60℃烤片后取出,常温保存备用。
(5)脱蜡:将切片依次放入二甲苯Ⅰ20min,二甲苯Ⅱ
20min,无水乙醇Ⅰ5min,无水乙醇Ⅱ5min,75%乙醇5min,自来水洗一遍。
(6)苏木素染色:切片放入苏木素染液中染色5min,自来水洗,分化液分化,自来水洗,返蓝液返蓝,流水冲洗。
(7)伊红染色:切片依次放入85%乙醇5min,95%乙醇5min,再放入伊红染液中染色5min。
(8)脱水封片:切片依次放入无水乙醇I 5min,无水乙醇II 5min,无水乙醇Ⅲ5min,二甲苯Ⅰ5min,二甲苯Ⅱ5min,取出,中性树脂封片。
(9)倒置显微镜观察,采集图像并分析。
I代表第一次洗涤或浸泡,Ⅱ代表第二次洗涤或浸泡,Ⅲ代表第三次洗涤或浸泡。
3.结果
皮肤刺激性评分结果见表7,组织HE染色见图7-1至7-5。
表7菟丝子多次给药皮肤刺激强度评分结果
由上表可知,15日内均未观察到豚鼠皮肤出现红斑和水肿,表明菟丝子水凝胶制剂的安全性较好。
由图7-1至7-5中的豚鼠连续15日给药皮肤HE染色图可知,各组表皮和真皮层厚度一致,表皮和真皮细胞均匀分布,无明显肿胀及炎性浸润。
实验例4采用动物模型评价制剂的抗黄褐斑药效
1.实验部分
1.1实验材料
菟丝子水凝胶制剂1-3、熊果苷水凝胶(实验室自制);
左旋多巴(L-DOPA,纯度>98.0%,上海阿拉丁生化科技股份有限公司,中国);
苯甲酸雌二醇注射液(兽用药,批号210301,上海全宇生物科技驻马店动物药业有限公司,中国);
异氟烷(深圳市瑞沃德生命科技有限公司,中国);
柠檬酸抗原修复液(武汉赛维尔生物科技有限公司,中国);
EDTA抗原修复液(武汉赛维尔生物科技有限公司,中国);
黑色素染液套装(武汉赛维尔生物科技有限公司,中国);
环保型脱蜡透明液(武汉赛维尔生物科技有限公司,中国);
一抗:
MITF抗体(C5)(Santa Cruz Biotechnology,货号sc-56725)
CREB-1抗体(D-12)(Santa Cruz Biotechnology,货号sc-377154)
p-CREB-1抗体(10E9)(Santa Cruz Biotechnology,货号sc-81486)
ER alpha抗体(D-12)(Santa Cruz Biotechnology,货号sc-8005)
20S Proteasomeα1抗体(C-7)(Santa Cruz Biotechnology,货号sc-166073);
Ubiquitin(P4D1)Mouse mAb(Cell Signaling Technology,货号3936S);
二抗:m-IgG Fc BP-HRP(Santa Cruz Biotechnology,货号sc-525416);
DAB显色液(武汉赛维尔生物科技有限公司,货号G1211);
苏木素分化液(武汉赛维尔生物科技有限公司,货号G1309);
苏木素返蓝液(武汉赛维尔生物科技有限公司,货号G1340);
其他试剂均为市售分析纯。
1.2实验仪器
PTX-FA110S电子天平(福州华志科学仪器有限公司,中国);
PL-S9W/01窄谱紫外线灯管(波长311nm,飞利浦,荷兰);
WKM-UV1紫外辐照计(深圳沃客密科技有限公司,中国);
R500通用型小动物麻醉机(深圳市瑞沃德生命科技有限公司,中国);
Centrifuge 5430R低温高速离心机(Eppendorf,德国);
KZ-Ⅱ高速组织研磨仪(武汉赛维尔生物科技有限公司,中国);
Spark 20M多功能酶标仪(TECAN,瑞士);
Eclipse Ts2倒置显微镜(Nikon,日本);
SI500控温摇床培养箱(Stuart,英国);
JB-L5包埋机(武汉俊杰电子有限公司,中国);
KD-P组织摊片机(浙江省金华市科迪仪器设备有限公司,中国);
Donatello Series 2自动组织脱水机(DIAPATH,意大利);
Giotto染色机(DIAPATH,意大利);
RM2016病理切片机(上海徕卡仪器有限公司,中国)。
1.3实验动物
雌性豚鼠,体重200-300g(北京昌扬西山养殖场,中国)。
1.4实验方法
1.4.1豚鼠黄褐斑模型的建立
20只体重约200-300g的雌性豚鼠,用电动剃毛器将每只豚鼠的背部区域的毛刮去。在造模期间,用异氟烷对豚鼠进行呼吸麻醉并固定于固定板上。用硬纸片覆盖每只动物的背部,并用在硬纸片上裁剪6个1×1cm矩形方格,使每只动物背部上6个方格暴露于紫外线辐射(最大发射波长约311nm,距离10cm),辐射剂量用紫外辐射计测量,剂量为每天照射150mJ/cm
1.4.2给药及取材
在造模第30天结束后,将空白基质(不含主药、配方其余成分不变)、3%熊果苷水凝胶(30g熊果苷加去离子水补重至1000g)、菟丝子水凝胶制剂1-3均匀涂抹于方格内,每天给药一次,继续连续给药15天,处死动物,剥下背部皮肤,裁剪合适大小,-80℃保存备用。
1.4.3组织黑色素含量测定
取合适大小皮肤标本,称重后加入1.0mL 1M NaOH,置于组织匀浆器中匀浆,并100℃加热20分钟,室温冷却,12000rpm离心15min,取上清液200μl在酶标仪490nm波长下测量各孔吸光度值,并均一化为组织重量。
1.4.4Masson-Fontana染色
(1)工作液配制:取黑色素染色液A10mL,逐滴加入浓氨水使产生沉淀,继续一边滴加浓氨水,一边摇动,使沉淀复溶,直至溶液澄清。再滴入黑色素染色液A数滴使溶液呈轻微混浊,最后加入蒸馏水20mL振摇均匀,过滤,备用。
VG染液配制:取黑色素染液B 9mL加入黑色素染液C1mL,均匀混合成VG染液,备用。
(2)组织标本石蜡包埋切片流程同实验例3的第2项。
(3)切片脱蜡:依次将切片放入二甲苯Ⅰ20min,二甲苯Ⅱ20min,无水乙醇Ⅰ5min,无水乙醇Ⅱ5min,75%乙醇5min,自来水洗一遍,蒸馏水浸泡洗涤三遍。
(4)孵育:将切片浸入工作液,盖严,放入冰箱4℃避光反应过夜,蒸馏水浸泡洗涤三遍。
(5)VG复染:将切片浸入VG染液,1min后取出,迅速蒸馏水洗一遍,无水乙醇Ⅰ、Ⅱ、Ⅲ快速脱水3s、5s、30s。
(6)透明封片:另取新配二甲苯Ⅰ、Ⅱ,依次透明20s、5min,中性树脂封片。
(7)倒置显微镜观察,采集图像并分析。
1.4.5Imokawa染色法
(1)表皮分离:取出合适大小皮肤标本,将标本在0.1M磷酸盐缓冲液(pH 6.8)中浸洗三遍,放入在1M溴化钠中,37℃孵育5h。
(2)固定:用镊子小心地将表皮与真皮分离,放入10%冷中性福尔马林中,4℃固定30分钟。
(3)孵育:用0.1M磷酸盐缓冲液(pH 6.8)浸洗三遍,并在0.1%L-Dopa的0.1M磷酸盐缓冲溶液(pH 6.8)中孵育5h。
(4)倒置显微镜观察,采集图像并分析。
1.4.6免疫组化染色
(1)组织标本石蜡包埋切片流程同实验例3的第2项。
(2)脱蜡:依次将切片放入脱蜡液Ⅰ15min,二甲苯Ⅱ15min,二甲苯Ⅱ15min,无水乙醇Ⅰ5min,无水乙醇Ⅱ5min,85%乙醇5min,75%乙醇5min,蒸馏水浸洗。
(3)抗原修复:切片放入盛满柠檬酸抗原修复缓冲液的修复盒中,在微波炉内进行抗原修复,中火8min至沸腾,停火保温8min再转小火7min。室温冷却后将载玻片置于PBS中,在摇床上洗涤3次,每次5min。
(4)阻断内源性过氧化物酶:切片放入3%过氧化氢水溶液,室温避光孵育25min,将载玻片置于PBS中,在摇床上洗涤3次,每次5min。
(5)封闭:滴加3%BSA均匀覆盖组织,室温封闭30min。
(6)一抗孵育:轻轻甩掉封闭液,在切片上滴加一抗,载玻片平放于湿盒内,4℃孵育过夜。
(7)二抗孵育:载玻片置于PBS中,在摇床上洗涤3次,每次5min。轻轻甩干切片,滴加二抗均匀覆盖组织,室温孵育50min。
(8)DAB显色:将载玻片放入PBS中,在摇床上洗涤3次,每次5min。轻轻甩干切片,滴加新鲜配制的DAB显色液,显微镜下控制显色时间,阳性为棕黄色,水洗切片终止显色。
(9)复染细胞核:苏木素复染3min,水洗,苏木素分化液分化10s,水洗,苏木素返蓝液返蓝,水洗。
(10)脱水封片:将切片依次放入75%乙醇5min,85%乙醇5min,无水乙醇Ⅰ5min,无水乙醇Ⅱ5min,正丁醇5min,二甲苯Ⅰ5min,取出晾干,中性树脂封片。
(11)倒置显微镜观察,采集图像并分析。
1.4.7统计分析
采用GraphPad Prism 9软件对数据进行统计分析并作图,计量资料釆用均数±标准差(Mean±SD)表示,两组数据间比较采用t检验,多组数据先进行方差齐性检验,若p>0.05表示样本符合正态分布,用单因素方差分析(One-way ANOVA)比较样本均值差异;若p<0.05表示数据不符合正态分布,用非参数检验比较样本均值差异。当p<0.05,表示存在显著差异,当p<0.01,表示存在极显著差异,两者均提示样本间差异具有统计学意义;当p>0.05,提示样本间差异无统计学意义。所有实验均至少重复三次(n=3)。
2.实验结果
2.1菟丝子黄褐斑模型评价
造模30天后,可见豚鼠背部6个方块内明显色素沉着,6个方块间颜色均匀,提示造模成功(图8-1)。继续给药15天后,与模型组相比,给药组色素沉着状态有一定减轻(图8-2)。
图中:1.空白基质组,2.模型组,3.3%熊果苷水凝胶,4.菟丝子水凝胶制剂1,5.菟丝子水凝胶制剂2,6.菟丝子水凝胶制剂3。
2.2对豚鼠表皮黑色素含量的影响
由图9可知,菟丝子水凝胶可减少豚鼠黄褐斑模型表皮黑色素含量(p<0.01),菟丝子水凝胶高剂量组药效优于中剂量组和低剂量组(p<0.05),高剂量组与熊果苷组药效接近(p>0.05)。图中:Control表示空白组,未经过任何处理;Sham表示空白基质组;Model表示模型组,加生理盐水;0.5%ECH表示菟丝子水凝胶制剂1,称低剂量组;1%ECH表示菟丝子水凝胶制剂2,称中剂量组;3%ECH表示菟丝子水凝胶制剂3,称高剂量组;**,与模型组相比,p<0.01;*,与模型组相比,p<0.05;#,p<0.05;n.s.,p>0.05。
2.3Masson-Fontana染色结果(图10-1至10-8)
由图10-1至10-8可知,给药15天后,可见各组间黑色素颗粒含量有一定差别,空白组表皮黑色素颗粒含量较低;空白基质组和模型组黑色素颗粒明显增加(p<0.01);菟丝子水凝胶低、中、高剂量组可明显减少表皮黑色素颗粒数量(p<0.01);菟丝子水凝胶低剂量组和高剂量组间有差异(p<0.05);菟丝子水凝胶中、高剂量组与熊果苷组间差异无统计学意义(p>0.05)。图中:Control表示空白组,未经过任何处理;Sham表示空白基质组;Model表示模型组,加生理盐水;0.5%ECH表示菟丝子水凝胶制剂1,称低剂量组;1%ECH表示菟丝子水凝胶制剂 2,称中剂量组;3%ECH表示菟丝子水凝胶制剂 3,称高剂量组;**,与Model组比较,p<0.01;#,p<0.05。
2.4Imokawa染色结果(图11-1至11-8)
由图11-1至11-8可知,给药15天后,各组间多巴阳性细胞数量存在差别,空白组表皮基本未见多巴阳性细胞;空白基质组和模型组多巴阳性细胞明显增加(p<0.01);菟丝子水凝胶中、高剂量组可明显减少表皮多巴阳性细胞数量(p<0.01),菟丝子水凝胶低剂量组可减少表皮多巴阳性细胞数量(p<0.05),菟丝子水凝胶低、中、高剂量组与熊果苷组间差异无统计学意义(p>0.05)。图中:Control表示空白组,未经过任何处理;Sham表示空白基质组;Model表示模型组,加生理盐水;0.5%ECH表示菟丝子水凝胶制剂1,称低剂量组;1%ECH表示菟丝子水凝胶制剂2,称中剂量组;3%ECH表示菟丝子水凝胶制剂3,称高剂量组;**与Model组比较,p<0.01;*与Model组比较,p<0.05。
2.5免疫组化染色结果(图12-1至12-7、图13-1至13-7)
由图12-1至12-7、图13-1至13-7可知:空白组表皮细胞MITF表达较少、TYR表达较少;模型组表皮基底层明显可见MITF、TYR阳性区域明显增加;熊果苷、菟丝子水凝胶制剂1-3可明显降低豚鼠表皮MITF和TYR受体表达。图中:Control表示空白组,未经过任何处理;Sham表示空白基质组;Model表示模型组,加生理盐水;0.5%ECH表示菟丝子水凝胶制剂1,称低剂量组;1%ECH表示菟丝子水凝胶制剂2,称中剂量组;3%ECH表示菟丝子水凝胶制剂3,称高剂量组;**,与模型组比较,p<0.01。
3.结果分析
结果显示,所用造模方法可以造成豚鼠表皮色素沉着;阳性药物熊果苷和菟丝子水凝胶可减少豚鼠黄褐斑模型表皮黑色素沉积,减少多巴阳性细胞数量,降低表皮黑色素含量;当菟丝子水凝胶浓度为3%时药效最优,与3%熊果苷水凝胶药效无明显差异。
实验例5二维色谱-质谱检测
采用实施例3中第1.4.1至1.4.2节的二维色谱-质谱法检测实施例2的菟丝子提取物EC2和EC4、实施例5的菟丝子提取物A2和A4、实施例6的菟丝子提取物B2和B4、实施例7的菟丝子提取物C2和C4。
实施例2的菟丝子提取物EC2、实施例5的菟丝子提取物A2、实施例6的菟丝子提取物B2、实施例7的菟丝子提取物C2的谱图如图14-1至14-4所示;实施例2的菟丝子提取物EC4、实施例5的菟丝子提取物A4、实施例6的菟丝子提取物B4、实施例7的菟丝子提取物C4的谱图如图15-1至15-4所示。
由图14-1至14-4可知,实施例2的菟丝子提取物EC2、实施例5的菟丝子提取物A2、实施例6的菟丝子提取物B2、实施例7的菟丝子提取物C2中的主要成分及含量近似。
由图15-1至15-4可知,实施例2的菟丝子提取物EC4、实施例5的菟丝子提取物A4、实施例6的菟丝子提取物B4、实施例7的菟丝子提取物C4中的主要成分及含量近似。
显然,上述实施例仅仅是为清楚地说明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引伸出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
- 菟丝子α-糖苷酶抑制活性提取物及其组合物的医药用途和制备方法
- 莬丝子提取物和制备方法、含有菟丝子提取物的中成药及其用途
