治疗靶向药物相关心脏毒性的中药浓缩丸及其制备和应用
文献发布时间:2024-04-18 19:58:53
技术领域
本发明属于中药技术领域,具体涉及一种治疗靶向药物相关心脏毒性的中药浓缩丸,以及该浓缩丸的制备和应用。
背景技术
分子靶向药物因其靶向性强、安全性高、毒副作用小等优点,已广泛用于肺癌、结直肠癌、乳腺癌等各种类型肿瘤的治疗,是继手术、放疗和化疗后的另一种有效的肿瘤治疗手段。然而,随着分子靶向药物的长期应用,相关的心脏毒性的发生率和死亡率却与日俱增,是其最严重的不良反应之一。曲妥珠单抗是最具代表性的分子靶向药物之一,在治疗HER2阳性转移性乳腺癌中发挥重要作用,当其与蒽环类药物联用时,心血管毒副作用发生率高达37%。一般认为,与蒽环类药物不同,曲妥珠单抗所引起的心脏毒性并非是剂量依赖性的,也并非所有患者都会出现,并且是可逆的。左室功能不全(LVD)和心衰(HF)是癌症治疗中比较常见和严重的心脏毒性表现。与一般心脏病相比具有特殊性,曲妥珠单抗心脏毒性是由阻断HER2信号通路引起。在正常生理情况下,HER2下游信号通路具有调节心肌稳态、能量代谢、肌丝发育,细胞存活等作用。在人诱导多能干细胞衍生的心肌细胞中,曲妥珠单抗减少心肌细胞的糖摄取,抑制线粒体功能,并且心肌收缩力和钙调控也受到影响。因此,曲妥珠单抗不直接损伤心肌细胞,而是通过阻碍这一重要的信号通路影响心肌能量代谢及稳态,最终导致心脏功能受损。
目前,仅有右丙亚胺单药是经美国食品药品监督管理局批准的心脏保护剂,用于预防蒽环类抗肿瘤药物导致的心脏毒性。然而右雷佐生发挥心脏保护作用的机制尚不十分清楚。右雷佐生为EDTA的环状衍生物,可透过细胞膜。实验室研究结果显示,右雷佐生在细胞内转变为开环螯合剂,干扰铁离子介导的自由基的形成,而后者为蒽环类抗生素产生心脏毒性的部分原因。另外,由于右雷佐生继发性恶性肿瘤和骨髓增生异常综合征不良反应的发生,其临床使用受到限制。对于分子靶向药物所致心脏毒性,临床上多采用停药观察或合用ACEI/ARB、β受体阻滞剂等常见心脏保护药物,但是改善效果并不乐观。对于抗肿瘤药物相关心脏毒性重点在于积极开展早期预防,“防”重于“治”,且应贯穿于治疗的前、中、后全过程,而目前临床上尚缺乏防治分子靶向药物相关心脏毒性的药物。
从中医学角度,根据患者临床表现,结合现代医学研究成果,抗肿瘤药物属于中医学“胸痹”“心悸”等范畴。抗肿瘤药物在杀伤肿瘤细胞的同时,对正常细胞也有损伤作用,属于中医学“邪毒”范畴,在祛除病邪的同时易耗气伤阴,从而使得机体正气更加亏虚。火热之邪蕴于体内耗气伤阴,易与痰瘀搏结、壅滞气血、损伤心络,临床每见心慌、胸闷、气短,动则加剧之心伤征象。因此,气阴两虚既是恶性肿瘤的病机根本,也是抗肿瘤药物心脏毒性的病机之本。综上所述,预防分子靶向药物相关心脏毒性关键在于益气养阴,活血通络。
因此,在不影响抗肿瘤药物疗效的同时,提高患者对抗肿瘤药物的耐受能力,预防抗肿瘤药物特别是分子靶向药物相关心脏毒性对肿瘤患者的安全用药具有重要意义。
发明内容
本发明的目的在于提供一种用于治疗分子靶向药物相关心脏毒性的中药浓缩丸及其制备方法。本发明对治疗分子靶向药物相关心脏毒性具有显著的疗效,具有较广阔的市场前景。
一方面,本申请提供了一种用于治疗肿瘤靶向药物相关心脏毒性的中药浓缩丸,其特征在于,所述中药浓缩丸由包括黄芪、党参、桂枝、当归、丹参、川芎、酸枣仁的原料制成。
进一步地,所述中药浓缩丸由包括:黄芪20-40份、党参5-20份、桂枝3-10份、当归5-15份、丹参5-40份、川芎5-20份、酸枣仁3-30份的原料制成。
进一步地,所述中药浓缩丸由生黄芪20份、党参15份、桂枝6份、当归9份、丹参12份、川芎9份、酸枣仁15份的原料制成。
所述中药浓缩丸的制备方法包括:
(1)将黄芪、丹参粉碎、过筛、混合得药粉;
(2)将党参、桂枝、当归、川芎、酸枣仁粉碎,用水进行提取,得提取液后加入乙醇,沉淀杂质,回收提取液浓缩为浸膏;
(3)将步骤(1)所得药粉与步骤(2)所得浸膏混合成丸。
进一步地,所述中药浓缩丸的制备方法包括:
(1)将黄芪、丹参、分别粉碎,过100-150目筛,混合得药粉;
(2)将党参、桂枝、当归、川芎、酸枣仁分别粉碎,过100-120目筛,混合均匀,加入相当于药粉10-12倍量的水,3000-4000r/min高速搅拌15-20min,加热至沸腾,随后在70-80℃下的提取45min-60min,过滤,得滤渣,再加入6-10倍量的水,加热至沸腾,随后在70-80℃下的提取30min-45min,过滤,合并滤液。将滤液浓缩至相对密度为1.15-1.20,加入80%乙醇使浓缩液含醇量为50-60%,静置24-72h后,离心取上清液,减压回收乙醇,浓缩至相对密度为1.25-1.42的浸膏状,备用;
(3)将步骤(1)制得的药粉与步骤(3)制得的浸膏混合,泛指成丸,过筛,成型,包衣,干燥。
另一方面,本申请提供了上述中药浓缩丸在制备治疗肿瘤得分子靶向药物相关心脏毒性的药物中的应用。
进一步地,所述治疗肿瘤的分子靶向药物为曲妥珠单抗。
进一步地,所述治疗肿瘤得分子靶向药物相关心脏毒性的药物具有以下一种或多种效果。
(A)降低cTnⅠ和/或BNP的心肌损伤标志物水平;
(B)降低选自CK-MB、LDH、HBDH中一种或多种的心肌酶水平;
(C)改善心功能指标LVIDs和/或LVESV;
(D)改善心肌细胞形态和排列,肌纤维排列,细胞增生。
本申请中中药浓缩丸中还可以根据需要加入其他治疗心脏疾病的中西药物已经药学上可接受的辅料。
本方中所用生黄芪大补肺脾之气,党参补中益气,二者合用使上焦、中焦之气得充;桂枝温阳化气,温通心阳而利血脉,与黄芪、党参相配补而不滞、补中有升,助膀胱气化而利水道、通小便,与心脏毒性之病机相契合;当归辛苦温,补血为主,兼以“行血中之气”,丹参活血祛瘀、凉血清心,川芎活血祛瘀止痛,为血中之气药,丹参、川芎一凉一温,与当归配伍而补血活血之力增;酸枣仁入心、肝、脾经,养血、宁心、安神,配当归、丹参、川芎,养心血、通心脉、安心神。“气为血帅、血为气母”,诸药合用,以益气温阳为主,气血双补,活血养心。
以蒽环类与曲妥珠单抗联用这一临床常见治疗方案,采用SD大鼠建立分子靶向药物相关心脏毒性模型,进行药效学评价预实验,研究发现:(1)本发明提供的中药浓缩丸可以改善抗肿瘤药物造模期间大鼠的生长状态;(2)本发明提供的中药浓缩丸可以改善模型大鼠的心脏功能;(3)本发明提供的中药浓缩丸可以降低模型大鼠血液中心肌损伤标志物的含量。(4)本发明提供的中药浓缩丸可以调节模型大鼠机体代谢水平。
效果方面:
本发明提供的中药浓缩丸具有补气升阳,安宁心神,活血通经的功效,补中有通,补而不滞的功效,是预防和辅助治疗分子靶向药物相关心脏毒性的可行药物。
本发明在临床实践的基础上,通过大量实验验证其对分子靶向药物相关心脏毒性的保护作用,实验结果表明,本发明提供的中药浓缩丸具有治疗分子靶向药物相关心脏毒性的用途。
本发明比较了本发明提供的中药浓缩丸与临床常用心脏保护剂右丙亚胺的疗效,发现本发明提供的中药浓缩丸在预防和辅助治疗分子靶向药物相关心脏毒性方面优于右丙亚胺,且中药浓缩丸组大鼠生长状态优于右丙亚胺组,表明本发明提供中药浓缩丸有助于改善机体综合状态,提高对抗肿瘤药物的耐受能力。
附图说明
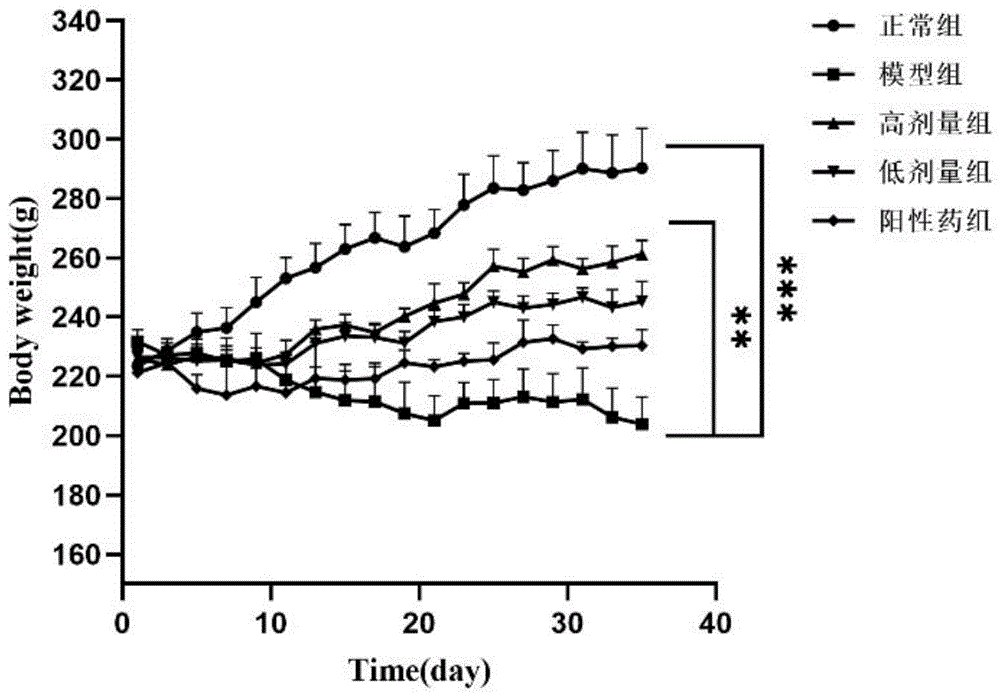
图1为给药期间大鼠体重变化情况趋势图;
图2A显示各组大鼠血浆中BNP含量;
图2B显示各组大鼠血浆中cTnⅠ含量;
图3A显示各组大鼠血浆中CK-MB浓度;
图3B显示各组大鼠血浆中LDH浓度;
图3C显示各组大鼠血浆中HBDH浓度;
图4A显示各组大鼠左室射血分数;
图4B显示各组大鼠左室短轴缩短率;
图4C显示各组大鼠左室收缩末期容积;
图4D显示各组大鼠左室收缩末期内径;
图5A为正常组大鼠M型超声心动图;
图5B为模型组大鼠M型超声心动图;
图5C为中药浓缩丸高剂量组大鼠M型超声心动图;
图5D为中药浓缩丸低剂量组大鼠M型超声心动图;
图5E为右丙亚胺组大鼠M型超声心动图;
图6A为正常组大鼠心脏HE染色结果;
图6B为模型组大鼠心脏HE染色结果;
图6C为右丙亚胺组大鼠心脏HE染色结果;
图6D为高剂量中药浓缩丸组大鼠心脏HE染色结果;
图7为负离子模式下PCA图;
图8为负离子模式下模型组与中药浓缩丸组的OPLS-DA图;
图9为正常组、模型组、浓缩丸组间差异变量韦恩图;
图10A为模型组与正常组显著上调基因和下调基因的火山图;
图10B为模型组与中药浓缩丸组显著上调基因和下调基因的火山图;
图11为KEGG通路富集分析。
具体实施方式
以下实施例用于对本发明进行说明,并不用来限制本发明的范围。实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件,或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可通过正规渠道商购买得到的常规产品。
实施例1
一种用于治疗肿瘤分子靶向药物相关心脏毒性的中药浓缩丸,所述中药浓缩丸的原料配比为:生黄芪15份、党参13份、桂枝8份、当归10份、丹参15份、川芎9份、酸枣仁20份。
中药浓缩丸的制备方法所述包括以下步骤:
(1)将黄芪、丹参分别粉碎,过120目筛,混合待用。
(2)将其余中药材分别粉碎,过100目筛,混合均匀,加入相当于药粉10倍量的水,3000r/min高速搅拌15min,加热至沸腾,随后在70℃下的提取45min,过滤,得滤渣,再加入8倍量的水,加热至沸腾,随后在70℃下的提取30min,过滤,合并滤液。将滤液浓缩至相对密度为1.15,加入80%乙醇使浓缩液含醇量为50%,静置24h后,离心取上清液,减压回收乙醇,浓缩至相对密度为1.25的浸膏状,备用。
(3)将步骤(1)制得的药粉与步骤(3)制得的浸膏混合,泛制成丸,过筛,成型,包衣,干燥。
实施例2
一种用于治疗肿瘤分子靶向药物相关心脏毒性的中药浓缩丸,所述中药浓缩丸的原料配比为:生黄芪20份、党参13份、桂枝4份、当归5份、丹参15份、川芎9份、酸枣仁18份。
制备方法同实施例1。
实施例3
一种用于治疗肿瘤分子靶向药物相关心脏毒性的中药浓缩丸,所述中药浓缩丸的原料配比为:生黄芪15份、党参13份、桂枝8份、当归10份、丹参15份、川芎9份、酸枣仁20份。
一种治疗肿瘤分子靶向药物相关心脏毒性的中药浓缩丸的制备方法,包括以下步骤:
(1)将黄芪、丹参分别粉碎,过150目筛,混合待用。
(2)将其余中药材分别粉碎,过100目筛,混合均匀,加入相当于药粉12倍量的水,4000r/min高速搅拌20min,加热至沸腾,随后在80℃下的提取60min,过滤,得滤渣,再加入10倍量的水,加热至沸腾,随后在80℃下的提取45min,过滤,合并滤液。将滤液浓缩至相对密度为1.20,加入80%乙醇使浓缩液含醇量为60%,静置72h后,离心取上清液,减压回收乙醇,浓缩至相对密度为1.42的浸膏状,备用。
(3)将步骤(1)制得的药粉与步骤(3)制得的浸膏混合,泛制成丸,过筛,成型,包衣,干燥。
实施例4
稳定性试验研究
将实施例1至3制备的中药浓缩丸各称取2g,于温度37~40℃和相对湿度75%的条件下保存,每月对本发明提供的中药浓缩丸的性状、水分、重量差异、装量、溶散时限、微生物限度进行考察,连续考察三个月。结果如表1所示。
实施例5
在本实施例中,采用实施例1中的中药浓缩丸进行分子靶向药物相关心脏毒性实验。
1.材料
1.1药品
模型组多柔比星累计剂量为15mg/kg,曲妥珠单抗累计剂量为20mg/kg。中药浓缩丸低剂量:18.18g·kg-1,中药浓缩丸高剂量:36.36g·kg-1。
(说明,中药浓缩丸打粉后用0.5%羧甲基纤维素钠混悬,其中低剂量组相当于人用剂量的2倍剂量,给药方式:灌胃)
1.2动物
八周龄雌性SD大鼠,体重200±20g
2.方法
2.1动物分组与给药及取材
取SD大鼠50只,正常饲养3-5天以适应环境。随后,记录体重,随机分成7组,每组10只,即:正常对照组(N),模型组(M),右雷佐生治疗组(D),中药浓缩丸低剂量组(L),中药浓缩丸高剂量组(G)。
2.2动物造模
分组后,除正常组外,对其他5组大鼠进行造模。造模方法,模型组多柔比星累计剂量为15mg/kg,曲妥珠单抗累计剂量为20mg/kg。从第1天到第11天连续给药6次,然后从第19天到第28天连续给药6次,给药方式为尾静脉注射。给药期间每隔两天记录大鼠体重,观察生长状况,包括:活动情况、粪便形状、毛发情况等。末次给药六天后,对大鼠进行超声心动图检测,记录心功能相关指标。随后处死大鼠,进行取材。下腔静脉取血,检测LDH、CK-MB、CK、cTnI、BNP等相关标志物的变化情况。解剖心脏,病理染色,观察各组大鼠心脏的病理改变情况。取大鼠血浆,进行拟靶向代谢组学检测,比较中药浓缩丸对大鼠机体代谢改善情况。
3实验结果
3.1给药期间大鼠一般状态观察
给药期间,对照组大鼠状态较好,饮水摄食正常,皮毛有光泽,体重呈增长趋势。模型组组大鼠状态较差,食欲下降,活动减少,有大量脱毛情况出现,个别大鼠出现腹水现象,在多柔比星给药期间体重呈下降趋势,后期虽有升高,但相较于对照组和治疗组体重增量仍然较少。高剂量组大鼠状态相较于模型组有所改善,无大量脱毛、腹水情况出现,体重整体呈上升趋势。给药期间无大鼠死亡现象。给药期间各组大鼠体重变化情况见图1。
3.2治疗结束后各组大鼠血液中心肌损伤标志物变化情况
与对照组相比,模型组的cTnⅠ显著升高(P<0.01);与模型组相比,中药浓缩丸高剂量组cTnⅠ显著下降,差异具有统计学意义(P<0.05);与对照组比相比,模型组的BNP显著升高(P<0.05);与模型组相比,中药浓缩丸高剂量组的BNP显著下降,差异具有统计学意义(P<0.05)。见图2A-B。
3.3治疗结束后各组大鼠血液中心肌酶谱变化情况
与正常组比较,模型组大鼠血清中心肌酶CK-MB、LDH、HBDH含量显著增强(P<0.01);与模型组相比,中药浓缩丸高剂量组的CK-MB、LDH、HBDH显著下降,差异具有统计学意义(P<0.01)。见图3A-C。
3.4治疗结束后各组大鼠心功能变化情况
与对照组相比,模型组的LVIDs、LVESV均显著上升(P<0.01),LVEF、FS均显著下降(P<0.01);与模型组相比,中药浓缩丸高剂量组的LVIDs、LVESV均显著下降(P<0.01),LVEF、FS均显著上升(P<0.01)。见图4A-D及图5A-E。
3.5治疗结束后,各组大鼠心脏病理改变情况
如图6所示,正常组心肌细胞形态正常,排列均匀,肌纤维排列整齐,未见异常细胞。模型组出现心肌细胞水肿,排列紊乱,断裂,细胞增生。中药浓缩丸高剂量组与模型组比较,心肌细胞排列较均匀,水肿减轻,纤维紊乱程度减轻,细胞增生不明显。结果说明中药浓缩丸改善了小鼠因抗肿瘤药物导致的心肌形态变化,减轻了心肌细胞的纤维化程度。
以上结果表明,本实施例中涉及的中药浓缩丸对分子靶向药物相关心脏毒性具有一定的保护作用。
实施例5
1方法
在本实施例中,采用实施例1中的中药浓缩丸,研究中药浓缩丸给药对大鼠血浆中生物代谢标志物的变化情况。大鼠造模与实施例4,给药浓度选择为高剂量的中药浓缩丸。给药周期结束后,收取大鼠血浆样本,样本解冻后,涡旋10s混匀,移取样本50μL到对应编号离心管中;加入20%乙腈甲醇内标提取液300μL,涡旋3min,在4℃条件下,12000r/min离心10min;离心后移取上清液200μL到另一对应编号离心管中,-20℃冰箱中静置30min;在4℃条件下,12000r/min再离心3min,移取上清液180μL到对应进样瓶内衬管中,用于上机分析。
2结果
2.1主成分分析
通过对样本(包括质控样本)进行主成分分析,以便初步了解各组样本之间的总体代谢差异和组内样本之间的变异度大小。PCA结果显示各组之间代谢组分离趋势,以及样本组内代谢组是否存在差异。PCA得分图7所示。由PCA结果所示,正常组、模型组、中药浓缩丸给药组组间能较好区分,表明不同生理状态下大鼠体内代谢轮廓各异。图中模型组距离正常组最远,提示相较于正常组,模型组大鼠体内代谢轮廓具有明显差异性,中药浓缩丸组也能与模型组较好区分,说明中药浓缩丸给药组能显著改变大鼠体内代谢。
为了进一步区分不同状态下大鼠生理代谢环境的差异,通过使用有监督的模式识别方法OPLS-DA进行分析.如图8所示,模型组与中药浓缩丸组间可明显区分,分别位于纵坐标两侧,提示中药浓缩丸能显著改变模型组大鼠的体内代谢。
2.2差异代谢物的筛选
在建立OPLS-DA模型基础上,根据变量重要性投影(Variable Importance inProjection,VIP),筛选模型组与中药浓缩丸组之间的差异代谢物,并结合单变量分析的P-value/FDR(生物学重复≥2)或者FC值来进一步筛选出差异代谢物。本项目差异代谢物筛选标准为VIP>1的代谢物,且P-value<0.05(Student’s t test)的代谢物。如图9所示,正常组和模型组相比,有566个差异变量,其中上调的有175个,下调的有391个;模型组与中药浓缩丸组相比,有643个差异变量,其中上调的有404个,下调的有239个。将两者的差异代谢物取交集,共有299个共同差异代谢物,见图10。
2.3KEGG富集通路分析
根据差异代谢物结果,进行KEGG通路富集,其中横坐标Rich Factor为对应通路中差异代谢物个数与该通路注释到的代谢物总数的比值,该值越大表示富集程度越大。纵坐标为通路名称(按照P-value排序),点的颜色为P-value大小,越红表示富集越显著。点的大小代表富集到的差异代谢物的个数多少。基于此,本实施例中中药浓缩丸治疗分子靶向相关心脏毒性涉及的主要代谢通路有色氨酸代谢(tryptophan metabolism),程序性坏死(necroptosis),5-羟色胺能突触(Serotonergic synapse),鞘脂信号通路(sphingolipidsignaling pathway)等。许多研究表明,代谢失调的发生与心血管疾病的发生发展息息相关,特别是氨基酸代谢的作用受到越来越多重视。色氨酸(Trp)是人体必需的一种氨基酸,是人体多种蛋白质合成的核心成分,也是促进一系列关键分子生成的关键底物来源。色氨酸可以通过色氨酸-犬尿氨酸(KYN)代谢途径、色氨酸-吲哚代谢途径、以及色氨酸-5-羟色胺(5-HT)途径,生成各种衍生物,发挥生物学效应。由上述结果可知,本发明提供的中药浓缩丸可能通过调节色氨酸代谢从而对分子靶向药物诱导的心脏毒性起到保护作用。
- 芦丁类药物在制备预防或治疗药物性心脏毒性的药物中的应用
- 中药在制备用于消除抗肿瘤药的心脏毒性副作用药物或与阿霉素协同抗肿瘤作用药物中应用
