病毒联合检测免疫层析试纸、检测笔和检测产品
文献发布时间:2024-04-18 19:53:33
技术领域
本发明涉及免疫层析试纸技术领域,尤其是涉及一种病毒联合检测免疫层析试纸、检测笔和检测产品。
背景技术
新型冠状病毒感染(Corona Virus Disease 2019,COVID-19)是由2019新型冠状病毒感染而引起的急性呼吸道传染病。感染后症状主要为发热、干咳、乏力,部分患者伴有鼻塞、流涕等上呼吸道症状,影响着人类的日常生活。因此新冠病毒的快速检测十分有必要。
流行性感冒(influenza)简称流感,人类流感是由甲、乙两种流感病毒引起的一种急性呼吸道传染病。其传播特点是传染性强、发病率高、传播快,主要由呼吸道吸入而感染,感染后主要症状为高热、乏力、头痛等。甲型流感病毒容易发生变异,曾多次引起世界范围内的大流行,是全世界都重视的公共卫生问题。
由于新冠病毒与流感病毒传播方式相似,都可以经由呼吸道传播,而且感染之后临床极其相似,甚至有部分患者出现混合感染的状况,通过普通医学手段如血项、医学影响等难以区分。且一般的检验手段需要专业人员在实验室操作,检测周期长,难以做到快速精确诊断,不利于患者及时治疗。因此,一种区分新冠和流感的快速检测产品至关重要。而且对于症状相似患者来说,精准快速诊断有利于患者及时得到有效治疗,避免交叉感染。现有的3种抗原在一根试纸条上同时检出的产品比较少。
市面上现存新冠、甲流、乙流的三合一快速诊断试纸多为双窗检测卡,加样时往往需要重复操作,前处理操作繁琐;并且大多用胶体金作为显色指示,共阳性情况下显色都呈红色,如果用户误读T线顺序就会造成诊断错误;现有产品质控线均为试纸条本身质控,没有取样质控,而在实际检测中,会有因为取样不到位而产生的假阴性或者假阳性结果,导致误诊;市面现行试剂盒检测试纸条大多是装入板型卡壳,取样完成后将取样头插入裂解液,孵育之后再进行上样,操作步骤多,并且检测试剂盒内配套零部件多,对于没有接触过医疗器械的普通居民来说操作步骤多、操作不专业都会有造成假阴性的风险。
因此,对于新型冠状病毒、甲型流感病毒、乙型流感病毒常态化联合检测来说,发明一种简便操作、结果易读的联合诊断检测手段有十分有必要。
鉴于此,提出本发明。
发明内容
本发明的目的在于提供一种病毒联合检测免疫层析试纸,实现新型冠状病毒、甲型流感病毒和乙型流感病毒三合一的免疫层析快速检测,该免疫层析试纸添加特异性结合人内参蛋白的抗体作为取样到位质控线,极大可能避免了因非专业人员自行取样没到位导致的假阴性;本发明使用不同颜色的标记物作为指示,三条检测线阳性时显色各不相同,避免了用户因T线位置误判导致的诊断错误。本试纸条15分钟即可判读结果,适用于小型现场快速检测以及个人自测。基于上述病毒联合检测免疫层析试纸,本发明还提供了主要由上述病毒联合检测免疫层析试纸和壳体组成的检测笔。本发明缓解了现有技术中存在的新型冠状病毒、甲型流感病毒和乙型流感病毒三合一检测产品操作复杂和不易判读的问题。
为解决上述技术问题,本发明特采用如下技术方案:
根据本发明的一个方面,本发明提供了一种病毒联合检测免疫层析试纸,所述病毒联合检测包括检测新型冠状病毒、甲型流感病毒和乙型流感病毒;所述免疫层析试纸沿待测样本层析方向包括依次设置于固定底板上的样品垫、结合垫、检测垫和吸水垫;
所述结合垫包被有标记物标记的标记抗体,所述标记抗体包括第一甲型流感病毒抗体、第一乙型流感病毒抗体、第一新型冠状病毒抗体和第一人内参蛋白抗体;所述第一甲型流感病毒抗体、所述第一乙型流感病毒抗体和所述第一新型冠状病毒抗体分别标记不同颜色的标记物;
所述结合垫沿待测样本层析方向包括第二结合垫和第一结合垫,所述第一新型冠状病毒抗体包被于所述第二结合垫;
所述检测垫包被检测抗体,所述检测抗体包括第二甲型流感病毒抗体、第二乙型流感病毒抗体、第二新型冠状病毒抗体和第二人内参蛋白抗体;
所述检测垫沿待测样本层析方向包括检测线T1、检测线T2、检测线T3和取样到位质控线C;所述第二新型冠状病毒抗体包被于检测线T3,所述第二人内参蛋白抗体包被于取样到位质控线C;
所述检测抗体和对应的所述标记抗体能够同时结合同一抗原。
根据本发明的另一个方面,本发明还提供了一种病毒联合检测笔,该病毒联合检测免疫层析试纸和壳体;所述壳体包括底座和笔身;所述底座中预装有样本裂解液;
所述笔身内设置有固定免疫层析试纸的卡槽,所述笔身靠近样品垫的一端设置有与所述样品垫接触的取样部;所述底座设置有固定笔身的卡扣;所述笔身插入所述底座后,所述取样部与所述样本裂解液接触,所述笔身设置有用于观测检测垫的可视部。
根据本发明的另一个方面,本发明还提供了一种病毒诊断产品,该产品包括上述毒联合检测免疫层析试纸,或上述病毒联合检测笔。
与现有技术相比,本发明具有如下有益效果:
本发明提供的病毒联合检测免疫层析试纸能够三合一的检测新型冠状病毒、甲型流感病毒和乙型流感病毒。该免疫层析试纸沿待测样本层析方向,包括依次设置于固定底板上的样品垫、结合垫、检测垫和吸水垫。样本结合垫包被标记抗体,标记抗体包括第一甲型流感病毒抗体、第一乙型流感病毒抗体、第一新型冠状病毒抗体和第一人内参蛋白抗体。本发明提供的免疫层析试纸采用双抗夹心原理,因此在检测区的不同检测线还分别包被有能够形成抗体-抗原-抗体复合物的第二甲型流感病毒抗体、第二乙型流感病毒抗体、第二新型冠状病毒抗体和第二人内参蛋白抗体。本发明中第一甲型流感病毒抗体、第一乙型流感病毒抗体和第一新型冠状病毒抗体分别标记不同颜色的标记物,使3条检测线阳性出线时有颜色区别,此设计避免了因为代表不同病毒阳性的检测线同色,用户读取结果时因为检测线出线位置判断错误导致诊断错误的情况出现。本发明免疫层析试纸中的质控线包括取样到位质控线C,其能够检测人内参蛋白。未取到样或者取样不到位时,取样到位质控线C不出线,表示取样不到位,结果无效;而取样到位质控线C出线时,表示取样到位,层析正常,结果具有参考性。此设计避免了因为用户取样不到位造成的假阴性情况。
根据本发明的另一个方面,本发明还提供了一种病毒联合检测笔,该检测笔由上述病毒联合检测免疫层析试纸和壳体组成,壳体包括预装有样本裂解液的底座,使用时只要将取样后的检测笔插入底座即可,取样上样简单方便,操作步骤少,产品零部件少,可行性高,结果简洁明了。本发明提供的检测笔可同时检测三种抗原,结合取样检测为一体,方便快捷。
本发明提供的免疫层析试纸和检测笔将新型冠状病毒、甲型流感病毒和乙型流感病毒检测合并在一根试纸条上,实现只加一次样,共阳性同时检出。同时考虑到会有共阳性的结果,使用不同颜色标记物区分开每条检测线出线的颜色,提高结果的易读性。本发明设置取样到位质控线C可以提示用户取样是否到位,从而指示该样本是否有效,避免了因为用户操作手法不规范以及其他原因所造成的取样无效问题。加入取样到位质控线的设计提升了免疫层析试纸类产品在取人体样本检测的有效性以及准确性。
本发明提供的免疫层析试纸和检测笔具有灵敏度高的优点,对于新型冠状病毒的检测LOD值可达50pg/Test;对于甲型流感病毒的检测LOD值可达50pg/Test;对于乙型流感病毒的检测LOD值可达1ng/Test;还具有特异性好的优点,对多种干扰病原体均无检出;还具有检测迅速的优点,15分钟内可肉眼判读结果,满足专业和非专业人员的日常检测需求,应用范围广泛。
附图说明
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1为实施例1病毒联合检测免疫层析试纸示意图;
图2为实施例1病毒联合检测免疫层析试纸取样到位质控线C出线情况示意图;
图3为实施例1病毒联合检测免疫层析试纸检测线出线情况示意图;
图4为实施例1病毒联合检测笔检测病毒后的照片。
具体实施方式
下面将结合实施例对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
需要说明的是,本文中“新型冠状病毒”、“新冠病毒”、“COVID-19”和“CoV”均表示新型冠状病毒,可以互相替换使用;本文中“甲型流感病毒”、“甲流病毒”、“甲流”和“FluA”均表示甲型流感病毒,可以互相替换使用;本文中“乙型流感病毒”、“乙流病毒”、“乙流”和“FluB”均表示乙型流感病毒,可以互相替换使用;本文中。“包被”、“包埋”和“喷点”均表示将抗体固定于免疫层析试纸,可以互相替换使用。
根据本发明的一个方面,本发明提供了一种病毒联合检测免疫层析试纸,该病毒联合检测包括检测新型冠状病毒、甲型流感病毒和乙型流感病毒;所述免疫层析试纸沿待测样本层析方向,包括依次设置于固定底板上的样品垫、结合垫、检测垫和吸水垫。
结合垫包被有标记物标记的标记抗体,标记抗体包括第一甲型流感病毒抗体、第一乙型流感病毒抗体、第一新型冠状病毒抗体和第一人内参蛋白抗体。第一甲型流感病毒抗体特异性结合甲型流感病毒抗原,第一乙型流感病毒抗体特异性结合乙型流感病毒抗原,第一新型冠状病毒抗体特异性结合新型冠状病毒抗原,第一人内参蛋白抗体特异性结合人内参蛋白抗原。并且,第一甲型流感病毒抗体、第一乙型流感病毒抗体和第一新型冠状病毒抗体分别标记不同颜色的标记物。
由于本发明标记抗体标记显示不同颜色的标记物,结合垫上需包被多种标记物,因此本发明使用双层结合垫进行层析,可以使层析过程中检测垫表面不会太花。沿待测样本层析方向,所述结合垫包括第二结合垫和第一结合垫,即第二结合垫靠近样本垫,第一结合垫靠近检测垫。第一新型冠状病毒抗体包被于所述第二结合垫,其余标记抗体任选的包被于第一结合垫或第二结合垫。在一些可选的实施方式中,第一结合垫包被有第一甲型流感病毒抗体和第一乙型流感病毒抗体,第二结合垫包被有第一新型冠状病毒抗体和第一人内参蛋白抗体。
检测垫包被检测抗体,检测抗体包括第二甲型流感病毒抗体、第二乙型流感病毒抗体、第二新型冠状病毒抗体和第二人内参蛋白抗体。第二甲型流感病毒抗体特异性结合甲型流感病毒抗原,第二乙型流感病毒抗体特异性结合乙型流感病毒抗原,第二新型冠状病毒抗体特异性结合新型冠状病毒抗原,第二人内参蛋白抗体特异性结合人内参蛋白抗原。
本发明采用双抗夹心原理,检测抗体和对应的标记抗体能够同时结合同一抗原,以形成抗体-抗原-抗体复合物,实现对病毒抗原的检测。即第一甲型流感病毒抗体和第二甲型流感病毒抗体能够同时结合于甲型流感病毒抗原,第一乙型流感病毒抗体和第二乙型流感病毒抗体能够同时结合于乙型流感病毒抗原,第一新型冠状病毒抗体和第二新型冠状病毒抗体能够同时结合于新型冠状病毒抗原,第一人内参蛋白抗体和第二人内参蛋白抗体能够同时结合于人内参蛋白。检测抗体和与其对应的标记抗体可以相同也可以不同,若同一种抗体可以同时结合于同一抗原,例如结合于同一抗原的不同位置的重复抗原表位,则同一种抗体可同时作为标记抗体和检测抗体。
检测垫沿待测样本层析方向依次包括检测线T3、检测线T2、检测线T1和取样到位质控线C;第二新型冠状病毒抗体包被于检测线T3,第二人内参蛋白抗体包被于取样到位质控线C;第二甲型流感病毒抗体和第一甲型流感病毒抗体任意的包被于检测线T2和检测线T1。在一些可选的实施方式中,检测线T3包被有第二新型冠状病毒抗体;检测线T2包被有第二甲型流感病毒抗体;检测线T1包被有第二乙型流感病毒抗体,取样到位质控线C包被有第二人内参蛋白抗体。
经实验验证,将第二甲型流感病毒抗体或第二乙型流感病毒抗体包被于检测线T3,会影响位于其样本层析方向下游的检测线T1和检测线T2的检测效果,因此本发明将第二新型冠状病毒抗体包被于距离结合垫最近的检测线T3,为了增加新型冠状病毒抗原的层析距离,提高灵敏度,将第一新型冠状病毒抗体包被于距离检测垫更远的第二结合垫,以增加层析距离。经实验验证,将第二人内参蛋白抗体或第二甲型流感病毒抗体与第二新型冠状病毒抗体共同包被于第二结合垫的检测结果,优于将第二新型冠状病毒抗体包被于第一结合垫的检测结果。
在一些可选的实施方式中,第一甲型流感病毒抗体和第二甲型流感病毒抗体可选地识别甲型流感病毒的任意抗原,识别的抗原可以为天然抗原也可以为重组抗原,在一些可选的实施方式中,第一甲型流感病毒抗体和第二甲型流感病毒抗体识别甲型流感病毒N蛋白(核衣壳蛋白),可选地为重组N蛋白。
在一些可选的实施方式中,第一乙型流感病毒抗体和第二乙型流感病毒抗体可选地识别乙型流感病毒的任意抗原,识别的抗原可以为天然抗原也可以为重组抗原,在一些可选的实施方式中,第一乙型流感病毒抗体和第二乙型流感病毒抗体识别乙型流感病毒N蛋白,可选地为重组N蛋白。
在一些可选的实施方式中,第一新型冠状病毒抗体和第二新型冠状病毒抗体可选地识别新冠病毒的任意抗原,识别的抗原可以为天然抗原也可以为重组抗原,在一些可选的实施方式中,第一新型冠状病毒抗体和第二新型冠状病毒抗体识别新型冠状病毒N蛋白,可选地为重组N蛋白。
在一些可选的实施方式中,取样到位质控线C检测的标靶人内参蛋白选自核糖核酸酶P、甘油醛-3-磷酸脱氢酶(GAPDH)、β微球蛋白、β微管蛋白(β-tubulin)、18sRNA、β-actin肌动蛋白(β-actin)或TATA结合蛋白,优选为甘油醛-3-磷酸脱氢酶。
在一些可选的实施方式中,标记物包括量子点、胶体金、彩色乳胶微球、荧光微球、纤维素微球、量子点颗粒和免疫磁珠中的至少一种;不同标记抗体可选自同一种类标记物,也可选自不同种类的标记物,只要使特异性识别病毒的标记抗体形成的抗体-病毒抗原-检测抗体复合物呈现不同的视觉信号即可。
在一些优选的实施方式中,标记物选自彩色乳胶颗粒,只要各标记抗体标记不同颜色的彩色乳胶颗粒即可,不限制每种标记抗体具体标记的彩色乳胶颗粒颜色,在一些可选的实施方式中,第一新型冠状病毒抗体标记蓝色乳胶颗粒,第一甲型流感病毒抗体标记绿色乳胶颗粒,第一乙型流感病毒抗体标记红色乳胶颗粒。彩色乳胶颗粒的粒径优选为200~400nm,例如可以为但不限于为200、250、300、350或400nm,或上述任一两点之间的粒径范围。彩色乳胶颗粒原液的浓度优选为4~10wt%,例如可以为但不限于为4、5、6、7、8、9或10wt%。
结合垫上包被的标记抗体是通过含有标记抗体的结合垫包被液喷点于结合垫上得到的,结合垫包被液中各标记抗体与彩色乳胶颗粒投料的质量比分别独立的为1:20~1:80,例如可以为但不限于为1:20、1:30、1:40、1:50、1:60、1:70或1:80。结合垫包被液中标记抗体的浓度优选为2~5mg/mL,例如可以为但不限于为2、3、4或5mg/mL;结合垫包被液喷点于结合垫上的喷量优选为1~2μL/cm,例如可以为但不限于为1、1.5或2μL/cm。
检测垫的检测线和取样到位质控线C是通过含有检测抗体的检测垫包被液喷点于检测垫上得到的。
在一些可选的实施方式中,检测垫包被液中第二人内参蛋白抗体的浓度为0.5~1.5mg/mL,优选为0.5~1mg/mL,更优选为1mg/mL。
在一些可选的实施方式中,检测垫包被液中第二乙型流感病毒抗体的浓度为0.3~1.5mg/mL,优选为0.4~1.0mg/mL,更优选为0.5mg/mL。
在一些可选的实施方式中,检测垫包被液中第二甲型流感病毒抗体的浓度为0.1~1.5mg/mL,优选为0.5~1.2mg/mL,更优选为0.7mg/mL。
在一些可选的实施方式中,检测垫包被液中第二新型冠状病毒抗体的浓度为0.1~1.5mg/mL,优选为0.3~0.8mg/mL,更优选为0.5mg/mL。
在一些可选的实施方式中,各检测抗体的检测垫包被液分别独立的含有0.8~1.0wt%NaCl、0.1~0.5wt%Na
在一些可选的实施方式中,检测线T1、检测线T2、检测线T3和取样到位质控线C上检测垫包被液的喷量分别独立的为0.7~1.2μL/cm。
在一些可选的实施方式中,检测线T3和检测线T2和的间隔为3.5~4.5mm,检测线T2和检测线T1和的间隔为3.5~4.5mm。
在一些可选的实施方式中,检测线T1和取样到位质控线C间隔为3~4mm。
在一些可选的实施方式中,样品垫经样品垫处理液预处理,所述样品垫处理液优选含有0.8~1.2wt%聚乙烯吡咯烷酮、0.3~1.0wt%S-9(Tetronic 1307)表面活性剂、0.01~0.1wt%叠氮钠和1~3.8wt%硼砂。
构成本发明联合检测免疫层析试纸的各部分的材质可选择本领域可接受的,公知的材料。样品垫材质可选地选自玻璃纤维膜、聚酯纤维膜或无纺布,优选为玻璃纤维膜;第一结合垫的材质可选地选自玻璃纤维膜、聚酯纤维膜或无纺布,优选为聚酯纤维膜;第二结合垫的材质可选地选自玻璃纤维膜、聚酯纤维膜或无纺布,优选为聚酯纤维膜;检测垫材质优选自硝酸纤维素膜;吸水垫材质优选自吸水纸。第一结合垫可选地和第二结合垫交错重叠1~3mm,检测垫可选地和第一结合垫交错重叠1~3mm,第二结合垫可选地与样品垫交错重叠1~3mm。优选的实施方式为吸水垫位于固定底板上,依次排列检测垫、第一结合垫、第二结合垫和样品垫,每部分重叠1~3mm。
根据本发明的另一个方面,本发明还提供了一种病毒联合检测笔,所述病毒联合检测笔包括免疫层析试纸和壳体,壳体包括底座和笔身。底座中预装有样本裂解液,笔身内设置有固定免疫层析试纸的卡槽,且笔身靠近样品垫的一端设置有与样品垫接触的取样部;底座设置有固定笔身的卡扣;笔身插入所述底座后,取样部与所述样本裂解液接触。免疫层析试纸可以预装于壳体中,或者在使用时再将其固定于卡槽内,固定后免疫层析试纸的样本垫与笔身的取样部接触,取样后将笔身插入底座,通过卡扣固定,取样部与样本裂解液接触,通过向上的层析作用,实现笔身中的免疫层析试纸对待测样本进行检测。
所述病毒联合检测笔的笔身设置有用于观测结果的可视部,在一些可选的实施方式中,所述可视部可选地为在检测垫对应笔身的区域的通孔,或者可选地为将检测垫对应笔身的区域设置为透明材质,以实现对检测结果的观测。在另一些可选的实施方式中,将笔身采用透明材质制作,以对免疫层析试纸的层析结果进行观测。
底座中预装有样本裂解液,所述底座可选地设置盖体,以实现对预装的样本裂解液进行封装,在使用时打卡盖体,将笔身插入底座中,实现取样部与样本裂解的接触。所述底座也可选地采用封口膜密封,相应的,所述笔身设置一突出端,当使用时,将笔身插入底座时,伴随着突出端破坏底座封口膜的完整性,使取样部插入底座中,与样本裂解液充分接触,实现对取样部取到的待测样本的裂解和免疫层析检测。
在一些可选的实施方式中,所述检测笔结构参考CN114414306A或CN114869277A记载的装置。本发明提供的病毒联合检测免疫层析试纸可选地为CN114414306A记载的采集装置中的检测元件,或可选地为CN114869277A记载的检测装置中的测试元件。
在一些可选的实施方式中,所述壳体为CN307182555S中记载的检测笔。
在一些可选的实施方式中,样本裂解液包括3~5wt%NaCl、0.2~1wt%BSA和0.02~0.2wt%叠氮钠。
在一些可选的实施方式中,病毒联合检测笔按照如下步骤使用:
S1,将病毒联合检测免疫层析试纸装入公开号为CN307182555S所述的笔形外壳的检测腔中;
S2,使用笔管尖端海绵取样头插入鼻腔2~3cm处,贴住鼻腔黏膜旋转5圈左右;
S3,将取样完成的海绵头垂直插入装有样本裂解液的底座中进行裂解层析;
S4,15min之后,根据试纸条取样到位质控线C和各检测线出线颜色判读检测结果。
根据本发明的另一个方面,本发明还提供了一种病毒诊断产品,该产品包括上述病毒联合检测免疫层析试纸,或上述病毒联合检测笔。所述病毒诊断产品还可选的包括用于检测病毒的常规试剂或耗材,例如当该病毒诊断产品的检测元件为上述病毒联合检测免疫层析试纸时,还可选的包括拭子、样本裂解液、干燥剂和置样容器中的一种或多种;当病毒诊断产品以上述病毒联合检测免疫层析试纸,或上述病毒联合检测笔作为主要检测元件时,还可以包含比色卡,以对结果进定性或半定量的判定。
下面结合优选实施例进一步说明本发明的技术方案和有益效果。
实施例1
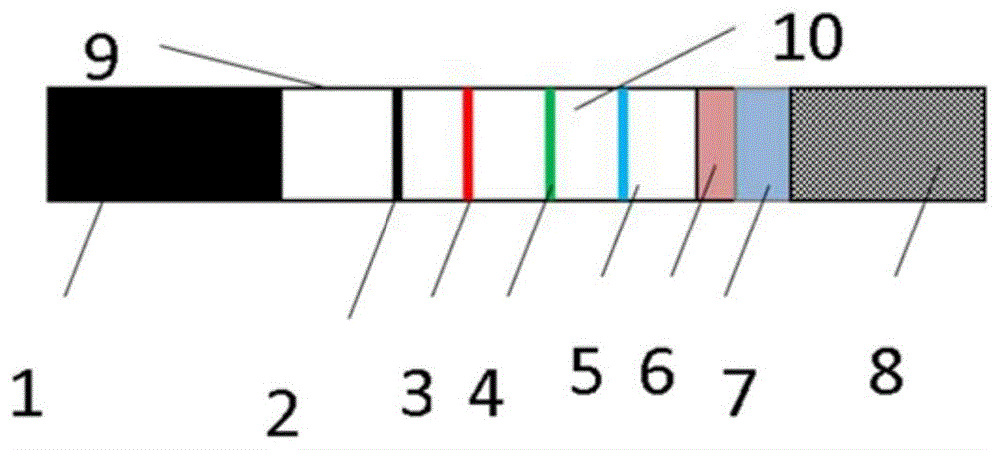
本实施例提供了一种病毒联合检测笔,由病毒联合检测免疫层析试纸和壳体组成。免疫层析试纸示意图如图1所示,图1中,1为吸水垫;2为取样到位质控线C;3为检测线T1;4为检测线T2;5为检测线T3;6为第一结合垫;7为第二结合垫;8为样品垫;9为固定底板;10为检测垫。
病毒联合检测免疫层析试纸沿待测样本层析方向,包括依次设置于固定底板9上的样品垫8、第二结合垫7、第一结合垫6、检测垫10和吸水垫1;第一结合垫6一端搭接检测垫10,另一端搭接第二结合垫7,第二结合垫7另一端搭接样品垫8,具体结构为:吸水垫1位于固定底板9上,依次排列检测垫10、第一结合垫6、第二结合垫7和样品垫8,每部分重叠1~3mm。样品垫8材质选自玻璃纤维,第一结合垫6和第二结合垫7的材质选自聚酯纤维,检测垫10材质选自硝酸纤维素膜,吸水垫1材质选自吸水纸。
第一结合垫6上包被有绿色乳胶颗粒标记的第一甲型流感病毒重组N蛋白抗体和红色乳胶颗粒标记的第一乙型流感病毒重组N蛋白抗体。第二结合垫7上包被有蓝色乳胶颗粒标记的第一新型冠状病毒重组N蛋白抗体和黑色乳胶颗粒标记的GAPDH抗体。结合垫包被液的喷量为1~2μL/cm。
本实施例中多色乳胶颗粒的标记方法如下:
首先使用pH值为6.0浓度为100mM的MES溶液清洗乳胶微球,离心后弃去上清液,再使用750μg/mL NHS与EDC溶液对乳胶微球进行活化,常温孵育1小时后离心弃上清液,加入MES溶液之后按照抗体与乳胶颗粒的投料比(质量比)为1:20加入抗体和乳胶颗粒,并使抗体的浓度为2~5mg/mL,孵育过夜,接着加入乙醇胺30μL,孵育半小时后离心去上清加入封闭液进行常温封闭4小时,其中,封闭液中含有0.02mg/mL NaN
检测垫10上沿待测样本层析方向依次设置检测线T3 5、检测线T2 4、检测线T1 3和取样到位质控线C 2。检测线T1 3包被有第二乙型流感病毒重组N蛋白抗体,检测线T2 4包被有第二甲型流感病毒重组N蛋白抗体,检测线T3 5包被有第二新型冠状病毒重组N蛋白抗体。取样到位质控线C 2包被有人GAPDH抗体。
第一甲型流感病毒重组N蛋白抗体来自杭州旭科生物,货号为R1403;第二甲型流感病毒重组N蛋白抗体来自杭州旭科生物,货号为R1401;第一乙型流感病毒重组N蛋白抗体来自杭州旭科生物,货号为R1404;第二乙型流感病毒重组N蛋白抗体来自杭州旭科生物,货号为R1402;第一新型冠状病毒重组N蛋白抗体来自杭州旭科生物,货号为RM0032;第二新型冠状病毒重组N蛋白抗体来自杭州旭科生物,货号为RM0033。结合垫上包被的GAPDH抗体和取样到位质控线C 2包被的人GAPDH抗体均为杭州华安生物技术有限公司GAPDH抗体(货号:ET1601-4)。
喷点检测线T1 3的含有第二乙型流感病毒重组N蛋白抗体的检测垫包被液中抗体的浓度为0.5mg/mL;喷点检测线T2 4的含有第二甲型流感病毒重组N蛋白抗体的检测垫包被液中抗体的浓度为0.7mg/mL;喷点检测线T3 5的含有第二新型冠状病毒重组N蛋白抗体的检测垫包被液中抗体的浓度为0.5mg/mL;喷点取样到位质控线的含有GAPDH抗体的检测垫包被液中抗体的浓度为1.0mg/mL。检测垫包被液中除去抗体外还含有9wt%NaCl、0.2wt%NaH
样品垫8使用样品垫处理液预处理,样品垫处理液含有1.0wt%聚乙烯吡咯烷酮、0.5wt%S-9(Tetronic 1307)表面活性剂、0.02wt%叠氮钠和2wt%硼砂。
喷点抗体后的结合垫和检测垫10,以及经预处理后的样品垫8组装:将吸水垫1、检测垫10、第一结合垫6、第二结合垫7和样品垫8依次黏贴在固定底板9上,经切条机切条,得到免疫层析试部分。
本实施例病毒联合检测笔的壳体为CN307182555S中记载的检测笔,壳体包括底座和笔身。底座中预装有样本裂解液,笔身内设置有固定免疫层析试纸的卡槽,且笔身靠近样品垫8的一端设置有与样品垫8接触的取样部,取样部为海绵取样头;底座设置有固定笔身的卡扣;笔身插入所述底座后,取样部与所述样本裂解液接触。免疫层析试纸预装于壳体中,固定后免疫层析试纸的样本垫与笔身的取样部接触,取样后将笔身插入底座,通过卡扣固定,海绵取样头与样本裂解液接触,通过向上的层析作用,实现笔身中的免疫层析试纸对待测样本进行检测。
本实施例提供的病毒联合检测笔的使用方法包括以下的步骤:
1.采集样本:
样本类型为人体鼻腔拭子,采集方法包括以下的步骤:
(1)用检测笔笔尖的海绵取样头塞入鼻腔2~3cm处,紧贴鼻腔黏膜将海绵头在鼻腔内部顺时针刮擦5圈,刮擦完毕取出,在另一侧鼻腔内进行相同操作。采样时,应适当用力,保证取到人体鼻腔黏膜内样本。
(2)在实验室进行药品验证,或者进行血清取样时,使用移液器将50μl血清样本均匀地涂布在海绵取样头上。
(3)批量取样时,将取完样的海绵头套上配套的塑料笔帽,装入样品袋,密封并做好标记。
2.检测样本:
(1)在筛查疑似具有传染源的检测时检测人员需按照检验传染病的防护措施穿戴防疫服,佩戴医用口罩、医用外科手套等防护装备。居民自测等小型现场直接取样检测即可。
(2)将采好样的取样头插到装有950μl样本裂解液的底座中,静置15分钟进行层析。底座应垂直放置于桌面上,将取样头插入装有样本裂解液的底座时应以听到“咔嗒”卡扣结合声为准。层析时,底座与检测笔均为垂直于桌面或者检测台进行向上层析,应尽量避免笔身以及底座晃动或者垂直于检测台。观察样本是否正常层析,如果未正常层析应重新拔出取样头,重新插。
(3)15min之后观察出线情况。测试结束后,将使用过的检测笔、以及底座按生物医疗废弃物进行处理。
3.结果判读:
C线质控区检测线设置为黑色,为了提高观感以及结果易读性,本实施例中的3条T线设置为不一样的颜色,基于现有材料检测线T1 3设置鲜亮的红色,检测线T2 4设置为绿色,检测线T3 5设置为蓝色。出线情况的示意图如图2和图3所示。
取样到位质控线C 2的出现情况示意图如图2所示,图2中左图为取样到位质控线C2出线,说明取样到位;右图为取样到位质控线C 2不出线,说明取样不到位。
图3中,A表示新冠病毒、甲型流感病毒和乙型流感病毒共阳性;B表示只有乙型流感病毒阳性,其余均为阴性;C表示只有新冠病毒阳性,其余均为阴性;D表示只有甲型流感病毒阳性,其余均为阴性;E表示新型冠状病毒和乙型流感病毒阳性,甲型流感病毒阴性;F表示甲型流感病毒和乙型流感病毒阳性,新冠病毒阴性;G表示新型冠状病毒和甲型流感病毒阳性,乙型流感病毒阴性;H表示三种病毒均为阴性且取样到位。阴性表示样本中不含有对应的病毒,或病毒的含量低于检测阈值。
下述试验例中均采用3个及以上平行样本进行测试,结果取95%以上平行样本的显色值或平均值。检测线与质控线的显色值参考来自于比色卡,该比色卡上印有显色由浅到深的色块,色块显色每年根据国家计量技术规范JJF1232-2009进行测定反射率校正。色卡显色值范围为1-10,数字越高表示显色越深。其中读值3.5及以上的色度判定为肉眼可见的出线。后续表格中T线出现深浅均以此读值方式表现。因此,肉眼可见出线的判定标准为T线的显色色度是否达到色卡读值3.5,其中“-”表示阴性。下述试验例中如无特别说明,免疫层析试纸和检测笔的制备方法同实施例1。
需要说明的是,本发明中在结合垫区域以及检测线区域使用申请人现有产品新冠-流感的双窗笔的参数。即结合垫中,CoV乳胶颗粒的喷点浓度为0.25%;FluA的乳胶颗粒喷点浓度为0.3%;FluB的乳胶颗粒喷点浓度为0.3%;喷点速度均为2μL/cm。在NC膜的检测区中,CoV的包被浓度为0.5mg/mL;FluA的包被浓度为0.7mg/mL;FluB的包被浓度为0.5mg/mL;包被速度均为1μL/cm。
试验例1
比较三种人内参蛋白作为取样到位质控线C的标靶:在本试验例中,采用了三种内参蛋白抗体分别为β-actin抗体、β-tubulin以及GAPDH抗体作为备选取样到位质控线C材料,使用35例人体鼻腔样本进行筛选,设计实验方案如下:
方案一:
使用三组不同的内参蛋白抗体作为取样到位质控线C的标靶,实验分组如下:
实验组一:质控线包被:β-actin抗体1;标记抗体:β-actin抗体1。
实验组二:质控线包被:β-tubulin抗体1;标记抗体:β-tubulin抗体1。
实验组三:质控线包被:GAPDH抗体1;标记抗体:GAPDH抗体1。
表1取样到位质控线抗体比较结果
由上表1可以看出,实验组三的C线出线的试验例明显高于实验组一与实验组二,说明以GAPDH作为取样到位质控线C的标靶,在结合垫和检测垫包被GAPDH抗体,优于以β-actin和β-tubulin作为取样到位质控线C的标靶。
方案二:
用两种GAPDH抗体分别用作检测线包被抗体和标记抗体,使用10例人体鼻腔样本验证,上述两种GAPDH抗体来自杭州华安生物技术有限公司,GAPDH抗体1货号:ET1601-4;GAPDH抗体2货号:M1310-2。结果如表2所示:
实验组一:检测线包被:GAPDH抗体1;标记抗体:GAPDH抗体1。
实验组二:检测线包被:GAPDH抗体1;标记抗体:GAPDH抗体2。
实验组三:检测线包被:GAPDH抗体2;标记抗体:GAPDH抗体2。
实验组四:检测线包被:GAPDH抗体2;标记抗体:GAPDH抗体1。
表2.
根据表2的实验结果,表示此新冠、甲流和乙流三合一病毒联合检测免疫层析试纸取样到位质控线C的取样到位设计与真实样本一致率为100%,上述结果证明此质控真实有效。因此本发明的取样到位质控线包被与标记抗体均优选地为GAPDH抗体1。GAPDH抗体1识别的抗原氨基酸序列为mouse GAPDH aa 94-333/333,推测可能是上述序列中有可被该单抗识别的重复位点,因此取样到位质控线包被与标记抗体均为GAPDH抗体1,也可形成抗体-抗原-抗体复合物。
试验例2
检测线颜色以及浓度探究:
方案一:
采用现有参数在本试验例检测线T1、T2和T3垫喷点不同抗体,实验分组如下:
实验组一:T1:FluA;T2:CoV;T3:FluB;
实验组二:T1:FluB;T2:FluA;T3:CoV;
实验组三:T1:CoV;T2:FluB;T3:FluA;
对照组双窗笔:T1:FluB;T2:FluA;T3:CoV。
此组实验使用阳性质控浓度为2倍双窗笔LOD。T线顺序设置对灵敏度的影响,结果如表3所示:
表3.
由上表对比可以看出,甲流乙流抗体为T3线时,T1和T2线受到T3线的干扰,检测灵敏度比双窗笔产品明显降低,因此检测线T3包被新冠抗体,检测效果更优。
试验例3
比较结合垫喷点不同的第一抗体对实验结果的影响,实验分组如下:
实验组一:第一结合垫喷点FluA和FluB乳胶颗粒;第二结合垫喷点CoV和GAPDH乳胶颗粒;
实验组二:第一结合垫喷点FluB和GAPDH乳胶颗粒;第二结合垫喷点FluA和CoV乳胶颗粒;
实验组三:第一结合垫喷点CoV和GAPDH乳胶颗粒;第二结合垫喷点FluA和FluB乳胶颗粒;
对照组:双窗笔产品T1:FluB;T2:FluA;T3:CoV;
本试验例所采用的阳性质控浓度为双窗笔产品的2倍LOD,实验结果如表4所示。
表4.实验结果
由上表所示,实验组三的T2、T3线灵敏度显著低于实验组一与实验组二。说明层析距离会影响T线的检测灵敏度。上述实验结果说明新冠病毒抗体喷点于第二结合垫检测结果更优。
试验例4
检测灵敏度评价
使用重组蛋白对实施例1提供的免疫检测笔进行评价,得到最低检出限为:
新型冠状病毒重组核衣壳蛋白:50pg/Test;
乙型流感重组核衣壳蛋白:1ng/Test;
甲型流感重组核衣壳蛋白:50pg/Test;
其中阳性质控均来自杭州旭科生物,其中新冠重组核衣壳蛋白货号为R1320;乙型流感重组核衣壳蛋白货号为R1301、甲型流感重组核衣壳蛋白货号为Q0015。
方案一:新冠检测灵敏度验证。
使用新冠重组蛋白选取不同浓度涂笔后进行层析,新冠重组蛋白检测灵敏度验证,实验结果如表5所示,确定新冠的检测灵敏度为50pg/Test。
表5.
方案二:乙型流感检测灵敏度验证。
使用乙型流感重组蛋白选取不同浓度涂在笔尖取样头上之后进行层析,乙型流感重组蛋白灵敏度验证结果见表6,确定乙型流感的检测灵敏度为1ng/Test。
表6.
方案三:甲型流感检测灵敏度验证
使用甲型流感重组蛋白,选取不停浓度涂布在笔尖取样头上之后进行层析,甲型流感重组蛋白灵敏度验证结果见表7,确定甲型流感的检测灵敏度为50pg/Test。
表7
试验例5
病毒检测实验:
使用实施例1的检测笔对表8来源的3种病毒抗原进行上样检测,检测结果如表9和图4所示,从图4可以看出,实施例1提供的检测笔能够分别检测出表8的三种病毒。
表8.
表9.
试验例6
分析特异性-干扰物质评价:
将下列38种来源的干扰物质稀释到表10的待验证浓度,使用表10干扰物质对实施例1检测笔进行干扰物质验证,每种干扰物质的验证次数为3次,实验结果如表11所示,从表11可以看出,表10中的38种内源或外源性干扰物质不会对实施例1的检测笔性能产生影响。
表10.
/>
表11.验证结果
/>
试验例7
分析特异性-交叉反应评价:
将下列48种来源的病原体使用表12信息进行前处理,使用表12病原体对实施例1提供的检测笔进行干扰物质验证,每种病原体的验证次数为3次,验证结果如表13所示,实验结果表明表12中48种病原体不会对实施例1检测笔的检测结果产生干扰。
表12
/>
/>
/>
表13.验证结果
/>
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
- 用于检测糖化血红蛋白含量的免疫层析试纸条及包含其的免疫分析检测装置
- 检测腺病毒抗原的胶体金免疫层析试纸及其制备方法、试纸盒、检测方法
- 用于检测新冠病毒的长余辉免疫层析试纸条与检测方法
