一种新型生殖基因NEK2在制备检测评估隐睾症的生殖预后产品中的应用
文献发布时间:2024-04-18 19:58:26
技术领域
本发明涉及生物医学技术领域,尤其涉及一种新型生殖基因NEK2在制备检测评估隐睾症的生殖预后产品中的应用。
背景技术
隐睾(Cryptorchidism)是小儿泌尿生殖系统常见畸形,隐睾往往会导致患侧睾丸和附睾出现萎缩,继而导致睾丸生精上皮细胞的发育与和精子的产生遭受严重障碍,组织细胞的超微结构均出现破坏或异常,是男性不育、睾丸肿瘤发生的危险因素之一。正常睾丸下降分为两个阶段。第一阶段是腹腔内的移行,发生于孕10周-15周,主要受胰岛素样因子3(Insulin-like 3,Insl3)调控。第二阶段是由腹股沟向阴囊内的移行,发生于孕26周以后,这一过程主要受睾丸引带移行及雄性激素控制。
隐睾的发生与多种因素密切相关,其中基因的改变对隐睾的发生起着重要作用,大量研究证实隐睾症形成与基因的差异表达有关。因此,从转录组水平探索新的隐睾差异表达基因,研究隐睾患儿发生隐睾风险的易感基因,进一步挖掘此类易感基因与隐睾症发生发展之间的关系,最终探讨隐睾症的发病机制,为隐睾症的研究提供新的指导与方向。
发明内容
本发明的目的是为了解决现有技术中缺乏新的隐睾差异表达基因的技术问题。
为了实现上述目的,本发明采用了如下技术方案:
NEK2在制备检测评估隐睾症的生殖预后产品中的应用。
优选的,所述产品用于预测隐睾症患者无精或少弱精。
优选的,所述产品为检测试剂盒。
优选的,所述NEK2通过HSD3B1/雄激素信号通路,调控睾丸及精子的发育过程,最终参与隐睾形成及影响精子生成。
本申请还提供了一种隐睾小鼠模型的构建方法,所述构建方法基于CRISPR/Cas9系统
优选的,所述构建方法包含以下步骤:
S1:设计并构建能够特异性识别NEK2基因的sgRNA;
S2:将该sgRNA与基于该sgRNA构建的打靶载体注入小鼠受精卵中;
S3:胚胎移植后,从产出的小鼠中筛选出NEK2基因突变的F0代小鼠与野生型小鼠杂交,得到NEK2基因突变的F1代小鼠模型。
优选的,所述S1中的sgRNA如下表所示:
。
本发明公开一种新型男性生殖基因——NEK2。通过隐睾样本的测序、动物模型的构建,确认其功能表型,敲除NEK2导致隐睾发生的分子机制等,阐明NEK2与隐睾之间的关系,为隐睾症、无精症和少弱精的发生,以及男性不育症的诊治提供开拓性的成果。
本发明还提供了一种新型隐睾小鼠模型的构建方法,基于CRISPR/Cas9系统,设计并构建能够特异性识别NEK2基因的sgRNA,将该sgRNA和基于该sgRNA构建的打靶载体注入小鼠受精卵中,胚胎移植后,在小鼠繁育过程采用NEK2
附图说明
图1为本发明一实施方式中NEK2在人体各器官中的RNA及蛋白含量图谱;
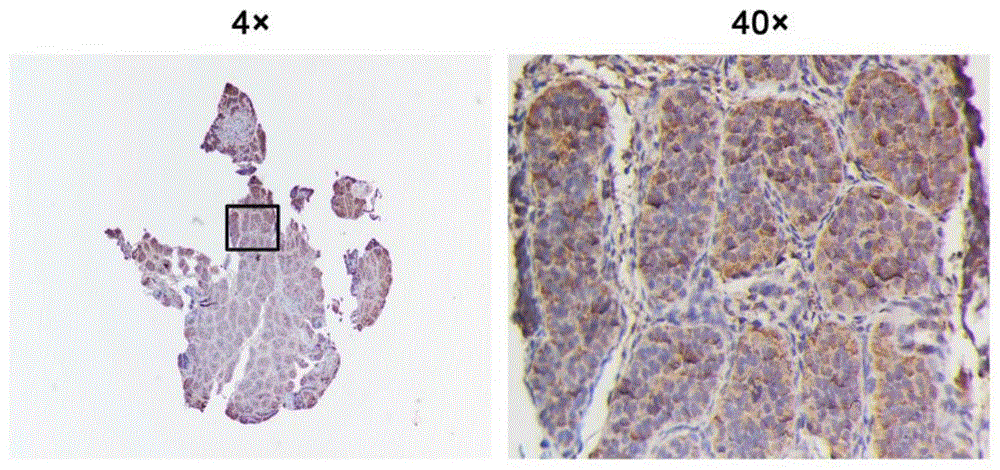
图2为本发明一实施方式中免疫组化法检测NEK2在人正常睾丸中的表达示意图;
图3为本发明一实施方式中NEK2基因敲除小鼠发生隐睾及精子畸形发生率对比图,其中A:小鼠膀胱、阴茎及睾丸位置图。红色圆圈为膀胱,黄色圆圈为睾丸,蓝色箭头为阴茎。B:各组小鼠隐睾发生率的统计结果图。C:小鼠畸形精子镜下图。D:小鼠精子畸形发生率统计图。
图4为本发明一实施方式中各组小鼠睾丸大体和组织结构的变化对比图,其中A:各组小鼠睾丸解剖大体图。B:各组小鼠睾丸组织HE染色。红色箭头标示小鼠睾丸生精小管内精原细胞、各级精母细胞和精细胞数量下降,管腔明显增大;绿色箭头标示曲细精管界膜增厚,出现明显空泡样变性。C:小鼠睾丸重量比对统计图。D:小鼠睾丸器官系数比对统计图;
图5为本发明一实施方式中关键通路蛋白其基因及蛋白表达水平,具体为,WesternBlot检测各组小鼠睾丸组织中Nr5a1、Insl3、及HSD3B1表达。*:P<0.05;
图6为本发明一实施方式中隐睾症患儿和NEK2(-/-)小鼠血清睾酮表达情况,其中A:与临床非泌尿系统畸形患儿相比,隐睾患儿的体内睾酮含量明显降低。B:与野生型小鼠相比,NEK2(-/-)小鼠的体内睾酮含量明显下降。
具体实施方式
以下结合具体实施例,对本发明作进一步地详细说明。
NEK2在制备检测评估隐睾症的生殖预后产品中的应用;
所述产品用于预测隐睾症患者无精或少弱精;
所述产品为检测试剂盒。
在一实施方式中,所述NEK2通过HSD3B1/雄激素信号通路,调控睾丸及精子的发育过程,最终参与隐睾形成及影响精子生成。
本申请还提供了一种隐睾小鼠模型的构建方法,所述构建方法基于CRISPR/Cas9系统;所述构建方法包含以下步骤:
S1:设计并构建能够特异性识别NEK2基因的sgRNA,
所述sgRNA序列如表1所示:
表1.sgRNA Sequence
S2:将该sgRNA与基于该sgRNA构建的打靶载体注入小鼠受精卵中;
S3:胚胎移植后,从产出的小鼠中筛选出NEK2基因突变的F0代小鼠与野生型小鼠杂交,得到NEK2基因突变的F1代小鼠模型。
具体的,在一实施方式中,在小鼠繁育过程采用NEK2
以下结合具体验证实验对本申请进行阐述:
实施例1:NEK2在睾丸组织中发挥了一定生物功能
一、THEHUMAN PROTEIN ATLAS(https://www.proteinatlas.org/)
人类蛋白质图谱(The Human Protein Atlas,PA)主要包括组织图谱、细胞图谱与病理学图谱三个部分,图谱中收录了最常见的20余种癌症的样本信息及图谱信息,使研究者更加简便地了解到每一个基因在不同癌症中的表达情况。
另外,通过此网站,可以明确某基因在人体所有器官中的表达量,从而明确某特定基因与疾病的相关性。
请参阅图1,人类蛋白质图谱分析(Human Protein Map Analysis)显示,NEK2在人体睾丸中的表达量明显高于其他器官。
二、标本收集与存储:
2016.01-2018.06在我院小儿外科手术的9例患儿,分别为隐睾症患儿6例、睾丸外伤患儿2例,嵌顿疝需开放手术1例。
临床收集隐睾睾丸组织6例,正常睾丸组织3例(睾丸外伤患儿的少量正常睾丸组织、嵌顿疝少量睾丸组织)。隐睾患儿睾丸组织取材部位为睾丸实质下极,远离附睾侧,大小约0.2*0.2*0.2cm3;睾丸外伤患儿修剪睾丸坏死组织,同时取得坏死组织边缘极少量正常睾丸组织。嵌顿疝睾丸组织取材方法同隐睾患儿。活检的睾丸组织,放入无RNase的Ep管中,在液氮罐中储存,并放置于-80℃冰箱内。一部分置入4%多聚甲醛溶液中进行标本固定,充分固定后将标本经不同浓度乙醇溶液梯度脱水,脱水后进行石蜡包埋,包埋标本沿睾丸横轴切片,每块切片6-8张,厚度为4mm,置于冰箱4℃冷藏室储存备用。
三、免疫组织化学染色(EnVision两步法)
脱蜡水化:首先把石蜡切片置入温度为60℃的恒温箱中,进行20min左右的烘烤。将干燥后的切片全部浸入二甲苯中进行浸泡,每次10min,共浸泡2次。
浸泡完成后进行乙醇溶液的梯度脱水,首先使用100%乙醇进行脱水,共计10min,接着分别95%、80%、70%乙醇脱水,每次10min。流水冲洗组织切片;
将上一步操作完成后的组织切片放置在耐高温切片架上,使用PH为6.0的柠檬酸盐缓冲液,高温抗原修复5min,待切片自然冷却后,用PBS溶液进行冲洗,共3次,每次5min;
在冲洗后的切片上滴入30%的双氧水进行避光孵育,孵育20min,用以消除内源性过氧化物酶的活性。孵育完成后使用蒸馏水冲洗,再用PBS溶液进行冲洗,共3次,每次5min,取出甩干;
在切片上加入兔多克隆抗体NEK2工作液(稀释比例为1:50)200μl,放置于4℃环境中,放置24h;
取出放置24h后的切片,立即复温1h,复温后将组织切片放入PBS缓冲液中,充分浸泡3次,每次5min,浸泡完成后取出甩干;
在切片上滴加200μl的二抗工作液,在室温环境下进行孵育,总耗时30min,孵育操作完成后将组织切片放入PBS缓冲液中,充分浸泡3次,每次5min,浸泡完成后取出甩干;
加入备好的DAB工作液显色,使用光镜调节显色的程度,在完全显色之后,再用蒸馏水进行冲洗;
室温下用苏木素复染2min,用蒸馏水流水震洗后甩干;
切片脱水,透明,封片;
使用光学显微镜进行观察,若细胞相应部位出现棕黄色信号,即为阳性结果;
实验过程中以PBS替代一抗当作空白对照组。
请参阅图2,免疫组化的实验结果证实,正常睾丸组织中NEK2高表。申请人前期测序结果发现,NEK2在隐睾组织低表达,提示NEK2可能与隐睾的发生有一定相关性。
实施例2:构建小鼠隐睾症模型,结果提示睾丸组织学和器官系数变化及生精障碍。
具体的,包含以下步骤:
基于CRISPR/Cas9技术构建小鼠隐睾症模型
本发明提供了一种NEK2基因突变小鼠模型的构建方法,基于CRISPR/Cas9系统,设计并构建能够特异性识别NEK2基因的sgRNA(表1),将该sgRNA和基于该sgRNA构建的打靶载体注入小鼠受精卵中,胚胎移植后,从产出小鼠中筛选出NEK2基因突变的F0代小鼠与野生型小鼠杂交,得到NEK2基因突变的F1代小鼠模型。小鼠剪尾后提取DNA扩增,经Sanger测序证实模型构建成功(委托江苏集萃药康生物科技股份有限公司)。
二、石蜡组织切片
断颈法处死小鼠后取出睾丸,取隐睾侧及正常侧睾丸。剥去睾丸白膜,置入4%多聚甲醛溶液中进行标本固定,充分固定后将标本经不同浓度乙醇溶液梯度脱水,脱水后进行石蜡包埋,包埋标本沿睾丸横轴切片,每块切片6-8张,厚度为4mm,置于冰箱4℃冷藏室储存备用。
三、HE染色
将上一步获得的睾丸组织石蜡切片置入60℃烤箱中,隔夜后取出;
将石蜡切片全部浸入常规二甲苯中进行两次脱蜡,每次用时10min;
使用乙醇溶液进行梯度脱水,首先使用100%乙醇进行脱水3次,每次5min,接着分别95%、80%、70%乙醇脱水2次,每次5min;
自来水冲洗1min,接着蒸馏水冲洗1min,置于室温下干燥;
苏木素浸染10min,蒸馏水冲洗2min;
将浸染后的石蜡切片移入含量为1%盐酸酒精分化液中,分化5s后使用流水冲洗10min;
将组织切片全部置入淡氨水中3-5min使胞核蓝化,操作完成后流水冲洗10min;
使用0.5%伊红酒精再次浸染切片,浸染30s-1min,浸染完成后流水冲洗10min;
再一次使用乙醇进行梯度脱水,首先使用含量为95%乙醇进行脱水,共2次,每次1min,接着100%乙醇脱水3次,每次1min;
二甲苯Ⅰ、Ⅱ分别透明3-5min;
在载玻片上滴上中性树胶,封片;
光镜下观察睾丸组织形态学表现;
使用显微镜进行摄像,分析摄像结果。
四、Diff-Quik染色法
包含以下步骤:
S1:吸取小鼠精子混合液均匀涂布于载玻片上;
S2:干燥涂片;
S3:涂片浸入固定剂内固定20-30秒,将玻片竖立在滤纸上吸去多余固定液;S4:涂片浸入染液A内染色5秒,将玻片竖立在滤纸上吸去多余固定液;
S5:涂片浸入染液B内染色15-20秒,去离子水浸洗浸掉多余染液;
S6:涂片干燥镜检观察精子形态。
五、实验结果
请参阅图3,运用CRISPR/Cas9技术构建NEK2基因敲除小鼠隐睾模型。对照组5只野生型小鼠的睾丸均降至阴囊内,而NEK2-/-组6只小鼠中4只出现隐睾,其中单侧型2只,双侧型2只。NEK2(-/-)小鼠隐睾发生率66.67%,单侧隐睾率33.33%,双侧隐睾率33.33%,发生率显著升高(图3A,B)。同时,巴氏染色镜下发现NEK2(-/-)小鼠的精子畸形率亦显著升高(图3C,D)。
请参阅图4,NEK2(-/-)敲除小鼠的睾丸重量较野生型小鼠睾丸下降明显,睾丸器官系数较野生型小鼠下降明显(图4A,C,D)。HE染色镜下发现NEK2(-/-)小鼠睾丸生精小管内精原细胞、各级精母细胞和精细胞数量下降,伴随着管腔显著扩张,且界膜增厚。在睾丸的近基底部观察到明显的空泡样变性(图4B)。
实施例3:验证NEK2(-/-)小鼠的睾丸中关键通路蛋白表达下调和隐睾发生的机制
一、蛋白免疫印迹实验
睾丸组织蛋白提取:取出保存于液氮箱内的睾丸组织标本,待其解冻后称取50mg至预冷的EP管内,加入适量蛋白裂解液(PMSF:RIPA=1:100),剪碎组织并利用高通量组织研磨仪研磨组织至匀浆状态,冰上静置15Min。提前降温离心机至4℃,12000rpm,离心30Min,吸取上清液至新的已预冷EP管内。
蛋白浓度测定:
利用紫外分光光度计测定蛋白浓度,每个样品测2次,取平均值。加入5×SDSLoading buffer,比例为4:1,移液枪吹打混匀后煮沸(100℃,10min),短暂离心后立即置于冰上冷却,吹打混匀并分装储存于-40℃冰箱备用。
免疫蛋白印迹实验:
1)制胶:按PAGE凝胶超快速配置试剂盒(Servicebio G2045-50T)说明制备分离胶和浓缩胶;
2)电泳:将配制的10%胶组装放入电泳槽内,并加入稀释好的1×电泳液,按照提前预设的蛋白上样顺序依次上样,每孔加入10μl体积样品。首先恒压80V跑胶,约40-45min,至蛋白Marker的条带出现分离时,调电压至120V跑至溴酚蓝染料指示剂接近底边时停止电泳;
3)转膜:将提前配制预冷的1×转膜液倒进转膜装置内,裁剪大小适当的PVDF膜,无水甲醇浸泡激活,剪角做标记。按照夹板黑面-海绵-滤纸-胶-PVDF膜-滤纸-海绵-夹板白面的三明治结构安装好,放入转膜盒内,并放入冰盒,恒流300mA,65min;
4)封闭:将PVDF膜浸入5%牛奶中,室温,摇床封闭2h后,TBST清洗PVDF膜1-2次至膜表面未见明显牛奶残留;
5)一抗体孵育:按相对应的比例,用一抗稀释液稀释,配置所需浓度的内参一抗(GAPDH)和主分子一抗,混匀后和PVDF膜一起放入抗体孵育盒,4℃,过夜;
6)复温:摇床慢速复温30min,回收一抗,TBST洗膜10min×3次;
7)孵育二抗:配置所需浓度的二抗,摇床室温孵育2h,TBST快速摇洗10min×3次。
8)显影成像及图像处理:按照ECL发光试剂盒说明按照1:1比例混合A液、B液,避光,均匀滴加至PVDF膜上,显影成像。利用ImageJ、GraphPad Prism 8.0.1软件对图像进行分析与作图统计。
二、ELISA酶联免疫吸附实验
采血方法:各组小鼠麻醉后从眼眶后静脉丛取血0.8~1ml,4℃孵育过夜。凝固后,将样品以2,000rpm离心30分钟,采用ELISA试剂盒测定小鼠血清体内睾酮含量。
标本准备:外周血血清自超低温冰箱取出放置室温平衡60Min,并再次离心;
试剂准备:剂盒自冷藏冰箱取出室温下平衡15-30Min;
样品稀释:待测样品5倍稀释,先向EP管内加入样品稀释液40μL,再加入待测样品10μL,移液枪吹打混匀;
加样:酶标包被板上设定标准品孔、空白孔、待测样品孔,标准品孔按照10、5、2.5、1.25、0.625、0ng/mL的浓度梯度依次加样,各孔均加50μL,再加入提前稀释好的待测样品,空白孔不加,轻轻晃动混匀;
加酶:除空白孔外每孔加入酶标试剂100μL;
温育:用封板膜封板后置于卧式轨道恒温摇床,设定温度为37℃,温育60Min;
配制洗涤液:ddH2O稀释20×浓缩洗涤液备用,稀释比例为1:20;
洗涤:小心揭掉封板膜,用力甩尽液体,每孔加满洗涤液,静置30秒后弃去,如此重复5次,在干净的纸上拍干酶标板;
显色:每孔先加入显色剂A50μL,再加入显色剂B50μL,轻轻震荡混匀,37℃避光显色15Min;
终止:每孔加终止液50μL,终止反应,此时液体由蓝色立转为黄色;
测定:加终止液后15Min以内完成测定,提前打开多功能酶标仪预热,以空白孔调零,在450nm波长下按照加样顺序测量各孔的吸光度(OD值);
绘制酶标曲线:用Excel绘制标准曲线,以标准品浓度和OD值分别作为横、纵坐标,计算标准曲线直线回归方程,代入样品OD值计算样品浓度,再乘以稀释倍数(5倍),即为样品的实际浓度。
三、实验结果
为探索NEK2突变(基因敲除)发生隐睾可能的分子机制,Western Blot进一步检测关键蛋白的表达水平(Nr5a1、Insl3及HSD3B1),结果提示HSD3B1在野生型组小鼠的睾丸组织中高表达,而在NEK2(-/-)小鼠睾丸中则低表达(图5),而Nr5a1和Insl3的表达无统计学意义。ELISA结果发现与临床非泌尿系统畸形患儿相比,隐睾患儿的体内睾酮含量明显降低。
同样NEK2(-/-)小鼠的体内睾酮含量亦明显下降(图6)。
在实施例1中免疫组化的实验结果证实,正常睾丸组织中NEK2高表达。我们前期测序结果发现,NEK2在隐睾组织低表达。这些数据表明,隐睾患儿NEK2突变会导致HSD3B1表达降低,HSD3B1作为一种性激素合成的关键限速酶,对雄性激素的产生起到增强作用,隐睾症患儿因NEK2表达的变化导致血清中睾酮的降低。NEK2参与了HSD3B1/雄激素信号通路,影响睾丸下降及精子的发育过程致使生精障碍。
本申请中提供了NEK2在制备检测评估隐睾症的生殖预后产品中的应用,本发明通过临床样本高通量测序,应用生信学分析GEO数据库筛选出一组隐睾的基因表达芯片谱:GSE25518,然后通过基因网站分析和功能预测,以及采用荧光实时定量PCR、免疫组化、蛋白印迹等方法,并结合基因敲除动物实验验证,确定了一种新型男性生殖基因——NEK2,与隐睾症、无精症和少弱精的发生密切相关,为临床上隐睾症辅助病因诊断,评估生殖预后,完善治疗策略和优生优育。
- 一种瑞士乳杆菌及其在制备调节生殖道微生态和缓解生殖道干涩产品中的应用
- 一种瑞士乳杆菌及其在制备调节生殖道微生态和缓解生殖道干涩产品中的应用
