包含碳酸酐酶的二氧化碳分离膜
文献发布时间:2023-06-19 10:00:31
技术领域
本发明涉及通过使用气体分离膜从气体混合物捕集CO
从烟气流捕集CO
用于气体分离的膜技术已经被广泛使用。尽管聚合物膜是经济的且技术上是有用的,但它们受限于它们的性能。渗透率和选择性之间的平衡影响了聚合物膜用于从烟气流分离CO
由于与其他气体例如N
膜分离的一个选择是使用促进运输膜。最广为人知的使用促进运输的膜类型是具有移动的促进运输载体的支撑液体膜(SLM)。对这些膜的研究已经有二十多年且已知它们同时具有高气体渗透率和高气体选择性。然而,SLM膜的严重降解问题例如溶液的蒸发和载体的失活已限制了它们进一步的开发和应用。
另一个替代方案是使用其中促进运输载体被固定在聚合物基质中的膜,即固定位点载体(FSC)膜。低CO
US 8764881 B2公开了这种适用于从气体混合物分离气体的固定位点膜,所述膜包含载于支撑物上的分子量为至少Mw 100,000的非交联PVAm,其中在浇铸到支撑物上之后,所述PVAm被加热到在50至150℃范围内的温度。
气体分离膜仍具有改进分离性能的需要,以便于对于工业应用特别是在混合物中CO
发明内容
本发明提供一种气体分离膜,所述气体分离膜包含:透气性或多孔支撑物层;以及至少一个CO
所述碳酸酐酶(CA)也可以固定在所述至少一个CO
在一个实施方式中,所述选择性聚合物层包含胺基和CA酶的混合物。
在一个实施方式中,所述CA酶是热稳定酶,优选地耐受至少50℃的温度。
通过使用不同的程序将所述CA酶固定在所述聚合物层中并任选地也固定在所述聚合物层的表面。
在一个实施方式中,所述CA酶首先用例如乙烯基化学修饰,并随后与单体一起共聚以形成生物聚合物,其中CA酶沿着聚合物链整合。
在另一个实施方式中,CA酶可以整体固定至已经存在的聚合物链。另一个实施方式包括将化学修饰的CA酶固定在膜表面上。本发明的一个实施方式组合了固定所述酶的不同程序。
所述CO
或者,所述CO
所述CO
所述气体分离膜包含向所述膜提供机械强度的支撑物层。该层可以是多孔的或致密的。用于水过滤膜的商用多孔支撑物层是适合的。它们可以由材料例如聚砜(PSF)、聚醚砜(PES)、聚酰胺(PA)、聚酰亚胺(PI)、聚二氟乙烯(PVDF)、聚丙烯腈(PAN)或乙酸纤维素(CA)制成。该支撑物层的厚度可以在10至250μm之间变化。优选地,所述多孔层的孔径是0.0001μm至1μm。
由具有高气体渗透率的透气性聚合物制成的致密层也可以被用作所述CO
本发明的气体分离层还可以包含由涂覆在所述CO
所述CO
本发明的气体分离膜适合用于从气体混合物例如烟气、天然气、沼气、空气、发酵工艺和麻醉气体中分离CO
本发明也涉及一种从气体混合物分离CO
图1显示了通过使用膜分离气体的示意图。
图2显示了气体分离膜的横截面图。
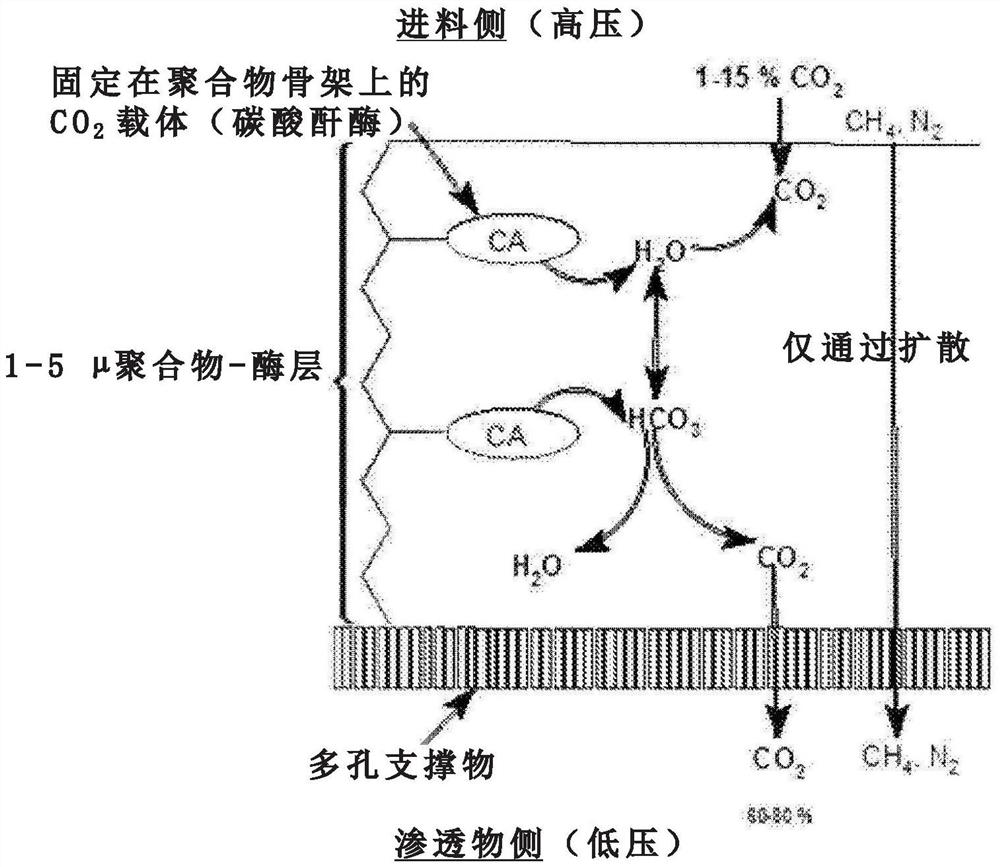
图3显示了根据本发明的CA酶-聚合物混合膜的分离原则。
图4显示了具有多层结构的混合膜的示意图,所述多层结构中一层用CA酶修饰且一层含NH
图5显示了具有多层结构的混合膜的示意图,所述多层结构中两层是CA酶修饰的聚合物。
图6显示了使用PVA/PSF混合膜和CA酶修饰的PVA/PSF混合膜所获得的作为进料压函数的CO
图7显示了使用PVA/PSF混合膜和CA酶修饰的PVA/PSF混合膜所获得的作为进料压函数的CO
图8显示了使用在多孔支撑物PSF和PVDF上CA-PAA生物聚合物的混合膜所获得的作为CO
图9显示了使用在致密支撑物PTMSP和PDMS上CA-PAA生物聚合物的混合膜所获得的作为CO
图10显示了混合膜在暴露于典型烟气时的时间耐久度。
图1显示了膜气体分离方法的简化的示意性设计。进入进料流1经过膜2并分离成两种组分:渗透物3和滞留物4。所述进料气体沿着膜行进并且部分进料气体穿过膜2从高压侧5行进至低压侧6,在所述低压侧作为渗透物3被移除。图2显示了包含被不对称多孔层8和编织支撑物9支撑的选择性层7的典型气体分离膜的细节。
根据本发明的气体分离膜包含CO
除了CA酶以外,所述CO
碳酸酐酶(CA)是通常在活性位点中包含锌离子的金属酶。它以多种类别和同工型存在,并且具有已知最快的与CO
(方程式1):CO
(方程式2):H
(方程式3):HCO
在这些反应中,CO
分离/生产所述CA酶,并且与所述酶的活性位点不相关的氨基酸残基的反应性侧基(例如胺、羟基、硫醇或酚基)允许后续的修饰以及整合/固定在聚合物基质中。
几种用于将CA酶稳定在聚合物层中的方法是可行的:
·可以将CA酶分散在所述聚合物内:将已知量的在水溶液中的酶与由聚合物例如聚乙烯醇(PVA)、聚丙烯酰胺(PAA)、藻酸盐、壳聚糖或任何其他适合的聚合物以及适合的溶剂组成的聚合物溶液混合,并将该混合物的薄层施加到所述支撑物层上并干燥。在所述聚合物和分散的酶之间会有弱氢键。
·可以首先用例如乙烯基对CA酶进行化学修饰,并随后与单体一起共聚以形成生物聚合物。因此,所述酶在聚合期间会原位固定至聚合物链。多种单体例如丙烯酰胺可以与CA酶聚合。
·可以通过将CA酶偶联至聚合物上的官能团来修饰存在的聚合物。所述聚合物在聚合物链中可以具有多种官能团例如胺基,其可以用于固定所述酶。因此,所述CA酶变成与所述聚合物链化学(共价)结合。
令人吃惊的是,已显示所述化学固定的CA酶在所述聚合物基质中保持它们的活性。
所得到的包含聚合物和固定的碳酸酐酶(CA)的混合膜层会组合有致密聚合物层的耐久度以及支撑液体膜(SLM)的选择性,从而消除SLM的缺陷,即,随着时间洗去载体。
图3说明了根据本发明的混合聚合物-酶膜的运输机制。所述膜包含其上布置有聚合物-酶(CA)层的多孔支撑物。所述聚合物-酶层的厚度可以在0.1至10μm、优选地1至5μm的范围内。
通过酶反应(促进运输)和溶液扩散两者,CO
优选地,所述CO
适合的水蒸气渗透性聚合物的实例是聚二甲基硅氧烷(PDMS)和聚[1-(三甲基甲硅烷基)-1-丙炔](PTMSP)和全氟聚合物例如聚[4,5-二氟-2,2-二(三氟甲基)-1,3-二氧杂环戊烯-共-四氟乙烯]。
气体分离膜通常可以采取两种形式,支撑的或未支撑的。本发明的膜载于支撑物上以向所述膜提供机械强度。如下文所述,所述支撑物可以是平板或中空纤维支撑物的形式。这两种支撑物类型都可以用于本发明。
适合赋予机械强度的支撑物是本领域中已知的,并且大多数是多孔的。适合的支撑物包括聚醚砜(PES)、聚四氟乙烯(PTFE)、聚丙烯、磺化聚砜、聚偏二氟乙烯、聚丙烯腈(PAN)及相关嵌段共聚物、乙酸纤维素、聚酰亚胺、聚醚酰亚胺(PEI)、脂肪族聚酰胺、聚醚醚酮(PEEK)、聚苯氧化物(PPO)和聚砜(PSF)。在优选实施方式中,所述支撑物是PSF。所述支撑物可以是平板或中空纤维支撑物。
这些支撑物中大多数的孔径在0.0001和1μm之间或更常见地以道尔顿和MWCO(截留分子量)表示:反渗透RO(1-100道尔顿)、纳米过滤NF(200-400道尔顿)、超滤UF(1000-200000道尔顿)和微滤MF(0.1至10μm)。
在本发明的一些实施方式中,使用微多孔支撑物结构。这样的支撑物具有大得多的孔径例如0.10至10μm,使得气体非常快速地运输通过。这些支撑物的孔径通常不以MWCO术语表示并且微多孔支撑物被认为具有大于100,000的MWCO值。
微多孔支撑物可以由任何适合的材料形成,包括上文提及的与超滤膜有关的那些材料和无机材料例如陶瓷(矾土、锆氧化物)、玻璃膜例如二氧化硅等。这些支撑物可以通过本领域已知的烧结技术、溶胶凝胶技术或浸取技术来制备。
向气体分离膜提供机械强度的支撑物也可以是高透气性致密支撑物。适合材料的实例是:PDMS(聚二甲基硅氧烷)和PTMSP(聚(1-三甲基甲硅烷基-1-丙炔))、PMP(聚甲基戊烯)和无定形氟塑料,例如4,5-二氟-2,2-二(三氟甲基)-1,3-二氧杂环戊烯-共-四氟乙烯例如AF2400或AF1600(特氟龙)。
所述气体分离膜还可以包含由涂覆在所述CO
所述CO
根据本发明的气体分离膜使得一步气体分离的方法成为可能。对于吸收而言只有一个相(气体-气体)而不存在液体。这导致了与使用酶的气体分离系统例如液体膜(SLM)和膜接触器(MC)相比降低的复杂性、降低的酶量、降低的安装尺寸和重量以及轻易的可扩展性。
根据本发明的气体分离膜被用于从气体混合物分离CO
特别优选的是包含低浓度CO
在从气体混合物分离CO
本发明的气体分离膜的应用包括从包含CO
优选地,所述膜用于从氮气和/或甲烷中分离二氧化碳。在后一方面,本发明的膜因此可以应用于其中这些气体存在于混合物例如烟气、天然气、沼气、空气、发酵工艺和麻醉气体的领域。
本发明的气体分离膜在低浓度的CO
如专利申请WO2014/090327A1中所述,本实验中使用的碳酸酐酶在大肠杆菌(Escherichia coli)中重组产生,并随后通过在65℃下热沉淀、然后离心来去除大部分宿主蛋白质。在以下实施例中使用的菌株是WO2014/090327A1中提及的SCA 11,但也可以使用任何其他菌株或其他CA。
通过在支撑物上溶液浇铸分离层,随后进行室温干燥或在烘箱中高温干燥,制备由致密或多孔的支撑物以及致密的CO
所用的多孔支撑物是可商购的超滤聚砜(PSF)5000MWCO或氟膜(PVDF)10000MWCO。
通过溶液浇铸在正己烷或环己烷溶剂中的PTMSP、PDMS以及在FC-72溶剂中的AF2400,随后进行室温干燥或在烘箱中高温干燥,在特氟龙盘上制备所述致密支撑物。在气体渗透试验中,也使用一些商用微多孔(0.2微米)PVDF膜作为在这些膜之下的独立机械支撑物。
在所述支撑物顶部的致密CO
·方法1:将CA酶化学偶联至CO
通过使用双官能连接物(戊二醛)将CA酶偶联至涂覆在支撑物上的PVA膜。一个官能团与羟基反应并且第二个官能团与CA酶的残留氨基反应。
采用顺序法以减少不希望的副反应:
1.通过在多孔支撑物上涂覆制备了所述PVA膜。
2.用10mL 0.5mmol/mL的戊二醛溶液活化所述PVA膜。
3.去除所述戊二醛溶液并在pH=7.4的缓冲溶液中添加10mg酶。
4.如下制备所述多层膜:去除多余的酶,添加新的10ml 0.5mmol/mL戊二醛溶液进行活化,随后添加酶缓冲溶液。
·方法2:将CA酶分散在分离层(PVA)的聚合物基质中
当分散在聚合物基质中时,所述CA酶通过氢键而变得与聚合物链弱结合。将2%的PVA水溶液与酶溶液混合。CA酶的浓度为52.9mg/g PVA。将混合物涂覆在PSF 50000MWCO支撑物上。
·方法3:化学修饰的CA酶与基于丙烯基的单体的共聚
用乙烯基修饰CA酶并在pH 7.4的缓冲溶液中与丙烯酰胺共聚。使用了两种不同的CA酶/Aam(丙烯酰胺)比例;40mg CA酶/g Aam和100mg CA酶/g Aam。为了引入乙烯基,用N-羟基琥珀酰亚胺丙烯酸酯(NSA)处理所述CA酶。使用了两种NSA/CA酶摩尔比;分别是8.89和5.56(较少乙烯基)。将所得到的聚合物溶液涂覆在多孔支撑物和致密支撑物上。获得了三种不同的生物聚合物:
CA酶-PAA 0:NSA/CA酶比例8.89和40mg CA/g Aam;
CA酶-PAA 1:NSA/CA酶比例5.56和40mg CA/g Aam,以及
CA酶-PAA 2:NSA/CA酶比例5.56和100mg CA/g Aam。
当使用致密支撑物时,它由PTMSP、PDMS和AF2400的独立膜组成,并且还使用了以下方法:
·方法4:在致密支撑物上用甲基丙烯酸缩水甘油酯(GMA)进行紫外接枝,随后进行CA酶偶联。
使用顺序法通过紫外接枝修饰所述膜表面。顺序法的优点是它减少了不希望的副反应。
1.为了建立单体接枝起始的接枝点,将所述膜浸泡在1%引发剂(二苯甲酮)的甲醇溶液中并暴露于紫外辐射下。
2.去除所述引发剂溶液,并用甲醇轻轻洗涤所述膜。
3.随后将所述膜浸泡在10%的单体溶液(甲基丙烯酸缩水甘油酯(GMA)溶液)中并暴露于紫外辐射以促进聚合。
4.随后去除所述单体溶液并用水洗涤所述膜数次以去除未反应的单体以及未结合到所述膜表面的聚合物。
5.通过环氧基将所述酶与聚甲基丙烯酸缩水甘油酯偶联。
·方法5:用AEMA紫外接枝,随后涂覆根据方法3获得的生物聚合物溶液。
使用方法4中描述的顺序,使用甲基丙烯酸氨基乙酯(AEMA)代替GMA单体来制备膜。随后使用通过方法3制备的生物聚合物溶液涂覆所述接枝膜。
·方法6:用AEMA紫外接枝,随后通过用戊二醛活化来偶联CA酶。
使用方法4中描述的顺序,使用AEMA单体代替GMA单体来制备膜。
然后使用戊二醛(GA)作为连接物将接枝膜与CA酶偶联。
通过使用完全增湿的N
实施例1
根据方法1用戊二醛和CA酶(600μl的17.6mg/ml CA酶溶液)修饰在50000MWCO PSF支撑物上的PVA。
CA酶添加对于在1.2bar、25℃以及在增湿N
表1
实施例2
根据方法2将CA酶分散在PVA聚合物溶液中并被支撑在50000MWCO PSF上。在25℃下用完全增湿N
分散在PVA中的CA酶对于在1.2bar、25℃以及在增湿N
表2
PVA/PSF和用CA酶修饰的PVA/PSF的CO
实施例3
根据方法3将化学修饰的CA酶和基于丙烯基的单体共聚。
使用在不同多孔支撑物上的CA酶-PAA生物聚合物在1.2bar、25℃下以及使用增湿N
表3
所有使用CA酶-PAA 1和CA酶-PAA 2制备的膜,无论是在多孔支撑物上还是在致密支撑物上,都显示出与参照物相比在CO
图8显示了总结了使用在多孔支撑物PSF和PVDF上的膜获得的结果的绘制图。与参照物相比,根据本发明的膜的CO
图9显示了总结了在1.2bar、25℃下以及使用增湿N
使用在致密支撑物上的CA酶-PAA生物聚合物在1.2bar、25℃以及使用增湿N
表4
表5
实施例4根据方法5用AEMA紫外接枝,随后涂覆生物聚合物(PAA-CA酶)溶液。
在1.2bar、25℃、完全增湿N
表6
与CA酶-PAA 1膜相比,CA酶-PAA 2膜具有少2.5倍的CA酶/毫克聚丙烯酰胺(PAA)。
对于紫外接枝程序,使用了水中10%的甲基丙烯酸氨基乙酯(AEMA)。
所述结果用渗透率(巴勒)而不是渗透量(m
所述结果显示了与PTMSP相比,由于CA酶的引入,CO
实施例5根据方法6用AEMA紫外接枝,随后通过用戊二醛活化来偶联CA酶。
在1.2bar、25℃、完全增湿N
表7
对于紫外接枝程序,使用了水中10%的甲基丙烯酸氨基乙酯(AEMA)。
所述结果用渗透率(巴勒)而不是渗透量(m
所述结果显示了与PTMSP相比,由于CA酶的引入,CO
选择了根据方法3中的程序制备的一种PAA-CA酶1/PTMSP膜并将所述膜暴露于以下测试条件下超过350小时:5%CO
所述结果呈现于图10。
- 包含碳酸酐酶的二氧化碳分离膜
- 一种固定化碳酸酐酶及其制备与在捕集烟气中二氧化碳的应用
