基因组编辑的方法和组合物
文献发布时间:2023-06-19 10:22:47
相关申请交叉引用
本申请要求于2018年4月18日提交的美国临时专利申请号62/659,627,于2018年6月14日提交的美国临时专利申请号62/685,243,以及于2018年9月25日提交的美国临时专利申请号62/736,400的权益,所有申请均通过引用整体并入本文。
技术领域
在大多数情况下,基因组编辑仍然是效率低的过程。有效率的基因组编辑的组合物和方法仍然是重要的未满足的需求。
背景技术
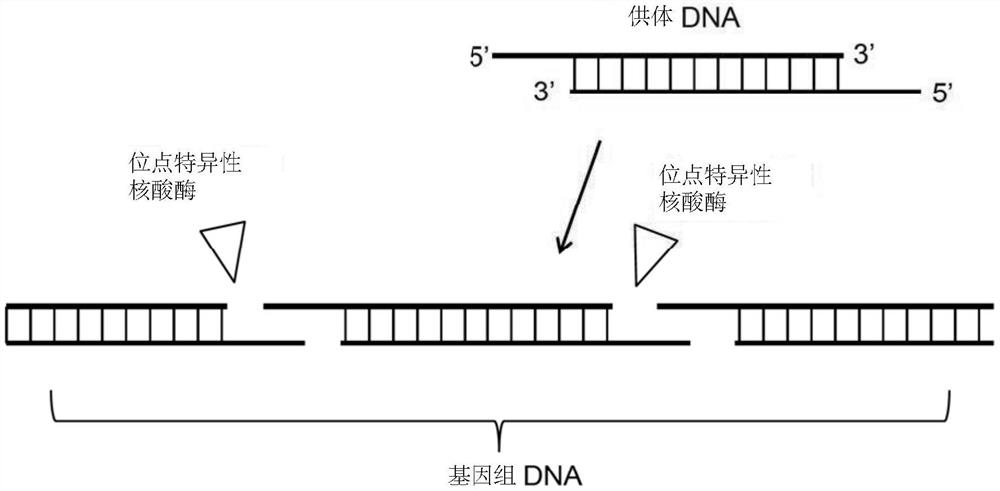
所提供的是使用粘性端进行基因组编辑的组合物和方法。在一些实施例中,主题方法包括:(a)在靶细胞的基因组DNA中的两个位置的每一个均产生交错的切割,从而产生两个粘性端(基因组的交错端);和(b)提供/引入线性双链供体DNA,其具有与基因组DNA的粘性端相对应的交错端(即,粘性端),使得供体DNA的粘性端与基因组DNA的粘性端杂交,并将供体DNA插入基因组。该方法在本文中通常也称为“俄罗斯方块(tetris)”或“俄罗斯方块介导的”。在一些情况下,通过将一种或多种序列特异性核酸酶(或编码一种或多种序列特异性核酸酶的一种或多种核酸)引入靶细胞以产生交错的切割,例如,大范围核酸酶,归巢核酸内切酶,锌指核酸酶(ZFN),TALEN,2类CRISPR/Cas效应蛋白(RNA-向导的CRISPR/Cas多肽)(如Cas9,CasX,CasY,Cpf1(Cas12a),Cas13,MAD7等)。
在一些情况下,供体DNA和一种或多种序列特异性核酸酶(或编码一种或多种序列特异性核酸酶的一种或多种核酸)是同一递送媒介物(其可被引入细胞/递送至细胞,例如,在体外,离体(ex vivo),或在体内)的有效负载。将多种有效负载作为同一递送媒介物(例如,纳米颗粒)的一部分进行递送的一个优点是每种有效负载的效率未被稀释。作为说明性示例,如果有效负载A和有效负载B在两个分开的包装(packages)/媒介物(分别为包装A和包装B)中被递送,则效率是相乘的,例如,如果包装A和包装B各自具有1%的转染效率,则将有效负载A和有效负载B递送至同一细胞的机会为0.01%(1%X1%)。但是,如果有效负载A和有效负载B都作为同一递送媒介物的一部分被递送,则将有效负载A和有效负载B递送至同一细胞的机会为1%,比0.01%提高了100倍。
在一些实施例中,当被递送时(例如,作为同一递送媒介物的一部分),供体DNA(例如,供体DNA的端)与一种或多种序列特异性核酸酶(例如,一个或多个核酸酶对)结合,例如,供体DNA可以与一种或多种核酸酶“预装配”。供体DNA与核酸酶的共递送可导致在与基因组切割位点结合期间发生热力学“转换”,从而使核酸酶(例如,一个或多个核酸酶对)从供体DNA转移至基因组上,然后供体DNA插入(slot into)基因组。主题组合物和方法提供了一种不使用同源定向修复(HDR),而是通过匹配“粘性端”来对插入进行介导,以将供体DNA插入DNA靶的方法。
递送媒介物可以包括但不限于,非病毒媒介物,病毒媒介物,纳米颗粒(例如,包括靶向配体和/或核的纳米颗粒,该核包含阴离子聚合物组合物,阳离子聚合物组合物,和阳离子多肽组合物),脂质体,胶束,水-油-水乳液颗粒,油-水-乳液胶束颗粒,多层水-油-水乳液颗粒,与带电荷的聚合物多肽结构域缀合的靶向配体(例如,肽靶向配体)(其中,靶向配体提供与细胞表面蛋白的靶向结合,并且带电荷的聚合物多肽结构域与核酸有效负载聚集(condensed)和/或与蛋白有效负载静电地相互作用),与有效负载缀合的靶向配体(例如,肽靶向配体)(其中,靶向配体提供与细胞表面蛋白的靶向结合)等。在一些情况下,有效负载作为脱氧核糖核蛋白复合物或核糖-脱氧核糖核蛋白复合物引入细胞。
所提供的组合物和方法可被用于在任何细胞类型(例如,工程T细胞,例如,在体内)中的任何基因座处进行基因组编辑。例如,可以对CD8+ T细胞群体或CD8+和CD4+ T细胞的混合物进行编程,以瞬时地或永久地表达CDR1,CDR2,和/或CDR3结构域的合适TCR α/TCRβ对,以进行抗原识别。
附图简要说明
当结合附图阅读时,通过以下详细描述可以最好地理解本发明。要强调的是,根据惯例,附图的多个特征未按比例绘制。相反,为了清楚起见,多个特征的尺寸被任意扩大或缩小。附图中包括以下图。
图1描述了具有粘性端的主题线性双链供体DNA的示例实施例的示意图。在一个所示的情况下,两端均具有5’突出端,而在另一个所示的情况下,两端均具有3’突出端。
图2描述了主题方法的一个示例的示意图。
图3描述了递送包装的示例实施例的示意图(在所示的情况下,一种类型是纳米颗粒)。
图4描述了递送包装的示例实施例的示意图(在所示的情况下,一种类型是纳米颗粒)。在这种情况下,所示的纳米颗粒是多层的,该纳米颗粒具有核(包括第一有效负载),该核被第一可脱落层包围,该第一可脱落层被中间层(包括附加的有效负载)包围,该中间层被第二可脱落层包围,该第二可脱落层的表面被包覆(即,包括外壳)。
图5(小图A-B)描述了主题纳米颗粒的表面涂层的靶向配体的示例构型的示意图。所示的递送分子包括与锚定结构域缀合的靶向配体,该锚定结构域与纳米颗粒的可脱落层静电地相互作用。应注意,靶向配体可以在N-或C-末端(每个小图的左侧)缀合,但是也可以在内部位置(每个小图的右侧)缀合。小图A中的分子包括接头,而小图B中的分子不包括接头。
图6(小图A-D)提供了递送包装的示例实施例的示意图(在所示的情况下,主题递送分子的示例构型)。应注意,靶向配体可以在N-或C-末端(每个小图的左侧)缀合,但是也可以在内部位置(每个小图的右侧)缀合。小图A和C中的分子包括接头,而小图B和D中的分子不包括接头。(小图A-B)递送分子,其包括与有效负载缀合的靶向配体。(小图C-D)递送分子,其包括与带电荷的聚合物多肽结构域缀合的靶向配体,该带电荷的聚合物多肽结构域与核酸有效负载聚集(和/或相互作用,例如,静电地与蛋白有效负载)。
图7提供了可被使用的细胞核定位信号(NLS)的非限制性示例(例如,作为纳米颗粒的一部分,例如,作为含NLS的肽;作为含NLS的肽的一部分/缀合至含NLS的肽,阴离子聚合物,阳离子聚合物,和/或阳离子多肽等)。该图改编自Kosugi等,《生物化学杂志(J BiolChem)》。2009年01月02日;284(1):478-85。(第1类,从上至下(SEQ ID NOs:201-221);第2类,从上至下(SEQ ID NOs:222-224);第4类,从上至下(SEQ ID NOs:225-230);第3类,从上至下(SEQ ID NOs:231-245);第5类,从上至下(SEQ ID NOs:246-264)。
图8(小图A-B)描述了小鼠(小图A)和人(小图B)造血细胞谱系,以及已经针对谱系内多种细胞被鉴定的标志物的示意图。
图9(小图A-B)描述了可被用于影响细胞分化和/或增殖的miRNA(小图A)和蛋白(小图B)因子的示意图。
图10-57描述了实验结果-参见“实验”部分。
图58描述了T细胞受体编辑的示例靶基因座。
图59描述了CRISPR/CAS向导序列和TALEN序列的示例,其被设计为在外显子1以及TCR α和TCR β的启动子区域产生双链断裂。
图60描述了如何为Cpf1(Cas12a)设计sgRNA,其在基因组的互补链上的TTTV PAM序列的+24和+19处产生交错的切割。通过使两个寡核苷酸(ssDNA1和ssDNA2)退火以产生具有相容性(compatible)突出端的dsDNA插入物(inserts)。在单切割(single-cut)Cpf1方法中未检测到GFP基因插入,而在TRBC1和TRBC2基因座处进行双切割时,则观察到了成功的俄罗斯方块介导的(tetris-mediated)(即,两个交错端切割+具有交错端的双链插入物)GFP插入。插入物编码Flag或GFP;相容性突出端在此图中标有下划线。经由核转染将60pmolCpf1 RNP和4ug dsDNA引入被刺激的T细胞。核转染后第4-10天,通过流式细胞术和TRBC1-TRBC2,GFP-GFP,或TRBC2-GFP之一的PCR扩增检测细胞的TCR敲除以分别确认基因组的缺失,GFP供体的存在,以及GFP插入至TRBC1-TRBC2基因座。
图61描述了冷藏保存的人原代T细胞被解冻,并在用CD3/CD28珠培养后一天刺激2天的流式细胞术结果(Attune NxT)。经过双重切割Cpf1介导的TRBC1/C2基因座编辑以及随后通过编码GFP的tetrisDNA模板(即,具有交错端的双链插入物)插入后,1.27%的细胞为GFP+。去除珠之后的当天,将细胞用Lonza Amaxa 4D系统,P3原代细胞试剂盒进行电穿孔。通过以室温孵育64pmol A.s.Cpf1(IDT,目录号1081068)和128pmol sgRNA(IDT)10-20分钟来形成RNP,然后将其添加至4μg的dsDNA插入物或IDT的Cpf1电穿孔增强剂(目录号1076301)并孵育10分钟。加入20μL的1x10e6被刺激的T细胞,然后转移到比色杯中,之后用脉冲EH-115(B,仅RNP)或EO-115(C,RNP+DNA)进行电穿孔。核转染后第7天,通过流式细胞术检测TCRa/b和GFP表达。图中示出了活群体中的细胞(Annexin和Sytox阴性)。使用QuickExtract(Lucigen)从细胞中收集DNA。
图62描述了人全(Pan)-T细胞中用靶向TRBC1和TRBC2基因座的Cpf1 gRNA的GFP敲入(泳道4+5,方格内的条带)和成功的TRBC1-TRBC2敲除(泳道1+2)。GFP供体扩增(泳道7+8)推测是由细胞中未整合的供体DNA所致,但受GFP-TRBC2引物(泳道4+5)控制。在孔1-2和7-8中分别清楚地观察到TRBC1-TRBC2缺失条带(731bp)和GFP-GFP条带(774bp)。在泳道4和5中可见525bp的敲入条带,相当于经由流式细胞术和GFP+细胞的约1.27%的有效基因插入。
图63描述了图62中所见的阳性条带和阴性条带。
图64描述了通过Cpf1向导靶向TRB外显子1的LL003 sgRNA-Cpf1复合物的Sanger测序轨迹图,该Cpf1向导对C1和C2基因座均具有特异性,并在基因组中进行两次切割。其对应的序列是TAATTTCTACTCTTGTAGATGGTGTGGGAGATCTCTGCTTCTGA。将FLAG序列或T2A-GFP序列插入被刺激的人原代T细胞的TRAC基因座中。在该图中,细胞未被转染。
图65描述了通过Cpf1向导靶向TRB外显子1的LL003 sgRNA-Cpf1复合物的Sanger测序轨迹图,该Cpf1向导对C1和C2基因座均具有特异性,并在基因组中进行两次切割。其对应的序列是TAATTTCTACTCTTGTAGATGGTGTGGGAGATCTCTGCTTCTGA。将FLAG序列或T2A-GFP序列插入被刺激的人原代T细胞的TRAC基因座中。在该图中,未使用供体DNA。
图66描述了通过Cpf1向导靶向TRB外显子1的LL003 sgRNA-Cpf1复合物的Sanger测序轨迹图,该Cpf1向导对C1和C2基因座均具有特异性,并在基因组中进行两次切割。其对应的序列是TAATTTCTACTCTTGTAGATGGTGTGGGAGATCTCTGCTTCTGA。将FLAG序列或T2A-GFP序列插入被刺激的人原代T细胞的TRAC基因座中。在该图中,使用了FLAG供体DNA(具有交错端)。
发明详述
如上所述,所提供的是使用粘性端进行基因组编辑的组合物和方法。主题方法可以包括(a)在靶细胞的基因组DNA中的两个位置的每一个均产生交错的切割,从而产生两个粘性端(基因组的交错端);和(b)提供/引入线性双链供体DNA,其具有与基因组DNA的粘性端对应的交错端(即,粘性端),使得供体DNA的粘性端与基因组DNA的粘性端杂交,并将供体DNA插入基因组。在一些情况下,通过将一种或多种序列特异性核酸酶(或编码一种或多种序列特异性核酸酶的一种或多种核酸)引入靶细胞以产生交错的切割,例如,大范围核酸酶,归巢核酸内切酶,锌指核酸酶(ZFN),TALEN,2类CRISPR/Gas效应蛋白(如Cas9,Cpf1等)。在一些情况下,供体DNA和一种或多种序列特异性核酸酶(或编码一种或多种序列特异性核酸酶的一种或多种核酸)是同一递送媒介物的有效负载。在一些情况下,递送媒介物是纳米颗粒(例如,包括靶向配体和/或核的纳米颗粒,该核包含阴离子聚合物组合物,阳离子聚合物组合物,和阳离子多肽组合物),以及在一些情况下,有效负载是纳米颗粒的核的一部分。在一些情况下,递送媒介物是主题递送分子,该主题递送分子具有与带电荷的聚合物多肽结构域缀合的靶向配体(例如,肽靶向配体)(其中靶向配体提供与细胞表面蛋白的靶向结合,并且带电荷的聚合物多肽结构域与有效负载相互作用,例如,与核酸有效负载聚集和/或与蛋白有效负载静电地相互作用)。
在描述本方法和组合物之前,应理解,本发明不限于所描述的特定方法或组合物,因为这些当然可以变化。还应理解,本文使用的术语仅出于描述特定实施例的目的,而不旨在进行限制,因为本发明的范围仅由所附权利要求进行限制。
当提供值的范围时,应当理解,除非上下文另有明确指示,否则介于该范围上限和下限之间的每个居间值(至下限单位的十分之一)也被具体公开。所表述范围内任何所表述值或居间值与所表述范围内任何其他所表述值或居间值之间的每个更小范围被涵盖在本发明内。这些更小范围的上限和下限可被独立地包括在该范围之内或排除在该范围之外,并且每个范围(其中更小范围包括任一限值,不包括限值,或包括两个限值)也被涵盖在本发明内,这取决于所表述范围内任何被具体排除的限值。当所表述范围包括限值的一个或两个时,排除那些被包括的限值的任一个或两个的范围也被包括在本发明内。
除非另有定义,否则本文使用的所有技术和科学术语具有与本发明所属领域的普通技术人员通常所理解的相同含义。尽管与本文描述的方法和材料类似或等同的任何方法和材料都可以用于本发明的实施或测试中,但是现在描述了一些潜在和优选的方法和材料。本文提及的所有出版物通过引用并入本文,以公开和描述与所引用的出版物有关的方法和/或材料。应当理解,在存有矛盾的情形下,本公开取代了所并入的出版物的任何公开。
对于本领域技术人员而言,在阅读本公开后将显而易见的是,本文描述和示出的每个单独的实施例具有离散的组件和特征,这些组件和特征可容易地与其他几个实施例中的任何一个的特征分离或组合而不偏离本发明的范围或精神。任何记载的方法都可以用记载的事件顺序进行或逻辑上可能的任何其他顺序进行。
必须注意的是,如本文和所附权利要求中所使用的,除非上下文另有明确指示,否则单数形式“一个(a)”,“一个(an)”,和“该(the)”包括复数指代。因此,例如,提及“一个细胞”包括多个这样的细胞,并且提及“该核酸内切酶”包括提及本领域技术人员已知的一种或多种核酸内切酶及其等同物,等等。还应注意,权利要求可被撰写为排除任何要素,例如,任何可选的要素。照此,本陈述旨在作为与权利要求要素的记载有关的例如“单独地”,“仅仅”等排他性术语的使用的引用基础,或作为“否定性”限制的使用的引用基础。
本文讨论的出版物被提供仅因为这些出版物的公开在本申请的申请日之前。本文中的任何内容均不应被解释为承认本发明无权提前于此类公开。此外,所提供的公开日期可能与实际公开日期不同,实际公开日期可能需要独立确认。
所提供的是有效率的基因组编辑的方法和组合物。在一些实施例中,主题方法包括(a)在靶细胞的基因组内的两个位置产生具有交错端的双链切割,从而产生第一基因组的交错端和第二基因组的交错端;和(b)引入在每端均具有5’或3’突出端的线性双链供体DNA,其中供体DNA的一端与第一基因组的交错端杂交,并且供体DNA的另一端与第二基因组的交错端杂交,从而导致线性双链供体DNA插入靶细胞的基因组。
编码位点特异性核酸酶的核酸可以是任何感兴趣的核酸,例如,作为递送媒介物的核酸有效负载,其可以是线性或环状的,并且可以是质粒,病毒基因组,RNA等。术语“核酸”涵盖被修饰的核酸。例如,核酸分子可以是模拟物,可以包括被修饰的糖主链,一个或多个被修饰的核苷间连接(例如,一个或多个硫代磷酸酯和/或杂原子核苷间连接),一个或多个被修饰的碱基等。在一些实施例中,主题有效负载包括三链形成(triplex-forming)肽核酸(PNA)(参见,例如,McNeer等,《基因治疗(Gene Ther)》。2013年6月;20(6):658-69)。主题供体DNA为双链,线性,并且具有交错端(即,线性供体DNA的每端具有突出端)。
在两个位置产生基因组的交错端
在一些情况下,为了产生交错的切割,将位点特异性核酸酶(一种或多种位点特异性核酸酶)(或编码一种或多种位点特异性核酸酶的核酸,例如,一种或多种核酸)引入靶细胞。如果靶细胞在体内,则可以通过将适当的组分(例如,作为一种或多种递送媒介物的一部分)施用给个体来实现。在一些情况下,靶细胞包括编码位点特异性核酸酶的DNA(可以,例如,在诱导型启动子的控制下可操作地连接),而主题方法的“产生”步骤包括诱导位点特异性核酸酶的表达。
两个基因组的交错端的每个突出端(在基因组的两个位置进行切割之后)可以独立地为5’或3’单链突出端。例如,在一些情况下,两个基因组的交错端(在基因组的两个位置进行切割之后)可以具有5’突出端。在一些情况下,两个基因组的交错端均具有3’突出端。在一些情况下,一个基因组的交错端(在两个切割位置之一)具有5’突出端,另一个基因组的交错端(在另一个切割位置)具有3’突出端。
两个基因组的交错端的每个突出端(在基因组的两个位置进行切割之后)可以是任何便利的长度。在一些实施例中,两个基因组的交错端的每个突出端(在两个位置切割基因组之后)可以独立地为2-20个核苷酸(nt)的长度(例如,2-18,2-15、2-12,2-10,2-8,2-7,2-6,2-5,3-20,3-18,3-15,3-12,3-10,3-8,3-7,3-6,3-5,4-20,4-18,4-15,4-12,4-10,4-8,4-7,或4-6nt)。在一些情况下,两个基因组的交错端的每个突出端(在两个位置切割基因组之后)可以独立地为2-20个核苷酸的长度。在一些情况下,两个基因组的交错端的每个突出端(在两个位置切割基因组之后)可以独立地为2-15个核苷酸的长度。在一些情况下,两个基因组的交错端的每个突出端(在两个位置切割基因组之后)可以独立地为2-10个核苷酸的长度。
在一些实施例中,在产生两个交错端切割(基因组中的两个位置)之前,两个位置相隔1,000,000个碱基对(bp)或更少(例如,500,000bp或更少,100,000bp或更少,50,000bp或更少,10,000bp或更少,1,000bp或更少,750bp或更少,或500bp或更少)。在一些情况下,两个位置相隔100,000bp或更少。在一些情况下,两个位置相隔50,000bp或更少。在一些实施例中,在产生两个交错端切割(基因组中的两个位置)之前,两个位置相隔的范围为5至1,000,000个碱基对(bp)(例如,5至500,000,5至100,000,5至50,000,5至10,000,5至5,000,5至1,000,5至500,10至1,000,000,10至500,000,10至100,000,10至50,000,10至10,000,10至5,000,10至1,000,10至500,50至1,000,000,50至500,000,50至100,000,50至50,000,50至10,000,50至5,000,50至1,000,50至500,100至1,000,000,100至500,000,100至100,000,100至50,000,100至10,000,100至5,000,100至1,000,100至500,300至1,000,000,300至500,000,300至100,000,300至50,000,300至10,000,300至5,000,300至1,000,300至500,500至1,000,000,500至500,000,500至100,000,500至50,000,500至10,000,500至5,000,500至1,000,1,000至1,000,000,1,000至500,000,1,000至100,000,1,000至50,000,1,000至10,000,或1,000至5,000bp)。
在一些情况下,两个位置相隔的范围为20至1,000,000bp。在一些情况下,两个位置相隔的范围为20至500,000bp。在一些情况下,两个位置相隔的范围为20至150,000bp。在一些情况下,两个位置相隔的范围为20至50,000bp。在一些情况下,两个位置相隔的范围为20至20,000bp。在一些情况下,两个位置相隔的范围为20至15,000bp。在一些情况下,两个位置相隔的范围为20至10,000bp。
在一些情况下,两个位置相隔的范围为500至1,000,000bp。在一些情况下,两个位置相隔的范围为为500至500,000bp。在一些情况下,两个位置相隔的范围为为500至150,000bp。在一些情况下,两个位置相隔的范围为500至50,000bp。在一些情况下,两个位置相隔的范围为500至20,000bp。在一些情况下,两个位置相隔的范围为500至15,000bp。在一些情况下,两个位置相隔的范围为500至10,000bp。
在一些情况下,两个位置相隔的范围为1,000至1,000,000bp。在一些情况下,两个位置相隔的范围为为1,000至500,000bp。在一些情况下,两个位置相隔的范围为为1,000至150,000bp。在一些情况下,两个位置相隔的范围为1,000至50,000bp。在一些情况下,两个位置相隔的范围为1,000至20,000bp。在一些情况下,两个位置相隔的范围为1,000至15,000bp。在一些情况下,两个位置相隔的范围为1,000至10,000bp。
在一些情况下,两个位置相隔的范围为5,000至1,000,000bp。在一些情况下,两个位置相隔的范围为为5,000至500,000bp。在一些情况下,两个位置相隔的范围为为5,000至150,000bp。在一些情况下,两个位置相隔的范围为5,000至50,000bp。在一些情况下,两个位置相隔的范围为5,000至20,000bp。在一些情况下,两个位置相隔的范围为5,000至15,000bp。在一些情况下,两个位置相隔的范围为5,000至10,000bp。
主题位点特异性核酸酶是一种可以在基因组DNA中引入双链切割以产生交错端的酶(例如,经由在DNA的互补链中的两个错位的单链切割)。在一些情况下,位点特异性核酸酶(例如,大范围核酸酶)(或2类CRISPR/Cas效应蛋白(例如,Cpf1))天然地产生交错端。一些位点特异性核酸酶是工程化蛋白(engineered proteins)(例如,锌指核酸酶(ZFN)和转录激活因子样效应物核酸酶(TALEN)),在一些情况下,此类蛋白被用作蛋白对以产生交错端。在一些情况下,位点特异性核酸酶是一种天然地产生钝性(blunt)单链切割的酶(例如,2类CRISPR/Cas效应蛋白(例如,Cas9)),但已被突变,使得该蛋白为切口酶(仅切割DNA的一条链)。通过使用靶向靶DNA的互补链的两个向导RNA,可将切口酶蛋白(如已突变的切口酶Cas9)用于产生交错端。因此,在一些情况下,主题方法包括使用具有两个向导RNA的序列特异性切口酶(例如,切口酶2类CRISPR/Cas效应蛋白(如切口酶Cas9)),以在(至少)两个基因组的位置之一产生交错的切割。在一些情况下,主题方法包括使用具有四个向导RNA的序列特异性切口酶(例如,切口酶2类CRISPR/Cas效应蛋白(如切口酶Cas9)),以在两个基因组的位置产生两个交错的切割。
可以使用任何便利的位点特异性核酸酶(例如,基因编辑蛋白(如任何便利的可编程基因编辑蛋白))。合适的可编程基因编辑蛋白的示例包括但不限于转录激活因子样效应物核酸酶(TALEN),锌指核酸酶(ZFN),和CRISPR/Cas RNA-向导的多肽(如Cas9,CasX,CasY,Cpf1,Cas13,MAD7等)。可被使用的位点特异性核酸酶的示例包括但不限于转录激活因子样效应物核酸酶(TALEN),锌指核酸酶(ZFN),和CRISPR/Cas RNA-向导的多肽(如Cas9,CasX,CasY,Cpf1,Cas13,MAD7等);大范围核酸酶(例如,I-Sce I,I-Ceu I,I-Cre I,I-Dmo I,I-Chu I,I-Dir I,I-Flmu I,I-Flmu II,I-Anil,I-SceIV,I-Csm I,I-Pan I,I-Pan II,I-PanM I,I-Sce II,I-Ppo I,I-Sce III,I-Ltr I,I-Gpi I,I-GZe I,I-Onu I,I-HjeM I,I-Mso I,I-Tev I,I-Tev II,I-Tev III,P I-Mle I,P I-Mtu I,P I-Psp I,P I-Tli I,P I-Tli II,P I-Sce V等);和归巢核酸内切酶。
在一些情况下,递送媒介物被用于递送编码基因编辑工具(即,基因编辑系统的组件,例如,位点特异性剪切(cleaving)系统(如可编程基因编辑系统))的核酸。例如,核酸有效负载可以包括以下一种或多种:(i)CRISPR/Cas向导RNA,(ii)编码CRISPR/Cas向导RNA的DNA,(iii)编码如锌指蛋白(ZFP)(例如,锌指核酸酶-ZFN),转录激活因子样效应物(TALE)蛋白(例如,融合至核酸酶-TALEN),和/或CRISPR/Cas RNA-向导的多肽(例如,Cas9,CasX,CasY,Cpf1,Cas13,MAD7等)的可编程基因编辑蛋白的DNA和/或RNA;(iv)编码大范围核酸酶的DNA和/或RNA;(v)编码归巢核酸内切酶的DNA和/或RNA;和(vi)供体DNA分子。
在一些情况下,主题递送媒介物被用于递送蛋白有效负载,例如蛋白,如ZFN,TALEN,CRISPR/CasRNA-向导的多肽(2类CRISPR/Cas效应蛋白)(例如,Cas9,CasX,CasY,Cpf1,Cas13,MAD7等),大范围核酸酶,和归巢核酸内切酶。Cas13,MAD7,
取决于系统的性质和想要的结果,基因编辑系统(例如,位点特异性基因编辑系统(如可编程基因编辑系统))可以包括单个组件(例如,ZFP,ZFN,TALE,TALEN,大范围核酸酶等)或可以包括多个组件。在一些情况下,基因编辑系统包括至少两个组件。例如,在一些情况下,基因编辑系统(例如,可编程基因编辑系统)包括(i)供体DNA分子核酸;(ii)基因编辑蛋白(例如,可编程基因编辑蛋白(如ZFP,ZFN,TALE,TALEN,DNA-向导的多肽(如格氏嗜盐碱杆菌Argonaute(NgAgo))),CRISPR/Cas RNA-向导的多肽(如Cas9,CasX,CasY,或Cpf1,Cas13,MAD7等)),或编码基因编辑蛋白的核酸分子(例如,DNA或RNA(如质粒或mRNA))。作为另一个示例,在一些情况下,基因编辑系统(例如,可编程基因编辑系统)包括(i)CRISPR/Cas向导RNA,或编码CRISPR/Cas向导RNA的DNA;和(ii)CRISPR/Cas RNA-向导的多肽(例如,Cas9,CasX,CasY,Cpf1,Cas13,MAD7等),或编码RNA-向导的多肽的核酸分子(例如,DNA或RNA(如质粒或mRNA))。作为另一个示例,在一些情况下,基因编辑系统(例如,可编程基因编辑系统)包括(i)NgAgo样(NgAgo-like)向导DNA;和(ii)DNA-向导的多肽(例如NgAgo),或编码DNA-向导的多肽的核酸分子(例如,DNA或RNA(如质粒或mRNA))。在一些情况下,基因编辑系统(例如,可编程基因编辑系统)包括至少三个组件:(i)供体DNA分子;(ii)CRISPR/Cas向导RNA,或编码CRISPR/Cas向导RNA的DNA;和(iii)CRISPR/Cas RNA-向导的多肽(例如,Cas9,CasX,CasY,或Cpf1),或编码RNA-向导的多肽的核酸分子(例如,DNA或RNA(如质粒或mRNA))。在一些情况下,基因编辑系统(例如,可编程基因编辑系统)包括至少三个组件:(i)供体DNA分子;(ii)NgAgo样向导DNA,或编码NgAgo样向导DNA的DNA;和(iii)DNA-向导的多肽(例如,NgAgo),或编码DNA-向导的多肽的核酸分子(例如,DNA或RNA(如质粒或mRNA))。
在一些实施例中,递送媒介物的有效负载包括一个或多个基因编辑工具。本文使用术语“基因编辑工具”以指代基因编辑系统的一个或多个组件。因此,在一些情况下,有效负载包括基因编辑系统,而在一些情况下,有效负载包括基因编辑系统的一个或多个组件(即,一个或多个基因编辑工具)。例如,靶细胞可能已经包括基因编辑系统的组件之一,而使用者仅需要添加其余的组件。在这种情况下,主题纳米颗粒的有效负载不一定包括给定的基因编辑系统的所有组件。照此,在一些情况下,有效负载包括一个或多个基因编辑工具。
作为说明性示例,靶细胞可能已经包括基因编辑蛋白(例如,ZFP,TALE,DNA-向导的多肽(例如,NgAgo),CRISPR/Cas RNA-向导的多肽(如Cas9,CasX,CasY,Cpf1,Cas13,MAD7等)),和/或编码蛋白的DNA或RNA,并且因此有效负载可以包括以下一种或多种:(i)供体DNA分子;和(ii)CRISPR/Cas向导RNA,或编码CRISPR/Cas向导RNA的DNA;或NgAgo样向导DNA。类似地,靶细胞可能已经包括CRISPR/Cas向导RNA和/或编码向导RNA的DNA或NgAgo样向导DNA,并且有效负载可以包括以下一种或多种:(i)供体DNA分子;和(ii)CRISPR/CasRNA-向导的多肽(例如,Cas9,CasX,CasY,Cpf1,Cas13,MAD7等),或编码RNA-向导的多肽的核酸分子(例如,DNA或RNA(如质粒或mRNA));或DNA-向导的多肽(例如,NgAgo),或编码DNA-向导的多肽的核酸分子。
与可编程基因编辑工具有关的其他信息(例如,CRISPR/Cas RNA-向导的蛋白(如Cas9,CasX,CasY,和Cpf1),锌指蛋白(如锌指核酸酶),TALE蛋白(如TALEN),CRISPR/Cas向导RNA等),参照例如,Dreier等,(2001)《生物化学杂志》276:29466-78;Dreier等,(2000)《分子生物学杂志(J Mol Biol)》303:489-502;Liu等,(2002)《生物化学杂志》277:3850-6);Dreier等,(2005)《生物化学杂志》280:35588-97;Jamieson等,(2003)《自然评论药物发现(Nature Rev Drug Discov)》2:361-8;Durai等,(2005)《核酸研究(Nucleic AcidsRes)》33:5978-90;Segal,(2002)《方法(Methods)》26:76-83;Porteus和Carroll,(2005)《自然生物技术(Nat Biotechnol)》23:967-73;Pabo等,(2001)《生物化学年鉴(Ann RevBiochem)》70:313-40;Wolfe等,(2000)《生物物理和生物分子结构年鉴(Ann Rev BiophysBiomol Struct)》29:183-212;Segal和Barbas,(2001)《生物技术新见(Curr OpinBiotechnol)》12:632-7;Segal等,(2003)《生物化学(Biochemistry)》42:2137-48;Beerli和Barbas,(2002)《自然生物技术》20:135-41;Carroll等,(2006)《自然实验手册(NatureProtocols)》1:1329;Ordiz等,(2002)《美国科学院院报(Proc Natl Acad Sci USA)》99:13290-5;Guan等,(2002)《美国科学院院报》99:13296-301;Sanjana等,《自然实验手册》,7:171-192(2012);Zetsche等,《细胞(Cell)》2015年10月22日;163(3):759-71;Makarova等,《自然评论微生物学(Nat Rev Microbiol)》2015年11月;13(11):722-36;Shmakov等,《分子细胞(Mol Cell)》2015年11月5日;60(3):385-97;Jinek等,《科学(Science)》2012年8月17日;337(6096):816-21;Chylinski等,《RNA生物学(RNA Biol)》2013年5月;10(5):726-37;Ma等,《生物医学国际化研究(Biomed Res Int)》2013;2013:270805;Hou等,《美国科学院院报》2013年9月24日;110(39):15644-9;Jinek等,《Elife》2013;2:e00471;Pattanayak等,《自然生物技术》2013年9月;31(9):839-43;Qi等,《细胞》2013年2月28日;152(5):1173-83;Wang等,《细胞》2013年5月9日;153(4):910-8;Auer等,《基因组研究(Genome Res)》2013年10月31日;Chen等,《核酸研究》2013年11月1日;41(20):e19;Cheng等,《细胞研究(CellRes)》2013年10月;23(10):1163-71;Cho等,《遗传学(Genetics)》2013年11月;195(3):1177-80;DiCarlo等,《核酸研究》2013年4月;41(7):4336-43;Dickinson等,《自然方法(NatMethods)》2013年10月;10(10):1028-34;Ebina等,《科学报告(Sci Rep)》2013;3:2510;Fujii等,《核酸研究》2013年11月1日;41(20):e187;Hu等,《细胞研究》2013年11月;23(11):1322-5;Jiang等,《核酸研究》2013年11月1日;41(20):e188;Larson等,《自然实验手册》2013年11月;8(11):2180-96;Mali等,《自然方法》2013年10月;10(10):957-63;Nakayama等《遗传学》2013年12月;51(12):835-43;Ran等,《自然实验手册》2013年11月;8(11):2281-308;Ran等,《细胞》2013年9月12日;154(6):1380-9;Upadhyay等,《G3(Bethesda)》2013年12月9日;3(12):2233-8;Walsh等,《美国科学院院报》2013年9月24日;110(39):15514-5;Xie等,《分子植物(Mol Plant)》2013年10月9日;Yang等,《细胞》2013年9月12日;154(6):1370-9;Briner等,《分子细胞》2014年10月23日;56(2):333-9;Burstein等,《自然(Nature)》2016年12月22日-印刷前的电子出版物;Gao等,《自然生物技术》2016年7月;34(7):768-73;和Shmakov等,《自然评论微生物学》2017年3月;15(3):169-182;以及国际专利申请公开号WO2002099084;WO00/42219;WO02/42459;WO2003062455;WO03/080809;WO05/014791;WO05/084190;WO08/021207;WO09/042186;WO09/054985;和WO10/065123;美国专利申请公开号20030059767;20030108880;20140068797;20140170753;20140179006;20140179770;20140186843;20140186919;20140186958;20140189896;20140227787;20140234972;20140242664;20140242699;20140242700;20140242702;20140248702;20140256046;20140273037;20140273226;20140273230;20140273231;20140273232;20140273233;20140273234;20140273235;20140287938;20140295556;20140295557;20140298547;20140304853;20140309487;20140310828;20140310830;20140315985;20140335063;20140335620;20140342456;20140342457;20140342458;20140349400;20140349405;20140356867;20140356956;20140356958;20140356959;20140357523;20140357530;20140364333;20140377868;20150166983;和20160208243;以及美国专利号6,140,466;6,511,808;6,453,242;8,685,737;8,906,616;8,895,308;8,889,418;8,889,356;8,871,445;8,865,406;8,795,965;8,771,945;和8,697,359;全部通过引用整体并入本文。
供体DNA和基因组的交错端
主题供体DNA是具有粘性端(即,交错端)的线性双链DNA(参见,例如,图1)。主题供体DNA是线性的,并且具有(i)彼此杂交形成碱基对的两条DNA链,和(ii)每端上的单链突出端。在一些情况下,使用两个供体DNA(例如,编辑基因组DNA的两个部分),在这种情况下,4个交错的切割被引入基因组-每个供体DNA两个。
在一些情况下,供体DNA的两条链彼此杂交形成总共10个或更多碱基对(bp)(例如,20个或更多,30个或更多,50个或更多,100个或更多,或200个或更多bp)。换句话说,在一些情况下,主题供体DNA具有10个或更多bp(例如,20个或更多,30个或更多,50个或更多,100个或更多,或200个或更多bp)。
在一些情况下,主题供体DNA总共具有10个碱基对(bp)至100个千碱基对(kbp)(例如,10bp至70kbp,10bp至50kbp,10bp至40kbp,10bp至25kbp,10bp至15kbp,10bp至10kbp,10bp至1kbp,10bp至750bp,10bp至500bp,10bp至250bp,10bp至150bp,10bp至100bp,10bp至50bp,18bp至100kbp,18bp至70kbp,18bp至50kbp,18bp至40kbp,18bp至25kbp,18bp至15kbp,18bp至10kbp,18bp至1kbp,18bp至750bp,18bp至500bp,18bp至250bp,18bp至150bp,25bp至100kbp,25bp至70kbp,25bp至50kbp,25bp至40kbp,25bp至25kbp,25bp至15kbp,25bp至10kbp,25bp至1kbp,25bp至750bp,25bp至500bp,25bp至250bp,25bp至150bp,50bp至100kbp,50bp至70kbp,50bp至50kbp,50bp至40kbp,50bp至25kbp,50bp至15kbp,50bp至10kbp,50bp至1kbp,50bp至750bp,50bp至500bp,50bp至250bp,50bp至150bp,100bp至100kbp,100bp至70kbp,100bp至50kbp,100bp至40kbp,100bp至25kbp,100bp至15kbp,100bp至10kbp,100bp至1kbp,100bp至750bp,100bp至500bp,100bp至250bp,200bp至100kbp,200bp至70kbp,200bp至50kbp,200bp至40kbp,200bp至25kbp,200bp至15kbp,200bp至10kbp,200bp至1kbp,200bp至750bp,或200bp至500bp)。换句话说,在一些情况下,供体DNA的两条链彼此杂交形成总共10bp至100kbp。在一些情况下,主题供体DNA具有总共10bp至50kbp。在一些情况下,主题供体DNA具有总共10bp至10kbp。在一些情况下,主题供体DNA具有总共10bp至1kbp。在一些情况下,主题供体DNA具有总共20bp至50kbp。在一些情况下,主题供体DNA具有总共20bp至10kbp。在一些情况下,主题供体DNA具有总共20bp至1kbp。
在一些实施例中,供体DNA突出端的长度是已知的并且被很好地定义。例如,如果使用核酸酶(如TALEN)从较大的模板上切割供体DNA,则可能导致供体DNA的群体具有多种不确定的和未知的突出端长度。另一方面,可以合成供体DNA(例如,体外合成),使得供体DNA的群体是同一供体DNA的拷贝,具有同一的,已知的,被定义的突出端。在一些情况下,供体DNA作为PCR产物被引入,随后被酶(例如,限制性酶或2类CRISPR/Cas效应蛋白(如Cas9))消化以产生粘性端。
主题供体DNA的每端可以独立地具有5’或3’单链突出端。例如,在一些情况下,供体DNA的两端均具有5’突出端。在一些情况下,供体DNA的两端均具有3’突出端。在一些情况下,供体DNA的一端具有5’突出端,而另一端具有3’突出端。每个突出端可以是任何便利的程度。在一些情况下,每个突出端的长度可以独立地为2-200个核苷酸(nt)长(参见,例如,2-150,2-100,2-50,2-25,2-20,2-15,2-12,2-10,2-8,2-7,2-6,2-5,3-150,3-100,3-50,3-25,3-20,3-15,3-12,3-10,3-8,3-7,3-6,3-5,4-150,4-100,4-50,4-25,4-20,4-15,4-12,4-10,4-8,4-7,4-6,5-150,5-100,5-50,5-25,5-20,5-15,5-12,5-10,5-8,或5-7nt)。在一些情况下,每个突出端的长度可以独立地为2-20个nt长。在一些情况下,每个突出端的长度可以独立地为2-15个nt长。在一些情况下,每个突出端的长度可以独立地为2-10个nt长。在一些情况下,每个突出端的长度可以独立地为2-7个nt长。
当供体DNA插入基因组的两个交错端(在本文中也称为基因组的交错端)(在两个位置切割基因组之后),供体DNA的每端可以独立地与基因组的突出端的总共2-20个碱基对(bp)(例如,2-18,2-16,2-15,2-12,2-10,2-8,2-6,2-5,3-20,3-18,3-16,3-15,3-12,3-10,3-8,3-6,3-5,4-20,4-18,4-16,4-15,4-12,4-10,4-8,4-6,5-20,5-18,5-16,5-15,5-12,5-10,8-20,8-18,8-16,8-15,8-12,8-10,5-8,10-20,10-18,10-16,10-15,或10-12bp)杂交。在一些情况下,供体DNA的突出端的长度等于或小于基因组的突出端的长度。在一些情况下,基因组的突出端的长度等于或小于供体DNA的突出端的长度。
在一些实施例中,供体DNA具有至少一个腺苷酸化的3’端。
在一些情况下,供体DNA包括模拟物,可以包括被修饰的糖主链,一个或多个被修饰的核苷间连接(例如,一个或多个硫代磷酸酯和/或杂原子核苷间连接),一个或多个被修饰的碱基等。
递送媒介物/有效负载
在一些实施例中,将主题组合物(例如,一种或多种序列特异性核酸酶,编码一种或多种序列特异性核酸酶的一种或多种核酸,线性双链供体DNA等)作为递送媒介物的有效负载(例如,在一些情况下作为同一递送媒介物的有效负载)递送至细胞。例如,在一些情况下,主题线性双链供体DNA(每端均具有突出端)和一种或多种序列特异性核酸酶(如大范围核酸酶,归巢核酸内切酶,锌指核酸酶,TALEN,CRISPR/Cas效应蛋白)(或编码一种或多种序列特异性核酸酶的多种核酸)是同一递送媒介物的有效负载。在一些此类情况下,有效负载结合在一起并形成脱氧核糖核蛋白复合物(例如,包括供体DNA和核酸酶的复合物)或核糖-脱氧核糖核蛋白复合物(例如,进一步包括CRISPR/Cas向导RNA的复合物)。
递送媒介物可以包括但不限于,非病毒媒介物,病毒媒介物,纳米颗粒(例如,包括靶向配体和/或核的纳米颗粒,该核包含阴离子聚合物组合物,阳离子聚合物组合物,和阳离子多肽组合物),脂质体,胶束,水-油-水乳液颗粒,油-水-乳液胶束颗粒,多层水-油-水乳液颗粒,与带电荷的聚合物多肽结构域缀合的靶向配体(例如,肽靶向配体)(其中,靶向配体提供与细胞表面蛋白的靶向结合,并且带电荷的聚合物多肽结构域与核酸有效负载聚集和/或与蛋白有效负载以静电方式相互作用),与有效负载缀合的靶向配体(例如,肽靶向配体)(其中,靶向配体提供与细胞表面蛋白的靶向结合)。
在一些情况下,递送媒介物是水-油-水乳液颗粒。在一些情况下,递送媒介物是油-水乳液胶束颗粒。在一些情况下,递送媒介物是多层水-油-水乳液颗粒。在一些情况下,递送媒介物是多层状颗粒。在一些情况下,递送媒介物是DNA折叠纳米机器人。对于上述任何一种,有效负载(核酸和/或蛋白)均可以在颗粒内部,共价地结合成核酸互补对,或在颗粒的水相中。在一些情况下,递送媒介物包括靶向配体,例如,在一些情况下,靶向配体(在本文其他地方更详细地描述)包覆在水-油-水乳液颗粒上,油-水乳液胶束颗粒上,多层水-油-水乳液颗粒上,多层状颗粒上,或DNA折叠纳米机器人上。在一些情况下,递送媒介物具有金属颗粒核,并且有效负载(例如,供体DNA和/或位点特异性核酸酶-或编码其的核酸)可以与金属核缀合(共价地结合)。
本公开的纳米颗粒包括有效负载,其可以由核酸和/或蛋白组成。例如,在一些情况下,主题纳米颗粒被用于递送核酸有效负载(例如,DNA和/或RNA)。在一些情况下,纳米颗粒的核包括一种或多种有效负载。在一些此类情况下,纳米颗粒核还可以包括阴离子聚合物组合物,阳离子聚合物组合物,和阳离子多肽组合物。在一些情况下,纳米颗粒具有含金属的核,并且有效负载与核相关联(在一些情况下,例如,与核的外部缀合)。在一些实施例中,有效负载是纳米颗粒核的一部分。因此,主题纳米颗粒的核可以包括核酸,DNA,RNA,和/或蛋白。因此,在一些情况下,主题纳米颗粒包括核酸(DNA和/或RNA)和蛋白。在一些情况下,主题纳米颗粒核包括核糖核蛋白(RNA和蛋白)复合物。在一些情况下,主题纳米颗粒核包括脱氧核糖核蛋白(DNA和蛋白,例如,供体DNA和ZFN,TALEN,或CRISPR/Cas效应蛋白)复合物。在一些情况下,主题纳米颗粒核包括核糖-脱氧核糖核蛋白(RNA和DNA和蛋白,例如,向导RNA,供体DNA和CRISPR/Cas效应蛋白)复合物。在一些情况下,主题纳米颗粒核包括PNA。在一些情况下,主题核包括PNA和DNA。
主题核酸有效负载(例如,供体DNA和/或编码序列特异性核酸酶的核酸)可以包括吗啉代主链结构。在一些情况下,主题核酸有效负载(例如,供体DNA和/或编码序列特异性核酸酶的核酸)可以具有一个或多个锁核酸(LNA)。合适的糖取代基包括甲氧基(-O-CH
在一些情况下,核酸有效负载可以包括缀合物部分(例如,增强核酸有效负载的活性,稳定性,细胞的分布或细胞的摄取的一个缀合物部分)。这些部分或缀合物可以包括与官能团(如伯羟基集团或仲羟基基团)共价地结合的缀合物基团。缀合物基团包括但不限于,嵌入剂,报告分子,多胺,聚酰胺,聚乙二醇,聚醚,增强寡聚物的药效学性质的基团,和增强寡聚物的药动学性质的基团。合适的缀合物基团包括但不限于,胆固醇,脂质,磷脂,生物素,吩嗪,叶酸,菲啶,蒽醌,吖啶,荧光素,若丹明,香豆素,和染料。增强药效学性质的基团包括改善摄取,增强对降解的抗性,和/或加强与靶核酸的序列特异性杂交的基团。增强药动学性质的基团包括改善主题核酸的摄取,分布,代谢或排泄的基团。
任何非供体DNA的方便的多核苷酸都可以用作主题核酸有效负载(例如,用于递送位点特异性核酸酶)。示例包括但不限于:RNA和DNA的种类,包括mRNA,m1A修饰的mRNA(腺苷1位的单甲基化),吗啉代RNA,类肽和肽核酸,cDNA,DNA折叠,具有合成核苷酸的DNA和RNA,具有预定义的二级结构的DNA和RNA,以及前述的多聚体和寡聚体。
在一些实施例中,多于一种有效负载作为同一包装(例如,纳米颗粒)的一部分被递送,例如,在一些情况下,不同的有效负载是不同的核的一部分。将多种有效负载作为同一递送媒介物(例如,纳米颗粒)的一部分进行递送的一个优点是,没有稀释每种有效负载的效率。作为说明性示例,如果有效负载A和有效负载B在两个分开的包装/媒介物(分别为包装A和包装B)中被递送,则效率是相乘的,例如,如果包装A和包装B各自具有1%的转染效率,则将有效负载A和有效负载B递送至同一细胞的机会为0.01%(1%X1%)。但是,如果有效负载A和有效负载B都作为同一递送媒介物的一部分被递送,则将有效负载A和有效负载B递送至同一细胞的机会为1%,比0.01%提高了100倍。
类似地,在包装A和包装B各自具有0.1%转染效率的情境下,将有效负载A和有效负载B递送至同一细胞的机会为0.0001%(0.1%X0.1%)。但是,如果在这种情境下将有效负载A和有效负载B都作为同一包装的一部分(例如,同一纳米颗粒-包装A的一部分)进行递送,则将有效负载A和有效负载B递送至同一细胞的机会为0.1%,比0.0001%提高了1000倍。
照此,在一些实施例中,将一种或多种基因编辑工具(例如,如上所述)和供体DNA与蛋白(和/或编码蛋白的DNA或mRNA)和/或提高基因组的编辑效率的非编码RNA组合(例如,作为同一纳米颗粒的一部分)进行递送。在一些情况下,将一种或多种基因编辑工具(例如,如上所述)和供体DNA与蛋白(和/或编码蛋白的DNA或mRNA)和/或控制细胞分裂和/或分化的非编码RNA组合(例如,作为同一纳米颗粒的一部分)进行递送。
作为上述的非限制性示例,在一些实施例中,一种或多种基因编辑工具和供体DNA可以与以下一种或多种组合进行递送:SCF(和/或编码SCF的DNA或mRNA),HoxB4(和/或编码HoxB4的DNA或mRNA),BCL-XL(和/或编码BCL-XL的DNA或mRNA),SIRT6(和/或编码SIRT6的DNA或mRNA),抑制miR-155的核酸分子(例如,siRNA和/或LNA),降低ku70表达的核酸分子(例如,siRNA,shRNA,miRNA),和降低ku80表达的核酸分子(例如,siRNA,shRNA,miRNA)。
对于可以与基因编辑工具(例如,位点特异性核酸酶)和供体DNA组合进行递送的miRNA的示例,请参见图9A。例如,以下miRNA可被用于以下目的:用于阻断多能干细胞向外胚层谱系的分化:miR-430/427/302(参见,例如,MiR Base登录号:MI0000738,MI0000772,MI0000773,MI0000774,MI0006417,MI0006418,MI0000402,MI0003716,MI0003717,和MI0003718);用于阻断多能干细胞向内胚层谱系的分化:miR-109和/或miR-24(参见,例如,MiR Base登录号:MI0000080,MI0000081,MI0000231,和MI0000572);用于驱动多能干细胞向内胚层谱系的分化:miR-122(参见,例如,MiR Base登录号:MI0000442和MI0000256)和/或miR-192(参见,例如,MiR Base登录号:MI0000234和MI0000551);用于驱动外胚层祖细胞向角质细胞宿命(fate)的分化:miR-203(参见,例如,MiR Base登录号:MI0000283,MI0017343,和MI0000246);用于驱动神经嵴干细胞向平滑肌宿命的分化:miR-145(参见,例如,MiR Base登录号:MI0000461,MI0000169,和MI0021890);用于驱动神经干细胞向神经胶质细胞宿命和/或向神经元宿命的分化:miR-9(参见,例如,MiR Base登录号:MI0000466,MI0000467,MI0000468,MI0000157,MI0000720,和MI0000721)和/或miR-124a(例如,参见,MiR Base登录号:MI0000443,MI0000444,MI0000445,MI0000150,MI0000716,和MI0000717);用于阻断中胚层祖细胞向软骨细胞宿命的分化:miR-199a(参见,例如,MiRBase登录号:MI0000242,MI0000281,MI0000241,和MI0000713);用于驱动中胚层祖细胞向成骨细胞宿命的分化:miR-296(参见,例如,MiR Base登录号:MI0000747和MI0000394)和/或miR-2861(参见,例如,MiR Base登录号:MI0013006和MI0013007);用于驱动中胚层祖细胞向心肌宿命的分化:miR-1(参见,例如,MiR Base登录号:MI0000437,MI0000651,MI0000139,MI0000652,MI0006283);用于阻断中胚层祖细胞向心肌宿命的分化:miR-133(参见,例如,MiR Base登录号:MI0000450,MI0000451,MI0000822,MI0000159,MI0000820,MI0000821,和MI0021863);用于驱动中胚层祖细胞向骨骼肌宿命的分化:miR-214(参见,例如,MiR Base登录号:MI0000290和MI0000698),miR-206(参见,例如,MiR Base登录号:MI0000490和MI0000249),miR-1和/或miR-26a(参见,例如,MiR Base登录号:MI0000083,MI0000750,MI0000573,和MI0000706);用于阻断中胚层祖细胞向骨骼肌宿命的分化:miR-133(参见,例如,MiR Base登录号:MI0000450,MI0000451,MI0000822,MI0000159,MI0000820,MI0000821,和MI0021863),miR-221(参见,例如,MiR Base登录号:MI0000298和MI0000709),和/或miR-222(参见,例如,MiR Base登录号:MI0000299和MI0000710);用于驱动造血祖细胞向分化的分化:miR-223(参见,例如,MiR Base登录号:MI0000300和MI0000703);用于阻断造血祖细胞向分化的分化:miR-128a(参见,例如,MiR Base登录号:MI0000447和MI0000155)和/或miR-181a(参见,例如,MiR Base登录号:MI0000269,MI0000289,MI0000223,和MI0000697);用于驱动造血祖细胞向淋巴样祖细胞分化的方法:miR-181(参见,例如,MiR Base登录号:MI0000269,MI0000270,MI0000271,MI0000289,MI0000683,MI0003139,MI0000223,MI0000723,MI0000697,MI0000724,MI0000823,和MI0005450);用于阻断造血祖细胞向淋巴样祖细胞的分化:miR-146(参见,例如,MiR Base登录号:MI0000477,MI0003129,MI0003782,MI0000170,和MI0004665);用于阻断造血祖细胞向髓系祖细胞的分化:miR-155,miR-24a,和/或miR-17(参见,例如,MiR Base登录号:MI0000071和MI0000687);用于驱动淋巴样祖细胞向T细胞宿命的分化:miR-150(参见,例如,MiR Base登录号:MI0000479和MI0000172);用于阻断髓系祖细胞向粒细胞宿命的分化:miR-223(参见,例如,MiR Base登录号:MI0000300和MI0000703);用于阻断髓系祖细胞向单核细胞宿命的分化:miR-17-5p(参见,例如,MiR Base登录号:MIMAT0000070和MIMAT0000649),miR-20a(参见,例如,MiR Base登录号:MI0000076和MI0000568),和/或miR-106a(参见,例如,MiR Base登录号:MI0000113和MI0000406);用于阻断髓系祖细胞向红细胞宿命的分化:miR-150(参见,例如,MiR Base登录号:MI0000479和MI0000172),miR-155,miR-221(参见,例如,MiR Base登录号:MI0000298和MI0000709),和/或miR-222(参见,例如,MiR Base登录号:MI0000299和MI0000710);以及驱动髓系祖细胞向红细胞宿命的分化:miR-451(参见,例如,MiR Base登录号:MI0001729,MI0017360,MI0001730,和MI0021960)和/或miR-16(参见,例如,MiR Base登录号:MI0000070,MI0000115,MI0000565,和MI0000566)。
对于可以与基因编辑工具和供体DNA组合进行递送(例如,作为蛋白或作为编码蛋白的DNA或RNA)的信号传导蛋白(例如,细胞外信号传导蛋白)的示例,请参见图9B。相同的蛋白可以用与靶向配体相似的方式被用作主题纳米颗粒的外壳的一部分,例如,出于使接收纳米颗粒的靶细胞中的分化偏向的目的。例如,以下信号传导蛋白(例如,细胞外信号传导蛋白)可被用于以下目的:用于驱动造血干细胞向共同淋巴样祖细胞谱系的分化:IL-7(参见,例如,NCBI基因ID 3574);用于驱动造血干细胞向共同髓系祖细胞谱系的分化:IL-3(参见,例如,NCBI基因ID 3562),GM-CSF(参见,例如,NCBI基因ID 1437),和/或M-CSF(参见,例如,NCBI基因ID 1435);用于驱动共同淋巴样祖细胞向B细胞宿命的分化:IL-3,IL-4(参见,例如,NCBI基因ID:3565),和/或IL-7;用于驱动普通淋巴样祖细胞向自然杀伤细胞宿命的分化:IL-15(参见,例如,NCBI基因ID 3600);用于驱动普通淋巴样祖细胞向T细胞宿命的分化∶IL-2(参见,例如,NCBI基因ID 3558),IL-7,和/或Notch(参见,例如,NCBI基因ID4851,4853,4854,4855);用于驱动普通淋巴样祖细胞向树突细胞宿命的分化:Flt-3配体(参见,例如,NCBI基因ID2323);用于驱动共同髓系祖细胞向树突细胞宿命的分化:Flt-3配体,GM-CSF,和/或TNF-α(参见,例如,NCBI基因ID 7124);用于驱动共同髓系祖细胞向粒细胞-巨噬细胞祖细胞谱系的分化:GM-CSF;用于驱动共同髓系祖细胞向巨核细胞-红系祖细胞谱系的分化:IL-3,SCF(参见,例如,NCBI基因ID 4254),和/或Tpo(参见,例如,NCBI基因ID 7173);用于驱动巨核细胞-红系祖细胞向巨核细胞宿命的分化:IL-3,IL-6(参见,例如,NCBI基因ID 3569),SCF,和/或Tpo;用于驱动巨核细胞-红系祖细胞向红细胞宿命的分化:促红细胞生成素(参见,例如,NCBI基因ID 2056);用于驱动巨核细胞向血小板宿命的分化:IL-11(参见,例如,NCBI基因ID 3589)和/或Tpo;用于驱动粒细胞-巨噬细胞祖细胞向单核细胞谱系的分化:GM-CSF和/或M-CSF;用于驱动粒细胞-巨噬细胞祖细胞向成髓细胞谱系的分化:GM-CSF;用于驱动单核细胞向单核细胞衍生的树突细胞宿命的分化:Flt-3配体,GM-CSF,IFN-α(参见,例如,NCBI基因ID 3439),和/或IL-4;用于驱动单核细胞向巨噬细胞宿命的分化:IFN-γ,IL-6,IL-10(参见,例如,NCBI基因ID 3586),和/或M-CSF;用于驱动成髓细胞向嗜中性粒细胞宿命的分化:G-CSF(参见,例如,NCBI基因ID 1440),GM-CSF,IL-6,和/或SCF;用于驱动成髓细胞向嗜酸性粒细胞宿命的分化:GM-CSF,IL-3,和/或IL-5(参见,例如,NCBI基因ID3567);用于驱动成髓细胞向嗜碱性粒细胞宿命的分化:G-CSF,GM-CSF,和/或IL-3。
可以与基因编辑工具和供体DNA组合进行递送(例如,作为蛋白和/或核酸(如编码蛋白的DNA或RNA))的蛋白的示例包括但不限于:SOX17,HEX,OSKM(Oct4/Sox2/Klf4/c-myc),和/或bFGF(例如,以驱动向肝干细胞谱系的分化);HNF4a(例如,以驱动向肝细胞宿命的分化);聚(I:C),BMP-4,bFGF,和/或8-Br-cAMP(例如,以驱动向内皮干细胞/祖细胞谱系的分化);VEGF(例如,以驱动向动脉内皮宿命的分化);Sox-2,Brn4,Mytl1,Neurod2,Ascl1(例如,以驱动向神经干细胞/祖细胞谱系的分化);和BDNF,FCS,毛喉萜(Forskolin)和/或SHH(例如,以驱动[向]神经元,星形胶质细胞,和/或少突胶质细胞宿命的分化)。
可以与基因编辑工具和供体DNA组合进行递送(例如,作为蛋白和/或核酸(如编码蛋白的DNA或RNA))的信号传导蛋白(例如,细胞外信号传导蛋白)的示例包括但不限于:细胞因子(例如,IL-2和/或IL-15,例如,用于激活CD8+ T细胞);配体和/或调节Notch,Wnt,和/或Smad信号传导途径的一种或多种的信号传导蛋白;SCF;干细胞编程因子(例如,Sox2,Oct3/4,Nanog,Klf4,c-Myc等);和用于后续分离/纯化/浓缩的临时表面标志物“标记”和/或荧光报告分子(reporters)。例如,成纤维细胞可以通过Sox2的递送转化为神经干细胞,而在Oct3/4和小分子“表观遗传重置因子”的存在下其将变成心室肌细胞。在有亨延顿病或CXCR4突变的患者中,这些成纤维细胞可分别编码与神经元和心肌细胞相关的患病表型性状。通过在单个包装中递送基因编辑校正和这些因子,可以显著降低由于引入的一种或多种但不是所有因子/有效负载而产生的有害影响的风险。
因为有效负载释放的时间和/或位置可以被控制(在本公开的其他地方更详细地描述),所以在同一的包装(例如,同一的纳米颗粒)中打包(packaging)多个有效负载并不妨碍人们实现不同有效负载的不同释放时间/速率和/或位置。例如上述蛋白(和/或编码蛋白的DNA或mRNA)和/或非编码RNA的释放可以与作为同一包装的一部分的一种或多种基因编辑工具的释放分别地被控制。例如,控制细胞增殖和/或分化的蛋白和/或核酸(例如,DNA,mRNA,非编码RNA,miRNA)可以比一种或多种基因编辑工具更早地释放或者可以比一种或多种基因编辑工具更晚地释放。例如,这可以通过使用多于一个可脱落层和/或通过使用多于一个核来实现(例如,其中一个核具有与另一个核不同的释放曲线(profile),例如,使用不同的D-与L-异构体比率,使用不同的ESP:ENP:EPP曲线等)。这样,可以逐步释放供体和核酸酶以实现最佳的编辑和插入效率。
主题纳米颗粒的核可以包括阴离子聚合物组合物(例如,聚(谷氨酸)),阳离子聚合物组合物(例如,聚(精氨酸),阳离子多肽组合物(例如,组蛋白尾肽),和有效负载(例如,核酸和/或蛋白有效负载,例如,供体RNA和/或位点特异性核酸酶或编码位点特异性核酸酶的核酸)。在一些情况下,核通过阳离子氨基酸聚合物和有效负载在阴离子氨基酸聚合物存在下(并且在一些情况下在阳离子多肽组合物的阳离子多肽存在下)的聚集(condensation)产生。在一些实施例中,与具有有效负载的阳离子聚合物的缀合物相比,构成核的组分的聚集可介导被提高的转染效率。在纳米颗粒核中包含阴离子聚合物可延长纳米颗粒在细胞内停留和有效负载释放的持续时间。
对于核的阳离子和阴离子聚合物组合物,可以控制D-异构体聚合物与L-异构体聚合物的比率以控制有效负载的定时的释放,其中所增加的D-异构体聚合物与L-异构体聚合物的比率引起所增加的稳定性(所降低的有效负载释放速率),这例如可以使得由主题纳米颗粒递送的有效负载实现更持久的基因表达。在一些情况下,改变纳米颗粒核内D-与L-异构体多肽的比率可导致基因表达谱(例如,由有效负载分子编码的蛋白的表达)为约1-90天(例如,1-80,1-70,1-60,1-50,1-40,1-30,1-25,1-20,1-15,1-10,3-90,3-80,3-70,3-60,3-50,3-40,3-30,3-25,3-20,3-15,3-10,5-90,5-80,5-70,5-60,5-50,5-40,5-30,5-25,5-20,5-15,或5-10天)。有效负载释放的控制(例如,当递送基因编辑工具时)对于进行基因组编辑可特别有效,例如,在需要同源定向修复的一些情况下。
在一些实施例中,纳米颗粒包括核和包裹该核的可脱落层,其中该核包括:(a)阴离子聚合物组合物;(b)阳离子聚合物组合物;(c)阳离子多肽组合物;和(d)核酸和/或蛋白有效负载,其中(a)和(b)中的一种包括氨基酸的D-异构体聚合物,(a)和(b)中的另一种包括氨基酸的L-异构体聚合物,并且其中D-异构体聚合物与L-异构体聚合物的比率在10∶1至1.5∶1的范围内(例如,8∶1至1.5∶1,6∶1至1.5∶1,5∶1至1.5∶1,4∶1至1.5∶1,3∶1至1.5∶1,2∶1至1.5∶1,10∶1至2∶1;8∶1至2∶1,6∶1至2∶1,5∶1至2∶1,10∶1至3∶1;8∶1至3∶1,6∶1至3∶1,5∶1至3∶1,10∶1至4∶1;4∶1至2∶1,6∶1至4∶1,或10∶1至5∶1),或1∶1.5至1∶10的范围内(例如,1∶1.5至1∶8,1∶1.5至1∶6,1∶1.5至1∶5,1∶1.5至1∶4,1∶1.5至1∶3,1∶1.5至1∶2,1∶2至1∶10,1∶2至1∶8,1∶2至1∶6,1∶2至1∶5,1∶2至1∶4,1∶2至1∶3,1∶3至1∶10,1∶3至1∶8,1∶3至1∶6,1∶3至1∶5,1∶4至1∶10,1∶4至1∶8,1∶4至1∶6,或1∶5至1∶10)。在一些此类情况下,D-异构体聚合物与L-异构体聚合物的比率不是1∶1。在一些此类情况下,阴离子聚合物组合物包括选自聚(D-谷氨酸)(PDEA)和聚(D-天冬氨酸)(PDDA)的阴离子聚合物,其中(任选地)阳离子聚合物组合物可包括选自聚(L-精氨酸),聚(L-赖氨酸),聚(L-组氨酸),聚(L-鸟氨酸),和聚(L-瓜氨酸)的阳离子聚合物。在一些情况下,阳离子聚合物组合物包含选自聚(D-精氨酸),聚(D-赖氨酸),聚(D-组氨酸),聚(D-鸟氨酸),和聚(D-瓜氨酸)的阳离子聚合物,其中(任选地)阴离子聚合物组合物可包括选自聚(L-谷氨酸)(PLEA)和聚(L-天冬氨酸)(PLDA)的阴离子聚合物。
在一些实施例中,纳米颗粒包括核和包裹该核的可脱落层,其中该核包括:(i)阴离子聚合物组合物;(ii)阳离子聚合物组合物;(iii)阳离子多肽组合物;和(iv)核酸和/或蛋白有效负载,其中(a)所述阴离子聚合物组合物包括阴离子氨基酸的D-异构体的聚合物和阴离子氨基酸的L-异构体的聚合物;和/或(b)所述阳离子聚合物组合物包括阳离子氨基酸的D-异构体的聚合物和阳离子氨基酸的L-异构体的聚合物。在一些此类情况下,阴离子聚合物组合物包含选自聚(D-谷氨酸)(PDEA)和聚(D-天冬氨酸)(PDDA)的第一阴离子聚合物;并且包含选自聚(L-谷氨酸)(PLEA)和聚(L-天冬氨酸)(PLDA)的第二阴离子聚合物。在一些情况下,阳离子聚合物组合物包含选自聚(D-精氨酸),聚(D-赖氨酸),聚(D-组氨酸),聚(D-鸟氨酸),和聚(D-瓜氨酸)的第一阳离子聚合物,并且包含选自聚(L-精氨酸),聚(L-赖氨酸),聚(L-组氨酸),聚(L-鸟氨酸),和聚(L-瓜氨酸)的第二阳离子聚合物。在一些情况下,阴离子氨基酸的D-异构体的聚合物相对于所述阴离子氨基酸的L-异构体的聚合物以10∶1至1∶10的范围的比率存在。在一些情况下,阳离子氨基酸的D-异构体的聚合物相对于所述阳离子氨基酸的L-异构体的聚合物以10∶1至1∶10的范围的比率存在。
在一些实施例中,可以通过选择特定类型的蛋白,例如,作为核的一部分(例如,阳离子多肽组合物的一部分,阳离子聚合物组合物的一部分,和/或阴离子聚合物组合物的一部分)来控制有效负载释放的时间。例如,可能想要将有效负载的释放延迟特定的时间范围,或直到有效负载存在于特定的细胞位置(例如,胞质溶胶,细胞核(nucleus),溶酶体,内体)或特定的条件下(例如,低pH,高pH等)。照此,在一些情况下,使用对特定蛋白活性(例如,酶活性)敏感的蛋白(例如,作为核的一部分),例如,是特定蛋白活性(例如,酶活性)的底物(substrate),并且这与对普遍存在的细胞机制(例如,一般降解机制)敏感相反。对特定蛋白活性敏感的蛋白在本文中被称为“酶敏感蛋白”(ESP)。ESP的说明性示例包括但不限于:(i)作为基质金属蛋白酶(MMP)活性(细胞外活性的示例)的底物的蛋白,例如,包括被MMP识别的基序(motif)的蛋白;(ii)作为组织蛋白酶活性(细胞内内体的活性的示例)的底物的蛋白,例如,包括被组织蛋白酶识别的基序的蛋白;和(iii)作为甲基转移酶和/或乙酰转移酶活性(细胞内细胞核活性的示例)的底物的蛋白(如组蛋白尾肽(HTP)),例如,包括可以被酶促甲基化/去甲基化的基序和/或可以被酶促乙酰化/去乙酰化的基序的蛋白。例如,在一些情况下,核酸有效负载与作为乙酰转移酶活性的底物的蛋白(如组蛋白尾肽)聚集,并且蛋白的乙酰化导致蛋白释放有效负载,因此,人们可以行使通过选择使用或多或少对乙酰化敏感的蛋白来控制有效负载的释放。
在一些情况下,主题纳米颗粒的核包括酶促中性多肽(ENP),其是多肽均聚物(即,具有重复序列的蛋白),其中多肽不具有特定的活性并且是中性的。例如,与NLS序列和HTP均具有特定的活性不同,ENP不具有特定的活性。
在一些情况下,主题纳米颗粒的核包括酶促被保护的多肽(EPP),其是对酶促活性具有抗性的蛋白。PP的示例包括但不限于:(i)包括能够抵抗蛋白水解的降解的D-异构体氨基酸(例如,D-异构体聚合物)的多肽;和(ii)自隐蔽(sheltering)结构域,如多聚谷氨酰胺重复结构域(例如,QQQQQQQQQQ)(SEQ ID NO:170)。
通过控制作为主题纳米颗粒的一部分(例如,纳米颗粒核的一部分)的敏感蛋白(ESP),中性蛋白(ENP),和被保护蛋白(EPP)的相对量,人们可以控制有效负载的释放。例如,与使用更多的EPP相比,使用更多的ESP通常可以引起有效负载更快的释放。另外,使用更多的ESP通常可以引起有效负载的释放,这取决于一组特定的条件/环境,例如,引起ESP敏感的蛋白(例如,酶)的活性的条件/环境。
阴离子聚合物组合物可包含一种或多种阴离子氨基酸聚合物。例如,在一些情况下,主题阴离子聚合物组合物包含选自以下的聚合物:聚(谷氨酸)(PEA),聚(天冬氨酸)(PDA),及其组合。在一些情况下,给定的阴离子氨基酸聚合物可包含天冬氨酸和谷氨酸残基(residues)的混合。每种聚合物可作为L-异构体或D-异构体的聚合物存在于组合物中,其中D-异构体在靶细胞中更稳定,因为其需要更长的时间降解。因此,在纳米颗粒核中包含D-异构体聚(氨基酸)延迟了核的降解以及随后的有效负载释放。因此,有效负载释放速率可以被控制并且与D-异构体的聚合物与L-异构体的聚合物的比率成比例,其中更高的D-异构体与L-异构体的比率增加了有效负载释放的持续时间(即,降低释放速率)。换句话说,D-和L-异构体的相对量可以调节纳米颗粒核的定时的释放动力学以及对降解和有效负载释放的酶促敏感性。
在一些情况下,主题纳米颗粒的阴离子聚合物组合物包含阴离子氨基酸聚合物(例如,聚(谷氨酸)(PEA)和聚(天冬氨酸)(PDA))的D-异构体的聚合物和L-异构体的聚合物。在一些情况下,D-与L-异构体的比率在10∶1-1∶10的范围内(例如,8∶1-1∶10,6∶1-1∶10,4∶1-1∶10,3∶1-1∶10,2∶1-1∶10,1∶1-1∶10,10∶1-1∶8,8∶1-1∶8,6∶1-1∶8,4∶1-1∶8,3∶1-1∶8,2∶1-1:8,1∶1-1∶8,10∶1-1∶6,8∶1-1∶6,6∶1-1∶6,4∶1-1∶6,3∶1-1∶6,2∶1-1∶6,1∶1-1∶6,10∶1-1∶4,8∶1-1∶4,6∶1-1∶4,4∶1-1∶4,3∶1-1∶4,2∶1-1∶4,1∶1-1∶4,10∶1-1∶3,8∶1-1∶3,6∶1-1∶3,4∶1-1∶3,3∶1-1∶3,2∶1-1∶3,1∶1-1∶3,10∶1-1∶2,8∶1-1∶2,6∶1-1∶2,4∶1-1∶2,3∶1-1∶2,2∶1-1∶2,1∶1-1∶2,10∶1-1∶1,8∶1-1∶1,6∶1-1∶1;4∶1-1∶1,3∶1-1∶1,或2∶1-1∶1)。
因此,在一些情况下,阴离子聚合物组合物包含第一阴离子聚合物(例如,氨基酸聚合物),该第一阴离子聚合物是D-异构体的聚合物(例如,选自聚(D-谷氨酸)(PDEA)和聚(D-天冬氨酸)(PDDA));并且包含第二阴离子聚合物(例如,氨基酸聚合物),该第二阴离子聚合物是L-异构体的聚合物(例如,选自聚(L-谷氨酸)(PLEA)和聚(L-天冬氨酸)(PLDA))。在一些情况下,第一阴离子聚合物(D-异构体)与第二阴离子聚合物(L-异构体)的比率在10∶1-1∶10的范围内(例如,8∶1-1∶10,6∶1-1∶10,4∶1-1∶10,3∶1-1∶10,2∶1-1∶10,1∶1-1∶10,10∶1-1∶8,8∶1-1∶8,6∶1-1∶8,4∶1-1∶8,3∶1-1∶8,2∶1-1∶8,1∶1-1∶8,10∶1-1∶6,8∶1-1∶6,6∶1-1∶6,4∶1-1∶6,3∶1-1∶6,2∶1-1∶6,1∶1-1∶6,10∶1-1∶4,8∶1-1∶4,6∶1-1∶4,4∶1-1∶4,3∶1-1∶4,2∶1-1∶4,1∶1-1∶4,10∶1-1∶3,8∶1-1∶3,6∶1-1∶3,4∶1-1∶3,3∶1-1∶3,2∶1-1∶3,1∶1-1∶3,10∶1-1∶2,8∶1-1∶2,6∶1-1∶2,4∶1-1∶2,3∶1-1∶2,2∶1-1∶2,1∶1-1∶2,10∶1-1∶1,8∶1-1∶1,6∶1-1∶1,4∶1-1∶1,3∶1-1∶1,或2∶1-1∶1)。
在一些实施例中,主题纳米颗粒的核的阴离子聚合物组合物包含(例如,除了或代替阴离子聚合物的任何前述示例)糖胺聚糖,糖蛋白,多糖,聚(甘露糖醛酸),聚(古洛糖醛酸),肝素,硫酸肝素,软骨素,硫酸软骨素,角质素,硫酸角质素,聚集蛋白聚糖,聚(葡糖胺),或包含其任何组合的阴离子聚合物。
在一些实施例中,核内的阴离子聚合物可具有范围为1-200kDa(例如,1-150,1-100,1-50,5-200,5-150,5-100,5-50,10-200,10-150,10-100,10-50,15-200,15-150,15-100,或15-50kDa)的分子量。作为示例,在一些情况下,阴离子聚合物包含分子量约为15kDa的聚(谷氨酸)。
在一些情况下,阴离子氨基酸聚合物包含半胱氨酸残基,其可以促进例如,与接头,NLS,和/或阳离子多肽(例如,组蛋白或HTP)的缀合。例如,半胱氨酸残基可被用于通过巯基化学(例如,二硫键)和/或胺反应性化学进行交联(缀合)。因此,在一些实施例中,阴离子聚合物组合物的阴离子氨基酸聚合物(例如,聚(谷氨酸)(PEA),聚(天冬氨酸)(PDA),聚(D-谷氨酸)(PDEA),聚(D-天冬氨酸)(PDDA),聚(L-谷氨酸)(PLEA),聚(L-天冬氨酸)(PLDA))包含半胱氨酸残基。在一些情况下,阴离子氨基酸聚合物在N-和/或C-末端包含半胱氨酸残基。在一些情况下,阴离子氨基酸聚合物包含内部的半胱氨酸残基。
在一些情况下,阴离子氨基酸聚合物包含(和/或缀合至)细胞核定位信号(NLS)(下面更详细地描述)。因此,在一些实施例中,阴离子聚合物组合物的阴离子氨基酸聚合物(例如,聚(谷氨酸)(PEA),聚(天冬氨酸)(PDA),聚(D-谷氨酸)(PDEA),聚(D-天冬氨酸)(PDDA),聚(L-谷氨酸)(PLEA),聚(L-天冬氨酸)(PLDA))包含(和/或缀合至)一种或多种(例如,两种或更多,三种或更多,或四种或更多)NLS。在一些情况下,阴离子氨基酸聚合物在N-和/或C-末端包含NLS。在一些情况下,阴离子氨基酸聚合物包含内部的NLS。
在一些情况下,当产生主题纳米颗粒核时,在阳离子聚合物之前添加阴离子聚合物。
阳离子聚合物组合物可包含一种或多种阳离子氨基酸聚合物。例如,在一些情况下,主题阳离子聚合物组合物包含选自以下的聚合物:聚(精氨酸)(PR),聚(赖氨酸)(PK),聚(组氨酸)(PH),聚(鸟氨酸),聚(瓜氨酸),及其组合。在一些情况下,给定的阳离子氨基酸聚合物可包含精氨酸,赖氨酸,组氨酸,鸟氨酸,和瓜氨酸残基的混合(以任何方便的组合)。每种聚合物可作为L-异构体或D-异构体的聚合物存在于组合物中,其中D-异构体在靶细胞中更稳定,因为其需要更长的时间降解。因此,在纳米颗粒核中包含D-异构体聚(氨基酸)延迟了核的降解以及随后的有效负载释放。因此,有效负载释放速率可以被控制并且与D-异构体的聚合物与L-异构体的聚合物的比率成比例,其中更高的D-异构体与L-异构体的比率增加有效负载释放的持续时间(即,降低释放速率)。换句话说,D-和L-异构体的相对量可以调节纳米颗粒核的定时的释放动力学以及对降解和有效负载释放的酶促敏感性。
在一些情况下,主题纳米颗粒的阳离子聚合物组合物包含阳离子氨基酸聚合物(例如,聚(精氨酸)(PR),聚(赖氨酸)(PK),聚(组氨酸)(PH),聚(鸟氨酸),聚(瓜氨酸))的D-异构体的聚合物和L-异构体的聚合物。在一些情况下,D-与L-异构体的比率在10∶1-1∶10的范围内(例如,8∶1-1∶10,6∶1-1∶10,4∶1-1∶10,3∶1-1∶10,2∶1-1∶10,1∶1-1∶10,10∶1-1∶8,8∶1-1∶8,6∶1-1∶8,4∶1-1∶8,3∶1-1∶8,2∶1-1∶8,1∶1-1∶8,10∶1-1∶6,8∶1-1∶6,6∶1-1∶6,4∶1-1∶6,3∶1-1∶6,2∶1-1∶6,1∶1-1∶6,10∶1-1∶4,8∶1-1∶4,6∶1-1∶4,4∶1-1∶4,3∶1-1∶4,2∶1-1∶4,1∶1-1∶4,10∶1-1∶3,8∶1-1∶3,6∶1-1∶3,4∶1-1∶3,3∶1-1∶3,2∶1-1∶3,1∶1-1∶3,10∶1-1∶2,8∶1-1∶2,6∶1-1∶2,4∶1-1∶2,3∶1-1∶2,2∶1-1∶2,1∶1-1∶2,10∶1-1∶1,8∶1-1∶1,6∶1-1∶1;4∶1-1∶1,3∶1-1∶1,或2∶1-1∶1)。
因此,在一些情况下,阳离子聚合物组合物包含第一阳离子聚合物(例如,氨基酸聚合物),该第一阳离子聚合物是D-异构体的聚合物(例如,选自聚(D-精氨酸),聚(D-赖氨酸),聚(D-组氨酸),聚(D-鸟氨酸),和聚(D-瓜氨酸));并且包含第二阳离子聚合物(例如,氨基酸聚合物),该第二阳离子聚合物是L-异构体的聚合物(例如,选自聚(L-精氨酸),聚(L-赖氨酸),聚(L-组氨酸),聚(L-鸟氨酸),和聚(L-瓜氨酸))。在一些情况下,第一阳离子聚合物(D-异构体)与第二阳离子聚合物(L-异构体)的比率在10∶1-1∶10的范围内(例如,8∶1-1∶10,6∶1-1∶10,4∶1-1∶10,3∶1-1∶10,2∶1-1∶10,1∶1-1∶10,10∶1-1∶8,8∶1-1∶8,6∶1-1∶8,4∶1-1∶8,3∶1-1∶8,2∶1-1∶8,1∶1-1∶8,10∶1-1∶6,8∶1-1∶6,6∶1-1∶6,4∶1-1∶6,3∶1-1∶6,2∶1-1∶6,1∶1-1∶6,10∶1-1∶4,8∶1-1∶4,6∶1-1∶4,4∶1-1∶4,3∶1-1∶4,2∶1-1∶4,1∶1-1∶4,10∶1-1∶3,8∶1-1∶3,6∶1-1∶3,4∶1-1∶3,3∶1-1∶3,2∶1-1∶3,1∶1-1∶3,10∶1-1∶2,8∶1-1∶2,6∶1-1∶2,4∶1-1∶2,3∶1-1∶2,2∶1-1∶2,1∶1-1∶2,10∶1-1∶1,8∶1-1∶1,6∶1-1∶1,4∶1-1∶1,3∶1-1∶1,或2∶1-1∶1)。
在一些实施例中,主题纳米颗粒的核的阳离子聚合物组合物包含(例如,除了或代替阳离子聚合物的任何前述示例)聚(乙烯亚胺),聚(酰胺基胺)(PAMAM),聚(天冬酰胺),类多肽(polypeptoids)(例如,用于形成用于核聚集的“蜘蛛网”状分支),电荷功能化的聚酯,阳离子多糖,乙酰化的氨基糖,壳聚糖,或包含其任何组合的阳离子聚合物(例如,以线性的或分支状(branched)形式)。
在一些实施例中,核内的阳离子聚合物可具有范围为1-200kDa(例如,1-150,1-100,1-50,5-200,5-150,5-100,5-50,10-200,10-150,10-100,10-50,15-200,15-150,15-100,或15-50kDa)的分子量。作为一个示例,在一些情况下,阳离子聚合物包含例如,分子量约为29kDa的聚(L-精氨酸)。作为另一示例,在一些情况下,阳离子聚合物包含分子量约为25kDa(PEI)的线性聚(乙烯亚胺)。作为另一示例,在一些情况下,阳离子聚合物包含分子量约为10kDa的分支状聚(乙烯亚胺)。作为另一示例,在一些情况下,阳离子聚合物包含分子量为约70kDa的分支状聚(乙烯亚胺)。在一些情况下,阳离子聚合物包含PAMAM。
在一些情况下,阳离子氨基酸聚合物包含半胱氨酸残基,其可以促进例如,与接头,NLS,和/或阳离子多肽(例如,组蛋白或HTP)的缀合。例如,半胱氨酸残基可被用于通过巯基化学(例如,二硫键)和/或胺反应性化学进行交联(缀合)。因此,在一些实施例中,阳离子聚合物组合物的阳离子氨基酸聚合物(例如,聚(精氨酸)(PR),聚(赖氨酸)(PK),聚(组氨酸)(PH),聚(鸟氨酸),和聚(瓜氨酸),聚(D-精氨酸)(PDR),聚(D-赖氨酸)(PDK),聚(D-组氨酸)(PDH),聚(D-鸟氨酸),和聚(D-瓜氨酸),聚(L-精氨酸)(PLR),聚(L-赖氨酸)(PLK),聚(L-组氨酸)(PLH),聚(L-鸟氨酸),和聚(L-瓜氨酸))包含半胱氨酸残基。在一些情况下,阳离子氨基酸聚合物在N-和/或C-末端包含半胱氨酸残基。在一些情况下,阳离子氨基酸聚合物包含内部的半胱氨酸残基。
在一些情况下,阳离子聚合物组合物的阳离子氨基酸聚合物包含(和/或缀合至)细胞核定位信号(NLS)(下面更详细地描述)。因此,在一些实施例中,阳离子聚合物组合物的阳离子氨基酸聚合物(例如,聚(精氨酸)(PR),聚(赖氨酸)(PK),聚(组氨酸)(PH),聚(鸟氨酸),和聚(瓜氨酸),聚(D-精氨酸)(PDR),聚(D-赖氨酸)(PDK),聚(D-组氨酸)(PDH),聚(D-鸟氨酸),和聚(D-瓜氨酸),聚(L-精氨酸)(PLR),聚(L-赖氨酸)(PLK),聚(L-组氨酸)(PLH),聚(L-鸟氨酸),和聚(L-瓜氨酸))包含(和/或缀合至)一种或多种(例如,两种或更多,三种或更多,或四种或更多)NLS。在一些情况下,阳离子氨基酸聚合物在N-和/或C-末端包含NLS。在一些情况下,阳离子氨基酸聚合物包含内部的NLS。
在一些实施例中,纳米颗粒的阳离子多肽组合物可介导稳定性,亚细胞的区室化,和/或有效负载释放。作为一个示例,主题纳米颗粒核内的组蛋白的N-末端片段,通常称为组蛋白尾肽,在一些情况下不仅能够通过多种组蛋白修饰去质子化(如在组蛋白乙酰转移酶介导的乙酰化的情况下),而且可以介导纳米颗粒核的组分(例如,有效负载)的有效的细胞核特异性解包装(unpackaging)。在一些情况下,阳离子多肽组合物包含组蛋白和/或组蛋白尾肽(例如,阳离子多肽可以是组蛋白和/或组蛋白尾肽)。在一些情况下,阳离子多肽组合物包括含NLS的肽(例如,阳离子多肽可以是含NLS的肽)。在一些情况下,阳离子多肽组合物包含被半胱氨酸残基分隔以促进交联的一种或多种含NLS的肽。在一些情况下,阳离子多肽组合物包括肽,该肽包括线粒体定位信号(例如,阳离子多肽可以是包含线粒体定位信号的肽)。
在一些实施例中,主题纳米颗粒包括包围(包裹)核的可脱落层(在本文中也称为“瞬态稳定层”)。在一些情况下,主题可脱落层可以在初始的细胞摄取之前和期间保护有效负载。例如,没有可脱落层,许多有效负载会在细胞的内化(internalization)期间损失。一旦处于细胞的环境,可脱落层“脱落”(例如,该层可能对pH-和/或谷胱甘肽敏感),从而暴露核的组分。
在一些情况下,主题可脱落层包括二氧化硅。在一些情况下,当主题纳米颗粒包括可脱落层(例如,二氧化硅的可脱落层)时,尽管降低了细胞摄取的可能性,但仍可观察到更高的细胞内的递送效率。不希望受到任何特定理论的束缚,用可脱落层(例如,二氧化硅涂层)包覆纳米颗粒核可以密封核,使其稳定直至层脱落,这导致有效负载的释放(例如,在预期的亚细胞的区室中进行处理)。通过受体介导的内吞作用进入细胞后,纳米颗粒脱落其最外层,可脱落层在内体的酸化环境或胞质溶胶的还原环境中降解,并暴露核,在一些情况下暴露定位信号(如细胞核定位信号(NLS)和/或线粒体定位信号)。此外,被可脱落层包裹的纳米颗粒核可以在血清中稳定并且可以适合于体内施用。
可以使用任何需要的可脱落层,并且本领域普通技术人员可以考虑他们需要在靶细胞(例如,在何种条件(如低pH)下)中何处(例如,内体,胞质溶胶,细胞核,溶酶体等)释放有效负载。取决于何时,何处,和/或在何种条件下想要可脱落涂层脱落(并且因此释放有效负载),可能更需要不同的可脱落层。例如,可脱落层可能是酸不稳定的。在一些情况下,可脱落层是阴离子可脱落层(阴离子涂层)。在一些情况下,可脱落层包含二氧化硅,类肽,聚半胱氨酸,和/或陶瓷(例如,生物陶瓷)。在一些情况下,可脱落[层]包含以下一种或多种:钙,锰,镁,铁(例如,可脱落层可能是磁性的,例如Fe
在一些情况下,需要不同有效负载的不同释放时间。例如,在一些情况下,需要尽早释放有效负载(例如,在接触靶细胞的0.5-7天内),并且在一些情况下,需要延迟释放有效负载(例如,在接触靶细胞的6天-30天内)。例如,在一些情况下,可能需要在接触靶细胞的0.5-7天内(例如,在接触靶细胞的0.5-5天,0.5-3天,1-7天,1-5天,或1-3天内)释放有效负载(例如,基因编辑工具(如CRISPR/Cas向导RNA,编码所述CRISPR/Cas向导RNA的DNA分子,CRISPR/Cas RNA-向导的多肽,和/或编码所述CRISPR/Cas RNA-向导的多肽的核酸分子))。在一些情况下,可能需要在接触靶细胞的6-40天内(例如,在接触靶细胞的6-30,6-20,6-15,7-40,7-30,7-20,7-15,9-40,9-30,9-20,或9-15天内)释放有效负载(例如,供体DNA分子)。在一些情况下,可以通过在不同时间递送具有不同有效负载的纳米颗粒来控制释放时间。在一些情况下,可以通过在同一时间递送纳米颗粒(作为不同制剂的一部分或作为同一制剂的一部分)来控制释放时间,其中纳米颗粒的组分被设计为实现需要的释放时间。例如,可以使用降解更快或更慢的可脱落层,或多或少抗降解的核组分,或多或少易于去聚集(de-condensation)的核组分等-以及任何或所有组分都可以用任何方便的组合进行选择以实现需要的定时。
在一些情况下,需要相对于另一有效负载(例如,一种或多种基因编辑工具)延迟一有效负载(例如,供体DNA分子)的释放。作为示例,在一些情况下,第一纳米颗粒包括供体DNA分子,因为有效负载被设计为使得该有效负载在接触靶细胞的6-40天内(例如,在接触靶细胞的6-30,6-20,6-15,7-40,7-30,7-20,7-15,9-40,9-30,9-20,或9-15天内)释放,而第二纳米颗粒包括一种或多种基因编辑工具(例如,ZFP或编码ZFP的核酸,TALE或编码TALE的核酸,ZFN或编码ZFN的核酸,TALEN或编码TALEN的核酸,CRISPR/Cas向导RNA或编码CRISPR/Cas向导RNA的DNA分子,CRISPR/Cas RNA-向导的多肽或编码CRISPR/Cas RNA-向导的多肽的核酸分子等),因为有效负载被设计为使得该有效负载在接触靶细胞的0.5-7天内(例如,在接触靶细胞的0.5-5天,0.5-3天,1-7天,1-5天,或1-3天内)释放。第二纳米颗粒可以是与第一纳米颗粒同一制剂或不同制剂的一部分。
在一些情况下,纳米颗粒包括多于一种有效负载,其中想要有效负载在不同的时间释放。这可以通过许多不同的方式实现。例如,纳米颗粒可以具有多于一个核,其中一个核由可以尽早(例如,在接触靶细胞的0.5-7天内,例如,在接触靶细胞的0.5-5天,0.5-3天,1-7天,1-5天,或1-3天内)释放有效负载(例如,siRNA,mRNA,和/或基因组编辑工具(如ZFP或编码ZFP的核酸,TALE或编码TALE的核酸,ZFN或编码ZFN的核酸,TALEN或编码TALEN的核酸,CRISPR/Cas向导RNA或编码CRISPR/Cas向导RNA的DNA分子,CRISPR/Cas RNA-向导的多肽或编码CRISPR/Cas RNA-向导的多肽的核酸分子等))的组分制成,并且另一个核由可以稍晚(例如,在接触靶细胞的6-40天内,例如,在接触靶细胞的6-30,6-20,6-15,7-40,7-30,7-20,7-15,9-40,9-30,9-20,或9-15天内)释放有效负载(例如,供体DNA分子)的组分制成。
作为另一示例,纳米颗粒可以包括多于一个可脱落层,其中在内部可脱落层脱落(释放另一有效负载)之前,外部可脱落层脱落(释放一有效负载)。在一些情况下,内部有效负载是供体DNA分子,并且外部有效负载是一种或多种基因编辑工具(例如,ZFN或编码ZFN的核酸,TALEN或编码TALEN的核酸,CRISPR/Cas向导RNA或编码CRISPR/Cas向导RNA的DNA分子,CRISPR/Cas RNA-向导的多肽或编码CRISPR/Cas RNA-向导的多肽的核酸分子等)。内部和外部有效负载可以是任何想要的有效负载,并且一种或两种可以包括例如,一种或多种siRNA,和/或一种或多种mRNA。照此,在一些情况下,纳米颗粒可具有多于一个可脱落层,并且可被设计为尽早(例如,在接触靶细胞的0.5-7天内,例如,在接触靶细胞的0.5-5天,0.5-3天,1-7天,1-5天,或1-3天内)释放一种有效负载(例如,siRNA,mRNA,基因组编辑工具(如ZFP或编码ZFP的核酸,TALE或编码TALE的核酸,ZFN或编码ZFN的核酸,TALEN或编码TALEN的核酸,CRISPR/Cas向导RNA或编码CRISPR/Cas向导RNA的DNA分子,CRISPR/Cas RNA-向导的多肽或编码CRISPR/Cas RNA-向导的多肽的核酸分子等)),而稍晚(例如,在接触靶细胞的6-40天内,例如,在接触靶细胞的6-30,6-20,6-15,7-40,7-30,7-20,7-15,9-40,9-30,9-20,或9-15天内)释放另一有效负载(例如,siRNA,mRNA,供体DNA分子)。
在一些实施例中(例如,在如上所述的实施例中),被改变的基因表达的时间可被用作有效负载释放的时间的代理(proxy)。作为说明性示例,如果想要确定到第12天有效负载是否已经被释放,则可以在第12天测定纳米颗粒递送的想要的结果。例如,如果想要的结果是例如,通过递送siRNA来减少靶细胞的靶基因的表达,则可以测定/监测靶基因的表达以确定siRNA是否已经被释放。作为另一示例,如果想要的结果是例如,通过递送编码感兴趣的蛋白的DNA或mRNA来表达感兴趣的蛋白,则可以测定/监测感兴趣的蛋白的表达以确定有效负载是否已经被释放。作为又一示例,如果想要的结果是例如,通过剪切基因组DNA和/或插入供体DNA分子的序列来改变靶细胞的基因组,则可以测定/监测则来自被靶向的基因座的表达和/或基因组改变的存在以确定有效负载是否已经被释放。
照此,在一些情况下,可脱落层提供纳米颗粒组分的阶段性释放。例如,在一些情况下,纳米颗粒具有多于一个(例如,两个,三个,或四个)可脱落层。例如,对于具有两个可脱落层的纳米颗粒,此类纳米颗粒从最内到最外可具有:核,例如,具有第一有效负载;第一可脱落层,中间层,例如,具有第二有效负载;和包围中间层的第二可脱落层(参见,例如,图4)。此类构型(多个可脱落层)便于多种想要的有效负载的阶段性释放。作为进一步的说明性示例,具有两个可脱落层的纳米颗粒(如上所述)可以在核中包含一种或多种想要的基因编辑工具(例如,以下一种或多种:供体DNA分子,CRISPR/Cas向导RNA,编码CRISPR/Cas向导RNA的DNA等),以及中间层中另一种想要的基因编辑工具(例如,以下一种或多种:可编程基因编辑蛋白(如CRISPR/Cas蛋白,ZFP,ZFN,TALE,TALEN等;编码可编程基因编辑蛋白的DNA或RNA;CRISPR/Cas向导RNA;编码CRISPR/Cas向导RNA的DNA等)-以任何想要的组合。
在一些实施例中,主题核(例如,包括如上所述的组分和/或构型的任何组合)是基于脂质的递送系统(例如,阳离子脂质递送系统)的一部分(参见,例如,Chesnoy和Huang,《生物物理学与生物分子结构年评(Annu Rev Biophys Biomol Struct)》2000,29:27-47;Hirko等,《当代药物化学(Curr Med Chem)》2003年7月10日;(14):1185-93;和Liu等,《当代药物化学》2003年7月10日;(14):1307-15)。在一些情况下,主题核(例如,包括如上所述的组分和/或构型的任何组合)没有被可脱落层包围。如上所述,核可能包括阴离子聚合物组合物(例如,聚(谷氨酸)),阳离子聚合物组合物(例如,聚(精氨酸)),阳离子多肽组合物(例如,组蛋白尾肽),和有效负载(例如,核酸和/或蛋白有效负载)。
在一些情况下,其中核为基于脂质的递送系统的一部分,该核被设计时考虑到定时和/或定位的(positional)(例如,环境特异性)释放。例如,在一些情况下,核包括ESP,ENP,和/或EPP,并且在一些此类情况下,这些组分成比率存在,使得有效负载释放延迟至核(例如,如上所述)遇到想要的条件(例如,细胞的位置,细胞的条件(如pH,特定酶的存在等))。在一些此类实施例中,核包括阴离子氨基酸的D-异构体的聚合物和阴离子氨基酸的L-异构体的聚合物,并且在一些情况下,D-和L-异构体的聚合物相对于彼此,在特定比率的范围内(例如,如上所述)存在。在一些情况下,核包括阳离子氨基酸的D-异构体的聚合物和阳离子氨基酸的L-异构体的聚合物,并且在一些情况下,D-和L-异构体的聚合物相对于彼此,在特定比率的范围内(例如,如上所述)存在。在一些情况下,核包括阴离子氨基酸的D-异构体的聚合物和阳离子氨基酸的L-异构体的聚合物,并且在一些情况下,D-和L-异构体的聚合物相对于彼此,在特定比率的范围内(例如,如上所述)存在。在一些情况下,核包括阴离子氨基酸的L-异构体的聚合物和阳离子氨基酸的D-异构体的聚合物,并且在一些情况下,D-和L-异构体的聚合物相对于彼此,在特定比率的范围内(例如,在本文其他地方所述)存在。在一些情况下,核包括包含NLS(例如,在本文其他地方所述)的蛋白。在一些情况下,核包括HTP(例如,在本文其他地方所述)。
阳离子脂质是非病毒载体,可被用于基因递送并具有聚集(condense)质粒DNA的能力。在合成用于脂质转染(lipofection)的N-[1-(2,3-二油氧基)丙基]-N,N,N-三甲基氯化铵之后,改善阳离子脂质的分子结构已成为活跃领域(active area),包括头部基团,接头,和疏水结构域修饰。修饰包括使用多价多胺,其可以通过增强的表面电荷密度来改善DNA结合和递送,以及使用基于甾醇的疏水性基团,如3B-[N-(N’,N’-二甲基氨基乙烷)-氨基甲酰基]胆固醇,其可以限制毒性。辅助脂质(如二油酰基磷脂酰乙醇胺(DOPE))可被用于通过增强的脂质体疏水性和六方倒相(hexagonal inverted-phase)转变来改善转基因表达以促进内体逃逸。在一些情况下,脂质制剂包括以下一种或多种:DLin-DMA,DLin-K-DMA,DLin-KC2-DMA,DLin-MC3-DMA,98N 12-5,C12-200,胆固醇,PEG-脂质,脂多胺(lipidopolyamine),地塞米松-精胺(DS),和双取代的精胺(D
多种基于脂质的递送系统的示例包括但不限于,以下出版物中描述的那些:国际专利公开号WO2016081029;美国专利申请公开号US20160263047和US20160237455;和美国专利号9,533,047;9,504,747;9,504,651;9,486,538;9,393,200;9,326,940;9,315,828;和9,308,267;全部通过引用整体并入本文。
照此,在一些情况下,主题核被脂质(例如,阳离子脂质(如LIPOFECTAMINE转染试剂))包围。在一些情况下,主题核存在于脂质制剂(例如,脂质纳米颗粒制剂)中。脂质制剂可以包括脂质体和/或脂质复合物(lipoplex)。脂质制剂可以包括由乙醇稀释形成的自发性囊泡(SNALP)脂质体(例如,包含阳离子脂质以及可以被聚乙二醇(PEG)和/或鱼精蛋白包覆的中性辅助脂质的脂质体)。
脂质制剂可以是基于类脂质(lipidoid)的制剂。类脂质的合成已被广泛描述并且含有这些化合物的制剂可被包含在主题脂质制剂中(参见,例如,Mahon等,《生物共轭化学(Bioconjug Chem)》201021:1448-1454;Schroeder等,《内科学杂志(J Intern Med)》2010267:9-21;Akinc等,《自然生物技术》200826:561-569;Love等,《美国科学院院报》2010107:1864-1869;和Siegwart等,《美国科学院院报》2011108:12996-3001;全部通过引用整体并入本文)。在一些情况下,主题脂质制剂可以包含以下一种或多种(以任何想要的组合):1,2-二油酰基-sn-丙三基-3-磷脂酰胆碱(DOPC);1,2-二油酰基-sn-丙三基-3-磷脂酰乙醇胺(DOPE);N-[1-(2,3-二油氧基)丙基]-N,N,N-三甲基氯化铵(DOTMA);1,2-二油酰氧基-3-三甲基铵-丙烷(DOTAP);双十八烷基酰胺基甘氨酰精胺(DOGS);N-(3-氨基丙基)-N,N-二甲基-2,3-双(十二烷氧基)-1(GAP-DLRIE);溴丙铵;十六烷基三甲基溴化铵(CTAB);6-月桂基己鸟氨酸(LHON);1-(2,3-二油酰氧基丙基)-2,4,6-三甲基吡啶(2Oc);2,3-二油氧基-N-[2(精胺甲酰氨基-乙基)-N,N-二甲基-1(DOSPA);三氟乙酸丙铵;1,2-二油烯基-3-三甲基铵-丙烷(DOPA);N-(2-羟乙基)-N,N-二甲基-2,3-双(十四烷氧基)-1(MDRIE);溴丙铵;二肉豆蔻氧基丙基二甲基羟乙基溴化铵(DMRI);3β-[N-(N’,N’-二甲基氨基乙烷)-氨基甲酰基]胆固醇DC-Chol;双胍-tren-胆固醇(BGTC);1,3-二脱氧-2-(6-羧基-精)-丙酰胺(DOSPER);二甲基十八烷基溴化铵(DDAB);双十八烷基酰胺基甘氨酰亚精胺(DSL);rac-[(2,3-双十八烷氧基丙基)(2-羟乙基)]-二甲基铵(CLIP-1);氯化rac-[2(2,3-双十六烷氧基丙基(CLIP-6);氧基甲氧基)乙基]三甲基溴化铵;乙基二肉豆蔻酰磷脂酰胆碱(EDMPC);1,2-二硬脂酰氧基-N,N-二甲基-3-氨基丙烷(DSDMA);1,2-二肉豆蔻酰基-三甲基铵丙烷(DMTAP);O,O’-二肉豆蔻基-N-赖氨酰天冬氨酸(DMKE);1,2-二硬脂酰基-sn-丙三基-3-乙基磷酸胆碱(DSEPC);N-棕榈酰基D-赤型-鞘氨醇氨基甲酰-精胺(CCS);N-叔丁基-N0-十四烷基-3-十四烷基氨基丙脒;双C14脒;十八烯氧基[乙基-2-十七烯基-3-羟乙基]咪唑啉(DOTIM);氯化N1-胆甾醇基氧基羰基-3,7-二氮杂壬烷-1,9-二胺(CDAN);2-[3-[双(3-氨基丙基)氨基]丙基氨基]-N-[2-[二(十四烷基)氨基]-2-氧代乙基]乙酰胺(RPR209120);双十四烷基氨基甲酰甲-乙基-乙酰胺;1,2-二亚油氧基-3-二甲基氨基丙烷(DLinDMA);2,2-二亚油基-4-二甲基氨基乙基-[1,3]-二氧戊环;DLin-KC2-DMA;二亚油基-甲基-4-二甲氨基丁酸酯;DLin-MC3-DMA;DLin-K-DMA;98N12-5;C12-200;胆固醇;PEG-脂质;脂多胺;地塞米松-精胺(DS);和双取代的精胺(D
在一些情况下,可脱落层(涂层)本身被附加层包覆,在本文中被称为“外壳”,“外部涂层”,或“表面涂层”。表面涂层可以起到多种不同的作用。例如,表面涂层可以提高递送效率和/或可以将主题纳米颗粒靶向特定的细胞类型。表面涂层可以包括肽,聚合物,或配体-聚合物缀合物。表面涂层可以包括靶向配体。例如,可以将一种或多种靶向配体(含有或不含有接头结构域)的水溶液添加至被包覆的纳米颗粒悬浮液(被可脱落层包覆的的纳米颗粒的悬浮液)。例如,在一些情况下,(锚定结构域的)被质子化的锚定残基的最终浓度在25至300μM之间。在一些情况下,添加表面涂层的过程产生颗粒的单分散的悬浮液,其平均粒径在50和150nm之间并且ζ电位在0和-10mV之间。
在一些情况下,表面涂层与最外部的可脱落层静电地相互作用。例如,在一些情况下,纳米颗粒具有两个可脱落层(例如,从最内到最外:核,例如,具有第一有效负载;第一可脱落层,中间层,例如,具有第二有效负载;和包围中间层的第二可脱落层);并且外壳(表面涂层)可以与第二可脱落层相互作用(例如,静电地)。在一些情况下,纳米颗粒仅具有一个可脱落层(例如,阴离子二氧化硅层),并且外壳在一些情况下可以与可脱落层静电地相互作用。
因此,在可脱落层(例如,最外部的可脱落层)是阴离子的情况下(例如,在可脱落层是二氧化硅涂层的一些情况下),如果表面涂层包含阳离子组分,则表面涂层可以与可脱落层静电地相互作用。例如,在一些情况下,表面涂层包括递送分子,其中靶向配体与阳离子锚定结构域缀合。阳离子锚定结构域与可脱落层静电地相互作用,并将递送分子锚定至纳米颗粒。类似地,在可脱落层(例如,最外部的可脱落层)是阳离子的情况下,如果表面涂层包含阴离子组分,则表面涂层可以与可脱落层静电地相互作用。
在一些实施例中,表面涂层包括细胞穿透肽(CPP)。在一些情况下,阳离子氨基酸的聚合物可以充当CPP(也称为“蛋白转导结构域”-PTD),这是用于指代促进穿过脂质双层,胶束,细胞膜,细胞器膜,或囊泡膜的多肽,多核苷酸,碳水化合物,或有机或无机化合物的术语。与另一分子附着的PTD(例如,嵌入主题纳米颗粒的可脱落层和/或与可脱落层相互作用),其范围从小极性分子至大分子和/或纳米颗粒,促进分子穿过膜,例如,从细胞外空间进入细胞内空间,或从胞质溶胶进入细胞器(例如,细胞核)内。
CPP的示例包括但不限于最小的十一肽蛋白转导结构域(对应于包含YGRKKRRQRRR(SEQ ID NO:160)的HIV-1TAT的残基47-57;包含足以引导进入细胞的多个精氨酸(例如,3,4,5,6,7,8,9,10,或10-50个精氨酸)的聚精氨酸序列;VP22结构域(Zender等(2002)《癌症基因疗法(Cancer Gene Ther)》9(6):489-96);果蝇属触角足蛋白转导结构域(Noguchi等(2003)《糖尿病(Diabetes)》52(7):1732-1737);被截短的人降钙素肽(Trehin等(2004)《药学研究(Pharm.Research)》21:1248-1256);1256);聚赖氨酸(Wender等(2000)《美国科学院院报》97:13003-13008);RRQRRTSKLMKR(SEQ ID NO:161);TransportanGWTLNSAGYLLGKINLKALAALAKKIL(SEQ ID NO:162);KALAWEAKLAKALAKALAKHLAKALAKALKCEA(SEQ ID NO:163);和RQIKIWFQNRRMKWKK(SEQ ID NO:164)。示例CPP包括但不限于:YGRKKRRQRRR(SEQ ID NO:160),RKKRRQRRR(SEQ ID NO:165),3个精氨酸残基至50个精氨酸残基的精氨酸均聚物,RKKRRQRR(SEQ ID NO:166),YARAAARQARA(SEQ ID NO:167),THRLPRRRRRR(SEQ ID NO:168),和GGRRARRRRRR(SEQ ID NO:169)。在一些实施例中,CPP是可激活的CPP(ACPP)(Aguilera等(2009)《整合生物学(Integr Biol(Camb))》6月;1(5-6):371-381)。ACPP包含通过可剪切的接头与匹配的聚阴离子(例如,Glu9或“E9”)连接的聚阳离子CPP(例如Arg9或“R9”),其将净电荷降低至接近零,从而抑制粘附和摄入细胞。在剪切接头后,聚阴离子被释放,局部地暴露聚精氨酸及其固有的粘附性,从而“激活”ACPP以穿过膜。
在一些情况下,可以通过使被包覆的核(被可脱落层包围的核)与包含CPP的组合物(例如,溶液)接触来将CPP添加至纳米颗粒。然后,CPP可以与可脱落层相互作用(例如,静电地)。
在一些情况下,表面涂层包括阳离子氨基酸的聚合物(例如,聚(精氨酸)(如聚(L-精氨酸)和/或聚(D-精氨酸)),聚(赖氨酸)(如聚(L-赖氨酸)和/或聚(D-赖氨酸)),聚(组氨酸)(如聚(L-组氨酸)和/或聚(D-组氨酸)),聚(鸟氨酸)(如聚(L-鸟氨酸)和/或聚(D-鸟氨酸)),聚(瓜氨酸)(如聚(L-瓜氨酸)和/或聚(D-瓜氨酸)等)。照此,在一些情况下,表面涂层包括聚(精氨酸),例如聚(L-精氨酸)。
在一些实施例中,表面涂层包括七肽,如selank(TKPRPGP-SEQ ID NO:147)(例如,N-乙酰基selank)和/或semax(MEHFPGP-SEQ ID NO:148)(例如,N-乙酰基semax)。照此,在一些情况下,表面涂层包括selank(例如,N-乙酰基selank)。在一些情况下,表面涂层包括semax(例如,N-乙酰基semax)。
在一些实施例中,表面涂层包括递送分子。递送分子包括靶向配体,并且在一些情况下,靶向配体与锚定结构域(例如,阳离子锚定结构域或阴离子锚定结构域)缀合。在一些情况下,靶向配体通过插入其中的(intervening)接头与锚定结构域(例如,阳离子锚定结构域或阴离子锚定结构域)缀合。
在一些情况下,表面涂层包含以下任何一种或多种(以任何想要的组合):(i)一种或多种上述聚合物,(ii)一种或多种靶向配体,一种或多种CPP,和一种或多种七肽。例如,在一些情况下,表面涂层可包含一种或多种(例如,两种或更多种,三种或更多种)靶向配体,但是也可包含一种或多种上述阳离子聚合物。在一些情况下,表面涂层可包含一种或多种(例如,两种或更多种,三种或更多种)靶向配体,但是也可包含一种或多种CPP。此外,表面涂层可包括糖肽的任何组合以促进隐形(stealth)功能,即防止血清蛋白吸附和补体(complement)活性。这可以通过叠氮化物-炔烃点击(click)化学实现,将含有炔丙基修饰的残基的肽与含有唾液酸,神经氨酸等的衍生物的叠氮化物偶联。
在一些情况下,表面涂层包括提供与CD34和硫酸肝素蛋白聚糖的靶向结合的靶向配体的组合。例如,聚(L-精氨酸)可被用作表面涂层的一部分以提供与硫酸肝素蛋白聚糖的靶向结合。照此,在一些情况下,在用阳离子聚合物(例如,聚(L-精氨酸))将纳米颗粒表面包覆之后,将被包覆的纳米颗粒与透明质酸一起孵育,从而形成两性离子和多价表面。
在一些实施例中,表面涂层是多价的。多价表面涂层是包括两种或更多种靶向配体(例如,包括不同配体的两种或更多种递送分子)的多价表面涂层。多聚体(在这种情况下为三聚体)表面涂层(外壳)的示例是包含靶向配体干细胞因子(SCF)(其靶向c-Kit受体,也称为CD117),CD70(其靶向CD27),和含SH2结构域的蛋白1A(SH2D1A)(其靶向CD150)的多聚体表面涂层。例如,在一些情况下,为靶向造血干细胞(HSC)[KLS(c-Kit
在一些示例实施例中,所有三种靶向配体(SCF,CD70,和SH2D1A)通过与阳离子锚定结构域(例如,聚-组氨酸(如6H),聚-精氨酸(如9R)等)融合而锚定至纳米颗粒。例如,(1)靶向多肽SCF(其靶向c-Kit受体)可以包含
其中X是阳离子锚定结构域(例如,聚-组氨酸(如6H),聚-精氨酸(如9R)等),例如,X在一些情况下可以存在于N-和/或C-末端,或可以嵌入多肽序列内;和(3)靶向多肽SH2D1A(其靶向CD150)可以包含
如上所述,本公开的纳米颗粒可包括多种靶向配体(作为表面涂层的一部分)以靶向想要的细胞类型,或靶向想要的细胞类型的组合。图8(小图A-B)描述了小鼠和人造血细胞谱系内的感兴趣的细胞的示例,以及已经针对那些细胞进行了鉴定的标志物。例如,感兴趣的细胞表面标志物的多种组合包括但不限于:[小鼠](i)CD150;(ii)Sca1,cKit,CD150;(iii)CD150和CD49b;(iv)Sca1,cKit,CD150,和CD49b;(v)CD150和Flt3;(vi)Sca1,cKit,CD150,和Flt3;(vii)Flt3和CD34;(viii)Flt3,CD34,Sca1,和cKit;(ix)Flt3和CD127;(x)Sca1,cKit,Flt3,和CD127;(xi)CD34;(xii)cKit和CD34;(xiii)CD16/32和CD34;(xiv)cKit,CD16/32,和CD34;和(xv)cKit;以及[人](i)CD90和CD49f;(ii)CD34,CD90,和CD49f;(iii)CD34;(iv)CD45RA和CD10;(v)CD34,CD45RA,和CD10;(vi)CD45RA和CD135;(vii)CD34,CD38,CD45RA,和CD135;(viii)CD135;(ix)CD34,CD38,和CD135;和(x)CD34和CD38。因此,在一些情况下,表面涂层包含提供与表面蛋白或表面蛋白的组合的靶向结合的一种或多种靶向配体,该一种或多种靶向配体选自:[小鼠](i)CD150;(ii)Sca1,cKit,CD150;(iii)CD150和CD49b;(iv)Sca1,cKit,CD150,和CD49b;(v)CD150和Flt3;(vi)Sca1,cKit,CD150,和Flt3;(vii)Flt3和CD34;(viii)Flt3,CD34,Sca1,和cKit;(ix)Flt3和CD127;(x)Sca1,cKit,Flt3,和CD127;(xi)CD34;(xii)cKit和CD34;(xiii)CD16/32和CD34;(xiv)cKit,CD16/32,和CD34;和(xv)cKit;以及[人](i)CD90和CD49f;(ii)CD34,CD90,和CD49f;(iii)CD34;(iv)CD45RA和CD10;(v)CD34,CD45RA,和CD10;(vi)CD45RA和CD135;(vii)CD34,CD38,CD45RA,和CD135;(viii)CD135;(ix)CD34,CD38,和CD135;和(x)CD34和CD38。因为主题纳米颗粒可包含多于一种靶向配体,并且因为一些细胞包含重叠的标志物,所以可以使用表面涂层的组合靶向多种不同的细胞类型,例如,在一些情况下,表面涂层可靶向一种特定的细胞类型,而在其他情况下,表面涂层可靶向多于一种特定细胞类型(例如,2种或更多种,3种或更多种,4种或更多种细胞类型)。例如,可以靶向造血谱系内的任何细胞的组合。作为说明性示例,靶向CD34(使用提供与CD34靶向结合的靶向配体)可导致纳米颗粒将有效负载递送至造血谱系内的几个不同的细胞(参见,例如,图8,小图A和B)。
所提供的是包括与(i)蛋白或核酸有效负载,或(ii)带电荷的聚合物多肽结构域缀合的靶向配体(肽)的递送分子。靶向配体提供(i)与细胞表面蛋白的靶向结合,并且在一些情况下(ii)长内体的再循环途径的参与(engagement)。在一些情况下,当靶向配体与带电荷的聚合物多肽结构域缀合时,该带电荷的聚合物多肽结构域与核酸有效负载和/或蛋白有效负载相互作用(例如,与其聚集)。在一些情况下,靶向配体通过插入其中的接头进行缀合。关于不同可能的缀合策略(即,主题递送分子的组分的不同可能的布置)的示例参照图6。在一些情况下,靶向配体提供与细胞表面蛋白的靶向结合,但不一定提供长内体的再循环途径的参与。因此,所提供的还有递送分子,该递送分子包括与蛋白或核酸有效负载缀合,或与带电荷的聚合物多肽结构域缀合的靶向配体(例如,肽靶向配体),其中靶向配体提供与细胞表面蛋白的靶向结合(但不一定提供长内体的循环途径的参与)。
在一些情况下,本文公开的递送分子被设计为使得核酸或蛋白有效负载到达其细胞外的靶标(例如,通过提供与细胞表面蛋白的靶向结合),并且优选地不在溶酶体内被破坏或被螯合(sequestered)至“短”内体的再循环内体中。相反,本公开的递送分子可以提供“长”(间接/缓慢)内体的再循环途径的参与,其可以允许内体逃逸和/或与细胞器的内体融合。
例如,在一些情况下,β-抑制蛋白(β-arrestin)参与介导七-跨膜GPCR的剪切(McGovern等,《实验药理学手册(Handb Exp Pharmacol)》2014;219:341-59;Goodman等,《自然》1996年10月3日;383(6599):447-50;Zhang等,《生物化学杂志》1997年10月24日;272(43):27005-14)和/或肌动蛋白细胞骨架的单跨膜受体酪氨酸激酶(RTK)的剪切(例如,在内吞作用期间),触发想要的内体分选途径。因此,在一些实施例中,本公开的递送分子的靶向配体在结合至细胞表面蛋白时提供β-抑制蛋白的参与(例如,以提供信号传导偏差并且通过正构(orthosteric)结合后的内吞作用促进内化)。
在一些情况下,靶向配体(例如,主题递送分子)与带电荷的聚合物多肽结构域(锚定结构域,如阳离子锚定结构域或阴离子锚定结构域)缀合(参见,例如,图5和图6)。带电荷的聚合物多肽结构域可以包括重复的残基(例如,阳离子残基(如精氨酸,赖氨酸,组氨酸))。在一些情况下,带电荷的聚合物多肽结构域(锚定结构域)具有在3至30个氨基酸(例如,3-28,3-25,3-24,3-20,4-30,4-28,4-25,4-24,或4-20个氨基酸;或例如,4-15,4-12,5-30,5-28,5-25,5-20,5-15,5-12个氨基酸)的范围内的长度。在一些情况下,带电荷的聚合物多肽结构域(锚定结构域)具有在4至24个氨基酸的范围内的长度。在一些情况下,带电荷的聚合物多肽结构域(锚定结构域)具有在5至10个氨基酸的范围内的长度。带电荷的聚合物多肽结构域的合适的示例包括但不限于:RRRRRRRRR(9R)(SEQ ID NO:15)和HHHHHH(6H)(SEQ ID NO:16)。
带电荷的聚合物多肽结构域(阳离子锚定结构域,阴离子锚定结构域)可能是任何方便的带电荷的结构域(例如,阳离子带电荷的结构域)。例如,此类结构域可能是组蛋白尾肽(HTP)(在本文其他地方更详细地描述)。在一些情况下,带电荷的聚合物多肽结构域包括组蛋白和/或组蛋白尾肽(例如,阳离子多肽可能是组蛋白和/或组蛋白尾肽)。在一些情况下,带电荷的聚合物多肽结构域包括含NLS的肽(例如,阳离子多肽可能是含NLS的肽)。在一些情况下,带电荷的聚合物多肽结构域包括肽,该肽包括线粒体定位信号(例如,阳离子多肽可能是包括线粒体定位信号的肽)。
在一些情况下,主题递送分子的带电荷的聚合物多肽结构域被用作递送分子与有效负载(例如,核酸有效负载和/或蛋白有效负载)相互作用(例如,静电地相互作用,例如用于聚集)的方式。
在一些情况下,主题递送分子的带电荷的聚合物多肽结构域被用作锚以用递送分子包覆纳米颗粒的表面,例如,以便于靶向配体被用于将纳米颗粒靶向想要的细胞/细胞表面蛋白(参见,例如,图5)。因此,在一些情况下,带电荷的聚合物多肽结构域与纳米颗粒的带电荷的稳定层静电地相互作用。例如,在一些情况下,纳米颗粒包括被稳定层(例如,二氧化硅,类肽,聚半胱氨酸,或磷酸钙涂层)包围的核(例如,包括核酸,蛋白,和/或核糖核蛋白复合物有效负载)。在一些情况下,稳定层具有负电荷,并且带正电荷的聚合物多肽结构域可以因此与稳定层相互作用,从而有效地将递送分子锚定至纳米颗粒并用主题靶向配体包覆纳米颗粒表面(参见,例如,图5)。在一些情况下,稳定层具有正电荷,并且带负电荷的聚合物多肽结构域可以因此与稳定层相互作用,从而有效地将递送分子锚定至纳米颗粒并用主题靶向配体包覆纳米颗粒表面。可以通过任何方便的技术实现缀合,并且许多不同的缀合化学将是本领域普通技术人员已知的。在一些情况下,缀合通过巯基化学(例如,二硫键)。在一些情况下,使用胺反应性化学实现缀合。在一些情况下,靶向配体和带电荷的聚合物多肽结构域由于是同一多肽的一部分而缀合。
在一些情况下,带电荷的聚合物多肽结构域(阳离子)可包含聚合物,该聚合物选自:聚(精氨酸)(PR),聚(赖氨酸)(PK),聚(组氨酸)(PH),聚(鸟氨酸),聚(瓜氨酸),及其组合。在一些情况下,给定的阳离子氨基酸聚合物可包含精氨酸,赖氨酸,组氨酸,鸟氨酸,和瓜氨酸残基的混合(以任何方便的组合)。聚合物可作为L-异构体或D-异构体的聚合物存在,其中D-异构体在靶细胞中更稳定,因为其需要更长的时间降解。因此,包含D-异构体聚(氨基酸)延迟了降解(以及随后的有效负载释放)。因此,有效负载释放速率可以被控制并且与D-异构体的聚合物与L-异构体的聚合物的比率成比例,其中更高的D-异构体与L-异构体的比率增加了有效负载释放的持续时间(即,降低释放速率)。换句话说,D-和L-异构体的相对量可以调节释放动力学以及对降解和有效负载释放的酶促敏感性。
在一些情况下,阳离子聚合物包含阳离子氨基酸聚合物(例如,聚(精氨酸)(PR),聚(赖氨酸)(PK),聚(组氨酸)(PH),聚(鸟氨酸),聚(瓜氨酸))的D-异构体和L-异构体。在一些情况下,D-与L-异构体的比率在10∶1-1∶10的范围内(例如,8∶1-1∶10,6∶1-1∶10,4∶1-1∶10,3∶1-1∶10,2∶1-1∶10,1∶1-1∶10,10∶1-1∶8,8∶1-1∶8,6∶1-1∶8,4∶1-1∶8,3∶1-1∶8,2∶1-1∶8,1∶1-1∶8,10∶1-1∶6,8∶1-1∶6,6∶1-1∶6,4∶1-1∶6,3∶1-1∶6,2∶1-1∶6,1∶1-1∶6,10∶1-1∶4,8∶1-1∶4,6∶1-1∶4,4∶1-1∶4,3∶1-1∶4,2∶1-1∶4,1∶1-1∶4,10∶1-1∶3,8∶1-1∶3,6∶1-1∶3,4∶1-1∶3,3∶1-1∶3,2∶1-1∶3,1∶1-1∶3,10∶1-1∶2,8∶1-1∶2,6∶1-1∶2,4∶1-1∶2,3∶1-1∶2,2∶1-1∶2,1∶1-1∶2,10∶1-1∶1,8∶1-1∶1,6∶1-1∶1;4∶1-1∶1,3∶1-1∶1,或2∶1-1∶1)。
因此,在一些情况下,阳离子聚合物包含第一阳离子聚合物(例如,氨基酸聚合物),该第一阳离子聚合物是D-异构体的聚合物(例如,选自聚(D-精氨酸),聚(D-赖氨酸),聚(D-组氨酸),聚(D-鸟氨酸),和聚(D-瓜氨酸));并且包含第二阳离子聚合物(例如,氨基酸聚合物),该第二阳离子聚合物是L-异构体的聚合物(例如,选自聚(L-精氨酸),聚(L-赖氨酸),聚(L-组氨酸),聚(L-鸟氨酸),和聚(L-瓜氨酸))。在一些情况下,第一阳离子聚合物(D-异构体)与第二阳离子聚合物(L-异构体)的比率在10∶1-1∶10的范围内(例如,8∶1-1∶10,6∶1-1∶10,4∶1-1∶10,3∶1-1∶10,2∶1-1∶10,1∶1-1∶10,10∶1-1∶8,8∶1-1∶8,6∶1-1∶8,4∶1-1∶8,3∶1-1∶8,2∶1-1∶8,1∶1-1∶8,10∶1-1∶6,8∶1-1∶6,6∶1-1∶6,4∶1-1∶6,3∶1-1∶6,2∶1-1∶6,1∶1-1∶6,10∶1-1∶4,8∶1-1∶4,6∶1-1∶4,4∶1-1∶4,3∶1-1∶4,2∶1-1∶4,1∶1-1∶4,10∶1-1∶3,8∶1-1∶3,6∶1-1∶3,4∶1-1∶3,3∶1-1∶3,2∶1-1∶3,1∶1-1∶3,10∶1-1∶2,8∶1-1∶2,6∶1-1∶2,4∶1-1∶2,3∶1-1∶2,2∶1-1∶2,1∶1-1∶2,10∶1-1∶1,8∶1-1∶1,6∶1-1∶1,4∶1-1∶1,3∶1-1∶1,或2∶1-1∶1)。
在一些实施例中,阳离子聚合物包含(例如,除了或代替阳离子聚合物的任何前述示例)聚(乙烯亚胺),聚(酰胺基胺)(PAMAM),聚(天冬酰胺),类多肽(例如,用于形成用于核聚集的“蜘蛛网”状分支),电荷功能化的聚酯,阳离子多糖,乙酰化的氨基糖,壳聚糖,或包含其任何组合的阳离子聚合物(例如,以线性的或分支状形式)。
在一些实施例中,阳离子聚合物可具有范围为1-200kDa(例如,1-150,1-100,1-50,5-200,5-150,5-100,5-50,10-200,10-150,10-100,10-50,15-200,15-150,15-100,或15-50kDa)的分子量。作为一个示例,在一些情况下,阳离子聚合物包含例如,分子量约为29kDa的聚(L-精氨酸)。作为另一示例,在一些情况下,阳离子聚合物包含分子量约为25kDa(PEI)的线性聚(乙烯亚胺)。作为另一示例,在一些情况下,阳离子聚合物包含分子量约为10kDa的分支状聚(乙烯亚胺)。作为另一示例,在一些情况下,阳离子聚合物包含分子量为约70kDa的分支状聚(乙烯亚胺)。在一些情况下,阳离子聚合物包含PAMAM。
在一些情况下,阳离子氨基酸聚合物包含半胱氨酸残基,其可以促进例如,与接头,NLS,和/或阳离子多肽(例如,组蛋白或HTP)的缀合。例如,半胱氨酸残基可被用于通过巯基化学(例如,二硫键)和/或胺反应性化学进行交联(缀合)。因此,在一些实施例中,阳离子聚合物组合物的阳离子氨基酸聚合物(例如,聚(精氨酸)(PR),聚(赖氨酸)(PK),聚(组氨酸)(PH),聚(鸟氨酸),和聚(瓜氨酸),聚(D-精氨酸)(PDR),聚(D-赖氨酸)(PDK),聚(D-组氨酸)(PDH),聚(D-鸟氨酸),和聚(D-瓜氨酸),聚(L-精氨酸)(PLR),聚(L-赖氨酸)(PLK),聚(L-组氨酸)(PLH),聚(L-鸟氨酸),和聚(L-瓜氨酸))包含半胱氨酸残基。在一些情况下,阳离子氨基酸聚合物在N-和/或C-末端包含半胱氨酸残基。在一些情况下,阳离子氨基酸聚合物包含内部的半胱氨酸残基。
在一些情况下,阳离子氨基酸聚合物包含(和/或缀合至)细胞核定位信号(NLS)(下面更详细地描述)。因此,在一些实施例中,阳离子氨基酸聚合物(例如,聚(精氨酸)(PR),聚(赖氨酸)(PK),聚(组氨酸)(PH),聚(鸟氨酸),和聚(瓜氨酸),聚(D-精氨酸)(PDR),聚(D-赖氨酸)(PDK),聚(D-组氨酸)(PDH),聚(D-鸟氨酸),和聚(D-瓜氨酸),聚(L-精氨酸)(PLR),聚(L-赖氨酸)(PLK),聚(L-组氨酸)(PLH),聚(L-鸟氨酸),和聚(L-瓜氨酸))包含一种或多种(例如,两种或更多,三种或更多,或四种或更多)NLS。在一些情况下,阳离子氨基酸聚合物在N-和/或C-末端包含NLS。在一些情况下,阳离子氨基酸聚合物包含内部的NLS。
在一些情况下,带电荷的聚合物多肽结构域与核酸有效负载和/或蛋白有效负载聚集(参见,例如,图6)。在一些情况下,带电荷的聚合物多肽结构域与蛋白有效负载静电地相互作用。在一些情况下,带电荷的聚合物多肽结构域与二氧化硅,盐,和/或阴离子聚合物共聚集以提供更多的内体缓冲能力,稳定性,和例如任选的定时释放。在一些情况下,主题递送分子的带电荷的聚合物多肽结构域是例如,长度为约4-25个氨基酸或长度为约4-15个氨基酸中的一段重复的阳离子残基(例如精氨酸,赖氨酸,和/或组氨酸)。此类结构域可允许递送分子与阴离子可脱落基质(例如,共聚集的阴离子聚合物)静电地相互作用。因此,在一些情况下,主题递送分子的主题带电荷的聚合物多肽结构域是与阴离子可脱落基质和与核酸和/或蛋白有效负载相互作用(例如,静电地)的一段重复的阳离子残基。因此,在一些情况下,主题递送分子与有效负载(例如,核酸和/或蛋白)相互作用,并且与阴离子聚合物作为组合物的一部分存在(例如,与有效负载和阴离子聚合物共聚集)。
阴离子可脱落基质的阴离子聚合物(即,与主题递送分子的带电荷的聚合物多肽结构域相互作用的阴离子聚合物)可能是任何方便的阴离子聚合物/聚合物组合物。示例包括但不限于:聚(谷氨酸)(例如,聚(D-谷氨酸)(PDE),聚(L-谷氨酸)(PLE),多种想要的比例的PDE和PLE等)。在一些情况下,PDE被用作阴离子可脱落基质。在一些情况下,PLE被用作阴离子可脱落基质(阴离子聚合物)。在一些情况下,PDE被用作阴离子可脱落基质(阴离子聚合物)。在一些情况下,PLE和PDE均被用作阴离子可脱落基质(阴离子聚合物),例如,以1∶1的比率(50%PDE,50%PLE)。
阴离子聚合物
阴离子聚合物可包含一种或多种阴离子氨基酸聚合物。例如,在一些情况下,主题阴离子聚合物组合物包含选自以下的聚合物:聚(谷氨酸)(PEA),聚(天冬氨酸(PDA)),及其组合。在一些情况下,给定的阴离子氨基酸聚合物可包含天冬氨酸和谷氨酸残基的混合。每种聚合物可作为L-异构体或D-异构体的聚合物存在于组合物中,其中D-异构体在靶细胞中更稳定,因为其需要更长的时间降解。因此,包含D-异构体聚(氨基酸)可延迟核的降解以及随后的有效负载释放。因此,有效负载释放速率可以被控制并且与D-异构体的聚合物与L-异构体的聚合物的比率成比例,其中更高的D-异构体与L-异构体的比率增加了有效负载释放的持续时间(即,降低释放速率)。换句话说,D-和L-异构体的相对量可以调节纳米颗粒核的定时的释放动力学以及对降解和有效负载释放的酶促敏感性。
在一些情况下,阴离子聚合物组合物包含阴离子氨基酸聚合物(例如,聚(谷氨酸)(PEA)和聚(天冬氨酸)(PDA))的D-异构体的聚合物和L-异构体的聚合物。在一些情况下,D-与L-异构体的比率在10∶1-1∶10的范围内(例如,8∶1-1∶10,6∶1-1∶10,4∶1-1∶10,3∶1-1∶10,2∶1-1∶10,1∶1-1∶10,10∶1-1∶8,8∶1-1∶8,6∶1-1∶8,4∶1-1∶8,3∶1-1∶8,2∶1-1∶8,1∶1-1∶8,10∶1-1∶6,8∶1-1∶6,6∶1-1∶6,4∶1-1∶6,3∶1-1∶6,2∶1-1∶6,1∶1-1∶6,10∶1-1∶4,8∶1-1∶4,6∶1-1∶4,4∶1-1∶4,3∶1-1∶4,2∶1-1∶4,1∶1-1∶4,10∶1-1∶3,8∶1-1∶3,6∶1-1∶3,4∶1-1∶3,3∶1-1∶3,2∶1-1∶3,1∶1-1∶3,10∶1-1∶2,8∶1-1∶2,6∶1-1∶2,4∶1-1∶2,3∶1-1∶2,2∶1-1∶2,1∶1-1∶2,10∶1-1∶1,8∶1-1∶1,6∶1-1∶1;4∶1-1∶1,3∶1-1∶1,或2∶1-1∶1)。
因此,在一些情况下,阴离子聚合物组合物包含第一阴离子聚合物(例如,氨基酸聚合物),该第一阴离子聚合物是D-异构体的聚合物(例如,选自聚(D-谷氨酸)(PDEA)和聚(D-天冬氨酸)(PDDA));并且包含第二阴离子聚合物(例如,氨基酸聚合物),该第二阴离子聚合物是L-异构体的聚合物(例如,选自聚(L-谷氨酸)(PLEA)和聚(L-天冬氨酸)(PLDA))。在一些情况下,第一阴离子聚合物(D-异构体)与第二阴离子聚合物(L-异构体)的比率在10∶1-1∶10的范围内(例如,8∶1-1∶10,6∶1-1∶10,4∶1-1∶10,3∶1-1∶10,2∶1-1∶10,1∶1-1∶10,10∶1-1∶8,8∶1-1∶8,6∶1-1∶8,4∶1-1∶8,3∶1-1∶8,2∶1-1∶8,1∶1-1∶8,10∶1-1∶6,8∶1-1∶6,6∶1-1∶6,4∶1-1∶6,3∶1-1∶6,2∶1-1∶6,1∶1-1∶6,10∶1-1∶4,8∶1-1∶4,6∶1-1∶4,4∶1-1∶4,3∶1-1∶4,2∶1-1∶4,1∶1-1∶4,10∶1-1∶3,8∶1-1∶3,6∶1-1∶3,4∶1-1∶3,3∶1-1∶3,2∶1-1∶3,1∶1-1∶3,10∶1-1∶2,8∶1-1∶2,6∶1-1∶2,4∶1-1∶2,3∶1-1∶2,2∶1-1∶2,1∶1-1∶2,10∶1-1∶1,8∶1-1∶1,6∶1-1∶1,4∶1-1∶1,3∶1-1∶1,或2∶1-1∶1)。
在一些实施例中,阴离子聚合物组合物包含(例如,除了或代替阴离子聚合物的任何前述示例)糖胺聚糖,糖蛋白,多糖,聚(甘露糖醛酸),聚(古洛糖醛酸),肝素,硫酸肝素,软骨素,硫酸软骨素,角质素,硫酸角质素,聚集蛋白聚糖,聚(葡糖胺),或包含其任何组合的阴离子聚合物。
在一些实施例中,阴离子聚合物可具有范围为1-200kDa(例如,1-150,1-100,1-50,5-200,5-150,5-100,5-50,10-200,10-150,10-100,10-50,15-200,15-150,15-100,或15-50kDa)的分子量。作为示例,在一些情况下,阴离子聚合物包含分子量约为15kDa的聚(谷氨酸)。
在一些情况下,阴离子氨基酸聚合物包含半胱氨酸残基,其可以促进例如,与接头,NLS,和/或阳离子多肽(例如,组蛋白或HTP)的缀合。例如,半胱氨酸残基可被用于通过巯基化学(例如,二硫键)和/或胺反应性化学进行交联(缀合)。因此,在一些实施例中,阴离子聚合物组合物的阴离子氨基酸聚合物(例如,聚(谷氨酸)(PEA),聚(天冬氨酸)(PDA),聚(D-谷氨酸)(PDEA),聚(D-天冬氨酸)(PDDA),聚(L-谷氨酸)(PLEA),聚(L-天冬氨酸)(PLDA))包含半胱氨酸残基。在一些情况下,阴离子氨基酸聚合物在N-和/或C-末端包含半胱氨酸残基。在一些情况下,阴离子氨基酸聚合物包含内部的半胱氨酸残基。
在一些情况下,阴离子氨基酸聚合物包含(和/或缀合至)细胞核定位信号(NLS)(下面更详细地描述)。因此,在一些实施例中,阴离子聚合物组合物的阴离子氨基酸聚合物(例如,聚(谷氨酸)(PEA),聚(天冬氨酸)(PDA),聚(D-谷氨酸)(PDEA),聚(D-天冬氨酸)(PDDA),聚(L-谷氨酸)(PLEA),聚(L-天冬氨酸)(PLDA))包含(和/或缀合至)一种或多种(例如,两种或更多,三种或更多,或四种或更多)NLS。在一些情况下,阴离子氨基酸聚合物在N-和/或C-末端包含NLS。在一些情况下,阴离子氨基酸聚合物包含内部的NLS。
在一些情况下,阴离子聚合物与靶向配体缀合。
在一些实施例中,靶向配体通过插入其中的接头与锚定结构域(例如,阳离子锚定结构域,阴离子锚定结构域)或有效负载缀合。接头可以是蛋白接头或非蛋白接头。在一些情况下,接头可以有助于稳定性,防止补体激活,和/或相对于锚定结构域为配体提供柔性。
靶向配体与接头的缀合或接头与锚定结构域的缀合可以用多种不同的方式实现。在一些情况下,缀合通过巯基化学(例如,二硫键,例如,在两个半胱氨酸残基之间)。在一些情况下,使用胺反应性化学实现缀合。在一些情况下,靶向配体包括半胱氨酸残基并且通过半胱氨酸残基与接头缀合;和/或锚定结构域包括半胱氨酸残基并且通过半胱氨酸残基与接头缀合。在一些情况下,接头是肽接头并且包括半胱氨酸残基。在一些情况下,靶向配体和肽接头由于是同一多肽的一部分而缀合;和/或锚定结构域和肽接头由于是同一多肽的一部分而缀合。
在一些情况下,主题接头是多肽并且可以被称为多肽接头。应理解,尽管考虑了多肽接头,但是在一些情况下使用非多肽接头(化学接头)。例如,在一些实施例中,接头是聚乙二醇(PEG)接头。合适的蛋白接头包括长度在4个氨基酸和60个氨基酸之间(例如,长度为4-50,4-40,4-30,4-25,4-20,4-15,4-10,6-60,6-50,6-40,6-30,6-25,6-20,6-15,6-10,8-60,8-50,8-40,8-30,8-25、8-20,或8-15个氨基酸)的多肽。
在一些实施例中,主题接头是刚性的(例如,包含一个或多个脯氨酸残基的接头)。刚性接头的一个非限制性示例是GAPGAPGAP(SEQ ID NO:17)。在一些情况下,多肽接头在N-或C-末端包含C残基。因此,在一些情况下,刚性接头选自:GAPGAPGAPC(SEQ ID NO:18)和CGAPGAPGAP(SEQ ID NO:19)。
可以使用具有一定程度柔性的肽接头。因此,在一些情况下,主题接头是柔性的。连接肽实际上可具有任何氨基酸序列,因此(bearing in mind)柔性的接头将具有导致一般柔性肽的序列。小氨基酸(如甘氨酸和丙氨酸)的使用可用于产生柔性肽。此类序列的产生对于本领域技术人员而言是常规的。多种不同的接头可商购并且被认为适合于使用。示例接头多肽包括甘氨酸聚合物(G)
在一些情况下,主题多肽接头是内溶的(endosomolytic)。内溶的多肽接头包括但不限于:KALA(SEQ ID NO:35)和GALA(SEQ ID NO:36)。如上所述,在一些情况下,多肽接头在N-或C-末端包含C残基。因此,在一些情况下,主题接头包含选自以下的氨基酸序列:CKALA(SEQ ID NO:37),KALAC(SEQ ID NO:38),CGALA(SEQ ID NO:39),和GALAC(SEQ IDNO:40)。
巯基偶联反应的说明性示例
(例如,用于通过巯基化学的缀合,例如,使用半胱氨酸残基)
(例如,用于将靶向配体或糖肽缀合至接头,将靶向配体或糖肽缀合至锚定结构域(例如,阳离子锚定结构域),将接头缀合至锚定结构域(例如,阳离子锚定结构域)等)
二硫键
在典型的二硫化物交换反应中,处于还原状态的包含游离巯基的半胱氨酸残基容易与受保护的硫醇形成二硫键。
硫醚/硫酯键
半胱氨酸的巯基与马来酰亚胺和酰卤基团反应,分别形成稳定的硫醚键和硫酯键。
马来酰亚胺
酰卤
叠氮化物-炔烃环加成
通过对半胱氨酸残基进行化学修饰以使其包含炔键,或通过在合成肽制
备(例如,固相合成)中使用L-炔丙基氨基酸衍生物(例如,L-炔丙基半胱氨酸,如下图所示)促进缀合。然后借助Cu催化的点击化学实现偶联。
靶向配体的示例
靶向配体的示例包括但不限于,包括以下氨基酸序列的那些靶向配体:
因此,靶向配体的非限制性示例(可单独使用或与其他靶向配体组合使用)包括:
递送分子和组分的说明性示例
(0a)半胱氨酸缀合锚1(CCA1)
[锚定结构域(例如,阳离子锚定结构域)-接头(GAPGAPGAP)-半胱氨酸]
(0b)半胱氨酸缀合锚2(CCA2)
[半胱氨酸-接头(GAPGAPGAP)-锚定结构域(例如,阳离子锚定结构域)]
(1a)α5β1配体
[锚定结构域(例如,阳离子锚定结构域)-接头(GAPGAPGAP)-靶向配体]
(1b)α5β1配体
[靶向配体-接头(GAPGAPGAP)-锚定结构域(例如,阳离子锚定结构域)]
(1c)α5β1配体-Cys左
注意:这可以通过巯基化学(例如,二硫键)或胺反应性化学缀合至CCA1(见上)。
(1d)α5β1配体-Cys右
注意:这可以通过巯基化学(例如,二硫键)或胺反应性化学缀合至CCA2(见上)。
(2a)RGD α5β1配体
[锚定结构域(例如,阳离子锚定结构域)-接头(GAPGAPGAP)-靶向配体]
(2b)RGD α5b1配体
[靶向配体-接头(GAPGAPGAP)-锚定结构域(例如,阳离子锚定结构域)]
(2c)RGD配体-Cys左
注意:这可以通过巯基化学(例如,二硫键)或胺反应性化学缀合至CCA1(见上)。
(2d)RGD配体-Cys右
注意:这可以通过巯基化学(例如,二硫键)或胺反应性化学缀合至CCA2(见上)。
(3a)转铁蛋白配体
[锚定结构域(例如,阳离子锚定结构域)-接头(GAPGAPGAP)-靶向配体]
(3b)转铁蛋白配体
[靶向配体-接头(GAPGAPGAP)-锚定结构域(例如,阳离子锚定结构域)]
(3c)转铁蛋白配体-Cys左
注意:这可以通过巯基化学(例如,二硫键)或胺反应性化学缀合至CCA1(见上)。
(3d)转铁蛋白配体-Cys右
注意:这可以通过巯基化学(例如,二硫键)或胺反应性化学缀合至CCA2(见上)。
(4a)E-选择素配体[1-21]
[锚定结构域(例如,阳离子锚定结构域)-接头(GAPGAPGAP)-靶向配体]
(4b)E-选择素配体[1-21]
[靶向配体-接头(GAPGAPGAP)-锚定结构域(例如,阳离子锚定结构域)]
(4c)E-选择素配体[1-21]-Cys左
注意:这可以通过巯基化学(例如,二硫键)或胺反应性化学缀合至CCA1(见上)。
(4d)E-选择素配体[1-21]-Cys右
注意:这可以通过巯基化学(例如,二硫键)或胺反应性化学缀合至CCA2(见上)。
(5a)FGF片段[26-47]
[锚定结构域(例如,阳离子锚定结构域)-接头(GAPGAPGAP)-靶向配体]
注意:这可以通过巯基化学(例如,二硫键)或胺反应性化学缀合至CCA1(见上)。
(5b)FGF片段[26-47]
[靶向配体-接头(GAPGAPGAP)-锚定结构域(例如,阳离子锚定结构域)]
注意:这可以通过巯基化学(例如,二硫键)或胺反应性化学缀合至CCA1(见上)。
(5c)FGF片段[25-47]-左边的Cys是天然的
注意:这可以通过巯基化学(例如,二硫键)或胺反应性化学缀合至CCA1(见上)。
(5d)FGF片段[26-47]-Cys右
注意:这可以通过巯基化学(例如,二硫键)或胺反应性化学缀合至CCA2(见上)。
(6a)毒蜥外泌肽(Exendin)(S11C)[1-39]
注意:这可以通过巯基化学(例如,二硫键)或胺反应性化学缀合至CCA1(见上)。
可以使用多种靶向配体(例如,作为主题递送分子的一部分,例如,作为纳米颗粒的一部分),并且设想了许多不同的靶向配体。在一些实施例中,靶向配体是野生型蛋白的片段(例如,结合结构域)。例如,在一些情况下,主题递送分子的肽靶向配体可具有4-50个氨基酸(例如,4-40,4-35,4-30,4-25,4-20,4-15,5-50,5-40,5-35,5-30,5-25,5-20,5-15,7-50,7-40,7-35,7-30,7-25,7-20,7-15,8-50,8-40,8-35,8-30,8-25,8-20,或8-15个氨基酸)的长度。靶向配体可以是野生型蛋白的片段,但是在一些情况下具有相对于野生型氨基酸序列的突变(例如,插入,缺失,取代)(即,相对于相应的野生型蛋白序列的突变)。例如,靶向配体可以包括增加或降低与靶细胞表面蛋白的结合亲和力的突变。
在一些情况下,靶向配体是抗体的抗原结合区(F(ab))。在一些情况下,靶向配体是ScFv。“Fv”是包含完整的抗原识别和结合位点的最小抗体片段。在两链Fv种类中,此区由紧密,非共价缔合的一个重链和一个轻链可变结构域的二聚体组成。在单链Fv种类(scFv)中,一个重链和一个轻链可变结构域可以通过柔性肽接头共价连接,使得轻链和重链可以用类似于两链Fv种类中的“二聚体”结构缔合。有关scFv的综述,参见Pluckthun,《单克隆抗体药理学(The Pharmacology of Monoclonal Antibodies)》,第113卷,Rosenburg和Moore编辑,Springer-Verlag,纽约,第269-315页(1994)。
在一些情况下,靶向配体包括病毒糖蛋白,该病毒糖蛋白在一些情况下与普遍存在的表面标志物(如硫酸肝素蛋白聚糖)结合,并可通过膜皱褶(ruffling)相关过程在一些细胞群体中诱导微胞饮作用(micropinocytosis)(和/或巨胞饮作用(macropinocytosis))。聚(L-精氨酸)是靶向配体的另一示例,其也可用于结合表面标志物(如硫酸肝素蛋白聚糖)。
在一些情况下,靶向配体静电地或利用对颗粒表面或颗粒表面上的一种或多种聚合物的共价修饰而被包覆在颗粒表面(例如,纳米颗粒表面)上。在一些情况下,靶向配体可以包括添加半胱氨酸残基的突变,其可以促进与接头和/或锚定结构域(例如,阳离子锚定结构域)的缀合。例如,半胱氨酸可被用于通过巯基化学(例如,二硫键)和/或胺反应性化学进行交联(缀合)。
在一些情况下,靶向配体包含内部的半胱氨酸残基。在一些情况下,靶向配体在N-和/或C-末端包含半胱氨酸残基。在一些情况下,为了包含半胱氨酸残基,使靶向配体例如,相对于相应的野生型序列突变(例如,插入或取代)。照此,可通过插入和/或取代半胱氨酸残基(例如,半胱氨酸残基的内部,N-末端,C-末端插入或取代)来修饰本文描述的任何靶向配体。
所谓“相应的”野生型序列是指主题序列所衍生自或可能已经衍生自的野生型序列(例如,与感兴趣的序列具有高度序列同一性的野生型蛋白序列)。在一些情况下,“相应的”野生型序列是在感兴趣的氨基酸序列(stretch)上具有85%或更高的序列同一性(例如,90%或更高,92%或更高,95%或更高,97%或更高,98%或更高,99%或更高,99.5%或更高,或100%序列同一性)。例如,对于具有一个或多个突变(例如,取代,插入)但在其他方面与野生型序列高度相似的靶向配体,与该靶向配体最相似的氨基酸序列可被视为相应的野生型氨基酸序列。
相应的野生型蛋白/序列不必100%相同(例如,可以85%或更多相同,90%或更多相同,95%或更多相同,98%或更多相同,99%或更多相同等)(在被修饰的一个或多个位置外),但靶向配体和相应的野生型蛋白(例如,野生蛋白的片段)可以与预期的细胞表面蛋白结合,并保留足够使他们可被视为同源的序列同一性(被修饰的区域外)。可使用任何方便的方法(例如,使用任何方便的序列比较/比对软件,例如BLAST,MUSCLE,T-COFFEE等)鉴定/评估“相应的”野生型蛋白序列的氨基酸序列。
可被用作表面涂层的一部分(例如,作为表面涂层的递送分子的一部分)的靶向配体的示例包括但不限于,表1中列出的靶向配体。可被用作主题递送分子的一部分的靶向配体的示例包括但不限于,表3中列出的靶向配体(表3中列出的许多序列包括通过接头(例如,GGGGSGGGGS)与阳离子多肽结构域(例如,9R,6R等)缀合的靶向配体(例如,行2的SNRWLDVK)。可被包括在靶向配体中的氨基酸序列的示例包括但不限于:NPKLTRMLTFKFY(SEQ ID NO:xx)(IL2),TSVGKYPNTGYYGD(SEQ ID NO:xx)(CD3),SNRWLDVK(Siglec),EKFILKVRPAFKAV(SEQ ID NO:xx)(SCF);EKFILKVRPAFKAV(SEQ ID NO:xx)(SCF),EKFILKVRPAFKAV(SEQ ID NO:xx)(SCF),SNYSIIDKLVNIVDDLVECVKENS(SEQ ID NO:xx)(cKit),和Ac-SNYSAibADKAibANAibADDAibAEAibAKENS(SEQ ID NO:xx)(cKit)。因此在一些情况下,靶向配体包含与NPKLTRMLTFKFY(SEQ ID NO:xx)(IL2),TSVGKYPNTGYYGD(SEQ IDNO:xx)(CD3),SNRWLDVK(Siglec),EKFILKVRPAFKAV(SEQ ID NO:xx)(SCF);EKFILKVRPAFKAV(SEQ ID NO:xx)(SCF),EKFILKVRPAFKAV(SEQ ID NO:xx)(SCF),或SNYSIIDKLVNIVDDLVECVKENS(SEQ ID NO:xx)(cKit)具有85%或更高(例如,90%或更高,95%或更高,98%或更高,99%或更高,或100%)的序列同一性的氨基酸序列。
表1靶向配体的示例
(例如,递送分子的)靶向配体可包含氨基酸序列RGD和/或与SEQ ID NOs:1-12中任一个所示的氨基酸序列具有85%或更高的序列同一性(例如,90%或更高,95%或更高,97%或更高,98%或更高,99%或更高,99.5%或更高,或100%的序列同一性)的氨基酸序列。在一些情况下,靶向配体包含氨基酸序列RGD和/或SEQ ID NOs:1-12中任一个所示的氨基酸序列。在一些实施例中,靶向配体可包含半胱氨酸(内部的,C端,或N端),并且还可包含氨基酸序列RGD和/或与SEQ ID NOs:1-12中任一个所示的氨基酸序列具有85%或更高的序列同一性(例如,90%或更高,95%或更高,97%或更高,98%或更高,99%或更高,99.5%或更高,或100%的序列同一性)的氨基酸序列。
(例如,递送分子的)靶向配体可包含氨基酸序列RGD和/或与SEQ ID NOs:1-12和181-187中任一个所示的氨基酸序列具有85%或更高的序列同一性(例如,90%或更高,95%或更高,97%或更高,98%或更高,99%或更高,99.5%或更高,或100%的序列同一性)的氨基酸序列。在一些情况下,靶向配体包含氨基酸序列RGD和/或SEQ ID NOs:1-12和181-187中任一个所示的氨基酸序列。在一些实施例中,靶向配体可包含半胱氨酸(内部的,C端,或N端),并且还可包含氨基酸序列RGD和/或与SEQ ID NOs:1-12和181-187中任一个所示的氨基酸序列具有85%或更高的序列同一性(例如,90%或更高,95%或更高,97%或更高,98%或更高,99%或更高,99.5%或更高,或100%的序列同一性)的氨基酸序列。
(例如,递送分子的)靶向配体可包含氨基酸序列RGD和/或与SEQ ID NOs:1-12,181-187,和271-277中任一个所示的氨基酸序列具有85%或更高的序列同一性(例如,90%或更高,95%或更高,97%或更高,98%或更高,99%或更高,99.5%或更高,或100%的序列同一性)的氨基酸序列。在一些情况下,靶向配体包含氨基酸序列RGD和/或SEQ ID NOs:1-12,181-187,和271-277中任一个所示的氨基酸序列。在一些实施例中,靶向配体可包含半胱氨酸(内部的,C端,或N端),并且还可包含氨基酸序列RGD和/或与SEQ ID NOs:1-12,181-187,和271-277中任一个所示的氨基酸序列具有85%或更高的序列同一性(例如,90%或更高,95%或更高,97%或更高,98%或更高,99%或更高,99.5%或更高,或100%的序列同一性)的氨基酸序列。
在一些情况下,(例如,递送分子的)靶向配体可包含与SEQ ID NOs:181-187,和271-277中任一个所示的氨基酸序列具有85%或更高的序列同一性(例如,90%或更高,95%或更高,97%或更高,98%或更高,99%或更高,99.5%或更高,或100%的序列同一性)的氨基酸序列。在一些情况下,靶向配体包含氨基酸SEQ ID NOs:181-187,和271-277中任一个所示的氨基酸序列。在一些实施例中,靶向配体可包含半胱氨酸(内部的,C端,或N端),并且还可包含与SEQ ID NOs:181-187,和271-277中任一个所示的氨基酸序列具有85%或更高的序列同一性(例如,90%或更高,95%或更高,97%或更高,98%或更高,99%或更高,99.5%或更高,或100%的序列同一性)的氨基酸序列。
在一些情况下,(例如,递送分子的)靶向配体可包含与SEQ ID NOs:181-187中任一个所示的氨基酸序列具有85%或更高的序列同一性(例如,90%或更高,95%或更高,97%或更高,98%或更高,99%或更高,99.5%或更高,或100%的序列同一性)的氨基酸序列。在一些情况下,靶向配体包含氨基酸SEQ ID NOs:181-187中任一个所示的氨基酸序列。在一些实施例中,靶向配体可包含半胱氨酸(内部的,C端,或N端),并且还可包含与SEQ IDNOs:181-187中任一个所示的氨基酸序列具有85%或更高的序列同一性(例如,90%或更高,95%或更高,97%或更高,98%或更高,99%或更高,99.5%或更高,或100%的序列同一性)的氨基酸序列。
在一些情况下,(例如,递送分子的)靶向配体可包含与SEQ ID NOs:271-277中任一个所示的氨基酸序列具有85%或更高的序列同一性(例如,90%或更高,95%或更高,97%或更高,98%或更高,99%或更高,99.5%或更高,或100%的序列同一性)的氨基酸序列。在一些情况下,靶向配体包含氨基酸SEQ ID NOs:271-277中任一个所示的氨基酸序列。在一些实施例中,靶向配体可包含半胱氨酸(内部的,C端,或N端),并且还可包含与SEQ IDNOs:271-277中任一个所示的氨基酸序列具有85%或更高的序列同一性(例如,90%或更高,95%或更高,97%或更高,98%或更高,99%或更高,99.5%或更高,或100%的序列同一性)的氨基酸序列。
术语“靶向(targets)”和“靶向结合”在本文中是指特异性结合。术语“特异性结合(specific binding)”,“特异地结合(specifically binds)”等是指相对于溶液或反应混合物中的其他分子或部分的与分子非共价或共价优先结合(例如,相对于其他可用多肽,抗体与特定的多肽或表位(epitope)特异地结合,相对于其他可用受体,配体与特定的受体特异地结合)。在一些实施例中,一个分子对其特异地结合的另一分子的亲和力由10
在一些情况下,靶向配体提供与细胞表面蛋白的靶向结合,该细胞表面蛋白选自B族G蛋白偶联受体(GPCR),受体酪氨酸激酶(RTK),细胞表面糖蛋白,和细胞-细胞粘附分子。在受体对接时对配体的空间布置的考虑可被用于实现想要的功能选择性和内体的分选偏差,例如,便于配体与靶标之间的结构功能关系不会由于靶向配体与有效负载或锚定结构域(例如,阳离子锚定域)的缀合而被破坏。例如,与核酸,蛋白,核糖核蛋白,或锚定结构域(例如,阳离子锚定结构域)的缀合可能潜在地干扰一个或多个结合裂缝(cleft)。
因此,在一些情况下,如果与其配体结合的想要的靶标(细胞表面蛋白)的晶体结构可用(或此类结构可用于相关的蛋白),则可以使用3D结构建模和序列穿线来使配体与靶标之间相互作用的位点可视化。这可以促进例如,内部位点的选择以放置(例如,半胱氨酸残基的)取代和/或插入。
作为示例,在一些情况下,靶向配体提供与B族G蛋白偶联受体(GPCR)(也称为“分泌素家族”)的结合。在一些情况下,靶向配体提供与B族GPCR的变构-亲和结构域和正构结构域的结合以分别地提供靶向结合和长内体的再循环途径的参与。
G蛋白偶联受体(GPCR)具有共同的分子架构(具有七个推定的跨膜区段)和共同的信号传导机制,因为该G蛋白偶联受体与G蛋白(异三聚体GTP酶)相互作用以调节细胞内第二信使(如环AMP,肌醇磷酸酯,二酰基甘油和钙离子)的合成。GPCR的B族(分泌素受体家族或“家族2”)是小的但在结构上和功能上多样化的蛋白组,其包含多肽激素的受体和被认为在质膜处介导细胞间相互作用的分子(参见,例如,Harmar等,《基因组生物学(GenomeBiol)》2001;2(12):REVIEWS3013)。与分泌素受体家族的成员有关的结构生物学已经取得了重要的进展,包括具有或不具有结合配体的其N-末端的几种晶体结构的出版物,这项工作扩展了对配体结合的理解并且为基于结构的配体设计提供了有用的平台(参见,例如,Poyner等,《英国药理学杂志(Br J Pharmacol)》2012年5月;166(1):1-3)。
例如,人们可能想要使用毒蜥外泌肽-4配体,或其衍生物(例如,半胱氨酸取代的毒蜥外泌肽-4靶向配体(如SEQ ID NO:2所示))以使用主题递送分子靶向胰腺细胞表面蛋白GLP1R(例如,靶向β-胰岛)。因为GLP1R在脑和胰腺中很丰富,所以提供与GLP1R的靶向结合的靶向配体可被用于靶向脑和胰腺。因此,靶向GLP1R促进专注于治疗疾病(如亨延顿病(CAG重复扩增突变),帕金森氏病(LRRK2突变),ALS(SOD1突变),和其他CNS疾病)的方法(例如,治疗方法)(例如,通过递送一种或多种基因编辑工具)。靶向GLP1R还促进专注于将有效负载传递至胰腺β-胰岛(pancreatic β-islets)以治疗疾病(如,I型糖尿病,II型糖尿病,和胰腺癌)的方法(例如,治疗方法)(例如,通过递送一种或多种基因编辑工具)。
当使用毒蜥外泌肽-4的被修饰的版本靶向GLP1R时,可以通过使用PDB3维渲染图(renderings)比对毒蜥外泌肽-4氨基酸序列,即HGEGTFTSDLSKQMEEEAVRLFIEWLKNGGPSSGAPPPS(SEQ ID NO.1)与胰高血糖素-GCGR(4ERS)和GLP1-GLP1R-ECD复合物(PDB:3IOL)的晶体结构对半胱氨酸取代和/或插入(例如,用于与核酸有效负载缀合)的氨基酸进行识别,可以在3D空间中旋转该PDB3维渲染图以预测交联的复合物必须面对的方向以免破坏两个结合裂缝。当靶向配体(靶向B族GPCR)的想要的交联位点(例如,半胱氨酸残基的取代/插入的位点)与相应受体的两个结合裂缝充分正交时,高亲和力的结合可能发生并伴随着长的内体再循环途径螯合(例如,用于最佳的有效负载释放)。SEQ ID NO:1的氨基酸位置10,11,和/或12处的半胱氨酸取代赋予Gs偏向性信号级联放大(signaling cascade)的双峰结合和特异性启动,β抑制蛋白的参与,以及与肌动蛋白细胞骨架的受体解离。在一些情况下,这种靶向配体通过受体介导的内吞作用触发纳米颗粒的内化,这种机制仅通过与GPCR的N-末端结构域结合而没有伴随的正构位点参与而无法参与(就像仅结合亲和链,毒蜥外泌肽-4[31-39]的情况一样)。
在一些情况下,主题靶向配体包含与毒蜥外泌肽-4氨基酸序列(SEQ ID NO:1)具有85%或更高(例如,90%或更高,95%或更高,98%或更高,99%或更高,或100%)的同一性的氨基酸序列。在一些此类情况下,靶向配体包含与SEQ ID NO:1中所示的氨基酸序列的L10,S11,和K12相对应的一个或多个位置处的半胱氨酸取代或插入。在一些情况下,靶向配体包含与SEQ ID NO:1中所示的氨基酸序列的S11相对应的位置处的半胱氨酸取代或插入。在一些情况下,主题靶向配体包含具有毒蜥外泌肽-4氨基酸序列(SEQ ID NO:1)的氨基酸序列。在一些情况下,靶向配体与锚定结构域(例如,阳离子锚定结构域)缀合(含有或不含有接头)。
作为另一示例,在一些情况下,根据本公开的靶向配体提供与受体酪氨酸激酶(RTK)(如成纤维细胞生长因子(FGF)受体(FGFR))的结合。因此在一些情况下,靶向配体是FGF的片段(即,包含FGF的氨基酸序列)。在一些情况下,靶向配体与在正构结合期间被占据的RTK的区段结合(例如,参见下面的示例部分)。在一些情况下,靶向配体与RTK的肝素-亲和结构域结合。在一些情况下,靶向配体提供与FGF受体的靶向结合并且包含与氨基酸序列KNGGFFLRIHPDGRVDGVREKS(SEQ ID NO:4)具有85%或更高的序列同一性(例如,90%或更高,95%或更高,97%或更高,98%或更高,99%或更高,99.5%或更高,或100%的序列同一性)的氨基酸序列。在一些情况下,靶向配体提供与FGF受体的靶向结合并且包含SEQ IDNO:4所示的氨基酸序列。
在一些情况下,占据RTK的正构位点的小结构域(例如,长度为5-40个氨基酸)可被用于参与与RTK(例如,FGFR)的细胞核分选有关的内吞作用的(endocytotic)途径,而不参与细胞增殖和原癌基因的(proto-oncogenic)信号级联放大,该小结构域可能是天然生长因子配体所特有的。例如,被截短的bFGF(tbFGF)肽(a.a.30-115),包含bFGF受体结合位点和肝素结合位点的一部分,并且该肽可有效地与细胞表面上的FGFR结合而不刺激细胞增殖。
tbFGF的序列是
在一些情况下,靶向配体提供与FGF受体的靶向结合并且包含氨基酸序列HFKDPK(SEQ ID NO:5)(参见,例如,下面的示例部分)。在一些情况下,靶向配体提供与FGF受体的靶向结合,并且包含氨基酸序列LESNNYNT(SEQ ID NO:6)(参见,例如,下面的示例部分)。
在一些情况下,根据本公开的靶向配体提供与细胞表面糖蛋白的靶向结合。在一些情况下,靶向配体提供与细胞-细胞粘附分子的靶向结合。例如,在一些情况下,靶向配体提供与CD34的靶向结合,CD34是充当细胞-细胞粘附因子的细胞表面糖蛋白,并且是在(例如,骨髓的)造血干细胞上发现的蛋白。在一些情况下,靶向配体是选择素(如E-选择素,L-选择素,或P-选择素)的片段(例如,在选择素的前40个氨基酸中发现的信号肽)。在一些情况下,主题靶向配体包含选择素(例如,E-选择素,L-选择素,P-选择素)的sushi结构域。
在一些情况下,靶向配体包含与氨基酸序列MIASQFLSALTLVLLIKESGA(SEQ ID NO:7)具有85%或更高的序列同一性(例如,90%或更高,95%或更高,97%或更高,98%或更高,99%或更高,99.5%或更高,或100%的序列同一性)的氨基酸序列。在一些情况下,靶向配体包含如SEQ ID NO:7所示的氨基酸序列。在一些情况下,靶向配体包含与氨基酸序列MVFPWRCEGTYWGSRNILKLWVWTLLCCDFLIHHGTHC(SEQ ID NO:8)具有85%或更高的序列同一性(例如,90%或更高,95%或更高,97%或更高,98%或更高,99%或更高,99.5%或更高,或100%的序列同一性)的氨基酸序列。在一些情况下,靶向配体包含如SEQ ID NO:8所示的氨基酸序列。在一些情况下,靶向配体包含与氨基酸序列
具有85%或更高的序列同一性(例如,90%或更高,95%或更高,97%或更高,98%或更高,99%或更高,99.5%或更高,或100%的序列同一性)的氨基酸序列。在一些情况下,靶向配体包含如SEQ ID NO:9所示的氨基酸序列。在一些情况下,靶向配体包含与氨基酸序列
具有85%或更高的序列同一性(例如,90%或更高,95%或更高,97%或更高,98%或更高,99%或更高,99.5%或更高,或100%的序列同一性)的氨基酸序列。在一些情况下,靶向配体包含如SEQ ID NO:10所示的氨基酸序列。
可被用作主题靶向配体的选择素的片段(例如,在选择素的前40个氨基酸中发现的信号肽)可在一些情况下与特异地被修饰的唾液黏蛋白实现强结合,例如,多种唾液酸化Lewis
在一些情况下,根据本公开的靶向配体提供与E-选择素的靶向结合。E-选择素可介导肿瘤细胞与内皮细胞的粘附并且E-选择素的配体可在癌症转移中发挥作用。作为示例,P-选择素糖蛋白-1(PSGL-1)(例如,衍生自人嗜中性粒细胞)可充当E-选择素的高效配体(例如,由内皮细胞(endothelium)表达),并且主题靶向配体可因此在一些情况下包含PSGL-1氨基酸序列(或其与E-选择素结合的片段)。作为另一示例,E-选择素配体-1(ESL-1)可结合E-选择素,并且主题靶向配体可因此在一些情况下包含ESL-1氨基酸序列(或其与E-选择素结合的片段)。在一些情况下,具有PSGL-1和/或ESL-1氨基酸序列(或其与E-选择素结合的片段)的靶向配体带有一个或多个唾液酸化Lewis修饰以结合E-选择素。作为另一示例,在一些情况下,CD44,死亡受体-3(DR3),LAMP1,LAMP2,和Mac2-BP可结合E-选择素,并且主题靶向配体可因此在一些情况下包含以下氨基酸序列(或其与E-选择素结合的片段)中的任何一种:CD44,死亡受体-3(DR3),LAMP1,LAMP2,和Mac2-BP。
在一些情况下,根据本公开的靶向配体提供与P-选择素的靶向结合。在一些情况下,PSGL-1可以提供此类靶向结合。在一些情况下,主题靶向配体可因此在一些情况下包含PSGL-1氨基酸序列(或其与P-选择素结合的片段)。在一些情况下,具有PSGL-1氨基酸序列(或其与P-选择素结合的片段)的靶向配体具有一个或多个唾液酸化Lewis修饰以结合P-选择素。
在一些情况下,根据本公开的靶向配体提供与靶的靶向结合,该靶选自:CD3,CD8,CD4,CD28,CD90,CD45f,CD34,CD80,CD86,CD19,CD20,CD22,CD47,CD3-ε,CD3-γ,CD3-δ;TCRα,TCRβ,TCRγ,和/或TCRδ恒定区;4-1BB,OX40,OX40L,CD62L,ARP5,CCR5,CCR7,CCR10,CXCR3,CXCR4,CD94/NKG2,NKG2A,NKG2B,NKG2C,NKG2E,NKG2H,NKG2D,NKG2F,NKp44,NKp46,NKp30,DNAM,XCR1,XCL1,XCL2,ILT,LIR,Ly49,IL2R,IL7R,IL10R,IL12R,IL15R,IL18R,TNFα,IFNγ,TGF-β,和α5β1。
在一些情况下,根据本公开的靶向配体提供与转铁蛋白受体的靶向结合。在一些此类情况下,靶向配体包含与氨基酸序列THRPPMWSPVWP(SEQ ID NO:11)具有85%或更高的序列同一性(例如,90%或更高,95%或更高,97%或更高,98%或更高,99%或更高,99.5%或更高,或100%的序列同一性)的氨基酸序列。在一些情况下,靶向配体包含如SEQ ID NO:11所示的氨基酸序列。
在一些情况下,根据本公开的靶向配体提供与整合素(例如,α5β1整合素)的靶向结合。在一些此类情况下,靶向配体包含与氨基酸序列RRETAWA(SEQ ID NO:12)具有85%或更高的序列同一性(例如,90%或更高,95%或更高,97%或更高,98%或更高,99%或更高,99.5%或更高,或100%的序列同一性)的氨基酸序列。在一些情况下,靶向配体包含如SEQID NO:12所示的氨基酸序列。在一些情况下,靶向配体包含与氨基酸序列RGDGW(SEQ IDNO:181)具有85%或更高的序列同一性(例如,90%或更高,95%或更高,97%或更高,98%或更高,99%或更高,99.5%或更高,或100%的序列同一性)的氨基酸序列。在一些情况下,靶向配体包含如SEQ ID NO:181所示的氨基酸序列。在一些情况下,靶向配体包含氨基酸序列RGD。
在一些情况下,根据本公开的靶向配体提供与整合素的靶向结合。在一些此类情况下,靶向配体包含与氨基酸序列GCGYGRGDSPG(SEQ ID NO:182)具有85%或更高的序列同一性(例如,90%或更高,95%或更高,97%或更高,98%或更高,99%或更高,99.5%或更高,或100%的序列同一性)的氨基酸序列。在一些情况下,靶向配体包含如SEQ ID NO:182所示的氨基酸序列。在一些情况下,此类靶向配体在N-末端被乙酰化和/或在C-末端被酰胺化(NH2)。
在一些情况下,根据本公开的靶向配体提供与整合素(例如,α5β3整合素)的靶向结合。在一些此类情况下,靶向配体包含与氨基酸序列DGARYCRGDCFDG(SEQ ID NO:187)具有85%或更高的序列同一性(例如,90%或更高,95%或更高,97%或更高,98%或更高,99%或更高,99.5%或更高,或100%的序列同一性)的氨基酸序列。在一些情况下,靶向配体包含如SEQ ID NO:187所示的氨基酸序列。
在一些实施例中,用于靶向脑的靶向配体包含来自狂犬病病毒糖蛋白(RVG)的氨基酸序列(例如,YTIWMPENPRPGTPCDIFTNSRGKRASNGGGG(SEQ ID NO:183))。在一些此类情况下,靶向配体包含与如SEQ ID NO:183所示的氨基酸序列具有85%或更高的序列同一性(例如,90%或更高,95%或更高,97%或更高,98%或更高,99%或更高,99.5%或更高,或100%的序列同一性)的氨基酸序列。对于任何靶向配体(如本文其他地方所述),RVG可与锚定结构域(例如,9R肽序列)缀合和/或融合。例如,被用作主题纳米颗粒的表面涂层的一部分的主题递送分子可包含序列
在一些情况下,根据本公开的靶向配体提供与c-Kit受体的靶向结合。在一些此类情况下,靶向配体包含与如SEQ ID NO:184所示的氨基酸序列具有85%或更高的序列同一性(例如,90%或更高,95%或更高,97%或更高,98%或更高,99%或更高,99.5%或更高,或100%的序列同一性)的氨基酸序列。在一些情况下,靶向配体包含如SEQ ID NO:184所示的氨基酸序列。
在一些情况下,根据本公开的靶向配体提供与CD27的靶向结合。在一些此类情况下,靶向配体包含与如SEQ ID NO:185所示的氨基酸序列具有85%或更高的序列同一性(例如,90%或更高,95%或更高,97%或更高,98%或更高,99%或更高,99.5%或更高,或100%的序列同一性)的氨基酸序列。在一些情况下,靶向配体包含如SEQ ID NO:185所示的氨基酸序列。
在一些情况下,根据本公开的靶向配体提供与CD150的靶向结合。在一些此类情况下,靶向配体包含与如SEQ ID NO:186所示的氨基酸序列具有85%或更高的序列同一性(例如,90%或更高,95%或更高,97%或更高,98%或更高,99%或更高,99.5%或更高,或100%的序列同一性)的氨基酸序列。在一些情况下,靶向配体包含如SEQ ID NO:186所示的氨基酸序列。
在一些实施例中,靶向配体提供与KLS CD27
在一些实施例中,靶向配体提供与CD4+或CD8+ T细胞,造血干细胞和祖细胞(HSPC),或外周血单核细胞(PBMC)的靶向结合,以修饰T细胞受体。例如,可引入一种或多种基因编辑工具(在本文其他地方所述)以修饰T细胞受体。可以直接靶向T细胞受体并且用相应的同源定向修复供体DNA分子取代T细胞受体以形成新型T细胞受体。作为一个示例,可以将CRISPR/Cas RNA-向导的多肽(例如,Cas9,CasX,CasY,Cpf1)与适当的向导RNA一起递送,使其与TCR基因中的基因座结合并且在基因组中产生双链或单链断裂,启动基因组修复。在一些情况下,引入供体DNA分子(单链或双链)(作为有效负载的一部分)。对于技术人员显而易见的是,可根据本公开使用其它CRISPR向导RNA和HDR供体序列,靶向β-珠蛋白,CCR5,T细胞受体,或任何其它感兴趣的基因,和/或其它表达载体。
在一些实施例中,靶向配体是核酸适体。在一些实施例中,靶向配体是类肽。
还提供了具有两种不同的肽序列的递送分子,它们一起构成靶向配体。例如,在一些情况下,靶向配体是二价的(例如,异二价的)。在一些情况下,细胞穿透肽和/或硫酸肝素蛋白聚糖结合配体与本公开的任何靶向配体一起用作异二价内吞作用的触发物。异二价靶向配体可包含来自靶向配体之一的亲和序列和来自不同靶向配体的正构结合序列(例如,已知参与想要的内吞作用的运输(trafficking)途径的正构结合序列)。
锚定结构域
在一些实施例中,递送分子包含与锚定结构域(例如,阳离子锚定结构域,阴离子锚定结构域)缀合的靶向配体。在一些情况下,主题递送媒介物包括与锚定结构域聚集和/或静电地相互作用的有效负载(例如,递送分子可能是用于递送有效负载的递送媒介物)。在一些情况下,纳米颗粒的表面涂层包括具有锚定结构域的此类递送分子,并且在一些此类情况下,有效负载是在此类纳米颗粒的核中(与核相互作用)。与锚定结构域有关的其他细节请参见上述描述带电荷的聚合物多肽结构域的部分。
在一些实施例中,主题纳米颗粒的阳离子多肽组合物包括组蛋白肽或组蛋白肽的片段,如N-末端组蛋白尾(例如,H1,H2(例如,H2A,H2AX,H2B),H3,或H4组蛋白的组蛋白尾)。组蛋白的尾片段在本文中称为组蛋白尾肽(HTP)。因为此类蛋白(组蛋白和/或HTP)可与作为主题纳米颗粒的核的一部分的核酸有效负载聚集,所以包含一个或多个组蛋白或HTP(例如,作为阳离子多肽组合物的一部分)的核在本文中有时被称为核小体-模拟核。组蛋白和/或HTP可以作为单体包含在内,并且在一些情况下,当核酸有效负载聚集(condensing)成纳米颗粒核时,可以形成二聚体,三聚体,四聚体和/或八聚体。在一些情况下,HTP不仅能够通过多种组蛋白修饰去质子化(如在组蛋白乙酰转移酶介导的乙酰化的情况下),而且可以介导核组分的有效的细胞核特异性解包装(例如,有效负载的释放)。包含组蛋白和/或HTP的核的运输可能依赖于利用通过高尔基体和内质网的逆转运的可替代的内吞作用的途径。此外,一些组蛋白包括先天的细胞核定位序列,并且核中包含NLS可以将核(包括有效负载)引导至靶细胞的细胞核。
在一些实施例中,主题阳离子多肽组合物包含具有H2A,H2AX,H2B,H3,或H4蛋白的氨基酸序列的蛋白。在一些情况下,主题阳离子多肽组合物包括具有氨基酸序列的蛋白,该氨基酸序列与组蛋白的N-末端区域对应。例如,片段(HTP)可包含组蛋白的前5,10,15,20,25,30,35,40,45,或50个N端氨基酸。在一些情况下,主题HTP包含来自组蛋白的N-末端区域的5-50个氨基酸(例如5-45,5-40,5-35,5-30,5-25,5-20,8-50,8-45,8-40,8-35,8-30,10-50,10-45,10-40,10-35,或10-30个氨基酸)。在一些情况下,主题阳离子多肽包含5-150个氨基酸(例如,5-100,5-50,5-35,5-30,5-25,5-20,8-150,8-100,8-50,8-40,8-35,8-30,10-150,10-100,10-50,10-40,10-35,或10-30个氨基酸)。
在一些情况下,阳离子多肽组合物的阳离子多肽(例如,组蛋白或HTP,例如H1,H2,H2A,H2AX,H2B,H3,或H4)包括转译后(post-translational)修饰(例如,在一些情况下,在一个或多个组氨酸,赖氨酸,精氨酸,或其他互补残基上)。例如,在一些情况下,阳离子多肽被甲基化(和/或易受甲基化/去甲基化),被乙酰化(和/或易受乙酰化/去乙酰化),被巴豆酰化(crotonylated)(和/或易受巴豆酰化/去巴豆酰化),被泛素化(和/或易受泛素化/去泛素化),被磷酸化(和/或易受磷酸化/去磷酸化),被SUMO化(和/或易受SUMO化/去SUMO化),被法尼基化(farnesylated)(和/或易受法尼基化/去法尼基化),被硫酸化(和/或易受硫酸化/脱硫)或以其他方式被转译后修饰。在一些情况下,阳离子多肽组合物的阳离子多肽(例如,组蛋白或HTP,例如H1,H2,H2A,H2AX,H2B,H3,或H4)是p300/CBP底物(例如,参见下面的示例HTP,例如,SEQ ID NO:129-130)。在一些情况下,阳离子多肽组合物的阳离子多肽(例如,组蛋白或HTP,例如H1,H2,H2A,H2AX,H2B,H3,或H4)包含一个或多个硫醇残基(例如,可以包含半胱氨酸和/或蛋氨酸残基),其被硫酸化或易受硫酸化(例如,作为硫代硫酸盐硫转移酶底物)。在一些情况下,阳离子多肽的阳离子多肽(例如,组蛋白或HTP,例如,H1,H2,H2A,H2AX,H2B,H3,或H4)在C-末端被酰胺化。组蛋白H2A,H2B,H3,和H4(和/或HTP)可在其任何赖氨酸处被单甲基化,二甲基化,或三甲基化以促进或抑制转录活性并改变细胞核特异性释放动力学。
阳离子多肽可以用想要的修饰合成或可以在体外反应中被修饰。可替代地,阳离子多肽(例如,组蛋白或HTP)可以在细胞群体中被表达并且想要的被修饰的蛋白可以被分离/纯化。在一些情况下,主题纳米颗粒的阳离子多肽组合物包含被甲基化的HTP,例如,包括H3K4(Me3)的HTP序列-包含如SEQ ID NO:75或88所示的氨基酸序列。在一些情况下,阳离子多肽组合物的阳离子多肽(例如,组蛋白或HTP,例如H1,H2,H2A,H2AX,H2B,H3,或H4)包含C-末端酰胺。
组蛋白和HTP的示例
示例包括但不限于以下序列:
[cr:被巴豆酰化(巴豆酰化)]
照此,主题阳离子多肽组合物的阳离子多肽可包含具有SEQ ID NOs:62-139中任一个所示氨基酸序列的氨基酸序列。在一些情况下,主题阳离子多肽组合物的阳离子多肽包含与SEQ ID NOs:62-139中任一个所示的氨基酸序列具有80%或更高的序列同一性(例如,85%或更高,90%或更高,95%或更高,98%或更高,99%或更高,或100%的序列同一性)的氨基酸序列。在一些情况下,主题阳离子多肽组合物的阳离子多肽包含与SEQ IDNOs:62-139中任一个所示的氨基酸序列具有90%或更高的序列同一性(例如,95%或更高,98%或更高,99%或更高,或100%的序列同一性)的氨基酸序列。阳离子多肽可包含任何方便的修饰,并且上文讨论了许多此类预期的修饰,例如,甲基化,乙酰化,巴豆酰化,泛素化,磷酸化,SUMO化,法尼基化,硫酸化等。
在一些情况下,阳离子多肽组合物的阳离子多肽包含与SEQ ID NO:94中所示的氨基酸序列具有80%或更高的序列同一性(例如,85%或更高,90%或更高,95%或更高,98%或更高,99%或更高,或100%的序列同一性)的氨基酸序列。在一些情况下,阳离子多肽组合物的阳离子多肽包含与SEQ ID NO:94中所示的氨基酸序列具有95%或更高的序列同一性(例如,98%或更高,99%或更高,或100%的序列同一性)的氨基酸序列。在一些情况下,阳离子多肽组合物的阳离子多肽包含SEQ ID NO:94中所示的氨基酸序列。在一些情况下,阳离子多肽组合物的阳离子多肽包含由H3K4(Me3)(SEQ ID NO:95)表示的序列,该阳离子多肽包含人组蛋白3蛋白的前25个氨基酸,并且在赖氨酸4上三甲基化(例如,在一些情况下在C-末端酰胺化)。
在一些实施例中,阳离子多肽组合物的阳离子多肽(例如,组蛋白或HTP,例如,H1,H2,H2A,H2AX,H2B,H3,或H4)包含半胱氨酸残基,其可以促进与:阳离子(或在一些情况下为阴离子)氨基酸聚合物,接头,NLS,和/或其他阳离子多肽的缀合(例如,在一些情况下以形成分支状组蛋白结构)。例如,半胱氨酸残基可被用于通过巯基化学(例如,二硫键)和/或胺反应性化学进行交联(缀合)。在一些情况下,半胱氨酸残基是内部的。在一些情况下,半胱氨酸残基位于N-末端和/或C-末端。在一些情况下,阳离子多肽组合物的阳离子多肽(例如,组蛋白或HTP,例如,H1,H2,H2A,H2AX,H2B,H3,或H4)包括添加半胱氨酸残基的突变(例如,插入或取代)。包含半胱氨酸的HTP的示例包括但不限于:
在一些实施例中,将阳离子多肽组合物的阳离子多肽(例如,组蛋白或HTP,例如H1,H2,H2A,H2AX,H2B,H3,或H4)与主题纳米颗粒的核的阳离子(和/或阴离子)氨基酸聚合物缀合。作为示例,组蛋白或HTP可通过半胱氨酸残基与阳离子氨基酸聚合物(例如,包含聚(赖氨酸)的聚合物)缀合,例如,其中聚合物的一个或多个赖氨酸的一个或多个吡啶基二硫化物基团被组蛋白的半胱氨酸或HTP通过二硫键取代。
在一些实施例中,主题阳离子多肽组合物的阳离子多肽具有线性结构。在一些实施例中,主题阳离子多肽组合物的阳离子多肽具有分支状结构。
例如,在一些情况下,将阳离子多肽(例如,HTP,例如,具有半胱氨酸残基的HTP)与阳离子聚合物(例如,聚(L-精氨酸),聚(D-赖氨酸),聚(L-赖氨酸),聚(D-赖氨酸))的末端缀合(例如,在其C端),从而形成延伸的线性多肽。在一些情况下,将一个或多个(两个或更多,三个或更多,等等)阳离子多肽(例如,HTP,例如,具有半胱氨酸残基的HTP)与阳离子聚合物(例如,聚(L-精氨酸),聚(D-赖氨酸),聚(L-赖氨酸),聚(D-赖氨酸))的一端或多端缀合(例如,在其C-末端),从而形成延伸的线性多肽。在一些情况下,阳离子聚合物具有范围为4,500-150,000Da的分子量
作为另一示例,在一些情况下,将一个或多个(两个或更多,三个或更多,等等)阳离子多肽(例如,HTP,例如,具有半胱氨酸残基的HTP)与阳离子聚合物(例如聚(L-精氨酸),聚(D-赖氨酸),聚(L-赖氨酸),聚(D-赖氨酸))的侧链缀合(例如,在其C-末端),从而形成分支状结构(分支状多肽)。由纳米颗粒核的组分(例如,主题阳离子多肽组合物的组分)形成分支状结构可在一些情况下增加可被实现的(例如,核酸有效负载的)核聚集的量。因此,在一些情况下,想要使用形成分支状结构的组分。分支状结构的多种类型的是感兴趣的,并且可产生的分支状结构的示例(例如,使用主题阳离子多肽(如HTP),例如,具有半胱氨酸残基的HTP;类肽,聚酰胺等)包括但不限于:刷状聚合物,网状(例如,蜘蛛网状),接枝聚合物,星形聚合物,梳形聚合物,聚合物网络,树枝状聚合物等。
在一些情况下,分支状结构包含2-30个阳离子多肽(例如,HTP)(例如,2-25,2-20,2-15,2-10,2-5,4-30,4-25,4-20,4-15,或4-10个阳离子多肽),其中每个可与分支状结构的其他阳离子多肽相同或不同。在一些情况下,阳离子聚合物具有范围为4,500-150,000Da的分子量。在一些情况下,阳离子聚合物(例如,聚(L-精氨酸),聚(D-赖氨酸),聚(L-赖氨酸),聚(D-赖氨酸))的侧链的5%或更多(例如,10%或更多,20%或更多,25%或更多,30%或更多,40%或更多,或50%或更多)与主题阳离子多肽(例如,HTP,例如,具有半胱氨酸残基的HTP)缀合。在一些情况下,阳离子聚合物(例如聚(L-精氨酸),聚(D-赖氨酸),聚(L-赖氨酸),聚(D-赖氨酸))的侧链的高达50%(例如,高达40%,高达30%,高达25%,高达20%,高达15%,高达10%,或高达5%)与主题阳离子多肽(例如,HTP,例如,具有半胱氨酸残基的HTP)缀合。因此,HTP可从聚合物(如阳离子氨基酸聚合物)的主链上被分支出来。
在一些情况下,可使用如类肽(类多肽),聚酰胺,树枝状聚合物等组分促进分支状结构的形成。例如,在一些情况下,类肽(例如,类多肽)被用作纳米颗粒核的组分,例如,以产生网状(例如,蜘蛛网状)结构,其在一些情况下促进纳米颗粒核的聚集。
本文的一个或多个天然的或被修饰的多肽序列可被末端的或间歇的(intermittent)精氨酸,赖氨酸,或组氨酸序列修饰。在一个实施例中,每个多肽以相等的胺摩尔浓度被包含在纳米颗粒核内。在这个实施例中,每个多肽的C-末端均可用5R(5个精氨酸)修饰。在一些实施例中,每个多肽的C-末端均可用9R(9个精氨酸)修饰。在一些实施例中,每个多肽的N-末端均可用5R(5个精氨酸)修饰。在一些实施例中,每个多肽的N-末端均可用9R(9个精氨酸)修饰。在一些情况下,H2A,H2B,H3和/或H4组蛋白片段(例如,HTP)各自与FKFL组织蛋白酶B蛋白水解剪切结构域或RGFFP组织蛋白酶D蛋白水解剪切结构域串联桥接。在一些情况下,H2A,H2B,H3和/或H4组蛋白片段(例如,HTP)可以通过5R(5个精氨酸),9R(9个精氨酸),5K(5个赖氨酸),9K(9个赖氨酸),5H(5个组氨酸),或9H(9个组氨酸)阳离子间隔结构域串联桥接。在一些情况下,一个或多个H2A,H2B,H3和/或H4组蛋白片段(例如,HTP)在其N端与鱼精蛋白二硫键合。
为了说明如何产生分支状组蛋白结构,提供了制备的示例方法。此类方法的一个示例包括以下:组蛋白H2AX[134-143],组蛋白H3[1-21Cys],组蛋白H3[23-34Cys],组蛋白H4[8-25WC]与SV40T-Ag衍生的NLS的等摩尔比的共价修饰可在与10%吡啶基二硫化物修饰的聚(L-赖氨酸)[MW=5400,18000,或45000Da;n=30,100,或250]的反应中进行。在典型的反应中,可以将29μL的700μM Cys修饰的组蛋白/NLS(20nmol)的水溶液添加至57μL的0.2M磷酸盐缓冲液(pH8.0)。其次,然后可以将14μL的100μM吡啶基二硫化物保护的聚(赖氨酸)溶液添加至组蛋白溶液以使最终体积达到100μL,其中吡啶基二硫化物基团与半胱氨酸残基的比率为1∶2。该反应可以在室温下进行3小时。该反应可以重复四次并且可以通过吡啶-2-硫酮在343nm处的吸光度确定缀合度。
作为另一示例,摩尔比为0∶1,1∶4,1∶3,1∶2,1∶1,1∶2,1∶3,1∶4,或1∶0的组蛋白H3[1-21Cys]肽和组蛋白H3[23-34Cys]肽的共价修饰可在与10%吡啶基二硫化物修饰的聚(L-赖氨酸)或聚(L-精氨酸)[MW=5400,18000,或45000;n=30,100,或250]的反应中进行。在典型的反应中,可以将29μL的700μM Cys修饰的组蛋白(20nmol)的水溶液添加至57μL的0.2M磷酸盐缓冲液(pH 8.0)。其次,然后可以将14μL的100μM吡啶基二硫化物保护的聚(赖氨酸)溶液添加至组蛋白溶液以使最终体积达到100μL,其中吡啶基二硫化物基团与半胱氨酸残基的比率为1∶2。该反应可以在室温下进行3小时。该反应可以重复四次并且可以通过吡啶-2-硫酮在343nm处的吸光度确定缀合度。
在一些情况下,阴离子聚合物与靶向配体缀合。
在一些实施例中,阳离子多肽组合物的阳离子多肽(例如,组蛋白或HTP,例如,H1,H2,H2A,H2AX,H2B,H3,或H4)包含(和/或缀合至)一种或多种(例如,两种或更多,三种或更多,或四种或更多)细胞核定位序列(NLS)。因此,在一些情况下,主题纳米颗粒的阳离子多肽组合物包括肽,该肽包含NLS。在一些情况下,主题纳米颗粒的组蛋白(或HTP)包括一种或多种(例如,两种或更多,三种或更多)天然细胞核定位信号(NLS)。在一些情况下,主题纳米颗粒的组蛋白(或HTP)包含与组蛋白异源的一种或多种(例如,两种或更多,三种或更多)NLS(即,不是天然地作为组蛋白/HTP的一部分存在的NLS,例如,可人为添加的NLS)。在一些情况下,HTP在N-和/或C-末端包含NLS。
在一些实施例中,阳离子聚合物组合物的阳离子氨基酸聚合物(例如,聚(精氨酸)(PR),聚(赖氨酸)(PK),聚(组氨酸)(PH),聚(鸟氨酸),聚(瓜氨酸),聚(D-精氨酸)(PDR),聚(D-赖氨酸)(PDK),聚(D-组氨酸)(PDH),聚(D-鸟氨酸),聚(D-瓜氨酸),聚(L-精氨酸)(PLR),聚(L-赖氨酸)(PLK),聚(L-组氨酸)(PLH),聚(L-鸟氨酸),或聚(L-瓜氨酸))包含(和/或缀合至)一种或多种(例如,两种或更多,三种或更多,或四种或更多)NLS。在一些情况下,阳离子氨基酸聚合物在N-和/或C-末端包含NLS。在一些情况下,阳离子氨基酸聚合物包含内部的NLS。
在一些实施例中,阴离子聚合物组合物的阴离子氨基酸聚合物(例如,聚(谷氨酸)(PEA),聚(天冬氨酸)(PDA),聚(D-谷氨酸)(PDEA),聚(D-天冬氨酸)(PDDA),聚(L-谷氨酸)(PLEA),或聚(L-天冬氨酸)(PLDA))包含(和/或缀合至)一种或多种(例如,两种或更多,三种或更多,或四种或更多)NLS。在一些情况下,阴离子氨基酸聚合物在N-和/或C-末端包含NLS。在一些情况下,阴离子氨基酸聚合物包含内部的NLS。
可使用任何方便的NLS(例如,与组蛋白,HTP,阳离子氨基酸聚合物,阴离子氨基酸聚合物等缀合)。示例包括但不限于1类和2类“单分(monopartite)NLS”以及3-5类的NLS(例如,参见,图7,该图改编自Kosugi等,《生物化学杂志》。2009年01月02日;284(1):478-85。)在一些情况下,NLS具有以下式:(K/R)(K/R)X
在一些实施例中,阳离子多肽组合物的阳离子多肽包含一个或多个(例如,两个或更多,三个或更多,或四个或更多)NLS。在一些情况下,阳离子多肽不是组蛋白或组蛋白片段(例如,不是HTP)。因此,在一些情况下,阳离子多肽组合物的阳离子多肽是含NLS的肽。
在一些情况下,含NLS的肽包含半胱氨酸残基,其可以促进与:阳离子(或在一些情况下为阴离子)氨基酸聚合物,接头,HTP的组蛋白,和/或其他阳离子多肽(例如,在一些情况下,作为分支状组蛋白结构的一部分)。例如,半胱氨酸残基可被用于通过巯基化学(例如,二硫键)和/或胺反应性化学进行交联(缀合)。在一些情况下,半胱氨酸残基是内部的。在一些情况下,半胱氨酸残基位于N-末端和/或C-末端。在一些情况下,阳离子多肽组合物的含NLS的肽包括添加半胱氨酸残基的突变(例如,插入或取代)(例如,相对于野生型氨基酸序列)。
可被用作含NLS的肽(或与任何方便的阳离子多肽(如HTP或阳离子聚合物或阳离子氨基酸聚合物或阴离子氨基酸聚合物)缀合的NLS的示例包括但不限于(其中一些包含半胱氨酸残基):
对于可被使用的NLS的非限制性示例,参见,例如,Kosugi等,《生物化学杂志》2009年01月02日;284(1):478-85,例如,参加本公开的图7。
在一些实施例中,主题纳米颗粒的阳离子多肽(例如,组蛋白或HTP,例如,H1,H2,H2A,H2AX,H2B,H3,或H4),阴离子聚合物,和/或阳离子聚合物包括(和/或缀合至)一个或多个(例如,两个或更多个,三个或更多个,或四个或更多个)线粒体定位序列。可以使用任何方便的线粒体定位序列。线粒体定位序列的示例包括但不限于:
PEDEIWLPEPESVDVPAKPISTSSMMMP(SEQ ID NO:149),SDHB的线粒体定位序列,单/二/三苯基磷或其他磷,VAMP 1A,VAMP 1B,DGAT2的67N-末端氨基酸,和Bax的20N-末端氨基酸。
如上所述,在一些实施例中,主题方法包括在基因组DNA的两个位置的每一处产生交错的切割。在一些情况下,为了产生交错的切割,将位点特异性核酸酶(一种或多种位点特异性核酸酶)(或编码它们的核酸,例如,一种或多种核酸)引入靶细胞。如果靶细胞在体内,则可以通过将适当的组分(例如,作为一种或多种递送媒介物的一部分)施用至个体来实现。在一些情况下,靶细胞包括编码位点特异性核酸酶的DNA并且主题方法的“产生”步骤包括诱导位点特异性核酸酶的表达。
因此,在一些情况下,主题方法包括将位点特异性核酸酶(例如,一种或多种位点特异性核酸酶)引入靶细胞(例如,通过施用至个体,通过转染,通过纳米颗粒,通过递送分子等)。在一些情况下,此类步骤包括将编码一种或多种位点特异性核酸酶的核酸(例如,RNA或DNA)引入细胞。类似地,在一些情况下,主题方法包括将线性双链供体DNA引入靶细胞(例如,通过施用至个体,通过转染,通过纳米颗粒,通过递送分子等)。在一些情况下,供体DNA和位点特异性核酸酶(或编码它们的核酸)作为同一递送媒介物(例如,纳米颗粒,递送分子等)的一部分被引入细胞。组分-供体DNA和一种或多种位点特异性核酸酶(或编码它们一种或多种的核酸)-可被递送至任何想要的靶细胞,例如,任何想要的真核细胞。
在一些情况下,靶细胞是体外的(例如,细胞处于培养中),例如,细胞可以是已建立的组织培养细胞系的细胞。在一些情况下,靶细胞是离体的(例如,细胞是从个体,例如患者,分离的原代细胞(或最近的后代))。在一些情况下,靶细胞在体内,并且因此在生物体的(部分的)内部。
供体DNA和/或一种或多种位点特异性核酸酶(或编码它们的一种或多种核酸),例如,作为递送媒介物的有效负载,可通过以下任何途径被引入受试者(即,被施用至个体):全身,局部,肠胃外,皮下(s.c.),静脉内(i.v.),颅内(i.c.),脊髓内,眼内,皮内(i.d.),肌内(i.m.),淋巴内(i.l.),或进入脊髓液。可通过注射(例如,全身注射,直接局部注射,局部注射至肿瘤或肿瘤附近和/或肿瘤切除部位附近等),导管等引入组分。用于局部递送(例如,递送至肿瘤和/或癌症位点)的方法的示例包括例如,通过推注(bolus)注射,例如,通过注射器,例如,注射入关节,或肿瘤,或器官,或在关节,肿瘤,或器官附近;例如,通过连续输注,例如,通过插管,例如,通过对流(参见,例如,美国申请号20070254842,通过引用并入本文)。
对受试者的治疗的施用次数可变化。将供体DNA和/或一种或多种位点特异性核酸酶(或编码它们的一种或多种核酸),例如,作为递送媒介物的有效负载,引入个体可能是一次事件;但在某些情况下,此类治疗可能会在有限的时间内引起改善,并且需要持续的一系列重复治疗。在其他情况下,在观察到作用之前,可能需要多次施用供体DNA和/或一种或多种位点特异性核酸酶(或它们一种或多种核酸)。如本领域普通技术人员将容易理解的那样,确切的方案取决于疾病或病状,疾病的阶段以及所治疗个体的参数
“治疗有效剂量”或“治疗剂量”是足以实现想要的临床结果(即,达到治疗功效)的量。治疗有效剂量可以在一次或多次施用中被给予。出于本公开的目的,当被施用至个体时,治疗有效剂量的供体DNA和/或一种或多种位点特异性核酸酶(或编码它们的一种或多种核酸)的量足以缓解(palliate),改善,稳定,逆转,预防,减慢或延迟疾病状态/疾病(ailment)的进展。
一示例性治疗干预是,除了消融已整合到宿主基因组中的任何逆转录病毒DNA之外,还可以产生对HIV感染的抵抗力。T细胞直接受HIV影响,因此可以探索针对CD34+和CD45+细胞的混合血液靶向策略。例如,有效的治疗干预可包括同时靶向HSC和T细胞,并通过多种向导的核酸酶(例如,在单个颗粒内)向CCR5-Δ32和gag/rev/pol基因传递消融(和置换序列)。
在一些情况下,靶细胞是哺乳动物细胞(例如,啮齿动物细胞,小鼠细胞,大鼠细胞,有蹄类动物细胞,牛细胞,绵羊细胞,猪细胞,马细胞,骆驼细胞,兔细胞,犬科(犬)细胞,猫科(猫)细胞,灵长类细胞,非人灵长类细胞,人细胞)。任何细胞类型都可以被靶向,并且在一些情况下,特定细胞的特异性靶向取决于靶向配体的存在(例如,作为纳米颗粒的表面涂层的一部分,作为递送分子的一部分等),其中靶向配体提供与特定细胞类型的靶向结合。例如,可被靶向的细胞包括但不限于骨髓细胞,造血干细胞(HSC),长期HSC,短期HSC,造血干细胞和祖细胞(HSPC),外周血单核细胞(PBMC),髓系祖细胞,淋巴样祖细胞,T细胞,B细胞(例如,通过靶向CD19,CD20,CD22),NKT细胞,NK细胞,树突细胞,单核细胞,粒细胞,红细胞,巨核细胞,肥大细胞,嗜碱性粒细胞,嗜酸性粒细胞,嗜中性粒细胞,巨噬细胞(例如,通过SIRPα-模拟肽靶向CD47),红系祖细胞(例如,HUDEP细胞),巨核细胞-红系祖细胞(MEP),共同髓系祖细胞(CMP),多能祖细胞(MPP),造血干细胞(HSC),短期HSC(ST-HSC),IT-HSC,长期HSC(LT-HSC),内皮细胞,神经元,星形胶质细胞,胰腺细胞,胰岛β细胞,肌细胞,骨骼肌细胞,心肌细胞,肝细胞,脂肪细胞,肠细胞,结肠细胞,和胃细胞。
上文例如,在靶向配体的背景下讨论了多种应用的示例(例如,用于靶向神经元,胰腺细胞,造血干细胞,和多能祖细胞等)。例如,造血干细胞和多能祖细胞可以在体内被靶向以进行基因编辑(例如,插入)。即使在体内编辑1%的骨髓细胞(约150亿个细胞),与离体的疗法(约100亿个细胞)相比也将靶向更多的细胞。作为另一示例,可以靶向胰腺细胞(例如,β胰岛细胞),例如,以治疗胰腺癌,治疗糖尿病等。作为另一示例,可靶向脑中的体细胞(如神经元)(例如,以治疗适应症,如亨延顿病,帕金森氏病(例如,LRRK2突变),和ALS(例如,SOD1突变))。在一些情况下,这可以通过直接颅内注射实现。
作为另一示例,内皮细胞和造血系统的细胞(例如,巨核细胞和/或巨核细胞上游的任何祖细胞,如巨核细胞-红系祖细胞(MEP),共同髓系祖细胞(CMP),多能祖细胞细胞(MPP),造血干细胞(HSC),短期HSC(ST-HSC),IT-HSC,长期HSC(LT-HSC)-参见例如,图8)可被主题纳米颗粒(或主题病毒或非病毒的递送媒介物)靶向以治疗冯·威勒布兰德病。例如,在编码冯·威勒布兰德因子(VWF)的基因中携带突变的细胞(例如,内皮细胞,巨核细胞和/或巨核细胞上游的任何祖细胞,如MEP,CMP,MPP,HSC(如ST-HSC,IT-HSC,和/或LT-HSC)可以被靶向(体外,离体,体内)以编辑(和纠正)突变的基因,例如,通过引入替换序列(例如,通过供体DNA的递送)。在上述一些情况下(例如,在与治疗冯·威勒布兰德病有关的情况下,在与靶向在编码VWF的基因中携带突变的细胞有关的情况下),主题靶向配体提供与E-选择素的靶向结合。
本公开的方法和组合物可用于治疗任何数量的疾病,包括与已知的致病突变(例如,基因组中的突变)相关的任何疾病。例如,本公开的方法和组合物可用于治疗镰状细胞疾病,β地中海贫血,HIV,骨髓增生异常综合症,JAK2-介导的红细胞增多症,JAK2-介导的原发性骨髓纤维化,JAK2-介导的白血病,和多种血液病。作为另外的非限制性示例,本公开的方法和组合物也可用于B细胞抗体的产生,免疫疗法(例如,检查点封闭剂的递送),和干细胞分化应用。
在一些实施例中,靶向配体提供与KLS CD27
在一些实施例中,靶向配体提供与CD4+或CD8+ T细胞,造血干细胞和祖细胞(HSPC),或外周血单核细胞(PBMC)的靶向结合,以修饰T细胞受体。例如,可引入一种或多种基因编辑工具(在本文其他地方所述)以修饰T细胞受体。可以直接靶向T细胞受体并且用相应的同源定向修复供体DNA分子取代T细胞受体以形成新型T细胞受体。作为一个示例,可以将CRISPR/Cas RNA-向导的多肽(例如,Cas9,CasX,CasY,Cpf1)与适当的一个或多个向导RNA一起递送,使其与HBB基因中的基因座结合并且在基因组中的两个位置产生双链或单链切割,启动被引入的供体DNA的插入。对于本领域技术人员显而易见的是,可根据本公开使用其它CRISPR向导RNA和HDR供体序列,靶向β-珠蛋白,CCR5,T细胞受体,或任何其它感兴趣的基因,和/或其它表达载体。
在一些情况下,主题方法被用于靶向编码T细胞受体(TCR)的基因座,在一些情况下具有近100个结构域和多达1,000,000个碱基对,且恒定区与V(D)J区隔开约100,000个碱基对或更多。
在一些情况下,供体DNA的插入发生在编码T细胞受体(TCR)蛋白的核苷酸序列内。在一些此类情况下,供体DNA编码TCR蛋白的CDR1,CDR2,或CDR3区域的氨基酸。参见,例如,Dash等,《自然》。2017年7月6日;547(7661):89-93。Epub 2017年6月21日;和Glanville等,《自然》。2017年7月6日;547(7661):94-98。Epub 2017年6月21日。
在一些情况下,主题方法被用于插入基因,同时将其置于特定增强子的控制下(可操作地连接),作为基因组工程的保险(fail-safe)。如果插入失败,则增强子被破坏,导致随后的基因和任何可能的插入缺失都不太可能表达。如果基因插入成功,则可以插入端带有终止密码子的新基因,这对于多部分基因(例如TCR基因座)特别有用。在一些情况下,主题方法可用于将嵌合抗原受体(CAR)或其他构建体插入T细胞,或引起B细胞产生特异性抗体或抗体的替代物(如纳米抗体,鲨鱼抗体等)。
在一些情况下,供体DNA包括编码嵌合抗原受体(CAR)的核苷酸序列。在一些此类情况下,供体DNA的插入导致编码CAR的核苷酸序列与内源T细胞启动子的可操作连接(即,CAR的表达将在内源性启动子的控制下)在一些情况下,供体DNA包含与启动子可操作地连接并编码嵌合抗原受体(CAR)的核苷酸序列-因此,被插入的CAR将处于存在于供体DNA上的启动子的控制下。
在一些情况下,供体DNA包含编码细胞特异性靶向配体的核苷酸序列,该配体是膜结合的并在细胞外呈现。在一些情况下,所述供体DNA的插入导致编码细胞特异性靶向配体的核苷酸序列与内源性启动子的可操作的连接。在一些情况下,供体DNA包括启动子,该启动子可操作地连接至编码细胞特异性靶向配体的序列,该配体是膜结合的并在细胞外呈现-因此,在供体DNA插入后,膜结合的靶向配体的表达将处于存在于供体DNA上的启动子的控制下。
在一些实施例中,供体DNA的插入发生在编码T细胞受体(TCR)的α或δ亚单位的核苷酸序列中。在一些情况下,供体DNA的插入发生在编码TCRβ或γ亚单位的核苷酸序列内。在一些情况下,主题方法和/或组合物包括两个供体DNA。在一些此类情况下,一个供体DNA的插入发生在编码T细胞受体(TCR)α或δ亚单位的核苷酸序列内,而另一个供体DNA的插入发生在编码T细胞受体(TCR)β或γ亚单位的核苷酸序列内。
在一些实施例中,供体DNA的插入发生在编码T细胞受体(TCR)α或δ亚单位恒定区的核苷酸序列内。在一些情况下,供体DNA的插入发生在编码T细胞受体(TCR)β或γ亚单位恒定区的核苷酸序列内。在一些情况下,主题方法和/或组合物包括两个供体DNA。在一些此类情况下,一个供体DNA的插入发生在编码T细胞受体(TCR)α或δ亚单位恒定区的核苷酸序列内,而另一个供体DNA的插入发生在编码T细胞受体(TCR)β或γ亚单位恒定区的核苷酸序列内。
在一些实施例中,供体DNA的插入发生在充当T细胞受体(TCR)α或δ亚单位启动子的核苷酸序列内。在一些情况下,供体DNA的插入发生在充当T细胞受体(TCR)β或γ亚单位启动子的核苷酸序列内。在一些情况下,主题方法和/或组合物包括两个供体DNA。在一些此类情况下,一个供体DNA的插入发生在充当T细胞受体(TCR)α或δ亚单位启动子的核苷酸序列内,而另一供体DNA的插入发生在充当T细胞受体(TCR)β或γ亚单位启动子的核苷酸序列内。
在一些实施例中,供体DNA的序列的插入发生在编码T细胞受体(TCR)α或γ亚单位的核苷酸序列中。在一些情况下,供体DNA的序列的插入发生在编码TCRβ或γ亚单位的核苷酸序列内。在一些情况下,主题方法和/或组合物包括两个供体DNA。在一些此类情况下,一个供体DNA的序列的插入发生在编码T细胞受体(TCR)α或γ亚单位的核苷酸序列内,而另一个供体DNA的序列的插入发生在编码T细胞受体(TCR)β或γ亚单位的核苷酸序列内。
在一些实施例中,供体DNA的序列的插入发生在编码T细胞受体(TCR)α或γ亚单位恒定区的核苷酸序列内。在一些情况下,供体DNA的序列的插入发生在编码T细胞受体(TCR)β或δ亚单位恒定区的核苷酸序列内。在一些情况下,主题方法和/或组合物包括两个供体DNA。在一些此类情况下,一个供体DNA的序列的插入发生在编码T细胞受体(TCR)α或γ亚单位恒定区的核苷酸序列内,而另一个供体DNA的序列的插入发生在编码T细胞受体(TCR)β或δ亚单位恒定区的核苷酸序列内。
在一些实施例中,供体DNA的序列的插入发生在充当T细胞受体(TCR)α或γ亚单位启动子的核苷酸序列内。在一些情况下,供体DNA的序列的插入发生在充当T细胞受体(TCR)β或δ亚单位启动子的核苷酸序列内。在一些情况下,主题方法和/或组合物包括两个供体DNA。在一些此类情况下,一个供体DNA的序列的插入发生在充当T细胞受体(TCR)α或γ亚单位启动子的核苷酸序列内,而另一供体DNA的序列的插入发生在充当T细胞受体(TCR)β或δ亚单位启动子的核苷酸序列内。
在一些实施例中,供体DNA的插入导致所插入的供体DNA与T细胞受体(TCR)α,β,γ,或δ内源性启动子的可操作的连接。在一些情况下,供体DNA包含编码蛋白的可操作地连接TCRα,β,γ或δ启动子的核苷酸序列,使得在插入之后,编码蛋白的序列将保持可操作地连接供体DNA中存在的启动子(的控制下)。在一些情况下,所述供体DNA的插入导致所插入的供体DNA(例如,编码蛋白的核苷酸序列,如CAR,TCR-α,TCR-β,TCR-γ,或TCR-δ序列)与CD3或CD28启动子的可操作的连接。在一些情况下,供体DNA包括与启动子(例如,T细胞特异性启动子)可操作地连接的编码蛋白的核苷酸序列。在一些情况下供体DNA的插入导致所插入的供体DNA与内源性启动子(例如,干细胞特异性或体细胞特异性内源性启动子)的可操作的连接。在一些情况下,供体DNA包括核苷酸序列,其编码报告蛋白(例如,荧光蛋白,如GFP,RFP,YFP,CFP,近IR和/或远红报告蛋白等,例如,用于评估基因编辑效率)。在一些情况下,供体DNA包括不具有内含子的编码蛋白的核苷酸序列(例如,编码TCR蛋白的全部或一部分的核苷酸序列)。
在一些情况下,主题方法(和/或主题组合物)可用于序列的插入的应用,荧光报告分子(例如,荧光蛋白,例如绿色荧光蛋白(GFP)/红色荧光蛋白(RFP)/近IR/远红等)的插入,例如,进入任何被编码的感兴趣的蛋白(如跨膜蛋白)的C-和/或N-末端。
在一些实施例中,供体DNA的核苷酸序列插入细胞的基因组导致所插入的序列与内源性启动子(例如,(i)T细胞特异性启动子;(ii)CD3启动子;(iii)CD28启动子;(iv)干细胞特异性启动子;(v)体细胞特异性启动子;(vi)T细胞受体(TCR)α,β,γ,或δ启动子;(v)B细胞特异性启动子;(vi)CD19启动子;(vii)CD20启动子;(viii)CD22启动子;(ix)B29启动子;和(x)T细胞或B细胞V(D)J特异性启动子)的可操作的连接。在一些情况下,插入供体组合物的所插入的核苷酸序列包括与启动子(例如,(i)T细胞特异性启动子;(ii)CD3启动子;(iii)CD28启动子;(iv)干细胞特异性启动子;(v)体细胞特异性启动子;(vi)T细胞受体(TCR)α,β,γ,或δ启动子;(v)B细胞特异性启动子;(vi)CD19启动子;(vii)CD20启动子;(viii)CD22启动子;(ix)B29启动子;和(x)T细胞或B细胞V(D)J特异性启动子)可操作地连接的编码蛋白的序列。
在一些实施例中,插入细胞的基因组中的核苷酸序列编码蛋白。可以编码任何方便的蛋白-示例包括但不限于:T细胞受体(TCR)蛋白;T细胞受体(TCR)蛋白的CDR1,CDR2,或CDR3区域;嵌合抗原受体(CAR);膜结合且在细胞外呈现的细胞特异性靶向配体;报告蛋白(例如,荧光蛋白,如GFP,RFP,CFP,YFP,和在远红,近红外产生荧光的荧光蛋白等)。在一些实施例中,插入细胞基因组中的核苷酸序列编码多价(例如,异多价)表面受体(例如,在T细胞是靶细胞的一些情况下)。可以使用任何方便的多价受体,非限制性示例包括:双特异性或三特异性CAR和/或TCR,或免疫细胞上的其他亲和性标记。这样的插入将引起靶细胞表达受体。在一些情况下,通过插入单独的受体来实现多价,从而所插入的受体充当“或(OR)”门(一个或另一个触发激活),或“与(AND)”门(受体信号是共刺激的,同价结合不会激活/刺激细胞,例如被靶向的T细胞)。可以选择由所插入的DNA编码的蛋白(例如,CAR,TCR,多价表面受体),使得其结合(例如,将细胞(例如T细胞)靶向至)选自以下的一个或多个靶:CD3,CD8,CD4,CD28,CD90,CD45f,CD34,CD80,CD86,CD19,CD20,CD22,CD47,CD3-ε,CD3-γ,CD3-δ;TCRα,TCRβ,TCRγ,和/或TCRδ恒定区;4-1BB,OX40,OX40L,CD62L,ARP5,CCR5,CCR7,CCR10,CXCR3,CXCR4,CD94/NKG2,NKG2A,NKG2B,NKG2C,NKG2E,NKG2H,NKG2D,NKG2F,NKp44,NKp46,NKp30,DNAM,XCR1,XCL1,XCL2,ILT,LIR,Ly49,IL2R,IL7R,IL10R,IL12R,IL15R,IL18R,TNFα,IFNγ,TGF-β,和α5β1。
在一些情况下,所插入的核苷酸序列编码受体,由此被受体靶向(结合)的靶标对个体的疾病(例如,癌症/肿瘤)具有特异性。在一些情况下,所插入的核苷酸序列编码异多价受体,由此被异多价受体靶向的靶标的组合对个体的疾病(例如,癌症/肿瘤)具有特异性。作为一个说明性示例,可以对个体的癌症(例如肿瘤,例如,通过活组织检查)进行测序(核酸序列,蛋白质组学,代谢组学等),以鉴定可以作为靶标的疾病细胞的抗原(例如被过表达的抗原,或相对于个体的对照细胞而言对于肿瘤而言是独特的),以及编码与一个或多个这些靶标(例如2个或更多,3个或更多,5个或更多,10个或更多,15个或更多,或约20个这些靶标)结合的受体(例如,异多价受体)的核苷酸序列可以被插入免疫细胞(例如,NK细胞,B细胞,T细胞,例如使用CAR或TCR),从而免疫细胞特异性靶向个体的疾病细胞(例如肿瘤细胞)。这样,可以将所插入的核苷酸序列设计为具有诊断响应性,即可以在收到与患者蛋白质组学,基因组学或代谢组学相关的独特见解后设计一种或多种被编码的受体(例如,一种或多种异多价受体)(例如,通过测序等)-从而产生强烈且特异性的免疫系统反应。以此方式,免疫细胞(例如NK细胞,B细胞,T细胞等)可以被基因组编辑以表达被设计成有效对抗个体自身的疾病(例如癌症)的诸如CAR和/或TCR蛋白(例如异多价形式)的受体。在一些情况下,在诊断响应性药物治疗后,调节性T细胞可被赋予和受自身免疫影响的组织相似的活动性(avidity)。
在一些情况下,插入细胞基因组的供体DNA的核苷酸序列包括不具有内含子的编码蛋白的核苷酸序列。在一些情况下,不具有内含子的核苷酸序列编码TCR蛋白的全部或一部分。
在一些实施例中,将多于1种的递送媒介物引入靶细胞。例如,在一些情况下,主题方法包括将第一和第二递送媒介物的引入细胞,其中插入细胞基因组中的第一递送媒介物的供体DNA的核苷酸序列编码T细胞受体(TCR)α或δ亚单元,且插入细胞基因组中的第二递送媒介物的供体DNA的核苷酸序列编码TCRβ或γ亚单位。在一些情况下,主题方法包括将第一和第二所述递送媒介物引入细胞,其中插入细胞基因组中的第一递送媒介物的供体DNA的核苷酸序列编码T细胞受体(TCR)α或δ亚单元恒定区,且插入细胞基因组中的第二递送媒介物的供体DNA的核苷酸序列编码TCRβ或γ亚单元恒定区。
在一些情况下,主题方法包括将第一和第二所述递送媒介物引入细胞,其中将第一递送媒介物的供体DNA的核苷酸序列插入充当T细胞受体(TCR)α或δ亚单位启动子的核苷酸序列内,并且将第二递送媒介物的供体DNA的核苷酸序列插入充当TCRβ或γ亚单位启动子的核苷酸序列内。有关TCR蛋白和CDR的更多信息,参见,例如,Dash等,《自然》。2017年7月6日;547(7661):89-93。Epub 2017年6月21日;和Glanville等,《自然》。2017年7月6日;547(7661):94-98。Epub 2017年6月21日。
在一些情况下,主题方法包括将第一和第二所述递送媒介物引入细胞,其中插入细胞基因组中的第一递送媒介物的供体DNA的核苷酸序列编码T细胞受体(TCR)α或γ亚单元,且插入细胞基因组中的第二递送媒介物的供体DNA的核苷酸序列编码TCRβ或δ亚单元。在一些情况下,主题方法包括将第一和第二所述递送媒介物引入细胞,其中插入细胞基因组中的第一递送媒介物的供体DNA的核苷酸序列编码T细胞受体(TCR)α或δ亚单元恒定区,且插入细胞基因组中的第二递送媒介物的供体DNA的核苷酸序列编码TCRβ或γ亚单元恒定区。在一些情况下,主题方法包括将第一和第二所述递送媒介物引入细胞,其中将第一递送媒介物的供体DNA的核苷酸序列插入充当T细胞受体(TCR)α或γ亚单位启动子的核苷酸序列内,并且将第二递送媒介物的供体DNA的核苷酸序列插入充当TCRβ或δ亚单位启动子的核苷酸序列内。有关TCR蛋白和CDR的更多信息,参见,例如,Dash等,《自然》。2017年7月6日;547(7661):89-93。Epub 2017年6月21日;和Glanville等,《自然》。2017年7月6日;547(7661):94-98。Epub 2017年6月21日。
如上所述,将多个有效负载作为同一包装(递送媒介物)的一部分进行递送的一个优点是,每个有效负载的效率都不会被稀释。在一些实施例中,供体DNA和一种或多种位点特异性核酸酶(或编码它们的一种或多种核酸)是同一递送媒介物的有效负载。在一些实施例中,供体DNA和/或一种或多种基因编辑工具(例如,如本文其他部分所述)(例如,作为同一包装/递送媒介物的一部分,其中所述递送媒介物不必是本公开的纳米颗粒)与蛋白(和/或编码该蛋白的DNA或mRNA)和/或增加基因编辑效率的非编码RNA组合递送。在一些实施例中,一种或多种基因编辑工具(例如,作为同一包装/递送媒介物的一部分,其中所述递送媒介物不必是本公开的纳米颗粒)与蛋白(和/或编码该蛋白的DNA或mRNA)和/或控制细胞分裂和/或分化的非编码RNA组合递送。例如,在一些情况下,一种或多种基因编辑工具(例如,作为同一包装/递送媒介物的一部分,其中所述递送媒介物不必是本公开的纳米颗粒)与蛋白(和/或编码该蛋白的DNA或mRNA)和/或控制细胞分裂的非编码RNA组合递送。在一些情况下,一种或多种基因编辑工具(例如,作为同一包装/递送媒介物的一部分,其中所述递送媒介物不必是本公开的纳米颗粒)与蛋白(和/或编码该蛋白的DNA或mRNA)和/或控制细胞分化的非编码RNA组合递送。在一些情况下,一种或多种基因编辑工具(例如,作为同一包装/递送媒介物的一部分,其中所述递送媒介物不必是本公开的纳米颗粒)与蛋白(和/或编码该蛋白的DNA或mRNA)和/或偏置细胞细胞DNA修复机器的非编码RNA组合递送。
如上所述,在一些情况下,递送媒介物不需要是本公开的纳米颗粒。例如,在一些情况下,传递媒介物是病毒的,而在一些情况下,传递媒介物是非病毒的。非病毒递送系统的示例包括可用于以共聚集多核酸有效负载,或蛋白和核酸有效负载的组合的材料。示例包括但不限于:(1)基于脂质的颗粒,例如两性离子或阳离子脂质,以及外来体(exosome)或外来体衍生的囊泡;(2)无机/杂化复合颗粒,例如包含与核酸和/或蛋白有效负载共聚集的离子复合物的颗粒,以及可以从Ca,Mg,Si,Fe的阳离子性离子态和生理阴离子(如O
共递送的有效负载的示例
在一些实施例中,供体DNA和/或一种或多种基因编辑工具(例如,作为同一包装/递送媒介物的一部分,其中递送媒介物无需是本公开的纳米颗粒)可以与以下的一种或多种组合递送:SCF(和/或编码SCF的DNA或mRNA),HoxB4(和/或编码HoxB4的DNA或mRNA),BCL-XL(和/或编码BCL-XL的DNA或mRNA),SIRT6(和/或编码SIRT6的DNA或mRNA,抑制miR-155的核酸分子(例如siRNA和/或LNA),降低ku70表达的核酸分子(例如siRNA,shRNA,microRNA),和降低ku80表达的核酸分子(例如siRNA,shRNA,microRNA)。
对于可共同递送microRNA的示例(作为RNA或作为编码所述RNA的DNA被递送),参见图9A。例如,以下microRNA可用于以下目的:用于阻断多能干细胞向外胚层谱系的分化:miR-430/427/302;用于阻断多能干细胞向内胚层谱系的分化:miR-109和/或miR-24;用于驱动多能干细胞向内胚层谱系分化:miR-122和/或miR-192;用于驱动外胚层祖细胞向角质形成细胞宿命(fate)的分化:miR-203;用于驱动神经鞘干细胞向平滑肌宿命分化:miR-145;用于驱动神经干细胞向神经胶质细胞宿命和/或向神经元宿命分化:miR-9和/或miR-124a;用于阻断中胚层祖细胞向软骨细胞宿命的分化:miR-199a;用于驱动中胚层祖细胞向成骨细胞宿命的分化:miR-296和/或miR-2861;用于驱动中胚层祖细胞向心肌宿命的分化:miR-1;用于阻断中胚层祖细胞向心肌宿命的分化:miR-133;用于驱动中胚层祖细胞向骨骼肌宿命的分化:miR-214,miR-206,miR-1和/或miR-26a;用于阻断中胚层祖细胞向骨骼肌宿命的分化:miR-133,miR-221,和/或miR-222;用于驱动造血祖细胞向分化的分化:miR-223;用于阻断造血祖细胞向分化的分化:miR-128a和/或miR-181a;用于驱动造血祖细胞向淋巴样祖细胞的分化:miR-181;用于阻断造血祖细胞向淋巴样祖细胞的分化:miR-146;用于阻断造血祖细胞向髓系祖细胞的分化:miR-155,miR-24a,和/或miR-17;用于驱动淋巴祖细胞向T细胞宿命分化:miR-150;用于阻断髓系祖细胞向粒细胞宿命的分化:miR-223;用于阻断髓系祖细胞向单核细胞宿命的分化:miR-17-5p,miR-20a,和/或miR-106a;用于阻断髓系祖细胞向红细胞宿命的分化:miR-150,miR-155,miR-221,和/或miR-222;为了驱动髓系祖细胞向红细胞宿命的分化:miR-451和/或miR-16。
对于可以与供体DND和/或一种或多种基因编辑工具(例如,如本文其他部分所述)一起递送的信号蛋白(例如,细胞外信号蛋白)的示例,参见图9B。例如,以下信号蛋白(例如,细胞外信号蛋白)(例如,作为蛋白或诸如编码该蛋白的DNA或RNA的核酸被递送)可用于以下目的:用于驱动造血干细胞向共同淋巴样祖细胞谱系的分化:IL-7;用于驱动造血干细胞向共同髓系祖细胞谱系分化:IL-3,GM-CSF,和/或M-CSF;用于驱动共同淋巴样祖细胞向B细胞宿命分化:IL-3,IL-4,和/或IL-7;用于驱动共同淋巴祖细胞向自然杀伤细胞宿命的分化:IL-15;用于驱动共同淋巴样祖细胞向T细胞宿命分化:IL-2,IL-7,和/或Notch;用于驱动共同淋巴样祖细胞向树突细胞宿命分化:Flt-3配体;用于驱动共同髓样祖细胞向树突细胞宿命分化:Flt-3配体,GM-CSF,和/或TNF-α;用于驱动共同髓样祖细胞向粒细胞-巨噬细胞祖细胞谱系分化:GM-CSF;用于驱动共同髓样祖细胞向巨核-红系祖细胞谱系分化:IL-3,SCF,和/或Tpo;用于驱动巨核细胞-红系祖细胞向巨核细胞宿命分化:IL-3,IL-6,SCF,和/或Tpo;用于驱动巨核细胞-红系祖细胞向红细胞宿命的分化:促红细胞生成素;用于驱动巨核细胞向血小板宿命的分化:IL-11和/或Tpo;用于驱动粒细胞-巨噬细胞祖细胞向单核细胞谱系分化:GM-CSF和/或M-CSF;用于驱动粒细胞-巨噬细胞祖细胞向成髓细胞谱系分化:GM-CSF;用于驱动单核细胞向单核细胞衍生的树突细胞宿命的分化:Flt-3配体,GM-CSF,IFN-α,和/或IL-4;用于驱动单核细胞向巨噬细胞宿命的分化:IFN-γ,IL-6,IL-10,和/或M-CSF;用于驱动成髓细胞向中性粒细胞宿命的分化:G-CSF,GM-CSF,IL-6,和/或SCF;用于驱动成髓细胞向嗜酸性粒细胞宿命的分化:GM-CSF,IL-3,和/或IL-5;并且用于驱动成髓细胞向嗜碱性粒细胞宿命的分化:G-CSF,GM-CSF,和/或IL-3。
可以与供体DNA和/或一种或多种基因编辑工具(例如,如本文其他部分所述)一起递送的蛋白(例如,作为蛋白和/或诸如编码该蛋白的DNA或RNA的核酸)的示例包括但不限于:SOX17,HEX,OSKM(Oct4/Sox2/Klf4/c-myc),和/或bFGF(例如,驱动向肝干细胞谱系的分化);HNF4a(例如,驱动向肝细胞宿命的分化);聚(I:C),BMP-4,bFGF,和/或8-Br-cAMP(例如,驱动向内皮干细胞/祖细胞谱系的分化);VEGF(例如,促进向动脉内皮宿命的分化);Sox-2,Brn4,Mytl1,Neurod2,Ascl1(例如,驱动向神经干细胞/祖细胞谱系的分化);BDNF,FCS,毛喉萜,和/或SHH(例如,驱动分化神经元,星形胶质细胞,和/或少突胶质细胞宿命)。
可以与供体DNA和/或一种或多种基因编辑工具(例如,如本文其他部分所述)一起递送(例如,作为蛋白和/或如编码该蛋白的DNA或RNA的核酸)的信号蛋白(例如,细胞外信号蛋白)的示例包括但不限于:细胞因子(例如,IL-2和/或IL-15,例如,用于激活CD8+ T细胞);配体和或调节一个或多个Notch,Wnt信号,和/或Smad信号途径的信号蛋白;SCF;干细胞编程因子(例如,Sox2,Oct3/4,Nanog,Klf4,c-Myc等);以及临时表面标志物“标记”和/或荧光报告分子,用于随后的分离/纯化/浓缩。例如,成纤维细胞可以通过Sox2的递送而转化为神经干细胞,而在存在Oct3/4和小分子“表观遗传重置因子”的情况下,它将转化为心肌细胞。在患有亨延顿病或CXCR4突变的患者中,这些成纤维细胞可分别编码与神经元和心脏细胞相关的疾病表型特性(trait)。通过在单个包装中提供基因编辑校正和这些因子,可以显著降低由于一种或多种但非所有因子/有效负载被引入而造成有害影响的风险。
应用包括体内途径,其中细胞死亡提示在基因编辑不成功时可以是有条件的(conditional),且细胞分化/增殖/激活与组织/器官特异性的启动子和/或外源因子关联在一起。接受基因编辑的疾病细胞可能激活并增殖,但是由于存在另一个启动子驱动的表达基因盒(cassette)(例如,与肿瘤抑制子(例如p21或p53)不关联的表达盒),这些细胞随后将被清除。另一方面,可以触发表达想要的特征的细胞,以进一步分化为想要的下游谱系。
试剂盒也在本公开的范围内。例如,在一些情况下,主题试剂盒可包含以下一种或多种(以任何组合):(i)供体DNA;(ii)一种或多种位点特异性核酸酶(或一种或多种编码它们的核酸),如ZFN对,TALEN对,切口酶Ca9,Cpf1等;(iii)一个靶向配体,(iv)接头,(v)缀合至接头的靶向配体,(vi)缀合至锚定结构域的靶向配体(例如,含有或不含有接头),(vii)用作可脱落层的试剂(例如,二氧化硅),(viii)额外的有效负载,例如,siRNA或用于siRNA或shRNA转录模板;基因编辑工具等,(ix)可用作阳离子聚合物的聚合物,(x)可用作阴离子聚合物的聚合物,(xi)可用作阳离子多肽的多肽,例如一种或多种HTP,以及(xii)主题病毒或非病毒的媒介物。在一些情况下,主题试剂盒可能包含使用说明。试剂盒通常包括标明试剂盒内容物预期用途的标签。术语标签包括在试剂盒上的或随试剂盒一起提供的或试剂盒随附的任何书写,或记录的材料,例如计算机可读介质。
程序在无菌,无尘的环境(BSL-II通风橱)中进行。将气密注射器用70%乙醇消毒,然后用过滤的无核酸酶的水冲洗3次,并在使用前于4℃保存。使用前先用RNA酶抑制剂处理表面。
纳米颗粒核
通过将适量的有效负载(在这种情况下为质粒DNA(EGFP-N1质粒)与聚(D-谷氨酸)和聚(L-谷氨酸)的水性混合物(“阴离子聚合物组合物”)组合,制得第一溶液(阴离子溶液)。用10mM Tris-HCl于pH 8.5将该溶液稀释至合适的体积。第二溶液(阳离子溶液),是“阳离子聚合物组合物”和“阳离子多肽组合物”的组合,通过于pH 5.5用60mM HEPES将含有适量聚集剂的浓缩溶液稀释至适当体积而制得。在这种情况下,“阳离子聚合物组合物”是聚(L-精氨酸),“阳离子多肽组合物”是16μg的H3K4(me3)(组蛋白H3尾,在K4上三甲基化)。
可以通过将聚集溶液逐滴滴加到玻璃小瓶或低蛋白结合离心管中的有效负载溶液中,然后于4℃孵育30分钟,来分批进行小于200μl的纳米颗粒核的沉淀。对于大于200μl的批次,可以将两种溶液以微流体形式组合(例如,使用标准混合芯片(例如DolomiteMicromixer)或流体动力流聚焦芯片)。理想的输入流速可以被确定为使得所得到的纳米颗粒核的悬浮液为单分散,表现低于100nm颗粒尺寸。
在这种情况下,以上的两种等体积的溶液(一种阳离子聚集剂和一种阴离子聚集剂)通过混合进行制备。对于阳离子聚集剂溶液,将聚合物/肽溶液添加到一个低蛋白结合管(eppendorf)中,然后用60mM HEPES(pH 5.5)稀释至100μl的总体积(如上所述)。将该溶液保持在室温,同时制备阴离子溶液。对于阴离子聚集剂溶液,将阴离子溶液在冰上冷却并最小化光暴露。用10mM Tris-HCl(pH 8.5)将水溶液中的10μg核酸(约1μg/μl)和7μg的聚(D-谷氨酸)水溶液[.1%]稀释至100μl(如上所述)。
两种溶液均使用0.2微米针筒过滤器过滤,然后转移至其上的1ml的Hamilton气密性注射器(玻璃,(插入产品编号)。每个针筒均置于Harvard Pump 11Elite双针泵上。使用管将注射器连接到Dolomite Micro Mixer芯片的适当入口,然后以120μl/min的速度运行注射泵,使总体积为100μl。所得溶液包括核成分(现包括核酸有效负载,阴离子组分,和阳离子组分)。
核稳定化(增加可脱落层)
为了在核上包覆一层可覆盖的层,然后将所得的纳米颗粒核的悬浮液与硅酸钠在10mM Tris HCl(pH 8.5,10-500mM)中的稀释溶液或氯化钙在10mM PBS(pH 8.5,10-500mM)合并,并以室温孵育1-2小时。在这种情况下,将核组合物添加至稀释的硅酸钠溶液中,以用聚合性二氧化硅的酸不稳定涂层(可脱落层的示例)包覆核。为此,首先将10μl的保存的硅酸钠(Sigma)溶解在1.99ml的Tris缓冲液(10mM Tris pH=8.5,1∶200稀释度)中,并充分混合。使用无菌的0.1-微米注射器过滤器过滤硅酸盐溶液,然后将其转移到安装在注射器泵上的无菌Hamilton气密性注射器中。还将以上所得的核组合物转移到无菌的Hamilton气密性注射器中,该注射器也安装在注射泵上。使用PTFE管将注射器连接到Dolomite MicroMixer芯片的适当入口,并以120μl/min的速度运行注射泵。
可以使用标准离心过滤装置(100kDa Amicon Ultra,密理博(Millipore))纯化稳定的(包覆的)核,或使用高分子量截留膜在30mM HEPES(pH 7.4)中进行透析。在这种情况下,使用离心过滤装置纯化稳定的(包覆的)核。收集的包覆的纳米颗粒(纳米颗粒溶液)用稀释的PBS(1∶800)或HEPES洗涤并再次过滤(该溶液可以重悬于500μl无菌分散缓冲液或无核酸酶的水中以进行保存)。显示了有效的二氧化硅涂层。稳定的核的尺寸为110.6nm,ζ电位为-42.1mV(95%)。
表面涂层(外壳)
通过将配体种(在这种情况下是与9-Arg肽序列融合的狂犬病病毒糖蛋白,作为阳离子锚定结构域-‘RVG9R’)静电地移接至稳定的纳米颗粒(在这种情况下为二氧化硅涂层)的带负电荷的表面,可以完成表面涂层(也称为外壳)的添加,有时也称为“表面功能化”。首先将二氧化硅包覆的纳米颗粒过滤并重悬于分散缓冲液或水中,确定每种纳米颗粒悬液的最终体积,以及所需添加的聚合物或肽的量,以使质子化胺基的最终浓度至少为75uM。加入所需的表面成分,并将溶液超声处理20-30秒,然后孵育1小时。离心过滤以300kDa进行(可以使用标准离心过滤设备,例如Amicon Ultra Millipore的300-500kDa纯化最终产品,或使用高分子量截留膜在30mM HEPES(pH 7.4)中进行透析),最后在细胞培养基或分散缓冲液中进行重悬。在一些情况下,最佳的外壳添加会产生单分散悬液,颗粒的平均颗粒尺寸在50到150nm之间,ζ电位在0到-10mV之间。在这种情况下,具有外壳的纳米颗粒的尺寸为115.8nm,ζ电位为-3.1mV(100%)。
于室温,37℃或阳离子和阴离子组分在室温和37℃之间的差值下合成纳米颗粒。在阳离子和阴离子组分混合过程中利用自然静电相互作用在水性缓冲液中制备溶液。开始时,将阴离子组分溶解在Tris缓冲液(30mM-60mM;pH=7.4-9)或HEPES缓冲液(30mM,pH=5.5)中,将阳离子组分溶解在HEPES缓冲液(30mM-60mM,pH=5-6.5)中。
具体地,有效负载(例如,遗传物质(RNA或DNA),遗传物质-蛋白-细胞核定位信号多肽复合物(核蛋白),或多肽)在碱性,中性或酸性缓冲液中重构。出于分析目的,将有效负载制造成与荧光团共价地标记或基因地编码荧光团。使用对AGAGAG串联重复序列具有特异性的具有pDNA有效负载的Cy5标记的肽核酸(PNA)来荧光地标记荧光报告蛋白载体和荧光报告蛋白-治疗基因载体。还在碱性,中性或酸性缓冲液中重构定时释放的组分,该组分也可用作带负电荷的聚集物(例如聚谷氨酸)。具有与接头-锚序列缀合的野生型衍生的或野生型突变的靶向肽的靶向配体在酸性缓冲液中重构。在纳米颗粒中包含有其他聚集物或细胞核定位信号肽的情况下,它们也在缓冲液中重构,作为阳离子物的0.03%w/v工作溶液和阴离子物的0.015%w/v。还使用阳离子物的0.1%w/v的工作溶液和阴离子物的0.1%w/v的进行实验。除与遗传物质复合的多肽外,所有多肽均进行10分钟的超声波处理以提高溶解性。
上述本主题事项的各方面,包括实施例,可以与一个或多个其他方面或实施例单独或组合使用。无意于限制上述描述,以下在组A和组B中提供了本公开的某些非限制性方面。如在阅读本公开时对本领域的普通技术人员将显而易见的那样,每个独立编号的方面可被使用,或结合任何在之前或之后独立编号的方面。这旨在为各方面的所有此类组合提供支持,并且不限于以下明确提供的各方面的组合。对于本领域的普通技术人员将显而易见的是,在不脱离本发明的精神或范围的情况下,可以进行各种改变和修改。
1.在靶细胞中进行基因组编辑的方法,包括:
(a)在所述靶细胞的基因组内的两个位置产生具有交错端的双链切割,从而产生第一基因组交错端和第二基因组交错端;和
(b)将在每端均具有5’或3’突出端的线性双链供体DNA引入所述靶细胞,
其中,所述供体DNA的一端与所述第一基因组的交错端杂交,所述供体DNA的另一端与所述第二基因组的交错端杂交,从而导致所述线性双链供体DNA插入所述靶细胞的基因组。
2.根据1所述的方法,其中,所述供体DNA的至少一端具有5’突出端,并且所述基因组的交错端中的至少一个具有5’突出端。
3.根据1或2所述的方法,其中,所述供体DNA的至少一端具有3’突出端,并且所述基因组的交错端中的至少一个具有3’突出端。
4.根据1-3中任一项所述的方法,其中,所述产生包括将一种或多种序列特异性核酸酶,或编码所述一种或多种序列特异性核酸酶的一种或多种核酸引入所述靶细胞以产生所述双链切割。
5.根据4所述的方法,其中,所述一种或多种序列特异性核酸酶包含以下至少一种:大范围核酸酶,归巢核酸内切酶,锌指核酸酶(ZFN),和转录激活因子样效应物核酸酶(TALEN)。
6.根据4所述的方法,其中,所述一种或多种序列特异性核酸酶包含交错端切割CRISPR/Cas效应蛋白。
7.根据6所述的方法,其中,所述产生进一步包括将CRISPR/Cas向导核酸,或编码所述CRISPR/Cas向导核酸的核酸引入所述细胞。
8.根据4-7中任一项所述的方法,其中,所述方法包括将以下作为同一递送媒介物的有效负载引入所述细胞:(i)所述一种或多种序列特异性核酸酶,或编码所述一种或多种序列特异性核酸酶的一种或多种核酸,和(ii)所述线性双链供体DNA。
9.根据8所述的方法,其中,将所述一种或多种序列特异性核酸酶和所述线性双链供体DNA作为脱氧核糖核蛋白复合物或核糖-脱氧核糖核蛋白复合物引入所述细胞。
10.根据8或9所述的方法,其中,在所述引入期间,所述供体DNA的所述端以位点特异性方式结合至所述一种或多种序列特异性核酸酶。
11.根据8-10中任一项所述的方法,其中,所述递送媒介物是非病毒的。
12.根据8-11中任一项所述的方法,其中,所述递送媒介物是纳米颗粒。
13.根据12所述的方法,其中,除了(i)和(ii)之外,所述纳米颗粒还包含核,所述核包含阴离子聚合物组合物,阳离子聚合物组合物,和阳离子多肽组合物。
14.根据13所述的方法,其中,所述阴离子聚合物组合物包含选自聚(谷氨酸)和聚(天冬氨酸)的阴离子聚合物。
15.根据13或14所述的方法,其中,所述阳离子聚合物组合物包含选自聚(精氨酸),聚(赖氨酸),聚(组氨酸),聚(鸟氨酸),和聚(瓜氨酸)的阳离子聚合物。
16.根据13-15中任一项所述的方法,其中,纳米颗粒进一步包含包裹所述核的可脱落层。
17.根据16所述的方法,其中,所述可脱落层是阴离子涂层或阳离子涂层。
18.根据16或17所述的方法,其中,所述可脱落层包含以下一种或多种:二氧化硅,类肽,聚半胱氨酸,钙,氧化钙,羟基磷灰石,磷酸钙,硫酸钙,锰,氧化锰,磷酸锰,硫酸锰,镁,氧化镁,磷酸镁,硫酸镁,铁,氧化铁,磷酸铁,和硫酸铁。
19.根据16-18中任一项所述的方法,其中,所述纳米颗粒进一步包含包围所述可脱落层的表面涂层。
20.根据19所述的方法,其中,所述表面涂层包含与所述可脱落层静电地相互作用的阳离子或阴离子锚定结构域。
21.根据19或20所述的方法,其中,所述表面涂层包含一种或多种靶向配体。
22.根据19或20所述的方法,其中,所述表面涂层包含一种或多种靶向配体,所述靶向配体选自:狂犬病病毒糖蛋白(RVG)片段,ApoE-转铁蛋白,乳铁蛋白,黑素铁蛋白,卵转铁蛋白,L-选择素,E-选择素,P-选择素,唾液酸化肽,聚唾液酸化O-连接肽,TPO,EPO,PSGL-1,ESL-1,CD44,死亡受体-3(DR3),LAMP1,LAMP2,Mac2-BP,干细胞因子(SCF),CD70,含SH2结构域的蛋白1A(SH2D1A),毒蜥外泌肽-4,GLP1,RGD,转铁蛋白配体,FGF片段,琥珀酸,二膦酸盐,造血干细胞趋化脂质,鞘氨醇,神经酰胺,鞘氨醇-1-磷酸盐,神经酰胺-1-磷酸盐,和任何上述靶向配体的活性靶向片段。
23.根据19或20所述的方法,其中,所述表面涂层包含一种或多种靶向配体,所述靶向配体提供与靶的靶向结合,所述靶选自:CD3,CD28,CD90,CD45f,CD34,CD80,CD86,CD3-ε,CD3-γ,CD3-δ;TCRα,TCRβ,TCRγ,和/或TCRδ恒定区;4-1BB,OX40,OX40L,CD62L,ARP5,CCR5,CCR7,CCR10,CXCR3,CXCR4,CD94/NKG2,NKG2A,NKG2B,NKG2C,NKG2E,NKG2H,NKG2D,NKG2F,NKp44,NKp46,NKp30,DNAM,XCR1,XCL1,XCL2,ILT,LIR,Ly49,IL2,IL7,IL10,IL12,IL15,IL18,TNFα,IFNγ,TGF-β,和α5β1。
24.根据19或20所述的方法,其中,所述表面涂层包含一种或多种靶向配体,所述靶向配体提供与靶细胞的靶向结合,所述靶细胞选自:骨髓细胞,造血干细胞(HSC),造血干细胞和祖细胞(HSPC),外周血单核细胞(PBMC),髓系祖细胞,淋巴样祖细胞,T细胞,B细胞,NKT细胞,NK细胞,树突细胞,单核细胞,粒细胞,红细胞,巨核细胞,肥大细胞,嗜碱性粒细胞,嗜酸性粒细胞,嗜中性粒细胞,巨噬细胞,红系祖细胞,巨核细胞-红系祖细胞(MEP),共同髓系祖细胞(CMP),多能祖细胞(MPP),造血干细胞(HSC),短期HSC(ST-HSC),IT-HSC,长期HSC(LT-HSC),内皮细胞,神经元,星形胶质细胞,胰腺细胞,胰岛β细胞,肝脏细胞,肌细胞,骨骼肌细胞,心肌细胞,肝细胞,脂肪细胞,肠细胞,结肠细胞,和胃细胞。
25.根据8-10中任一项所述的方法,其中,所述递送媒介物是与所述有效负载缀合的靶向配体,其中,所述靶向配体提供与细胞表面蛋白的靶向结合。
26.根据8-10中任一项所述的方法,其中,所述递送媒介物是与带电荷的聚合物多肽结构域缀合的靶向配体,其中,所述靶向配体提供与细胞表面蛋白的靶向结合,并且其中,所述带电荷的聚合物多肽结构域与核酸有效负载聚集和/或与蛋白有效负载静电地相互作用。
27.根据25或26所述的方法,其中,所述靶向配体是肽,ScFv,F(ab),核酸适体,或类肽。
28.根据26所述的方法,其中,所述带电荷的聚合物多肽结构域具有在3至30个氨基酸的范围内的长度。
29.根据26-28中任一项所述的方法,其中,所述递送媒介物进一步包含与所述有效负载和所述带电荷的聚合物多肽结构域相互作用的阴离子聚合物。
30.根据29所述的方法,其中,所述阴离子聚合物选自聚(谷氨酸)和聚(天冬氨酸)。
31.根据25-30中任一项所述的方法,其中,所述靶向配体具有5-50个氨基酸的长度。
32.根据25-31中任一项所述的方法,其中,所述靶向配体提供与细胞表面蛋白的靶向结合,所述细胞表面蛋白选自B族G蛋白偶联受体(GPCR),受体酪氨酸激酶(RTK),细胞表面糖蛋白,和细胞-细胞粘附分子。
33.根据25-31中任一项所述的方法,其中,所述靶向配体选自:狂犬病病毒糖蛋白(RVG)片段,ApoE-转铁蛋白,乳铁蛋白,黑素铁蛋白,卵转铁蛋白,L-选择素,E-选择素,P-选择素,唾液酸化肽,聚唾液酸化O-连接肽,TPO,EPO,PSGL-1,ESL-1,CD44,死亡受体-3(DR3),LAMP1,LAMP2,Mac2-BP,干细胞因子(SCF),CD70,含SH2结构域的蛋白1A(SH2D1A),毒蜥外泌肽-4,GLP1,RGD,转铁蛋白配体,FGF片段,琥珀酸,二膦酸盐,造血干细胞趋化脂质,鞘氨醇,神经酰胺,鞘氨醇-1-磷酸盐,神经酰胺-1-磷酸盐,和任何上述靶向配体的活性靶向片段。
34.根据25-31中任一项所述的方法,其中,所述靶向配体提供与靶的靶向结合,所述靶选自:CD3,CD28,CD90,CD45f,CD34,CD80,CD86,CD3-ε,CD3-γ,CD3-δ;TCRα,TCRβ,TCRγ,和/或TCRδ恒定区;4-1BB,OX40,OX40L,CD62L,ARP5,CCR5,CCR7,CCR10,CXCR3,CXCR4,CD94/NKG2,NKG2A,NKG2B,NKG2C,NKG2E,NKG2H,NKG2D,NKG2F,NKp44,NKp46,NKp30,DNAM,XCR1,XCL1,XCL2,ILT,LIR,Ly49,IL2,IL7,IL10,IL12,IL15,IL18,TNFα,IFNγ,TGF-β,和α5β1。
35.根据25-31中任一项所述的方法,其中,所述靶向配体提供与细胞类型的结合,所述细胞类型选自:骨髓细胞,造血干细胞(HSC),长期HSC,短期HSC,造血干细胞和祖细胞(HSPC),外周血单核细胞(PBMC),髓系祖细胞,淋巴样祖细胞,T细胞,B细胞,NKT细胞,NK细胞,树突细胞,单核细胞,粒细胞,红细胞,巨核细胞,肥大细胞,嗜碱性粒细胞,嗜酸性粒细胞,嗜中性粒细胞,巨噬细胞,红系祖细胞(例如,HUDEP细胞),巨核细胞-红系祖细胞(MEP),共同髓系祖细胞(CMP),多能祖细胞(MPP),造血干细胞(HSC),短期HSC(ST-HSC),IT-HSC,长期HSC(LT-HSC),内皮细胞,神经元,星形胶质细胞,胰腺细胞,胰岛β细胞,肌细胞,骨骼肌细胞,心肌细胞,肝细胞,脂肪细胞,肠细胞,结肠细胞,和胃细胞。
36.根据1-35中任一项所述的方法,其中,在所述靶细胞的基因组内的所述两个位置产生所述双链切割之前,所述两个位置相隔1,000,000个碱基对或更少。
37.根据1-35中任一项所述的方法,其中,在所述靶细胞的基因组内的所述两个位置产生所述双链切割之前,所述两个位置相隔100,000个碱基对或更少。
38.根据1-35中任一项所述的方法,其中,所述供体DNA总共具有10个碱基对(bp)至100千个碱基对(kbp)。
39.根据1-38中任一项所述的方法,其中,所述供体DNA的所述插入发生在编码T细胞受体(TCR)蛋白的核苷酸序列内。
40.根据39所述的方法,其中,所述供体DNA编码所述TCR蛋白的CDR1,CDR2,或CDR3区域的氨基酸。
41.根据1-38中任一项所述的方法,其中,所述供体DNA包含编码嵌合抗原受体(CAR)的核苷酸序列,并且其中,所述供体DNA的插入导致编码所述CAR的所述核苷酸序列与内源性T细胞启动子的可操作的连接。
42.根据1-38中任一项所述的方法,其中,所述供体DNA包含与启动子可操作地连接并编码嵌合抗原受体(CAR)的核苷酸序列。
43.根据1-38中任一项所述的方法,其中,所述供体DNA包含编码细胞特异性靶向配体的核苷酸序列,所述细胞特异性靶向配体是膜结合并在细胞外呈现,并且其中,所述供体DNA的插入导致编码所述细胞特异性靶向配体的所述核苷酸序列与内源性启动子的可操作的连接。
44.根据1-38中任一项所述的方法,其中,所述供体DNA包含与编码细胞特异性靶向配体的序列可操作地连接的启动子,所述细胞特异性靶向配体是膜结合并在细胞外呈现。
45.根据1-38中任一项所述的方法,其中,所述方法包含:
在所述靶细胞的基因组内的四个位置产生具有交错端的双链切割,从而除所述第一和第二基因组的交错端之外还产生第三基因组的交错端和第四基因组的交错端;和
引入两个线性双链供体DNA,每个线性双链供体DNA在每端均具有5’或3’突出端,
其中,一个供体DNA的所述端与所述第一和第二基因组的交错端杂交,另一个供体DNA的所述端与所述第三和第四基因组的交错端杂交和端,
从而导致所述两个供体DNA插入所述靶细胞的基因组。
46.根据45所述的方法,其中:
一个供体DNA的插入发生在编码T细胞受体(TCR)α或δ亚单位的核苷酸序列内,另一个供体DNA的插入发生在编码TCRβ或γ亚单位的核苷酸序列内。
47.根据45所述的方法,其中一个供体DNA的插入发生在编码T细胞受体(TCR)α或δ亚单位恒定区的核苷酸序列内,而另一个供体DNA的插入发生在编码TCRβ或γ亚单位恒定区的核苷酸序列内。
48.根据45所述的方法,其中:
一个供体DNA的插入发生在充当T细胞受体(TCR)α或δ亚单位启动子的核苷酸序列内,另一个供体DNA的插入发生在充当TCRβ或γ亚单位启动子的核苷酸序列内。
49.根据1-48中任一项所述的方法,其中,所述供体DNA的插入导致所述插入的供体DNA与T细胞受体(TCR)α,β,γ,或δ内源性启动子的可操作的连接。
50.根据1-48中任一项所述的方法,其中,所述供体DNA包含与TCRα,β,γ,或δ启动子可操作地连接的编码蛋白的核苷酸序列。
51.根据1-48中任一项所述的方法,其中,所述供体DNA的插入导致所述插入的供体DNA与CD3或CD28启动子的可操作的连接。
52.根据1-48中任一项所述的方法,其中,所述供体DNA包含与T细胞特异性启动子可操作地连接的编码蛋白的核苷酸序列。
53.根据1-48中任一项所述的方法,其中,所述供体DNA包含与启动子可操作地连接的编码蛋白的核苷酸序列。
54.根据1-48中任一项所述的方法,其中,所述供体DNA的插入导致所述插入的供体DNA与干细胞特异性或体细胞特异性内源性启动子的可操作的连接。
55.根据1-54中任一项所述的方法,其中,所述供体DNA包含编码报告蛋白(例如,近IR和/或远红报告蛋白,例如,用于评估基因编辑效率)的核苷酸序列。
56.根据55所述的方法,其中,所述供体DNA的插入导致所述所插入的供体DNA与内源性启动子的可操作的连接。
57.根据55所述的方法,其中,所述供体DNA包含与编码所述报告蛋白的核苷酸序列可操作地连接的启动子。
58.根据1-57中任一项所述的方法,其中,所述供体DNA包含不具有内含子的编码蛋白的核苷酸序列。
59.根据58所述的方法,其中,所述不具有内含子的核苷酸序列编码TCR蛋白的全部或一部分。
60.根据1-59中任一项所述的方法,其中,所述供体DNA具有至少一个腺苷酸化的3’端。
61.根据1-60中任一项所述的方法,其中,所述靶细胞是哺乳动物细胞。
62.根据1-61中任一项所述的方法,其中,所述靶细胞是人细胞。
63.一种试剂盒或组合物,包含:
(a)线性双链供体DNA,其在每端均具有5’或3’突出端;和
(b)序列特异性核酸酶,或编码所述序列特异性核酸酶的核酸,
其中(a)和(b)是作为同一递送媒介物一部分的有效负载。
64.根据63所述的试剂盒或组合物,其中,所述递送媒介物是纳米颗粒。
65.根据64所述的试剂盒或组合物,其中,所述纳米颗粒包含核,所述核包含(a),(b),阴离子聚合物组合物,阳离子聚合物组合物,和阳离子多肽组合物。
66.根据64或65所述的试剂盒或组合物,其中,所述纳米颗粒包含使所述纳米颗粒靶向细胞表面蛋白的靶向配体。
67.根据63-66中任一项所述的试剂盒或组合物,其中,所述线性双链供体和所述序列特异性核酸酶彼此结合而形成脱氧核糖核蛋白或核糖-脱氧核糖核蛋白复合物。
68.根据63-67中任一项所述的试剂盒或组合物,其中,所述递送媒介物是与带电荷的聚合物多肽结构域缀合的靶向配体,其中,所述靶向配体提供与细胞表面蛋白的靶向结合,并且其中,所述带电荷的聚合物多肽结构域与所述有效负载静电地相互作用。
69.根据68所述的试剂盒或组合物,其中,所述递送媒介物还包含与所述有效负载和所述带电荷的聚合物多肽结构域相互作用的阴离子聚合物。
70.根据63-67中任一项所述的试剂盒或组合物,其中,所述递送媒介物是与(a)和/或(b)缀合的靶向配体,其中,所述靶向配体提供与细胞表面蛋白的靶向结合。
71.根据63-67中任一项所述的试剂盒或组合物,其中,所述递送媒介物包括靶向配体,所述靶向配体包覆在水-油-水乳液颗粒上,油-水乳液胶束颗粒上,多层水-油-水乳液颗粒上,多层状颗粒上,或DNA折叠纳米机器人上。
72.根据66-71中任一项所述的方法,其中,所述靶向配体是肽,ScFv,F(ab),核酸适体,或类肽。
73.根据63-67中任一项所述的试剂盒或组合物,其中,所述递送媒介物是非病毒的。
1.在靶细胞中进行基因组编辑的方法,包括:
(a)在所述靶细胞的基因组内的两个位置产生具有交错端的双链切割,从而产生第一基因组的交错端和第二基因组的交错端;和
(b)将在每端均具有5’或3’突出端的线性双链供体DNA引入所述靶细胞,
其中,所述供体DNA的一端与所述第一基因组的交错端杂交,所述供体DNA的另一端与所述第二基因组的交错端杂交,从而导致所述线性双链供体DNA插入所述靶细胞的基因组。
2.根据1所述的方法,其中,所述供体DNA的至少一端具有5’突出端,并且所述基因组的交错端中的至少一个具有5’突出端。
3.根据1或2所述的方法,其中,所述供体DNA的至少一端具有3’突出端,并且所述基因组的交错端中的至少一个具有3’突出端。
4.根据1-3中任一项所述的方法,其中,所述产生包括将一种或多种序列特异性核酸酶,或编码所述一种或多种序列特异性核酸酶的一种或多种核酸引入所述靶细胞以产生所述双链切割。
5.根据4所述的方法,其中,所述一种或多种序列特异性核酸酶包含以下至少一种:大范围核酸酶,归巢核酸内切酶,锌指核酸酶(ZFN),和转录激活因子样效应物核酸酶(TALEN)。
6.根据4所述的方法,其中,所述一种或多种序列特异性核酸酶包含交错端切割CRISPR/Cas效应蛋白。
7.根据6所述的方法,其中,所述产生进一步包括将CRISPR/Cas向导核酸,或编码所述CRISPR/Cas向导核酸的核酸引入所述细胞。
8.根据4-7中任一项所述的方法,其中,所述方法包括将以下作为同一递送媒介物的有效负载引入所述细胞:(i)所述一种或多种序列特异性核酸酶,或编码所述一种或多种序列特异性核酸酶的一种或多种核酸,和(ii)所述线性双链供体DNA。
9.根据8所述的方法,其中,将所述一种或多种序列特异性核酸酶和所述线性双链供体DNA作为脱氧核糖核蛋白复合物或核糖-脱氧核糖核蛋白复合物引入所述细胞。
10.根据8或9所述的方法,其中,在所述引入期间,所述供体DNA的所述端以位点特异性方式结合至所述一种或多种序列特异性核酸酶。
11.根据8-10中任一项所述的方法,其中,所述递送媒介物是非病毒的。
12.根据8-11中任一项所述的方法,其中,所述递送媒介物是纳米颗粒。
13.根据12所述的方法,其中,除了(i)和(ii)之外,所述纳米颗粒还包含核,所述核包含阴离子聚合物组合物,阳离子聚合物组合物,和阳离子多肽组合物。
14.根据13所述的方法,其中,所述阴离子聚合物组合物包含选自聚(谷氨酸)和聚(天冬氨酸)的阴离子聚合物。
15.根据13或14所述的方法,其中,所述阳离子聚合物组合物包含选自聚(精氨酸),聚(赖氨酸),聚(组氨酸),聚(鸟氨酸),和聚(瓜氨酸)的阳离子聚合物。
16.根据13-15中任一项所述的方法,其中,纳米颗粒进一步包含包裹所述核的可脱落层。
17.根据16所述的方法,其中,所述可脱落层是阴离子涂层或阳离子涂层。
18.根据16或17所述的方法,其中,所述可脱落层包含以下一种或多种:二氧化硅,类肽,聚半胱氨酸,钙,氧化钙,羟基磷灰石,磷酸钙,硫酸钙,锰,氧化锰,磷酸锰,硫酸锰,镁,氧化镁,磷酸镁,硫酸镁,铁,氧化铁,磷酸铁,和硫酸铁。
19.根据16-18中任一项所述的方法,其中,所述纳米颗粒进一步包含包围所述可脱落层的表面涂层。
20.根据19所述的方法,其中,所述表面涂层包含与所述可脱落层静电地相互作用的阳离子或阴离子锚定结构域。
21.根据19或20所述的方法,其中,所述表面涂层包含一种或多种靶向配体。
22.根据19或20所述的方法,其中,所述表面涂层包含一种或多种靶向配体,所述靶向配体选自:狂犬病病毒糖蛋白(RVG)片段,ApoE-转铁蛋白,乳铁蛋白,黑素铁蛋白,卵转铁蛋白,L-选择素,E-选择素,P-选择素,唾液酸化肽,聚唾液酸化O-连接肽,TPO,EPO,PSGL-1,ESL-1,CD44,死亡受体-3(DR3),LAMP1,LAMP2,Mac2-BP,干细胞因子(SCF),CD70,含SH2结构域的蛋白1A(SH2D1A),毒蜥外泌肽,毒蜥外泌肽-S11C,GLP1,RGD,转铁蛋白配体,FGF片段,α5β1配体,IL2,Cde3-ε,肽-HLA-A*2402,CD80,CD86,琥珀酸,二膦酸盐,造血干细胞趋化脂质,鞘氨醇,神经酰胺,鞘氨醇-1-磷酸盐,神经酰胺-1-磷酸盐,和任何上述靶向配体的活性靶向片段。
23.根据19或20所述的方法,其中,所述表面涂层包含一种或多种靶向配体,所述靶向配体提供与靶的靶向结合,所述靶选自:CD3,CD8,CD4,CD28,CD90,CD45f,CD34,CD80,CD86,CD3-ε,CD3-γ,CD3-δ;TCRα,TCRβ,TCRγ,和/或TCRδ恒定区;4-1BB,OX40,OX40L,CD62L,ARP5,CCR5,CCR7,CCR10,CXCR3,CXCR4,CD94/NKG2,NKG2A,NKG2B,NKG2C,NKG2E,NKG2H,NKG2D,NKG2F,NKp44,NKp46,NKp30,DNAM,XCR1,XCL1,XCL2,ILT,LIR,Ly49,IL2R,IL7R,IL10R,IL12R,IL15R,IL18R,TNFα,IFNγ,TGF-β,和α5β1。
24.根据19或20所述的方法,其中,所述表面涂层包含一种或多种靶向配体,所述靶向配体提供与靶细胞的靶向结合,所述靶细胞选自:骨髓细胞,造血干细胞(HSC),造血干细胞和祖细胞(HSPC),外周血单核细胞(PBMC),髓系祖细胞,淋巴样祖细胞,T细胞,B细胞,NKT细胞,NK细胞,树突细胞,单核细胞,粒细胞,红细胞,巨核细胞,肥大细胞,嗜碱性粒细胞,嗜酸性粒细胞,嗜中性粒细胞,巨噬细胞,红系祖细胞,巨核细胞-红系祖细胞(MEP),共同髓系祖细胞(CMP),多能祖细胞(MPP),造血干细胞(HSC),短期HSC(ST-HSC),IT-HSC,长期HSC(LT-HSC),内皮细胞,神经元,星形胶质细胞,胰腺细胞,胰岛β细胞,肝脏细胞,肌细胞,骨骼肌细胞,心肌细胞,肝细胞,脂肪细胞,肠细胞,结肠细胞,和胃细胞。
25.根据8-10中任一项所述的方法,其中,所述递送媒介物是与所述有效负载缀合的靶向配体,其中,所述靶向配体提供与细胞表面蛋白的靶向结合。
26.根据8-10中任一项所述的方法,其中,所述递送媒介物是与带电荷的聚合物多肽结构域缀合的靶向配体,其中,所述靶向配体提供与细胞表面蛋白的靶向结合,并且其中,所述带电荷的聚合物多肽结构域与核酸有效负载聚集和/或与蛋白有效负载静电地相互作用。
27.根据25或26所述的方法,其中,所述靶向配体是肽,ScFv,F(ab),核酸适体,或类肽。
28.根据26所述的方法,其中,所述带电荷的聚合物多肽结构域具有在3至30个氨基酸的范围内的长度。
29.根据26-28中任一项所述的方法,其中,所述递送媒介物进一步包含与所述有效负载和所述带电荷的聚合物多肽结构域相互作用的阴离子聚合物。
30.根据29所述的方法,其中,所述阴离子聚合物选自聚(谷氨酸)和聚(天冬氨酸)。
31.根据25-30中任一项所述的方法,其中,所述靶向配体具有5-50个氨基酸的长度。
32.根据25-31中任一项所述的方法,其中,所述靶向配体提供与细胞表面蛋白的靶向结合,所述细胞表面蛋白选自B族G蛋白偶联受体(GPCR),受体酪氨酸激酶(RTK),细胞表面糖蛋白,和细胞-细胞粘附分子。
33.根据25-31中任一项所述的方法,其中,所述靶向配体选自:狂犬病病毒糖蛋白(RVG)片段,ApoE-转铁蛋白,乳铁蛋白,黑素铁蛋白,卵转铁蛋白,L-选择素,E-选择素,P-选择素,唾液酸化肽,聚唾液酸化O-连接肽,TPO,EPO,PSGL-1,ESL-1,CD44,死亡受体-3(DR3),LAMP1,LAMP2,Mac2-BP,干细胞因子(SCF),CD70,含SH2结构域的蛋白1A(SH2D1A),毒蜥外泌肽,毒蜥外泌肽-S11C,GLP1,RGD,转铁蛋白配体,FGF片段,α5β1配体,IL2,Cde3-ε,肽-HLA-A*2402,CD80,CD86,琥珀酸,二膦酸盐,造血干细胞趋化脂质,鞘氨醇,神经酰胺,鞘氨醇-1-磷酸盐,神经酰胺-1-磷酸盐,和任何上述靶向配体的活性靶向片段。
34.根据25-31中任一项所述的方法,其中,所述靶向配体提供与靶的靶向结合,所述靶选自:CD3,CD8,CD4,CD28,CD90,CD45f,CD34,CD80,CD86,CD3-ε,CD3-γ,CD3-δ;TCRα,TCRβ,TCRγ,和/或TCRδ恒定区;4-1BB,OX40,OX40L,CD62L,ARP5,CCR5,CCR7,CCR10,CXCR3,CXCR4,CD94/NKG2,NKG2A,NKG2B,NKG2C,NKG2E,NKG2H,NKG2D,NKG2F,NKp44,NKp46,NKp30,DNAM,XCR1,XCL1,XCL2,ILT,LIR,Ly49,IL2R,IL7R,IL10R,IL12R,IL15R,IL18R,TNFα,IFNγ,TGF-β,和α5β1。
35.根据25-31中任一项所述的方法,其中,所述靶向配体提供与细胞类型的结合,所述细胞类型选自:骨髓细胞,造血干细胞(HSC),长期HSC,短期HSC,造血干细胞和祖细胞(HSPC),外周血单核细胞(PBMC),髓系祖细胞,淋巴样祖细胞,T细胞,B细胞,NKT细胞,NK细胞,树突细胞,单核细胞,粒细胞,红细胞,巨核细胞,肥大细胞,嗜碱性粒细胞,嗜酸性粒细胞,嗜中性粒细胞,巨噬细胞,红系祖细胞(例如,HUDEP细胞),巨核细胞-红系祖细胞(MEP),共同髓系祖细胞(CMP),多能祖细胞(MPP),造血干细胞(HSC),短期HSC(ST-HSC),IT-HSC,长期HSC(LT-HSC),内皮细胞,神经元,星形胶质细胞,胰腺细胞,胰岛β细胞,肌细胞,骨骼肌细胞,心肌细胞,肝细胞,脂肪细胞,肠细胞,结肠细胞,和胃细胞。
36.根据1-35中任一项所述的方法,其中,在所述靶细胞的基因组内的所述两个位置产生所述双链切割之前,所述两个位置相隔1,000,000个碱基对或更少。
37.根据1-35中任一项所述的方法,其中,在所述靶细胞的基因组内的所述两个位置产生所述双链切割之前,所述两个位置相隔100,000个碱基对或更少。
38.根据1-35中任一项所述的方法,其中,在所述TCR α基因座处或所述TCR β基因座处产生所述第一和第二基因组的交错端。
39.根据1-35中任一项所述的方法,其中,(1)使用图59所示的一个或多个CRISPR/Cas向导RNA(gRNA)序列,和/或(2)通过靶向图59所示的一个或多个TALEN序列,以产生所述第一和第二基因组的交错端中的至少一个。
40.根据1-35中任一项所述的方法,其中,所述供体DNA总共具有10个碱基对(bp)至100千个碱基对(kbp)。
41.根据1-40中任一项所述的方法,其中,所述供体DNA的所述插入发生在编码T细胞受体(TCR)蛋白的核苷酸序列内。
42.根据41所述的方法,其中,所述供体DNA编码所述TCR蛋白的CDR1,CDR2,或CDR3区域的氨基酸。
43.根据1-40中任一项所述的方法,其中,所述供体DNA包含编码嵌合抗原受体(CAR)的核苷酸序列,并且其中,所述供体DNA的插入导致编码所述CAR的所述核苷酸序列与内源性T细胞启动子的可操作的连接。
44.根据1-40中任一项所述的方法,其中,所述供体DNA包含与启动子可操作地连接并编码嵌合抗原受体(CAR)的核苷酸序列。
45.根据1-40中任一项所述的方法,其中,所述供体DNA包含编码细胞特异性靶向配体的核苷酸序列,所述细胞特异性靶向配体是膜结合并在细胞外呈现,并且其中,所述供体DNA的插入导致编码所述细胞特异性靶向配体的所述核苷酸序列与内源性启动子的可操作的连接。
46.根据1-40中任一项所述的方法,其中,所述供体DNA包含与编码细胞特异性靶向配体的序列可操作地连接的启动子,所述细胞特异性靶向配体是膜结合并在细胞外呈现。
47.根据1-40中任一项所述的方法,其中,所述方法包含:
在所述靶细胞的基因组内的四个位置产生具有交错端的双链切割,从而除所述第一和第二基因组的交错端之外还产生第三基因组的交错端和第四基因组的交错端;和
引入两个线性双链供体DNA,每个线性双链供体DNA在每端均具有5’或3’突出端,
其中,一个供体DNA的所述端与所述第一和第二基因组的交错端杂交,另一个供体DNA的所述端与所述第三和第四基因组的交错端杂交和端,
从而导致所述两个供体DNA插入所述靶细胞的基因组。
48.根据47所述的方法,其中:
(1)一个供体DNA的插入发生在编码T细胞受体(TCR)α或δ亚单位的核苷酸序列内,另一个供体DNA的插入发生在编码TCR β或γ亚单位的核苷酸序列内;或
(2)一个供体DNA的插入发生在编码T细胞受体(TCR)α或γ亚单位的核苷酸序列内,另一个供体DNA的插入发生在编码TCR β或δ亚单位的核苷酸序列内;或
(3)一个供体DNA的插入发生在编码IgA,IgD,IgE,IgG,或IgM蛋白的κ链的核苷酸序列内,另一个供体DNA的插入发生在编码IgA,IgD,IgE,IgG,或IgM蛋白的λ链的核苷酸序列内。
49.根据47所述的方法,其中一个供体DNA的插入发生在编码T细胞受体(TCR)α或δ亚单位恒定区的核苷酸序列内,而另一个供体DNA的插入发生在编码TCR β或γ亚单位恒定区的核苷酸序列内。
50.根据47所述的方法,其中:
(1)一个供体DNA的插入发生在充当T细胞受体(TCR)α或δ亚单位启动子的核苷酸序列内,另一个供体DNA的插入发生在充当TCR β或γ亚单位启动子的核苷酸序列内;或
(2)一个供体DNA的插入发生在充当T细胞受体(TCR)α或γ亚单位启动子的核苷酸序列内,另一个供体DNA的插入发生在充当TCR β或δ亚单位启动子的核苷酸序列内;或
(3)一个供体DNA的插入发生在充当IgA,IgD,IgE,IgG,或IgM蛋白的κ链的启动子的核苷酸序列内,另一个供体DNA的插入发生在充当IgA,IgD,IgE,IgG,或IgM蛋白的λ链的启动子的核苷酸序列内。
51.根据1-50中任一项所述的方法,其中,所述供体DNA的插入导致所述插入的供体DNA与T细胞受体(TCR)α,β,γ,或δ内源性启动子的可操作的连接。
52.根据1-50中任一项所述的方法,其中,所述供体DNA包含与TCRα,β,γ,或δ启动子可操作地连接的编码蛋白的核苷酸序列。
53.根据1-50中任一项所述的方法,其中,所述供体DNA的插入导致所述插入的供体DNA与启动子的可操作的连接,所述启动子选自:(i)T细胞特异性启动子;(ii)CD3启动子;(iii)CD28启动子;(iv)干细胞特异性启动子;(v)体细胞特异性启动子;(vi)T细胞受体(TCR)α,β,γ,或δ启动子;(v)B细胞特异性启动子;(vi)CD19启动子;(vii)CD20启动子;(viii)CD22启动子;(ix)B29启动子;和(x)T细胞或B细胞V(D)J特异性启动子。
54.根据1-50中任一项所述的方法,其中,所述供体DNA包含与T细胞特异性启动子可操作地连接的编码蛋白的核苷酸序列。
55.根据1-50中任一项所述的方法,其中,所述供体DNA包含与启动子可操作地连接的编码蛋白的核苷酸序列。
56.根据1-50中任一项所述的方法,其中,所述供体DNA的插入导致所述插入的供体DNA与干细胞特异性或体细胞特异性内源性启动子的可操作的连接。
57.根据1-56中任一项所述的方法,其中,所述供体DNA包含编码报告蛋白(例如,近IR和/或远红报告蛋白,例如,用于评估基因编辑效率)的核苷酸序列。
58.根据57所述的方法,其中,所述供体DNA的插入导致所述所插入的供体DNA与内源性启动子的可操作的连接。
59.根据57所述的方法,其中,所述供体DNA包含与编码所述报告蛋白的核苷酸序列可操作地连接的启动子。
60.根据1-59中任一项所述的方法,其中,所述供体DNA包含核苷酸序列,所述核苷酸序列编码(i)T细胞受体(TCR)蛋白;(ii)IgA,IgD,IgE,IgG,或IgM蛋白;或(iii)IgA,IgD,IgE,IgG,或IgM蛋白的κ或λ链。
61.根据1-60中任一项所述的方法,其中,所述供体DNA包含不具有内含子的编码蛋白的核苷酸序列。
62.根据61所述的方法,其中,所述不具有内含子的核苷酸序列编码TCR蛋白或免疫球蛋白的全部或一部分。
63.根据1-62中任一项所述的方法,其中,所述供体DNA具有至少一个腺苷酸化的3’端。
64.根据1-63中任一项所述的方法,其中,所述靶细胞是哺乳动物细胞。
65.根据1-64中任一项所述的方法,其中,所述靶细胞是人细胞。
66.一种试剂盒或组合物,包含:
(a)线性双链供体DNA,其在每端均具有5’或3’突出端;和
(b)序列特异性核酸酶,或编码所述序列特异性核酸酶的核酸,
其中(a)和(b)是作为同一递送媒介物一部分的有效负载。
67.根据66所述的试剂盒或组合物,其中,所述递送媒介物是纳米颗粒。
68.根据67所述的试剂盒或组合物,其中,所述纳米颗粒包含核,所述核包含(a),(b),阴离子聚合物组合物,阳离子聚合物组合物,和阳离子多肽组合物。
69.根据67或68所述的试剂盒或组合物,其中,所述纳米颗粒包含使所述纳米颗粒靶向细胞表面蛋白的靶向配体。
70.根据66-69中任一项所述的试剂盒或组合物,其中,所述线性双链供体和所述序列特异性核酸酶彼此结合而形成脱氧核糖核蛋白或核糖-脱氧核糖核蛋白复合物。
71.根据66-70中任一项所述的试剂盒或组合物,其中,所述递送媒介物是与带电荷的聚合物多肽结构域缀合的靶向配体,其中,所述靶向配体提供与细胞表面蛋白的靶向结合,并且其中,所述带电荷的聚合物多肽结构域与所述有效负载静电地相互作用。
72.根据71所述的试剂盒或组合物,其中,所述递送媒介物还包含与所述有效负载和所述带电荷的聚合物多肽结构域相互作用的阴离子聚合物。
73.根据66-70中任一项所述的试剂盒或组合物,其中,所述递送媒介物是与(a)和/或(b)缀合的靶向配体,其中,所述靶向配体提供与细胞表面蛋白的靶向结合。
74.根据69-73中任一项所述的试剂盒或组合物,其中,所述细胞表面蛋白是CD47。
75.根据74所述的试剂盒或组合物,其中,所述靶向配体是SIRPα蛋白模拟物。
76.根据69-75中任一项所述的试剂盒或组合物,其中,所述递送媒介物还包含触发内吞作用的配体。
77.根据66-70中任一项所述的试剂盒或组合物,其中,所述递送媒介物包括靶向配体,所述靶向配体包覆在水-油-水乳液颗粒上,油-水乳液胶束颗粒上,多层水-油-水乳液颗粒上,多层状颗粒上,或DNA折叠纳米机器人上。
78.根据69-74中任一项所述的方法,其中,所述靶向配体是肽,ScFv,F(ab),核酸适体,或类肽。
79.根据66-70中任一项所述的试剂盒或组合物,其中,所述递送媒介物是非病毒的。
实验
示出以下示例以向本领域的普通技术人员提供有关如何制作和使用本发明的完整公开和描述,而不是为了限制本发明的范围,也不是为了表示以下实验是所执行的全部的或仅有的实验。已经做出努力以确保所使用的数字(例如,数量,温度等)的准确性,但是应当考虑一些实验误差和偏差。除非另有说明,否则份数是重量份,分子量是重均分子量,温度是摄氏度,压力是大气压或接近大气压。
本说明书中引用的所有公开和专利申请均通过引用并入本文,就如同每个单独的公开或专利申请均被明确地和单独地指出通过引用并入。
已经根据发现或提出的包括实施本发明的优选方式的特定实施例描述了本发明。本领域技术人员将理解,根据本公开,在不脱离本发明的意图范围的情况下,可以在示例性的特定实施方式中进行多种修改和改变。例如,由于密码子冗余,可以在不影响蛋白序列的情况下改变基础(underlying)DNA序列。而且,由于生物学功能等价性的考虑,可以改变蛋白结构而不影响生物学作用的类型或数量。所有这些修改旨在被包括在所附权利要求的范围内。
我们用流式细胞术和高通量筛选来表征细胞吸收和表型,针对多种细胞亚群进行递送效率的量化和基因编辑。
在这些实验中,将未经刺激的人原代全-T细胞(CD4+和CD8+ T细胞的混合物)和外周血单核细胞(PBMC)快速转染(与纳米颗粒孵育30分钟),并用含10ug/ml乙酰肝素硫酸盐的PBS洗涤两次,并在24小时后在Attune NxT流式细胞仪上进行分析。用对CD4和CD8具有特异性的抗体对细胞染色,并在每个亚群中对EGFP-标记的Cas9转导进行量化。
多模态数据集
用流式细胞术和高通量筛选来表征细胞吸收和表型,针对多种细胞亚群进行递送效率的量化和基因编辑。
在这些实验中,将未经刺激的人原代全-T细胞(CD4+和CD8+ T细胞的混合物)和外周血单核细胞(PBMC)快速转染(与纳米颗粒孵育30分钟),并用含10ug/ml乙酰肝素硫酸盐的PBS洗涤两次,并在24小时后在Attune NxT流式细胞仪上进行分析。用对CD4和CD8具有特异性的抗体对细胞染色,并在每个亚群中对EGFP-标记的Cas9的转导及进行定量。下表示出了转染后1h使用BioTek Cytation 5成像读取器进行的成像的比较,40x物镜vs.24h时收集的流式细胞术数据。无意于受到任何具体理论的束缚,认为在≥24h时间点确定细胞内部化,而在早期的时间点确定细胞的亲和力。利用无监督(unsupervised)学习从图像中确定1h时间点的细胞亲和力,并将成像数据与通过流式细胞术评估的24h时间点的细胞吸收进行比较。
将20M全-T细胞(IQ Biosciences)解冻到含有20mL培养基的烧瓶中。第二天,将CD3/CD28珠(10M珠)引入未经刺激的细胞。解冻和重悬后2天,将细胞粒化(pelleted)并更换培养基。解冻和重悬后3天除去珠。
对于核转染,如以下实施例所示,使用160pmol sgRNA和126pmol Cpf1(A.s.或L.b.):
冷藏保存的人原代T细胞被解冻,并在用CD3/CD28珠培养后一天刺激2天。经过双重切割Cpf1介导的TRBC1/C2基因座编辑以及随后通过具有编码GFP的交错端的供体DNA模板的插入后,1.27%的细胞为GFP+。去除珠之后的当天,将细胞用Lonza Amaxa 4D系统P3原代细胞试剂盒进行电穿孔。通过以室温孵育64pmol A.s.Cpf1(IDT,目录号1081068)和128pmol sgRNA(IDT)10-20分钟来形成RNP,然后将其添加至4μg的dsDNA插入物或IDT的Cpf1电穿孔增强剂(目录号1076301)并孵育10分钟。加入20μL的1x10e6刺激的T细胞,然后转移到比色杯中,之后用脉冲EH-115(B,仅RNP)或EO-115(C,RNP+DNA)进行电穿孔(图62)。核转染后第7天,通过流式细胞术检测TCRa/b和GFP表达。图中示出了活群体中的细胞(Annexin和Sytox阴性)。使用QuickExtract(Lucigen)从细胞中收集DNA。
比较各种引物(TRBC1-TRBC2,GFP-GFP,和GFP-TRBC2),结果在双切割Cpf1研究中有一条微弱的条带,在此切割了TRBC1/TRBC2位点,形成了具有4bp突出端的双链断裂。突出端与GFP插入序列或FLAG插入序列匹配,并通过流式细胞术和PCR(GFPvs.Cpf1仅RNP),或Sanger测序(仅FLAG vs.Cpf1仅RNP)进行检查。
表描述用于TRAC,TRB1 C1/C2,和TRB启动子区域的sgRNA序列
- 用于提高基因组编辑效率的喹喔啉酮化合物,组合物,方法和试剂盒
- 用于使用基因组编辑产生显性矮株型等位基因的方法和组合物
