含核酸的溶液的处理方法及含核酸的溶液的处理装置
文献发布时间:2023-06-19 10:46:31
【技术领域】
本发明涉及含核酸的溶液的处理方法及含核酸的溶液的处理装置。
【背景技术】
为了对含核酸的溶液进行处理,开发了各种装置。所述装置可对溶液中所含的核酸进行电化学分析。在核酸的电化学分析中,有使核酸与固定于装置内的电极的探针杂交。此时,可基于杂交前及杂交后的电化学分析(例如,循环伏安法(CV)的测定)的比较,对核酸的杂交程度进行定量分析。
在非专利文献1中记载了,对含核酸的溶液进行处理的装置的一例。此装置含由电极及抗蚀剂划定的孔。这样的装置可含侵到含核酸的溶液中。此时,溶液位于孔的内部至孔的外部。
【现有技术文献】
【非专利文献】
非专利文献1:Hiroshi Aoki,Akiko Kitajima and Hiroaki Tao“Electrochemical Sensor Array Chips for Multiple Gene Detection”Sensors andMaterials,Vol.22,No.7(2010)327-336
【发明的概要】
【发明要解决的课题】
如上所述,在含核酸的溶液的处理中,有使用孔的。本发明人探讨了使用孔对少靶拷贝数的核酸进行电化学分析。例如,如上所述,在溶液位于孔的内部至孔的外部时,核酸的靶拷贝数可变多。
特别是,在上述的以往的方法中,难以检测癌患者特有的微RNA(miRNA)。例如,在以往的方法中,位于孔的内部至孔的外部的溶液量最小也是10μL左右。在此时,为了得到互补的核酸的杂交,最低限必要的核酸浓度是4nM之时,核酸的靶拷贝数成为400amol左右。如后所述,由于从癌患者的10mL的血清得到的miRNA的总量是约1amol以下,在以往的方法中,难以检测癌患者特有的miRNA。
本发明的目的一例在于对少靶拷贝数的核酸进行电化学分析。本发明的其他目的从本说明书的记载明了。
【用于解决课题的手段】
本发明的一实施方式是含核酸的溶液的处理方法,其包括:
在具有含由电极及抗蚀剂划定的孔的第1面的第1基材的上述第1面上配置上述溶液,
在上述第1基材的上述第1面上配置上述溶液之后,以具有疏水性的第2面的第2基材的上述第2面和上述第1基材的上述第1面互相面对的方式使上述第1基材及上述第2基材互相压合。
本发明的其他实施方式是含核酸的溶液的处理装置,其具备:
具有含由电极及抗蚀剂划定的孔的第1面的第1基材,
具有疏水性的第2面的第2基材,和
用于以上述第1面及上述第2面互相面对的方式使上述第1基材及上述第2基材互相压合的部件。
本发明的还其他实施方式是含核酸的溶液的处理装置,其具备:
具有含由电极及抗蚀剂划定的孔的第1面的第1基材,和
具有疏水性的第2面的第2基材,
上述第1基材及上述第2基材以上述第1面及上述第2面互相面对的方式互相接合。
【发明的效果】
根据本发明的上述的实施方式,可对少靶拷贝数的核酸进行电化学分析。
【附图的简单的说明】
【图1】是用于对实施方式涉及的溶液的处理方法的一例进行说明的图。
【图2】是用于对实施方式涉及的溶液的处理方法的一例进行说明的图。
【图3】是用于对实施方式涉及的溶液的处理方法的一例进行说明的图。
【图4】是用于对实施方式涉及的溶液的处理方法的一例进行说明的图。
【图5】是第1基材的平面图的一例。
【图6】是用于对实施方式涉及的溶液的处理装置的第1例进行说明的图。
【图7】是用于对实施方式涉及的溶液的处理装置的第2例进行说明的图。
【图8】是用于对实施例中算出的电势差ΔE进行说明的图。
【图9】是显示实施例中的电势差ΔE的算出结果的图。
【图10】是显示实施例中的电势差ΔE的算出结果的图。
【图11】是显示实施例中的电势差ΔE的算出结果的图。
【具体实施方式】
以下,使用附图对本发明的实施方式进行说明。在全部的附图中,向同样的构成要素附同样的符号,省略适宜说明。
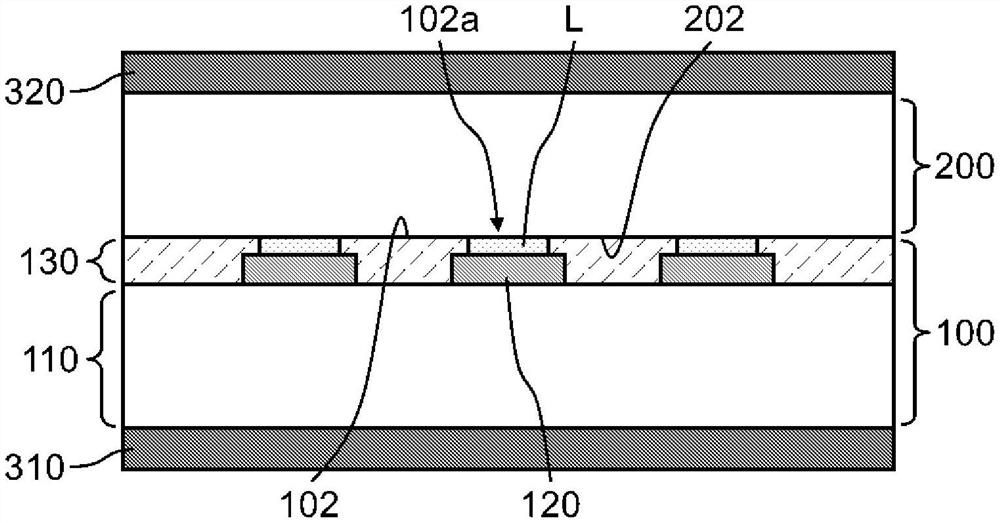
图1~图4是用于对实施方式涉及的溶液的处理方法的一例进行说明的图。图5是第1基材100的平面图的一例。图1~图4显示图5的A-A′截面中的截面。
使用图1~图4,对实施方式涉及的溶液的处理方法的概要进行说明。首先,如图1所示,准备第1基材100。第1基材100具有第1面102。第1面102含孔102a。孔102a由电极120及抗蚀剂130划定。接下来,如图2所示,在第1基材100的第1面102上配置溶液L。溶液L含核酸。接下来,如图3所示,准备第2基材200。第2基材200具有第2面202。第2基材200的第2面202变得疏水性。接下来,如图4所示,以第1面102及第2面202互相面对的方式使第1基材100及第2基材200互相压合。在图4中所示的例中,使用第1部件310及第2部件320,使第1基材100及第2基材200互相压合。在其他例中,第1基材100及第2基材200也可由与图4中所示的方法不同的方法(例如,在向固定台上装载第1基材100的状态下,将第2基材200向第1基材100下压),互相压合。
根据实施方式涉及的溶液的处理方法,可对少靶拷贝数的核酸进行电化学分析。具体而言,在实施方式涉及的溶液的处理方法中,如图4所示,与各电极120接触的溶液L可仅在孔102a内蓄积。即,溶液L变得在由电极120、抗蚀剂130、第2基材200的第2面202划定的空间内停留(溶液L变得仅与电极120、抗蚀剂130及第2面202相接触)。特别是,第2基材200的第2面202变得疏水性,抑制孔102a的内部的溶液L可由毛细管现象漏到孔102a的外部。这样,可根据实施方式涉及的溶液的处理方法,根据孔102a的容积而限制与各电极120接触的溶液L内的核酸的靶拷贝数。从而,可对少靶拷贝数的核酸进行电化学分析。
在实施方式及实施例中,含核酸的溶液含杂交溶液及核酸(例如,RNA(例如,miRNA)或DNA)。
如图3及图4所示,第1基材100的第1面102在抗蚀剂130之中,含与第2基材200的第2面202面对的面。从而,当使第1基材100及第2基材200互相压合时,与抗蚀剂130之中的第2面202面对的面和第2基材200的第2面202变得互相接触。
使用图5,对第1基材100的平面布图的一例的详细进行说明。图5中所示的平面布图不过是第1基材100的平面布图的一例。第1基材100也可具有与图5中所示的平面布图不同的平面布图。
第1基材100含多个电极120、多个配线122及抗蚀剂130。
抗蚀剂130具有多个开口。在图5中所示的例中,抗蚀剂130的各开口具有圆形状。在其他例中,抗蚀剂130的各开口也可具有与圆形状不同的形状。
各电极120的一部分从抗蚀剂130的各开口露出。这样,由各电极120及抗蚀剂130划定孔102a。在图1~图5中所示的例中,孔102a具有圆筒形状。
各配线122的一端与各电极120连接。各配线122的另一端也可与用于取得各电极120的电信号的端(未图示)连接。
使用图1~图4,对本实施方式涉及的溶液的处理方法的详细内容进行说明。
首先,如图1所示,准备第1基材100。第1基材100含基板110、多个电极120及抗蚀剂130。
基板110,例如,可为玻璃基板,也可为半导体基板(例如,硅基板),或者也可为树脂基板。在其他例中,第1基材100也可代替基板110而含具有能形成电极120及抗蚀剂130的表面的部件(例如,具有与板形状不同的形状的部件)。
多个电极120处于基板110上。电极120由导电材料、例如,金属构成。电极120变得能作为作用电极发挥功能。
抗蚀剂130具有多个开口。抗蚀剂130的各开口露出各电极120的一部分。抗蚀剂130由绝缘材料、例如,树脂构成。
电极120具有从抗蚀剂130露出的面。在一例中,电极120的露出面也可具有亲水性。此时,在图2中的溶液L的配置中,可使溶液L在电极120的露出面上扩展变得容易。电极120的露出面的亲水性也可使用例如,覆盖抗蚀剂130,具有与电极120重叠的开口的罩而对电极120的露出面选择性地进行亲水化处理而赋予。
抗蚀剂130的表面可具有比电极120的露出面低的亲水性,例如,可具有疏水性。
第1基材100具有第1面102,第1面102含多个孔102a。各孔102a由电极120及抗蚀剂130划定。具体而言,电极120形成孔102a的底面,抗蚀剂130形成孔102a的内侧面。
在一例中,孔102a的容积也可设为1nL以下。此时,在图4中的溶液L的封入中,可使孔102a内的溶液L的量变少。
在图1中所示的例中,第1基材100含多个电极120(即,多个孔102a)。在其他例中,第1基材100也可含仅1个电极120(即,仅1个孔102a)。
接下来,如图2所示,在第1基材100的第1面102上配置溶液L。溶液L含核酸。
在图2中所示的例中,溶液L位于孔102a的内部至孔102a的外部(换言之,溶液L的一部分配置于孔102a的外部,例如,以覆盖第1面102的方式配置)。在此例中,可通过图3及图4中的第1基材100及第2基材200的压合,向第1基材100及第2基材200的外部排出孔102a的外部的溶液L。在图2中所示的例中,位于孔102a的外部的溶液L也可部分分离。
在其他例中,溶液L之任一者的部分均可不位于孔102a的内部(换言之,溶液L的整体配置于孔102a的外部)。在此例中,可通过图3及图4中的第1基材100及第2基材200的压合,向孔102a放入孔102a的外部的溶液L。
在进一步其他例中,溶液L也可各自给到多个孔102a。溶液L可例如通过滴下各自滴到各孔102a中。在此例中,各孔102a中的溶液L可滴下仅与孔102a的容积实质上相等的量或比孔102a的容积多的量。在各孔102a中的溶液L的体积比孔102a的容积大时,溶液L的表面也可向比第1基材100的第1面102(抗蚀剂130的上表面)高的位置突出。在此例中,如图3及图4所示,在用具有疏水性的面(第2基材200的第2面202)覆盖孔102a时,可抑制流体L的干燥。另外,可使封入到各孔102a的溶液L的体积变得一定,由此,对各孔102a间的杂交程度进行比较变得可能。再者,在具有疏水性的面(第2基材200的第2面202)覆盖孔102a时,可与具有亲水性的面覆盖孔102a时比较而抑制由毛细管现象的溶液L的孔102a的泄露。
接下来,如图3所示,准备第2基材200。
在图3中所示的例中,第2基材200是基板,具有板形状。在其他例中,第2基材200也可具有与板形状不同的形状。
第2基材200的第2面202变得疏水性。具体而言,第2基材200的第2面202相对于水而具有90°以上的接触角。假设,当第2基材200的第2面202具有亲水性时,有孔102a内的溶液L经由第1基材100及第2基材200之间的间隙而由毛细管现象漏出到第1基材100及第2基材200的外部的担忧。与此相比,当第2基材200的第2面202具有疏水性时,可抑制孔102a内的溶液L漏到第1基材100及第2基材200的外部,可具有高可靠性地在孔102a内蓄积溶液L。
在一例中,第2基材200的第2面202由具有疏水性的材料、例如,聚四氟乙烯构成。在其他例中,第2基材200的第2面202也可被疏水化处理。第2基材200的整体可不具有疏水性,也可第2基材200的整体具有疏水性。
接下来,如图4所示,以第1面102及第2面202互相面对的方式使第1基材100及第2基材200互相压合。
在图4中所示的例中,由第1部件310将第1基材100向第2基材200下压,由第2部件320将第2基材200向第1基材100下压。即,第1部件310及第2部件320成为用于使第1基材100及第2基材200互相压合的部件。在一例中,第1部件310及第2部件320也可为夹。
可通过第1部件310及第2部件320的压合,具有高可靠性地使溶液L在孔102a内蓄积。在一例中,在第1基材100及第2基材200的压合前溶液L位于孔102a的内部至孔102a的外部时,可向第1基材100及第2基材200的外部排出孔102a的外部的溶液L。在其他例中,在第1基材100及第2基材200的压合前溶液L不位于孔102a的内部时,可向孔102a放入孔102a的外部的溶液L。
图1~图4中所示的溶液的处理方法可适用于含核酸的溶液的处理的各种各样的例,例如,可适用于核酸的杂交。
在下文中,对将图1~图4中所示的溶液的处理方法适用于核酸的杂交的例进行说明。
在此例中,可在使第1基材100及第2基材200互相压合的状态下(例如,图4),使溶液L内的核酸与固定在电极120的探针杂交。在此例中,可使少靶拷贝数的核酸杂交。
再者,也可在使核酸与探针杂交之前、具体而言,溶液L配置到第1基材100的第1面102上前(图2)并且探针及巯基(巯基是不与靶核酸结合、并且物理性支持探针的结构的物质,例如,6-羟基-1-己硫醇(HHT))固定到电极120后,使用电极120实施电化学分析。在一例中,也可从电极120由CV测定伏安图。
再者,也可在使核酸与探针杂交之后,具体而言,从第1基材100解下第2基材200,清洗第1基材100之后,使用电极120实施电化学分析。在一例中,也可从电极120由CV测定伏安图。在此例中,可对少靶拷贝数的核酸进行电化学分析。
在上述的例中,可基于杂交前的电化学分析(例如,由CV测定的伏安图)及杂交后的电化学分析(例如,由CV测定的伏安图)的比较(例如,使用图8而后述的电势差ΔE)而判定核酸的杂交程度。
本实施方式涉及的溶液的处理方法不仅是上述的CV,还能适用于CV以外的电化学分析(例如,SWV(Square Wave Voltammetry))。
在一例中,核酸也可设为微RNA(miRNA)。miRNA也可从血液采集。一般而言,难以从血液得到含大量的miRNA的试样。根据图1~图4中所示的溶液的处理方法,可对少靶拷贝数的miRNA进行电化学分析。
图6是用于对实施方式涉及的溶液处理装置10的第1例进行说明的图。
溶液处理装置10具备第1基材100、第2基材200、第1部件310及第2部件320。第1部件310及第2部件320成为用于以第1面102及第2面202互相面对的方式使第1基材100及第2基材200互相压合的部件。在不设有第1部件310及第2部件320时,第1基材100及第2基材200变得能互相离间。从而,可使用图1~图4中所示的溶液的处理方法,使用溶液处理装置10,对少靶拷贝数的核酸进行电化学分析。
图7是用于对实施方式涉及的溶液处理装置10的第2例进行说明的图。
溶液处理装置10具备第1基材100及第2基材200。第1基材100及第2基材200以第1面102及第2面202互相面对的方式互相接合。第1基材100及第2基材200也可经例如接附层互相接合。在图7中所示的例中,可经由通向孔102a的导入路(在图7中未图示)向孔102a导入溶液。在图7中所示的例中,也可对少靶拷贝数的核酸进行电化学分析。
【实施例】
图8是用于对实施例中算出的电势差ΔE进行说明的图。
在实施例中,由以下的处理算出电势差ΔE。
首先,如图1所示,准备第1基材100,将各自具有与靶miRNA互补的序列的探针及巯基固定于电极120。接下来,使用电极120,由CV测定测定伏安图C1(图8)。
接下来,如图2所示,向第1基材100的第1面102上滴下含靶miRNA的溶液(此溶液含靶miRNA及杂交溶液)。
接下来,如图3及图4所示,由夹(第1部件310及第2部件320)使第1基材100及第2基材200互相压合。这样,可在在孔102a内蓄积溶液的状态下,向第1基材100及第2基材200的外部压出额外的溶液L。
接下来,在由夹(第1部件310及第2部件320)使第1基材100及第2基材200互相压合的状态下,对第1基材100及第2基材200进行加热,使miRNA杂交。
接下来,将夹(第1部件310及第2部件320)从第1基材100及第2基材200拆下,从第1基材100拆下第2基材200。接下来,清洗第1基材100的第1面102。
接下来,使用电极120,由CV测定测定伏安图C2(图8)。
如图8所示,伏安图C1含第1氧化波O1及第1还原波R1,伏安图C2含第2氧化波O2及第2还原波R2。
第1氧化波O1在电势Ep
第2氧化波O2在电势Ep
电势差ΔE是第1氧化波O1的电势E1及第2氧化波O2的电势E2的差异。
发生电势差ΔE的理由如以下。电极120(作用电极)的电势可因由杂交的靶核酸发生的负的总电荷量ΔQ降低。在氧化波的测定中,可在作用电极形成电容C的电双层。作用电极的电势的降低可估计为ΔQ/C。从而,杂交后的氧化波(在图8中所示的例中,第2氧化波O2)从杂交前的氧化波(在图8中所示的例中,第1氧化波O1)仅ΔQ/C可向高电势变动。电势差ΔE可估计为从杂交前的氧化波(在图8中所示的例中,第1氧化波O1)向杂交后的氧化波(在图8中所示的例中,第2氧化波O2)的变动量,可与ΔQ/C变得大概相等。这样,电势差ΔE可成为用于对核酸的杂交程度进行定量分析的指标。
图9~图11是显示实施例中的电势差ΔE的算出结果的图。
在图9~图11中,夹第1基材100及第2基材200(第1部件310及第2部件320)而使压合的状态下(图4)、使miRNA与探针杂交。
在图9中,孔102a的容积设为2.1pL(孔102a的直径:30μm、孔102a的深度:3μm)。对于与探针互补的miRNA及与探针非互补的miRNA各自,对含以下的靶拷贝数的核酸的试样进行测定。图9中的互补的miRNA的各标绘点表示使用75个测定系(75个电极120)各自算出的75个电势差ΔE的中位值。同样,图9中的非互补的miRNA的各标绘点表示使用75个测定系(75个电极120)各自算出的75个电势差ΔE的中位值。
11zmol(5nM×2.1pL)
17zmol(8nM×2.1pL)
51zmol(24nM×2.1pL)
168zmol(80nM×2.1pL)
509zmol(240nM×2.1pL)
1.7amol(800nM×2.1pL)
在图10中,孔102a的容积设为35pL(孔102a的直径:67μm、孔102a的深度:10μm)。对于与探针互补的miRNA及与探针非互补的miRNA各自,对含以下的靶拷贝数的核酸的试样进行测定。图10中的互补的miRNA的各标绘点表示使用75个测定系(75个电极120)各自算出的75个电势差ΔE的中位值。同样,图10中的非互补的miRNA的各标绘点表示使用75个测定系(75个电极120)各自算出的75个电势差ΔE的中位值。
141zmol(4nM×35pL)
0.84amol(24nM×35pL)
1.4amol(40nM×35pL)
2.8amol(80nM×35pL)
8.4amol(240nM×35pL)
在图11中,孔102a的容积设为71pL(孔102a的直径:95μm、孔102a的深度:10μm)。对于与探针互补的miRNA及与探针非互补的miRNA各自,对含以下的靶拷贝数的核酸的试样进行测定。图11中的互补的miRNA的各标绘点表示使用75个测定系(75个电极120)各自算出的75个电势差ΔE的中位值。同样,图11中的非互补的miRNA的各标绘点表示使用75个测定系(75个电极120)各自算出的75个电势差ΔE的中位值。
1.7amol(24nM×71pL)
5.7amol(80nM×71pL)
8.5amol(120nM×71pL)
17amol(240nM×71pL)
从图9中所示的结果来看,图9的孔102a的靶拷贝数的检测界限可估计为约17zmol。
从图10中所示的结果来看,图10的孔102a的靶拷贝数的检测界限可估计为约141zmol。
从图11中所示的结果来看,图11的孔102a的靶拷贝数的检测界限可估计为约1.7amol。
图9~图11中所示的结果提示,通过使第1基材100及第2基材200互相压合,能进行少靶拷贝数的miRNA的电化学分析。
再者,在图9~图11之任一者中,检测界限均大致达1amol。从而,图9~图11中所示的方法可在血液中的miRNA的检测中利用。存在于10mL的血清(20mL的血液)之中的癌患者的miRNA(1种)的总量是约1amol以下。从而,在血液中的miRNA的检测中,约1amol以下的检测界限是必要的。如上所述,在图9~图11中所示的方法之任一者中,检测界限均大致达1amol。
如从本说明书的记载明了,本发明的目的不限于癌患者特有的miRNA的检测。本发明的各实施方式还能适用于癌患者特有的miRNA以外的核酸的检测。
以上,参照附图而对于本发明的实施方式进行叙述,但这些是本发明的例示,也可采用上述以外的各种各样的构成。
此申请主张以2018年10月25日申请的日本申请特愿2018-200570号作为基础的优先权,其公开的全部内容并入本文。
【符号的说明】
10:溶液处理装置
100:第1基材
102:第1面
102a:孔
110:基板
120:电极
122:配线
130:抗蚀剂
200:第2基材
202:第2面
310:第1部件
320:第2部件
- 含核酸的溶液的处理方法及含核酸的溶液的处理装置
- 使用粘土矿物和碱性溶液制备含核酸样品的方法
