氨基酸修饰的S,R-七环羧酸,其合成,活性和应用
文献发布时间:2024-04-18 19:58:21
发明领域
本发明涉及下式的(2S,5S)-四氢吡嗪[1,2:1,6]并双{(1S,1R)-[乙酰基-AA]-2,3,4,9-四氢-1H-吡啶[3,4-b]并吲哚}-1,4-二酮(AA表示:L-Ala残基、L-Asp残基、L-Glu残基、L-Phe残基、L-Gly残基、L-Ile残基、L-Leu残基、GL-Asn残基、L-Pro残基、L-Ser残基、L-Val残基、L-Tyr残基),涉及它的制备方法,涉及它的抗动脉血栓活性,涉及它抑制体内P-选择素表达的活性。因而本发明涉及它们在制备抗动脉血栓药物中的应用、在制备凝P-选择素拮抗剂中的应用。本发明属于生物医药领域。
背景技术
血栓性疾病严重威胁人类的生命健康,其发病率高居各种疾病之首,是当前乃至未来医学研究的重点。血栓形成是全世界死亡的主要原因,占四分之一的死亡人数。随着全球老龄化人口的增加,血栓性疾病发病率可能会随着人口老龄化而增加。目前相当多的研究已显示血小板中的P-选择素表达在与动脉血栓形成相关的疾病中升高,例如冠状动脉疾病、急性心肌梗塞、中风和外周动脉疾病。血小板在活化的内皮上滚动,类似于白细胞的滚动以及血小板与白细胞的相互作用,是由P-选择素与其配体PSGL-1的相互作用介导的。血小板P-选择素与白细胞上的P-选择素糖蛋白配体-1(PSGL-1)相互作用,形成血小板-白细胞聚集体。但目前P-选择素抑制剂的进展较为缓慢,目前仅有PSI697处于临床试验阶段,大多数研究仍处于动物实验阶段。P-选择素作为粘附分子的选择素家族的成员,在血栓形成的过程中起到非常重要的作用,血栓性疾病对人类健康影响重大,新型P-选择素抑制剂抗栓药物的研发势在必行。基于公开研究,β-四氢咔啉药效团和二酮哌嗪药效团能够与抑制P-选择素结合,发挥抗血栓活性。发明人假设包含β-四氢咔啉药效团的二酮哌嗪类衍生物,(2S,5S)-四氢吡嗪[1,2:1,6]并双{(1S,1R)-[1-羧甲酸]-2,3,4,9-四氢-1H-吡啶[3,4-b]并吲哚}-1,4-二酮预期将成为优秀的高亲和力的P-选择素抑制剂,发挥抗动脉血栓活性。发明人进一步假设,用12种氨基酸修饰这种新型七环羧酸,应具有更强的抗动脉血栓活性。于是,发明人提出本发明。
发明内容
本发明的第一个内容是提供下式的(2S,5S)-四氢吡嗪[1,2:1,6]并双{(1S,1R)-[乙酰基-AA]-2,3,4,9-四氢-1H-吡啶[3,4-b]并吲哚}-1,4-二酮(AA表示:L-Ala残基、L-Asp残基、L-Glu残基、L-Phe残基、L-Gly残基、L-Ile残基、L-Leu残基、GL-Asn残基、L-Pro残基、L-Ser残基、L-Val残基、L-Tyr残基)。
本发明的第二个内容是提供(2S,5S)-四氢吡嗪[1,2:1,6]并双{(1S,1R)-[乙酰基-AA]-2,3,4,9-四氢-1H-吡啶[3,4-b]并吲哚}-1,4-二酮(AA表示:L-Ala残基、L-Asp残基、L-Glu残基、L-Phe残基、L-Gly残基、L-Ile残基、L-Leu残基、GL-Asn残基、L-Pro残基、L-Ser残基、L-Val残基、L-Tyr残基)的合成方法,该方法包括:
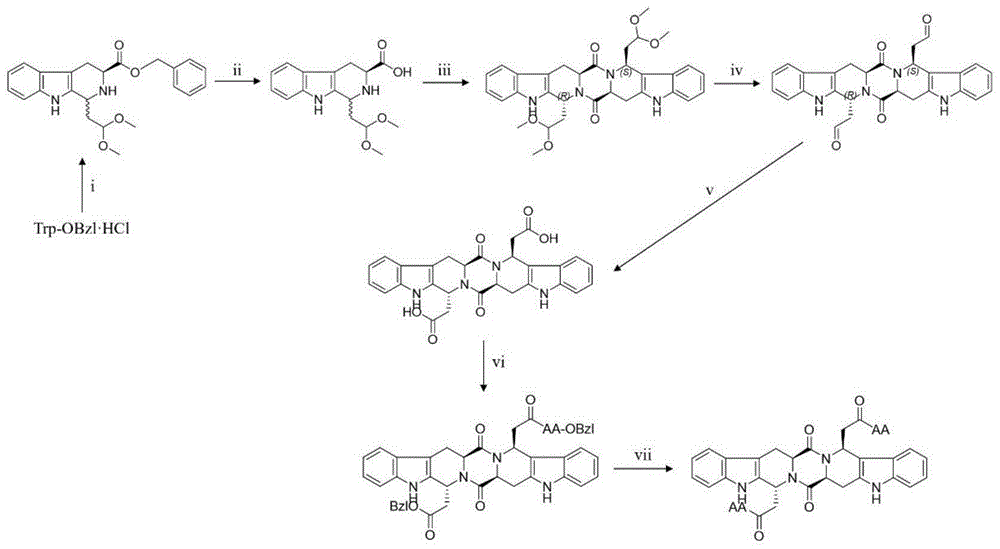
(1)将L-色氨酸苄酯在三氟醋酸的催化下与1,1,3,3-四甲氧基丙烷进行Pictet-Spengler缩合,得到1-(2,2-二甲氧基乙基)-2,3,4,9-四氢-β-咔啉-3-羧酸苄酯(1);
(2)在甲醇溶液中1-(2,2-二甲氧基乙基)-2,3,4,9-四氢-β-咔啉-3-羧酸苄酯在Pd/C催化下,与H
(3)在2-(7-氧化苯并三氮唑)-N,N,N',N'-四甲基脲六氟磷酸酯(HATu)和N-羟基苯并三唑(HOBt)存在下,(3S)-1-(2,2-二甲氧基乙基)-2,3,4,9-四氢-1H-吡啶并[3,4-b]吲哚-3-甲酸在N,N-二甲基甲酰胺(无水DMF)中进行分子间缩合为(2S,5S)-四氢吡嗪[1,2:1,6]并双{(1S,R)-[1-二甲氧乙基-2-基]-2,3,4,9-四氢-1H-吡啶[3,4-b]并吲哚}-1’,4’-二酮(3);
(4)(2S,5S)-四氢吡嗪[1,2:1,6]并双{(1S,R)-[1-二甲氧乙基-2-基]-2,3,4,9-四氢-1H-吡啶[3,4-b]并吲哚}-1’,4’-二酮,在冰醋酸、水的条件下,将缩醛转变为醛基得到(2S,5S)-四氢吡嗪[1,2:1,6]并双{(1S,1R)-[1-羰甲基]-2,3,4,9-四氢-1H-吡啶[3,4-b]并吲哚}-1,4-二酮(4);
(5)(2S,5S)-四氢吡嗪[1,2:1,6]并双{(1S,1R)-[1-羰甲基]-2,3,4,9-四氢-1H-吡啶[3,4-b]并吲哚}-1,4-二酮在DMF作溶剂的条件下,使用KMnO
(6)(2S,5S)-四氢吡嗪[1,2:1,6]并双{(1S,1R)-[1-羧甲酸]-2,3,4,9-四氢-1H-吡啶[3,4-b]并吲哚}-1,4-二酮在DMF作溶剂的条件下,以二环己基碳二亚胺(DCC)、1-羟基苯并三唑(HoBt)为缩合剂,与12种天然氨基酸苄酯进行分子间缩合反应,得(2S,5S)-四氢吡嗪[1,2:1,6]并双{(1S,1R)-[乙酰基-AA-苄酯]-2,3,4,9-四氢-1H-吡啶[3,4-b]并吲哚}-1,4-二酮(AA表示:L-Ala残基、L-Asp残基、L-Glu残基、L-Phe残基、L-Gly残基、L-Ile残基、L-Leu残基、GL-Asn残基、L-Pro残基、L-Ser残基、L-Val残基、L-Tyr残基);
(7)(2S,5S)-四氢吡嗪[1,2:1,6]并双{(1S,1R)-[乙酰基-AA-苄酯]-2,3,4,9-四氢-1H-吡啶[3,4-b]并吲哚}-1,4-二酮在在Pd/C催化下,与H
本发明的第三个内容是评价(2S,5S)-四氢吡嗪[1,2:1,6]并双{(1S,1R)-[乙酰基-AA]-2,3,4,9-四氢-1H-吡啶[3,4-b]并吲哚}-1,4-二酮抗动血栓形成的活性。
本发明的第四个内容是评价(2S,5S)-四氢吡嗪[1,2:1,6]并双{(1S,1R)-[乙酰基-AA]-2,3,4,9-四氢-1H-吡啶[3,4-b]并吲哚}-1,4-二酮抑制体内P-选择素表达活性。
附图说明
图1.(2S,5S)-四氢吡嗪[1,2:1,6]并双{(1S,1R)-[乙酰基-AA]-2,3,4,9-四氢-1H-吡啶[3,4-b]并吲哚}-1,4-二酮的合成路线。i)CH
具体实施方式
为了进一步阐述本发明,下面给出一系列实施例。这些实施例完全是例证性的,它们仅用来对本发明进行具体描述,不应当理解为对本发明的限制。
实施例1制备1-(2,2-二甲氧基乙基)-2,3,4,9-四氢-β-咔啉-3-羧酸苄酯(1)
称取6.8g(20.0mmol)L-Trp-OBzl,量取7mL1,1,3,3-四甲氧基丙烷、7mL三氟醋酸,在250mL茄瓶中加100mLCH
实施例2制备1-(2,2-二甲氧基乙基)-2,3,4,9-四氢-β-咔啉-3-羧酸(2)
称取3.94g(10.0mmol)1-(2,2-二甲氧基乙基)-2,3,4,9-四氢-β-咔啉-3-羧酸苄酯(1),500mg Pd/C,在200mL茄瓶中加70mLMeOH溶解,室温反应14小时,TLC(CH
实施例3制备(2S,5S)-四氢吡嗪[1,2:1,6]并双{(1S,R)-[1-二甲氧乙基-2-基]-2,3,4,9-四氢-1H-吡啶[3,4-b]并吲哚}-1’,4’-二酮(3)
称取3.04g(10mmol)1-(2,2-二甲氧基乙基)-2,3,4,9-四氢-β-咔啉-3-羧酸(2),1.29g(3.4mmol)HATu,在在200mL茄瓶中加100mL无水DMF溶解,冰浴搅拌下分批加入1.29g(3.4mmol)HATu,然后用三甲基吡啶将反应液的pH调至9,反应14h后点TLC板监测原料点变浅,有新点产生(PE:EA=1:1),终止反应;加入反应液5倍量蒸馏水,用100mL乙酸乙酯溶解后转移至250mL分液漏斗中,先后分别用饱和NaHCO
实施例4制备(2S,5S)-四氢吡嗪[1,2:1,6]并双{(1S,1R)-[1-羰甲基]-2,3,4,9-四氢-1H-吡啶[3,4-b]并吲哚}-1,4-二酮(4)
称取200mg(2S,5S)-四氢吡嗪[1,2:1,6]并双{(1S,R)-[1-二甲氧乙基-2-基]-2,3,4,9-四氢-1H-吡啶[3,4-b]并吲哚}-1’,4’-二酮(3),在100mL茄瓶中加30ml冰醋酸、3mL水,冰浴搅拌下加入(3),室温下反应12h,有黄色固体析出,TL C点板检测原料点消失,终止反应,减压过滤,得134mg滤饼,即为标题化合物,为土黄色固体,产率为60%。ESI-MS(m/e):479[M-H]
实施例5制备(2S,5S)-四氢吡嗪[1,2:1,6]并双{(1S,1R)-[1-羧甲酸]-2,3,4,9-四氢-1H-吡啶[3,4-b]并吲哚}-1,4-二酮(5)
称取480mg(1mmol)(2S,5S)-四氢吡嗪[1,2:1,6]并双{(1S,1R)-[1-羰甲基]-2,3,4,9-四氢-1H-吡啶[3,4-b]并吲哚}-1,4-二酮(4),称取237mg(1.5mmol)KMn O
实施例6(2S,5S)-四氢吡嗪[1,2:1,6]并双{(1S,1R)-[乙酰基-丙氨酸]-2,3,4,9-四氢-1H-吡啶[3,4-b]并吲哚}-1,4-二酮(5A)
称取102mg(2S,5S)-四氢吡嗪[1,2:1,6]并双{(1S,1R)-[1-羧甲酸]-2,3,4,9-四氢-1H-吡啶[3,4-b]并吲哚}-1,4-二酮(5),88mg(0.4mmol)DCC,58mg(0.4mmol)HOBt,在100ml茄瓶中,加入40ml无水DMF溶解,冰浴搅拌20min,后加入390mg(1.2mmol)Ala-OBzl·TOS,用NMM调节反应液pH值至9,常温下搅拌反应12h,TLC监测反应(DCM:MeOH=20:1),TLC监测显示原料点消失,终止反应。在反应液中加入5倍反应液的水,加入乙酸乙酯萃取水层,依次使用饱和NaHCO
用20ml甲醇溶解50mg5-Ala-OBzl,加入5mgPd/C,充入H
8h,TLC监测反应(DCM:MeOH:HAc=10:1:1),反应完全,过滤旋干,使用C1
8纯化,得到20mg棕黄色固体,即为标题化合物。ESI-MS(m/e):653[M-H]
ESI-MS(m/e):655[M+H]
(s,1H),11.34(s,1H),7.96(d,J=8.50,2H),7.66–7.28(m,4H),7.05(m,,4H),5.91(d,J=9.5Hz,1H),5.35(s,1H),4.43(m,2H),3.07–2.95(m,
2H),2.89(m,4H),2.74(m,4H),1.38–1.12(m,6H).
实施例7制备(2S,5S)-四氢吡嗪[1,2:1,6]并双{(1S,1R)-[乙酰基-天冬氨酸]-2,3,4,9-四氢-1H-吡啶[3,4-b]并吲哚}-1,4-二酮(5D)
称取102mg(0.2mmol)(2S,5S)-四氢吡嗪[1,2:1,6]并双{(1S,1R)-[1-羧甲酸]-2,3,4,9-四氢-1H-吡啶[3,4-b]并吲哚}-1,4-二酮(5),88mg(0.4mmol)DCC,58mg(0.4mmol)HOBt,在100mL茄瓶中,加入40mL无水DMF溶解,冰浴搅拌20min,后加入134mg(0.4mmol)Asp(OBzl)-OBzl·HCl,用NMM调节反应液pH值至9,常温下搅拌反应12h。TLC监测反应(DCM:MeOH=20:1),TLC监测显示原料点消失,终止反应。在反应液中加入5倍反应液的超纯水,加入乙酸乙酯萃取,依次使用饱和NaHCO
用20mL甲醇溶解50mg 5-Asp(OBzl)-OBzl,加入5mg Pd/C,充入H
实施例8(2S,5S)-四氢吡嗪[1,2:1,6]并双{(1S,1R)-[乙酰基-谷氨酸]-2,3,4,9-四氢-1H-吡啶[3,4-b]并吲哚}-1,4-二酮(5E)
称取102mg(0.2mmol)(2S,5S)-四氢吡嗪[1,2:1,6]并双{(1S,1R)-[1-羧甲酸]-2,3,4,9-四氢-1H-吡啶[3,4-b]并吲哚}-1,4-二酮(5),88mg(0.4mmol)DCC,58mg(0.4mmol)HOBt,在100mL茄瓶中,加入40mL无水DMF溶解,冰浴搅拌20min,后加入142mg(0.4mmol)Glu(OBzl)-OBzl·HCl,用NMM调节反应液pH值至9,常温下搅拌反应12h。TLC监测反应(DCM:MeOH=20:1),TLC监测显示原料点消失,终止反应。在反应液中加入5倍反应液的超纯水,加入乙酸乙酯萃取,依次使用饱和NaHCO
用20mL甲醇溶解50mg 5-Glu(OBzl)-OBzl,加入5mg Pd/C,充入H
实施例9(2S,5S)-四氢吡嗪[1,2:1,6]并双{(1S,1R)-[乙酰基-苯丙氨酸]-2,3,4,9-四氢-1H-吡啶[3,4-b]并吲哚}-1,4-二酮(5F)
称取102mg(0.2mmol)(2S,5S)-四氢吡嗪[1,2:1,6]并双{(1S,1R)-[1-羧甲酸]-2,3,4,9-四氢-1H-吡啶[3,4-b]并吲哚}-1,4-二酮(5),88mg(0.4mmol)DCC,58mg(0.4mmol)HOBt,在100mL茄瓶中,加入40mL无水DMF溶解,冰浴搅拌20min,后加入120mg(0.4mmol)Phe-OBzl·HCl,NMM调节反应液pH值至9,常温下搅拌反应16h。TLC监测反应(DCM:MeOH=20:1),TLC监测显示原料点消失,终止反应。在反应液中加入5倍反应液的超纯水,加入乙酸乙酯萃取,依次使用饱和NaHCO
用20mL甲醇溶解50mg 5-Phe-OBzl,加入5mgPd/C,充入H
实施例10制备(2S,5S)-四氢吡嗪[1,2:1,6]并双{(1S,1R)-[乙酰基-甘氨酸]-2,3,4,9-四氢-1H-吡啶[3,4-b]并吲哚}-1,4-二酮(5G)
称取102mg(0.2mmol)(2S,5S)-四氢吡嗪[1,2:1,6]并双{(1S,1R)-[1-羧甲酸]-2,3,4,9-四氢-1H-吡啶[3,4-b]并吲哚}-1,4-二酮(5),88mg(0.4mmol)DCC,58mg(0.4mmol)HOBt,在100mL茄瓶中,加入40ml无水DMF溶解,冰浴搅拌20min,后加入120mg(0.4mmol)Gly-OBzl·TOS,NMM调节反应液pH值至9,常温下搅拌反应16h。TLC监测反应(DCM:MeOH=20:1),TLC监测显示原料点消失,终止反应。在反应液中加入5倍反应液的超纯水,加入乙酸乙酯萃取,依次使用饱和NaHCO
在50mL茄瓶中,用20mL甲醇溶解50mg 5-Gly-OBzl,加入5mgPd/C,充入H
实施例11制备(2S,5S)-四氢吡嗪[1,2:1,6]并双{(1S,1R)-[乙酰基-异亮氨酸]-2,3,4,9-四氢-1H-吡啶[3,4-b]并吲哚}-1,4-二酮(5I)
称取102mg(0.2mmol)(2S,5S)-四氢吡嗪[1,2:1,6]并双{(1S,1R)-[1-羧甲酸]-2,3,4,9-四氢-1H-吡啶[3,4-b]并吲哚}-1,4-二酮(5),88mg(0.4mmol)DCC,58mg(0.4mmol)HOBt,在100mL茄瓶中,加入40mL无水DMF溶解,冰浴搅拌20min,后加入95mg(0.4mmol)Ile-OBzl·TOS,NMM调节反应液pH值至9,常温下搅拌反应16h。TLC监测反应(DCM:MeOH=20:1),TLC监测显示原料点消失,终止反应。在反应液中加入5倍反应液的超纯水,加入EA萃取,依次使用饱和NaHCO
在50mL茄瓶中,用20mLl甲醇溶解50mg 5-Ile-OBzl,加入5mgPd/C,充入H
实施例12制备(2S,5S)-四氢吡嗪[1,2:1,6]并双{(1S,1R)-[乙酰基-亮氨酸]-2,3,4,9-四氢-1H-吡啶[3,4-b]并吲哚}-1,4-二酮(5L)
称取102mg(0.2mmol)(2S,5S)-四氢吡嗪[1,2:1,6]并双{(1S,1R)-[1-羧甲酸]-2,3,4,9-四氢-1H-吡啶[3,4-b]并吲哚}-1,4-二酮(5),88mg(0.4mmol)DCC,58mg(0.4mmol)HOBt,在100mL茄瓶中,加入40mL无水DMF溶解,冰浴搅拌20min,后加入93mg(0.4mmol)Leu-OBzl·TOS,NMM调节反应液pH值至9,常温下搅拌反应16h。TLC监测反应(DCM:MeOH=20:1),TLC监测显示原料点消失,终止反应。在反应液中加入5倍反应液的超纯水,加入乙酸乙酯萃取,依次使用饱和NaHCO
在50mL茄瓶中,用20mL甲醇溶解50mg 5-Leu-OBzl,加入5mgPd/C,充入H
实施例13制备(2S,5S)-四氢吡嗪[1,2:1,6]并双{(1S,1R)-[乙酰基-天冬酰胺]-2,3,4,9-四氢-1H-吡啶[3,4-b]并吲哚}-1,4-二酮(5N)
称取102mg(0.2mmol)(2S,5S)-四氢吡嗪[1,2:1,6]并双{(1S,1R)-[1-羧甲酸]-2,3,4,9-四氢-1H-吡啶[3,4-b]并吲哚}-1,4-二酮(5),88mg(0.4mmol)DCC,58mg(0.4mmol)HOBt,在100mL茄瓶中,加入40mL无水DMF溶解,冰浴搅拌20min,后加入111mg(0.4mmol)Asn-OBzl·HCl,NMM调节反应液pH值至9,常温下搅拌反应16h,TLC监测反应(DCM:MeOH=20:1),TLC监测显示原料点消失,终止反应。在反应液中加入5倍反应液的超纯水,加入EA萃取,依次使用饱和NaHCO3溶液(10mL×3),饱和NaCl溶液(10mL×3),5% KHSO
在50mL茄瓶中,用20mL甲醇溶解50mg 5-Asn-OBzl,加入5mgPd/C,室温搅拌18h,TLC监测反应(DCM:MeOH=20:1),反应完全,过滤旋干,使用C18纯化,得到21mg黄色固体,即为标题化合物,TLC条件为DCM:MeOH:HAc=15:1:1;ESI-MS(m/e):739[M-H]
实施例14制备(2S,5S)-四氢吡嗪[1,2:1,6]并双{(1S,1R)-[乙酰基-脯氨酸]-2,3,4,9-四氢-1H-吡啶[3,4-b]并吲哚}-1,4-二酮(5P)
称取102mg(0.2mmol)(2S,5S)-四氢吡嗪[1,2:1,6]并双{(1S,1R)-[1-羧甲酸]-2,3,4,9-四氢-1H-吡啶[3,4-b]并吲哚}-1,4-二酮(5),88mg(0.4mmol)DCC,58mg(0.4mmol)HOBt,在100mL茄瓶中,加入40mL无水DMF溶解,冰浴搅拌20min,后加入153mg(0.4mmol)Pro-OBzl·HCl,NMM调节反应液pH值至9,常温下搅拌反应16h。TLC监测反应(DCM:MeOH=20:1),TLC监测显示原料点消失,终止反应。在反应液中加入5倍反应液的超纯水,加入乙酸乙酯萃取,依次使用饱和NaHCO
在50mL茄瓶中,用20mL甲醇溶解50mg 5-Pro-OBzl,加入5mgPd/C,充入H
实施例15制备(2S,5S)-四氢吡嗪[1,2:1,6]并双{(1S,1R)-[乙酰基-丝氨酸]-2,3,4,9-四氢-1H-吡啶[3,4-b]并吲哚}-1,4-二酮(5S)
称取102mg(0.2mmol)(2S,5S)-四氢吡嗪[1,2:1,6]并双{(1S,1R)-[1-羧甲酸]-2,3,4,9-四氢-1H-吡啶[3,4-b]并吲哚}-1,4-二酮(5),88mg(0.4mmol)DCC,58mg(0.4mmol)HOBt,在100mL茄瓶中,加入40mL无水DMF溶解,冰浴搅拌20min,后加入99mg(0.4mmol)Ser-OBzl·HCl,NMM调节反应液pH值至9,常温下搅拌反应16h。TLC监测反应(DCM:MeOH=20:1),TLC监测显示原料点消失,终止反应。在反应液中加入5倍反应液的超纯水,加入EA萃取,依次使用饱和NaHCO3溶液(10mL×3),饱和NaCl溶液(10mL×3),5% KHSO
在50mL茄瓶中,用20mL甲醇溶解50mg5-Ser-OBzl,加入5mgPd/C,充入H
实施例16制备(2S,5S)-四氢吡嗪[1,2:1,6]并双{(1S,1R)-[乙酰基-缬氨酸]-2,3,4,9-四氢-1H-吡啶[3,4-b]并吲哚}-1,4-二酮(5V)
称取102mg(0.2mmol)(2S,5S)-四氢吡嗪[1,2:1,6]并双{(1S,1R)-[1-羧甲酸]-2,3,4,9-四氢-1H-吡啶[3,4-b]并吲哚}-1,4-二酮(5),88mg(0.4mmol)DCC,58mg(0.4mmol)HOBt,在100mL茄瓶中,加入40mL无水DMF溶解,冰浴搅拌20min,后加入168mg(0.4mmol)Val-OBzl·TOS,NMM调节反应液pH值至9,常温下搅拌反应16h。TLC监测反应(DCM:MeOH=20:1),TLC监测显示原料点消失,终止反应。在反应液中加入5倍反应液的超纯水,加入EA萃取,依次使用饱和NaHCO
在50mL茄瓶中,用20mL甲醇溶解50mg 5-Val-OBzl,加入5mgPd/C,室温搅拌12h,TLC监测反应(DCM:MeOH:HAc=20:1),反应完全,过滤旋干,使用C18纯化,得到13mg棕黄色固体,即为标题化合物,TLC条件为DCM:MeOH:HAc=10:1:1;ESI-MS(m/e):711[M+H]
实施例17制备(2S,5S)-四氢吡嗪[1,2:1,6]并双{(1S,1R)-[乙酰基-酪氨酸]-2,3,4,9-四氢-1H-吡啶[3,4-b]并吲哚}-1,4-二酮(5Y)
称取102mg(0.2mmol)(2S,5S)-四氢吡嗪[1,2:1,6]并双{(1S,1R)-[1-羧甲酸]-2,3,4,9-四氢-1H-吡啶[3,4-b]并吲哚}-1,4-二酮(5),88mg(0.4mmol)DCC,58mg(0.4mmol)HOBt,在100mL茄瓶中,加入40mL无水DMF溶解,冰浴搅拌20min,后加入116mg(0.4mmol)Tyr-OBzl·HCl,NMM调节反应液pH值至8,常温下搅拌反应16h。TLC监测反应(DCM:MeOH=20:1),TLC监测显示原料点消失,终止反应。在反应液中加入5倍反应液的超纯水,加入EA萃取,依次使用饱和NaHCO
在50mL茄瓶中,用20mL甲醇溶解50mg 5-Trp-OBzl,加入5mgPd/C,室温搅拌16h,TLC监测反应(DCM:MeOH=20:1),反应完全,过滤旋干,使用C18纯化,得到16mg黄色固体,即为标题化合物,TLC条件为DCM:MeOH:HAc=15:1:1;ESI-MS(m/e):838[M-H]
实施例18评价5A-5Y的抗动脉血栓活性
1)实验材料:
乌拉坦(氨基甲酸乙酯,CAS:51-79-6,国药集团化学试剂有限公司)、肝素钠(CAS:9041-08-1,百灵威科技有限公司)、生理盐水(石家庄四药有限公司)。
2)实验动物:
SD品系大鼠,雄性,200±20g,购自北京维通利华实验动物技术有限公司。
3)实验方法:
实验采用动静脉旁路丝线血栓形成模型。
4)旁路插管的准备:
旁路插管由三段组成,将内径1.0mm,外径2.0mm的聚乙烯管受热拉成一端为斜口的细管,定长为10.0cm,分别为右颈静脉和左颈动脉插管,位于旁路插管的两端;中段由内径3.5mm的聚乙烯管构成,定长为8.0cm;将表面毛糙的丝线定长为6.0cm,选用重4.0±0.1mg且毛糙程度相同的丝线。三段聚乙烯管内壁均用1%的硅醚溶液(1%硅油的乙醚溶液)进行硅烷化,在完全晾干后,将丝线于颈动脉插管方向置于中段聚乙烯管中,利用封口膜将三段聚乙烯管组装并固定,插管前需在管中充满肝素。
5)分组及给药剂量:
5剂量为1μmol/kg;5A-5Y系列化合物剂量为0.1μmol/kg;阳性对照阿司匹林剂量为167μmol/kg,阴性对照为羧甲基纤维素钠。
6)所用试剂配制:
麻醉剂为用生理盐水配制的20%的乌拉坦水溶液,抗凝剂为用生理盐水配制的42mg/100mL的肝素钠水溶液。
7)实验操作:
以0.3mL/100g体重的剂量分别对大鼠进行灌胃给药,给药30min后腹腔注射20%的乌拉坦溶液进行麻醉(0.7mL/100g)。仰卧位将大鼠固定于大鼠固定板上,剪开颈部皮肤,分离右颈总动脉及左颈外静脉,分别将右颈总动脉和左颈外静脉的远心端用手术线进行结扎,于暴露的左颈外静脉剪一V字型小口,将上面制好的旁路插管的静脉端斜口插入左颈外静脉开口的近心端,插管处用手术线将血管与聚乙烯管固定,以0.1mL/100g体重的剂量通过旁路插管准确注入肝素钠水溶液,注射器不撤离聚乙烯管。用动脉夹夹住右颈总动脉近心端,在暴露的动脉上剪一V字型小口,将聚乙烯管的尖端从注射器取下,将管插入右颈总动脉的近心端,用手术线将动脉血管与聚乙烯管固定,松开动脉夹,建立体外循环旁路。维持大鼠体温及旁路插管中血流通畅,体循环15min后先将静脉端插管剪断观察血液循环是否顺畅,从插管的动脉端取出血栓线,在滤纸上吸去丝线上的浮血后称量并记录其湿重,代表抗动脉血栓活性。
8)实验结果及讨论:
利用动静脉旁路丝线血栓形成模型评价5和5A-5Y系列化合物的体内抗动脉血栓形成的活性。口服给予的阴性对照羧甲基纤维素钠组的血栓湿重为33.36±3.95mg,而口服给予的阳性对照167μmol/kg的阿司匹林组的血栓湿重为23.03±4.24mg,这两组数据具有显著性差距P<0.05,这表明该模型建立成功。
在1μmol/kg口服给药的剂量下,5的血栓湿重为24.43±5.31mg,与阴性对照羧甲基纤维素钠组(血栓湿重为33.36±3.95mg)相比具有显著差异P<0.05,这表明5可以抑制体内动脉血栓的形成,表现出良好的抗动脉血栓活性。
在0.1μmol/kg口服给药剂量下,5A-5Y系列化合物组中,除了5L和5N,其他受试化合物血栓湿重与阴性对照羧甲基纤维素钠组相比均具有显著性差异P<0.05,说明修饰前与修饰后的化合物均可以明显抑制血栓形成。而且与5相比P>0.05,不具有统计学差异,其中5A、5D、5E、5F、5G、5I、5P、5S、5V、5Y与Aspirin相比P>0.05,不具有统计学差异,说明在该剂量下抗栓活性与阿司匹林相当,说明羧基端经氨基酸修饰的化合物,在较母体结构剂量低10倍条件下,仍可发挥体内抗血栓的作用,且部分化合物的活性在降低10倍剂量下与化合物5活性相当,说明本发明符合了设计的初衷,提高了抗血栓活性。
表1 5A-5Y的抗动脉血栓活性
a)与羧甲基纤维素钠比P<0.05;b)与阿司匹林组相比P>0.05;c)与5组相比P>0.05;n=12.
实施例19评价化合物5D抗动脉血栓的量效关系
1)实验材料:
乌拉坦(氨基甲酸乙酯,CAS:51-79-6,国药集团化学试剂有限公司)、肝素钠(CAS:9041-08-1,百灵威科技有限公司)、羧甲基纤维素钠(石家庄四药有限公司)。
2)实验动物:
SD品系大鼠,雄性,200±20g,购自北京维通利华实验动物技术有限公司。
3)实验方法:
实验采用动静脉旁路丝线血栓形成模型。
4)旁路插管的准备:
旁路插管由三段组成,将内径1.0mm,外径2.0mm的聚乙烯管受热拉成一端为斜口的细管,定长为10.0cm,分别为右颈静脉和左颈动脉插管,位于旁路插管的两端;中段由内径3.5mm的聚乙烯管构成,定长为8.0cm;将表面毛糙的丝线定长为6.0cm,选用重4.0±0.1mg且毛糙程度相同的丝线。三段聚乙烯管内壁均用1%的硅醚溶液(1%硅油的乙醚溶液)进行硅烷化,在完全晾干后,将丝线于颈动脉插管方向置于中段聚乙烯管中,利用封口膜将三段聚乙烯管组装并固定,插管前需在管中充满肝素。
5)分组及给药剂量:
5D为三个剂量分别是0.1μmol/kg、0.01μmol/kg、0.001μmol/kg;阳性对照阿司匹林剂量为167μmol/kg,阴性对照为羧甲基纤维素钠。
6)所用试剂配制:
麻醉剂为用生理盐水配制的20%的乌拉坦水溶液,抗凝剂为用生理盐水配制的42mg/100mL的肝素钠水溶液。
7)实验操作:
以0.3mL/100g体重的剂量分别对大鼠进行灌胃给药,给药30min后腹腔注射20%的乌拉坦溶液进行麻醉(0.7mL/100g)。仰卧位将大鼠固定于大鼠固定板上,剪开颈部皮肤,分离右颈总动脉及左颈外静脉,分别将右颈总动脉和左颈外静脉的远心端用手术线进行结扎,于暴露的左颈外静脉剪一V字型小口,将上面制好的旁路插管的静脉端斜口插入左颈外静脉开口的近心端,插管处用手术线将血管与聚乙烯管固定,以0.1mL/100g体重的剂量通过旁路插管准确注入肝素钠水溶液,注射器不撤离聚乙烯管。用动脉夹夹住右颈总动脉近心端,在暴露的动脉上剪一V字型小口,将聚乙烯管的尖端从注射器取下,将管插入右颈总动脉的近心端,用手术线将动脉血管与聚乙烯管固定,松开动脉夹,建立体外循环旁路。维持大鼠体温及旁路插管中血流通畅,体循环15min后先将静脉端插管剪断观察血液循环是否顺畅,从插管的动脉端取出血栓线,在滤纸上吸去丝线上的浮血后称量并记录其湿重,代表抗动脉血栓活性。
8)实验结果及讨论:
利用动静脉旁路丝线血栓形成模型评价5D的体内抗动脉血栓形成的活性是否存在剂量依赖关系。口服给予的阴性对照CMCNa组的血栓湿重为31.36±3.87mg,而口服给予的阳性对照167μmol/kg的阿司匹林组的血栓湿重为20.92±2.59mg,这两组数据具有显著性差距P<0.05,这表明该模型建立成功。
(0.1μmol/kg)5D的栓重与CMCNa组相比P<0.05,说明在0.1μmol/kg的剂量下5D表现出了优秀的抗动脉血栓活性;在降低10倍剂量之后,(0.01μmol/kg)5D组的栓重与CMCNa组相比P<0.05,说明在降低10倍剂量后5D仍具有抗动脉血栓活性;在降低100倍剂量后,(0.001μmol/kg)5D的栓重与CMCNa组相比P>0.05,说明已经不具有抗动脉血栓活性。
表2化合物5D的抗动脉血栓的量效关系
a)与CMCNa比P<0.05;b)与Aspirin比P<0.05;n=12
实施例20评价5A-5Y抑制体内P-选择素表达的活性
1)实验材料:
柠檬酸钠(CAS:68-04-2,国药集团化学试剂有限公司)、NS(石家庄四药有限公司)、蒸馏水;
2)实验样本:
大鼠抗动脉血栓实验,体循环后动脉血
3)实验方法:
采用大鼠p选择素酶联免疫试剂盒来进行检测。
4)试剂的配制:
1.从试剂盒中取出一只标准品,于6000-10000rpm离心30s,用1mL样本稀释液溶解,并用枪头对准冻存管底部反复吸打5次以助溶解,充分混合得到标准品S7,放置备用。取7个1.5ml离心管(S0-S6)依次排列,各加入250μL样本稀释液,吸取250μL标准品S7到第一个离心管中(S6),轻轻吹打混匀。从S6中吸取250μL到第二个EP管中(S5),轻轻吹打混匀。依次类推进行标准品的倍比稀释。S0为样本稀释液。标准品浓度分别为:S7(600ng/mL)、S6(300ng/mL)、S5(150ng/mL)、S4(75ng/mL)、S3(37.5ng/mL)、S2(18.75ng/mL)、S1(9.38ng/mL)、S0(0ng/mL)。
2.浓洗涤液按1:25倍用去离子水进行稀释。在临用前配妥,浓洗涤液低温保存会有盐析出,稀释时可在水浴中加温助溶。
3.生物素标记抗体液按1:100倍用生物素标记抗体稀释液进行稀释,在临用前10分钟内配妥。
4.辣根过氧化物酶标记亲和素按1:100倍用辣根过氧化物酶标记亲和素稀释液进行稀释,在临用前10分钟内配妥。
5)样本的采集:
用3.8%的枸橼酸钠溶液为抗凝剂,采集大鼠抗动脉血栓循环后的颈动脉血,与30min内于4℃1000rpm每分钟,离心15min,取上清液(血浆)作为样品进行检测。
6)样本检测:
将各种试剂移至室温(18-25℃)平衡至少30min,按前述方法配置试剂,备用。分别设标准品孔、待测样品孔。在每孔分别加入标准品或待测样本100μL,轻轻晃动混匀,覆上板贴,37℃温育2h。弃去液体,甩干,不用洗涤。每孔加入生物素标记抗体工作液100μL,覆上新的板贴,37℃温育1h。弃去孔内液体,甩干,洗板3次,每次浸泡2min,200μL/每孔,甩干。每孔加辣根过氧化物酶标记亲和素工作液100μL,覆上新的板贴,37℃温育1h。弃去液体,甩干,洗板5次,200μL/每孔,甩干。依序每孔加底物溶液90μL,37℃避光显色15-30min,依序每孔加终止溶液50μL,终止反应。在5min内用酶标仪在450nm波长依序测量各孔的光密度(OD值)。
7)实验结果:
CMCNa组与正常健康组大鼠相比,P<0.05,存在显著性差异,说明经手术造模后,大鼠血浆中P-选择素的表达显著增加;同时,CMCNa组与其他目标化合物组相比,P<0.05,也存在显著性差异,5A、5D、5E、5F、5I、5L、5S、5V、5Y目标化合物组与sham组相比,P>0.05,不存在显著性差异,说明母体结构5(剂量为1μmol/kg)以及目标化合物5A、5D、5E、5F、5I、5L、5S、5V、5Y(剂量为0.1μmol/kg)可以降低抗动脉血栓模型大鼠体内的P-选择素的表达且降低至正常水平。据此可以推测,以上化合物可能是通过下调血浆中P-选择素的表达从而发挥抗栓作用的。
表3 5A-5Y抑制体内P-选择素表达的活性
注:n=5,a)与CMCNa组相比,P<0.05;b)与sham组相比,P<0.05.
- 脂肪氨基酸修饰的吲哚乙醇衍生物,其合成,活性和应用
- 氨基酸修饰的S,R-七环醛,其合成,活性及应用
- 氨基酸修饰的S,R-七环醛,其合成,活性和应用
