一种促进干细胞体外增殖和分化的培养方法
文献发布时间:2023-06-19 12:05:39
技术领域
本发明属于干细胞培养技术领域。更具体地,涉及一种促进干细胞体外增殖和分化的培养方法及采用的无血清培养基。
背景技术
间充质干细胞(mesenchymal stem cells,MSCs)是一种来源于发育早期中胚层的多能干细胞,广泛存在于各种机体组织如骨髓、脂肪、脐带、胎盘等,并且具有自我更新和多向分化潜能以及独特的细胞因子分泌功能。间充质干细胞在不同的诱导条件下可分化为骨髓基质细胞、成骨细胞、成软骨细胞、脂肪细胞等多种细胞。间充质干细胞还具有免疫调节功能和促再生特性,在不同的疾病领域有临床应用报道,包括骨和软骨修复、呼吸道、心血管和肝胆等方面的疾病应用。
传统的人间充质干细胞的培养方法多采用添加10%胎牛血清(Fetal bovineserum,FBS)的培养基,但是含有动物血清的培养方法普遍存在以下不足:①动物血清作为异种血清,存在免疫排斥反应;②动物血清可能含有致病因子和外源毒物,如病毒和脘病毒的传播,安全性较低;③血清不同批次间存在质量差异;④血清中含有大量外泌体,不能用于人脐带间充质干细胞外泌体的分离和提纯。上述不足大大增加了间充质干细胞临床转化的困难,因此,无血清培养体系得以建立。
无血清培养基具有成分明确稳定,制备简单的优点,可以弥补有血清培养基的缺陷,但是,使用目前的无血清培养基培养的间充质干细胞形态、表面抗原、诱导分化能力、增殖速率及干性标志物与有血清培养存在一定的差异。总得来说,目前组合配制的化学成分限定的无血清培养体系还不能完全达到血清培养的效果。
血小板裂解物含有许多不同的生长因子,能够对细胞起到支持生长的作用,也是当前使用较多的一种血清替代物。有研究表明,血小板裂解物能够很好的维持间充质干细胞的干性,使其在体外能够连续传代,且传代的间充质干细胞具有良好的形态、细胞表型和分化潜能。
银耳多糖是一种存在于银耳深层发酵孢子体中的酸性杂多糖,其主链结构是由α-(1→3)糖苷键连接的甘露聚糖,支链由葡萄糖醛酸和木糖组成。目前银耳多糖已经被应用于成骨细胞的体外培养(中国专利申请CN106434549A)、牙髓干细胞的分离及培养(中国专利申请CN109897821A),显示其与某些组分的特定配合能够降低细胞发生凋亡的概率。
二氢硫辛酸(DHLA)以化合物的形式广泛存在于各种原核细胞和真核细胞中,参与能量代谢。多项研究表明,二氢硫辛酸具有强大的抗氧化能力,其可以将DSSH还原成GSH,同时还可以通过氧化还原偶联再生其他内源性抗氧化剂,如VE、辅酶Q
目前,未见将血小板裂解物、银耳多糖及二氢硫辛酸作为添加成分联合用于体外培养间充质干细胞并维持其干性的报道。
发明内容
本发明要解决的技术问题是克服现有间充质干细胞培养存在的缺陷和不足,提供一种适用于体外培养间充质干细胞的方法,该培养方法关键技术点在于采用了含血小板裂解物、银耳多糖及二氢硫辛酸功能成分的无血清培养基,经试验证明,该无血清培养基培养获得的间充质干细胞经连续传代后仍然具有非常好的新盖、细胞表型和分化潜能,培养效果相当于10%FBS连续培养效果,证明其完全可以取代血清培养。
本发明的目的是提供一种适用于培养间充质干细胞的无血清培养基,每1L所述无血清培养基包含:
优选地,每1L所述无血清培养基包含:
优选地,每1L所述无血清培养基包含:
优选地,每1L所述无血清培养基包含:
优选地,每1L所述无血清培养基包含:
本发明使用的人血小板裂解物(Human Platelet Lysate)采购于上海微科生物技术有限公司,其富含各类生长因子,是很好的胎牛血清替代物。
本文中二氢硫辛酸可以是化学合成的产物,其分子式为:C
具体地,本发明使用的二氢硫辛酸购买于北京百灵威科技有限公司。
在本发明其中一个实施方式中,所述银耳多糖混合物由两种具有不同分子量的银耳多糖组成。本文中“分子量”是指质均分子量(Mw),本发明中银耳多糖可通过常规制备方法获得,包括但不限于采用生物发酵技术获得、采用生物提取方法获得。具体地,本发明使用的银耳多糖通过生物提取方法获得,通过控制提取工艺中的提取条件可获得不同分子量的银耳多糖。通常,不同分子量的银耳多糖常常表现出不同的生理活性。
在本发明其中一个实施方式中,所述两种具有不同分子量的银耳多糖其分子量分别为25万Da和78万Da。发明人已经证实,加入两种不同分子量的银耳多糖与血小板裂解物、二氢硫辛酸联合作为添加成分对于间充质干细胞的体外培养是更有利的。更有利地是加入分子量分别为25万Da和78万Da,由于具有不同分子量的银耳多糖表现出不同的生理活性,因此这种由于不同分子量的组合引起的效果差异也是被认为合理的。
在本发明其中一个实施方式中,最好控制所述分子量为25万Da的银耳多糖和所述分子量为78万Da的银耳多糖之间的重量比为3:1~2。更有利地,控制所述分子量为25万Da的银耳多糖和所述分子量为78万Da的银耳多糖之间的重量比为3:1是最佳的实施方式。
已有非常多的现有技术表明,单纯加入血小板裂解物作为添加成分已经能够满足间充质干细胞的传代培养需求并很好地维持其干性,培养效果与血清培养无明显差异。但是发明人发现,上述效果需要保证血小板裂解物维持在较高的浓度,目前来看是至少10%以上,才能达到10%FBS血清连续培养的效果。
而令人惊讶的是,银耳多糖与二氢硫辛酸的加入能够与血小板裂解物在间充质干细胞的培养中表现出协同的相互作用,发明人已经证实,如果加入一定量的银耳多糖与二氢硫辛酸,配合低浓度的血小板裂解物对间充质干细胞进行体外培养即可达到10%FBS血清连续培养的效果,大大降低了培养的成本。
在本发明其中一个实施方式中,在低浓度的血小板裂解物基础上,复配不同分子量的银耳多糖,并控制两者的比例,可以获得最佳的培养效果。
优选地,所述基础培养基选自DMEM-F12培养基和L-DMEM培养基中的一种。本发明中采用的DMEM-F12培养基作为培养基质,其来源于市购(购于北京清大天一生物技术有限公司,产品代号MD207-050)。
本发明另一目的在于提供所述的无血清培养基在体外培养间充质干细胞中的用途。
发明人已证实,采用本发明所述无血清培养基培养间充质干细胞能够明显地提高间充质干细胞的扩增能力、分化能力并维持其干细胞特性。
本文中涉及的“间充质干细胞”理论上包括人脐带间充质干细胞、人脂肪间充质干细胞和人骨髓间充质干细胞。
本发明另一目的在于提供采用所述无血清培养基在体外培养间充质干细胞的方法,其包括以下步骤:
S1、将处理后的脐带于无菌的条件下剪碎,形成组织块;
S2、将上述组织块接种于所述的无血清培养基中,于37℃、5%CO
S3、待细胞汇合度至80~90%时采用胰酶消化传代,将消化获得的间充质干细胞以1~3×10
在本发明其中一个实施方式中,所述步骤S1脐带的处理具体步骤为:无菌条件下,用PBS缓冲液将新鲜健康的脐带清洗至无血液残留,然后剥离脐带动脉、静脉及外膜。
在本发明其中一个实施方式中,所述步骤S1中将组织块剪碎成2mm×2mm的大小。
与现有技术相比,本发明具有以下有益效果:
(1)本发明提供的无血清培养基采用人血小板裂解物替代胎牛血清,无批次间差异,大大提高了间充质干细胞临床应用的安全性问题。
(2)本发明提供的无血清培养基以低浓度的人血小板裂解物复合特定分子量组合的银耳多糖及二氢硫辛酸,即可满足间充质干细胞的体外传代连续培养。试验结果表明,采用本发明提供的无血清培养基培养的人脐带间充质干细胞形态均一,且均能诱导分化为成骨细胞和脂肪细胞,细胞表面标志物表达符合标准,增殖效率高,培养效果与10%胎牛血清培养无明显差异。
附图说明
图1为各组培养基培养获得的人脐带干细胞成骨诱导分化茜素红染色图;
图2为各组培养基培养获得的人脐带干细胞成脂诱导分化油红O染色图;
图3为各组培养基培养获得的人脐带干细胞成软骨诱导分化阿新蓝染色图;
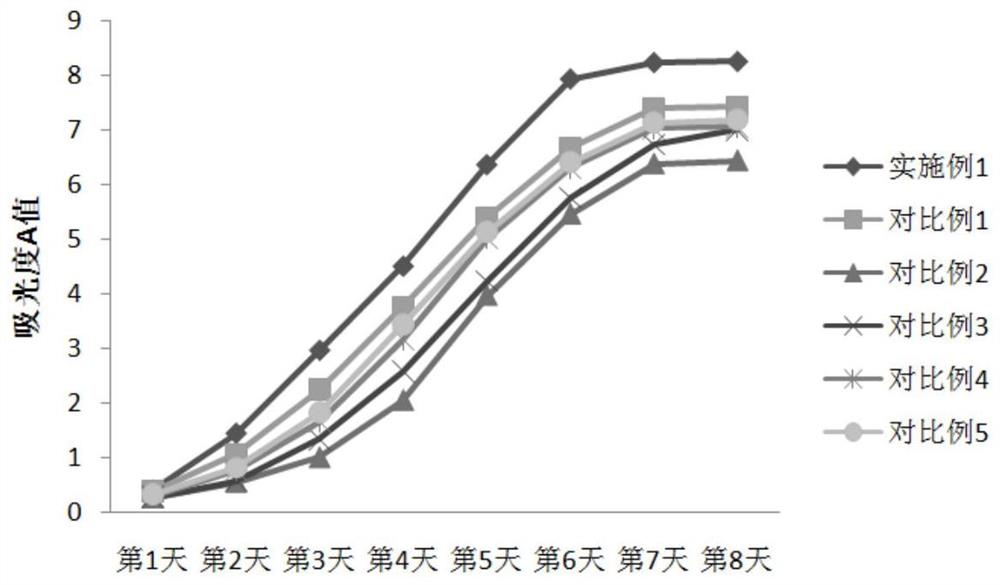
图4为各组培养基培养获得的人脐带干细胞的生长曲线图。
具体实施方式
通过下面的实施例可以对本发明进行进一步的描述,然而,本发明的范围并不限于下述实施例。本领域的专业人员能够理解,在不背离本发明的精神和范围的前提下,可以对本发明进行各种变化和修饰。
实施例1、无血清培养基
本发明实施例1每1L所述无血清培养基包含:
其中,所述银耳多糖混合物由分子量为25万Da的银耳多糖与分子量为78万Da的银耳多糖按重量比为3:1组成。
实施例2、无血清培养基
本发明实施例2每1L所述无血清培养基包含:
其中,所述银耳多糖混合物由分子量为25万Da的银耳多糖与分子量为78万Da的银耳多糖按重量比为3:1.5组成。
实施例3、无血清培养基
本发明实施例3每1L所述无血清培养基包含:
其中,所述银耳多糖混合物由分子量为25万Da的银耳多糖与分子量为78万Da的银耳多糖按重量比为3:2组成。
实施例4、无血清培养基
本发明实施例4每1L所述无血清培养基包含:
其中,所述银耳多糖混合物由分子量为25万Da的银耳多糖与分子量为78万Da的银耳多糖按重量比为3:1.2组成。
对比例1、
对比例1每1L所述无血清培养基包含:
胎牛血清 10v/v%;
DMEM-F12培养基 补足。
对比例2、与实施例1的区别在于,不加入二氢硫辛酸,其余参数与实施例1相同。
对比例3、与实施例1的区别在于,不加入银耳多糖混合物,其余参数与实施例1相同。
对比例4、与实施例1的区别在于,仅加入分子量为25万Da的银耳多糖,其余参数与实施例1相同。
对比例5、与实施例1的区别在于,仅加入分子量为78万Da的银耳多糖,其余参数与实施例1相同。
上述具体实施方式中,不同分子量的银耳多糖由下述制备方法制备得到:
取银耳粉末,装入提取罐内,按料液比为1:50加入去离子水,加热至90℃,往罐内通入蒸汽进行提取,提取过程中保持提取温度在110~120℃之间,罐压为0.03MPa,提取200min;
采用NaOH调节提取料液的pH为3.5,加入银耳粉末0.5%质量的复合酶(果胶酶和纤维素酶按1:1质量比复合)和2%的酶解促进剂醋酸钠,于50℃下酶解2.5h,过滤,浓缩,得到膏状物;
往膏状物中缓慢加入无水乙醇进行沉淀,静置1.5h,除去上清液,加入2倍体积的乙醇对沉淀物进行脱水;脱水后进行抽滤,于60℃,真空度为0.09~0.1MPa的条件下干燥6h,即得到分子量为25万Da的银耳多糖。
分子量为78万Da的银耳多糖参考上述制备方法,不同在于,罐压控制为0.03MPa,提取时间为60min。
银耳多糖的分子量测定
采用高效凝胶渗透色谱法进行分子量的测定(测定方法参考:刘芹,宁嘉玲,丁侃.基于高效凝胶渗透色谱法的银耳多糖质量控制研究[J].中草药,2011,42(09):1732-1735.)。检测结果显示,上述制备方法制备的银耳多糖分子量分别为25万Da和78万Da。
一、人脐带间充质干细胞分离培养
1)脐带间充质干细胞的分离及原代培养
于无菌条件下,用PBS缓冲液将新鲜健康的脐带清洗至无血液残留,然后剥离脐带动脉、静脉及外膜;采用剪刀剪碎至2mm×2mm大小的组织块,将上述组织块均匀接种于25T培养瓶中,加入2ml实施例1制备的无血清培养基,置于37℃、5%CO
在显微镜下观察细胞形态和生长情况,待细胞长到80%汇合度时,用滴管吸出培养基,采用PBS缓冲液清洗,加入适量0.25%胰蛋白酶进行消化4min;除去胰蛋白酶,加入DMEM-F12培养基,吹散细胞,收集到离心管内,离心5min,弃上清液;往离心管内继续加入2ml实施例1制备的无血清培养基重悬细胞,计数,按2×10
采用实施例2~4以及对比例1~5制备的间充质干细胞培养基替代上述培养方法采用的实施例1制备的无血清培养基,即获得不同间充质干细胞培养基培养的细胞。
二、脐带间充质干细胞的鉴定及结果
对采用实施例1~4以及对比例1~5制备的间充质干细胞培养基培养获得间充质干细胞的形态、免疫表型、体外分化能力及增值能力按下述方法和步骤进行鉴定。
2.试验方法
2.1人脐带间充质干细胞的形态观察:采用显微镜观察各组细胞形态,比较不同培养基培养对间充质干细胞的形态的影响。
2.2人脐带间充质干细胞免疫表型检测:收集第5代细胞,调整细胞浓度为1×10
2.3人脐带间充质干细胞体外分化潜能检测:
①成骨诱导:收集第5代细胞,按2×10
②成脂诱导:收集第5代细胞,按1×10
③成软骨诱导:收集第5代细胞,调整细胞浓度为1×10
2.4人脐带间充质干细胞增殖能力检测:收集第3代对数生长期的人脐带间充质干细胞悬液,调整细胞浓度为1×10
3.鉴定结果
3.1细胞形成观察结果
采用本发明实施例1~4传代培养获得的间充质干细胞在显微镜观察下均能贴壁生长,呈短梭形,形态均较为均一,规则生长,传代后细胞增长速度较快,平均2~3d即可传至下一代;胎牛血清组(对比例1)培养获得的细胞呈长梭形,呈旋涡状生长,传代速度较快,平均3~4d即可传至下一代;采用对比例2~5制备的培养基获得间充质干细胞无论是在细胞形态、传代速度等情况均明显差于实施例1。
3.2人脐带间充质干细胞的免疫表型检测结果
由上表可知,各组细胞表面抗原CD73、CD90和CD105呈阳性表达,CD45和CD34呈阴性表达,其中,实施例1~4组培养获得的细胞CD73、CD90和CD105阳性率均在95%以上,CD45和CD34阳性率低于2%,符合人脐带间充质干细胞的表型特征,且与10%胎牛血清培养的人脐带间充质干细胞表面抗原表达无明显差异。显示,本发明提供的无血清培养基能够替代10%血清培养。
3.3人脐带间充质干细胞体外分化潜能检测结果
从图1~3可看出,各组细胞传代至第5代后,实施例1~4培养获得的间充质干细胞在成骨诱导、成脂诱导及成软骨诱导分化能力与10%胎牛血清培养的人脐带间充质干细胞无统计学差异。
3.4人脐带间充质干细胞增殖能力检测结果
从图4可看出,实施例1组与10%胎牛血清培养组(对比例1组)细胞大致呈现“S”型的生长曲线,包含典型的潜伏期、对数生长期及平台期;其中,实施例1组较血清组生长更好,从第二天开始细胞增殖加速,进入对数生长期,第7天进入平台期。对比例2~5改变了培养基中的某个成分,其培养获得的间充质干细胞潜伏期更长,更缓慢进入对数生长期,且增殖较慢。
综上显示,本发明提供的无血清培养基与10%胎牛血清培养的人脐带间充质干细胞在细胞形态、诱导分化能力、细胞表型方面无明显差异,且增殖能力更强,可替代血清培养基。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 一种促进干细胞体外增殖和分化的培养方法
- 一种促进脐带间充质干细胞体外增殖并促进其分化的培养基
