一种红细胞抗原检测试纸条及应用
文献发布时间:2023-06-19 18:32:25
技术领域
本发明属于血型检测领域,具体涉及一种红细胞抗原检测试纸条及应用。
背景技术
红细胞血型是根据血液中红细胞膜表面抗原来划分的,根据抗原种类的不同,可以划分出20多个常见的分类系统,其中包括ABO血型系统和Rh血型系统。正确的血型鉴定对输血至关重要,输入不相容的血型会导致溶血的发生,进而导致严重的医疗事故。因此,快速、准确、操作简便的血型鉴定方法可为抢救危急病人、应对突发事件提供保障。
目前血型鉴定主要分为凝集法和基因法两大类。凝集法的原理为检测血液中红细胞(RBC)表面抗原,只要RBC表面存在相应抗原,即可与相应抗体发生凝集反应,包括纸片法、试管法、微柱法等。其优点是检测速度快,但受抗体保存条件的限制,不适用于野外紧急条件,且通常存在较大误差。基因法主要通过特异性引物对RBC基因进行分型,以此对各自血型进行鉴定,尤其适合复杂血型的鉴定。但其检测速度慢、操作不便、成本高。因此,依然有必要开发操作简便、检测速度快,检测结果准确的血型检测工具,例如,采用迁移层析法检测人血型的试剂卡(中国发明专利申请CN101074961A公开了一种快速测定干血血型的胶体金试纸卡及其制备方法;中国发明专利申请CN103884849A公开了一种血型和血型抗体测定结果的显示方式和制作方法,主要基于胶体金免疫层析试纸条技术)。
但这些传统的利用迁移层析法检测人血型的试剂卡,由于采用胶体金系统进行显色,一般都需要在试剂卡上专门设置含有胶体金标记抗体的结合垫使检测样本中的A血型抗原或B血型抗原先与胶体金标记抗体完成特异性结合,然后再通过检测线和质控线进行检测。因此这类试剂卡只能单侧加样,而且对结合垫的要求较高(血型抗原和胶体金的结合情况直接影响检测结果),因此其结构往往较为复杂,对制作工艺的要求也较高。另外,这类试剂卡需依据检测线和质控线处胶体金显色进行结果判读,但由于检测样本(全血或者红细胞悬液)中所含有的血红蛋白本身就有颜色,因此有可能会在结果判读时呈现肉眼可见的颜色干扰,进而影响检测结果的准确性。
现有技术中也有尝试通过红细胞凝集直接显色的技术方案。例如,中国发明专利申请CN101603967A公开了一种快速检测血型的试剂盒,通过判断血液与单一抗体在玻璃纤维上是否有发生凝集反应的红细胞残留来判断血型。但这种试剂盒结构复杂,检测精度低。为了确保检测精度,一张试纸检测条上仅能固定一种抗体,检测一种血型抗原。如果要检测多种血型抗原就要增设多张彼此独立的试纸检测条,分别加样检测。而血型检测通常就需要同时检测多种血型抗原。因此这种技术方案的检测效率低,多次加样导致样本整体用量大,并且检测的精度也容易因不同试纸条之间的差异和多次加样时存在的操作差异而受到影响。
因为上述原因,利用迁移层析法检测人血型试剂卡至今没有被广泛应用,目前市场上依然没有已注册的商品化血型检测试纸条产品,所以有必要对现有迁移层析法检测人血型的试剂卡进行优化改进。
发明内容
有鉴于此,本发明的目的在于提供一种红细胞抗原检测试纸条及应用,具体技术方案如下:
一种红细胞抗原检测试纸条,所述红细胞抗原检测试纸条包括硝酸纤维素膜(NC膜)和吸水纸基,所述吸水纸基边缘压在所述硝酸纤维素膜边缘上;所述吸水纸基厚度大于等于0.6mm,长度大于等于10mm(附图1中的Y1);所述硝酸纤维素膜毛细爬速为65-75s/4cm;所述硝酸纤维素膜上设置有显色线;,所述显色线预包被有血型抗体,所述血型抗体的浓度范围为0.01mg/ml~0.03mg/ml,所述显色线包括A线、B线和C线;所述A线包被有抗A血型抗原单克隆抗体;所述B线包被有抗B血型抗原单克隆抗体;所述C线为质控线,包被有抗红细胞抗体(抗RBC抗体);所述显色线之间平行排列,相邻显色线之间的间距为3-5mm;所述A线和所述B线相邻,并在其间设置有加样位置,用于加入待测样本,所述待测样本包含红细胞。
所述A线和所述B线相邻设置,并在其间设置有加样位置,是因为A线和B线需要用于检测A血型、B血型、O血型和AB血型,其重要程度最高,因此对样本量的均一性要求最高。进而将两线相邻设置并在中间设置加样位置,可以最大程度的保证扩散到两线的样本量是基本等量的,且判读结果最准确。
进一步,所述显色线还包括D线,所述D线包被有抗RhD抗原(可以简称为“D抗原”)的单克隆抗体。D线处如果显色,意味着检测样本中的红细胞上有RhD抗原,即样本血型按Rh血型系统划分为Rh阳性血(Rh(+));D线处如果没有显色,则意味着检测样本中的红细胞上没有RhD抗原,即样本血型按Rh血型系统划分为Rh阴性血(Rh(-))(又俗称“熊猫血”)。
优选的,所述红细胞抗原检测试纸条的加样位置设置在A线和B线的中间。
进一步,所述显色线上包被好所述血型抗体后,于30℃-37℃条件下干燥8-16h。
进一步,所述相邻显色线之间的间距为3mm、4mm或5mm。
进一步,所述硝酸纤维素膜长度为25mm(附图1中的Y2)。
进一步,所述硝酸纤维素膜毛细爬速为70s/4cm。
一种血型检测卡,包括上面任一项所述的红细胞抗原检测试纸条,其中所述硝酸纤维素膜下方设置有样品垫,所述样品垫和所述吸水纸基设置在背衬上,红细胞抗原检测试纸条整体置于外壳中。
进一步,所述血型检测卡外壳上设置观察窗口,所述观察窗口用于显示所述显色线(观察窗口的长度约为15-19mm);所述外壳上的端部还设置有缓冲液孔。可以理解的是,所述端部可以是血型检测卡外壳的上端部,也可以是血型检测卡外壳的下端部。
优选的,所述观察窗口的长度为15mm、16mm、17mm、18mm或19mm。
采用上述血型检测卡进行血型检测的方法,包括将红细胞抗体用抗体包被液稀释到浓度范围为0.01mg/ml~0.03mg/ml后包被到红细胞抗原检测试纸条的显色线上,将待测样本滴加到所述血型检测卡的加样位置;将冲洗液滴加到所述血型检测卡的缓冲液孔中,所述冲洗液与所述待测样本混合,促进所述待测样本在所述红细胞抗原检测试纸条上均匀扩散,并且将未与显色线反应的所述待测样本冲洗走(因此使得试纸条的背景更加干净),通过观察窗口进行结果判读。
进一步,所述待测样本为含红细胞的全血或红细胞悬浮液,所述待测样本的加样量为20μL - 30μL。
进一步,所述抗体包被液包括质量分数为4%-6%的蔗糖、0.3%-0.5%的BSA、0.1%-0.3%的Proclin 300和PBS缓冲液;所述冲洗液为含有质量分数0.5%-0.7% Tween-80和0.1%-0.3% Proclin 300的PBS缓冲液。优选的,所述PBS缓冲液的浓度为0.01M。
有益技术效果
1)首先,本发明通过对红细胞抗原检测试纸条上包被的血型抗体的浓度、显色线位置、加样位置、吸水纸基的长度及厚度、硝酸纤维素膜毛细爬速的优化,使得通过简易(NC膜试纸条)血型检测也可以达到血型检测所需要的必要准确度和速度:即在简化血型检测方式、缩短血型检测时间的同时实现了在同一张试纸条上对血液里的不同血型抗原的同时检测,并且还减少了假阳性、假阴性出现的概率。具体地,本发明的技术方案将加样位置设置在检测试纸条上4条显色线的中间,并且对NC膜试纸条的毛细爬行作用(通过液体的表面张力、重力和附着力共同作用而形成)和位于NC膜上下边缘的吸水纸基长度及厚度进行了优化,使NC膜上的红细胞可以顺畅穿行,提高样本的整体毛细爬行速度,此外协同优化后的吸水纸基,使样本(全血或红细胞悬浮液)中的红细胞不仅可以同时向加样位置的两侧快速、均匀地扩散,让样本可以以相对均匀的量快速到达两侧的显色线(包被有抗A、B、RhD血型抗原的抗体),同时还能使跑样背景干净、清晰,减少了假阳性概率。因此,本发明的技术方案在一定程度上避免了因检测线上样本量差异、反应时间差异影响检测结果准确性的情况(例如,因为现有技术中采用的单侧加样,很容易导致邻近加样位置一侧的检测线上的样本量明显高于远离加样位置一侧的样本量;邻近加样位置一侧的检测线上抗体与样本中抗原的反应时间也比远离加样位置一侧的检测线上的反应时间更长)。
另一方面,在本发明的技术方案中,相邻显色线之间的距离设置为3-5mm,既可以在一定程度上避免了因各显色线之间距离太小导致的交叉污染的问题,又使得红细胞样本一经毛细作用扩散就能迅速地跟显色线上包被的血型抗体发生结合反应,有效缩短了结果判读的时间。利用本发明的血型检测卡进行血型检测,结果判读的时间为加样5min后。而在传统检测卡中,加样位置一般在检测卡一侧的尽头。加入的全血或红细胞悬液样本需要先爬行到试纸条上的结合垫与胶体金标记抗体结合,然后再继续爬行到不同检测线位置与检测线上包被的抗体发生结合反应。并且,为了确保反应充分,样本在试纸条上的毛细爬行速度不能太快,这样就不可避免地会限制、延缓红细胞在膜上的爬行速度,导致需要更长的判读时间,一般为加样后15-30min;而且依然存在因为样本到达不同检测线位置的量的差异、样本中血型抗原与胶体金标记抗体结合情况等诸多因素而影响检测结果准确性的问题。
2)其次,本发明的检测试纸条在确保检测精度的前提下直接用待测样本中的红细胞作为阴阳性指示系统,可以在同一张试纸条上同时显示多种血型抗原和包被在试纸条上的血型抗体的结合反应。因此,本发明的技术方案既做到了单一试纸条、单次加样即可检测;同时也无需采用胶体金、微球等其他指示系统进行指示,避免了因胶体金系统中往往要引入胶体金或微球标记的蛋白,使操作步骤繁琐且易受pH值和金属离子影响等技术问题。
3)最后,本发明的检测试纸条由于采用毛细作用让样本在各显色线上均匀分布,因此所需加样量少,一般仅需20μL或30μL(可以根据相邻显色线之间的间距进行调节)即可,节约样本量。传统检测卡只能单侧加样,还要通过结合垫,导致爬行距离较长,因此需要足够的样本量才能使样本爬行到最远处的检测线或质控线并与之结合,因此需要的加样量一般需要大于60μL,而且难以解决单侧加样所产生的样本量分布不均、反应时间不一等技术问题。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍。显而易见地,下面描述中的附图是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其它的附图。
图1为本发明血型检测卡显色线位置的一种实施例;
图2为本发明血型检测卡显色线位置的另一种实施例;
图3为本发明血型检测卡显色线位置的另一种实施例。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述。显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
需要说明的是,在本文中,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者装置不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者装置所固有的要素。在没有更多限制的情况下,由语句“包括一个……”限定的要素,并不排除在包括该要素的过程、方法、物品或者装置中还存在另外的相同要素。
如在本说明书中使用的,术语“大约”,典型地表示为所述值的+/-5%,更典型的是所述值的+/-4%,更典型的是所述值的+/-3 %,更典型的是所述值的+/-2 %,甚至更典型的是所述值的+/-1 %,甚至更典型的是所述值的+/-0.5%。
在本说明书中,某些实施方式可能以一种处于某个范围的格式公开。应该理解,这种“处于某个范围”的描述仅仅是为了方便和简洁,且不应该被解释为对所公开范围的僵化限制。因此,范围的描述应该被认为是已经具体地公开了所有可能的子范围以及在此范围内的独立数字值。例如,范围1〜6的描述应该被看作已经具体地公开了子范围如从1到3,从1到4,从1到5,从2到4,从2到6,从3到6等,以及此范围内的单独数字,例如1,2,3,4,5和6。无论该范围的广度如何,均适用以上规则。
本发明采用免疫层析法原理,检测人ABO血型正定型和Rh血型。本发明的血型检测卡(以下简称“检测卡”或“血型检测卡”) 可用于ABO血型及Rh血型检测,其包含NC膜,NC膜的上下边缘设置吸水纸基(即制得本发明所述的红细胞抗原检测试纸条)。所述细胞抗原检测试纸条上包被三条检测线T线(A线、B线、D线)和一条质控线C线。T线包被有A抗体(即抗A血型抗原单克隆抗体)、B抗体(即抗B血型抗原单克隆抗体)、D抗体(即抗RhD抗原单克隆抗体),C线包被有抗人红细胞抗体。在本发明的技术方案中,所述细胞抗原检测试纸条对NC膜和吸水纸基分别进行了优化,选用毛细爬行速度为65-75s/4cm的NC膜既可以让样本中的红细胞与显色线上的抗体充分反应,也可以让红细胞在NC膜上顺畅穿行,有效缩短血型检测显示有效结果的时间。在一些实施例中,NC膜的长度(Y2)为大约25mm,这样长度的NC膜可以使4条显色线在优化的距离内进行均匀排布;吸水纸基的长度(Y1)为大于等于10mm,这样在血型检测时可以使整个试纸条的跑样背景干净清晰(参见实施例5 - 表5)。
本发明利用上述血型检测卡进行血型检测方法的步骤及原理如下:首先将红细胞悬液加至NC膜上指定位置,红细胞悬液由于毛细作用均匀分散在NC膜上,与检测线、质控线充分反应,向缓冲液孔滴加冲洗液,判读结果。如果样本中含有A抗原,则该抗原与NC膜上包被的A抗体结合,冲洗后该免疫复合物在A线处显示红色的线条,提示A抗原阳性结果;反之,如果样本中没有A抗原,则检测线A线不显色,显示阴性结果。同理,如果样本中含有B抗原,则该抗原与NC膜上包被的B抗体结合,冲洗后该免疫复合物在B线处显示红色的线条,提示B抗原阳性结果;反之,如果样本中没有B抗原,则检测线B线不显色,显示阴性结果。如果样本中含有RhD抗原,则该抗原与NC膜上包被的D抗体结合,冲洗后该免疫复合物在D线处显示红色的线条,提示RhD抗原阳性结果;反之,如果样本中没有RhD抗原,则检测线D线不显色,显示阴性结果。该检测卡还包含一条质控线C,不管是否有检测线出线(即显出颜色),红色的质控线C线都应出线;如果质控线C未出线,则表明检测结果无效,此样本需重新进行检测。
本发明所述的“检测卡”,指一种卡形载体,在其上形成有用于血型检测中进行化学或生物学反应的孔、槽、腔室等,以及用于观察血型检测中化学或生物学反应的窗口,所述检测卡内还可选地设置吸水垫等常规部件。
实施例1
本发明的血型检测卡示例(附图1-附图3)。
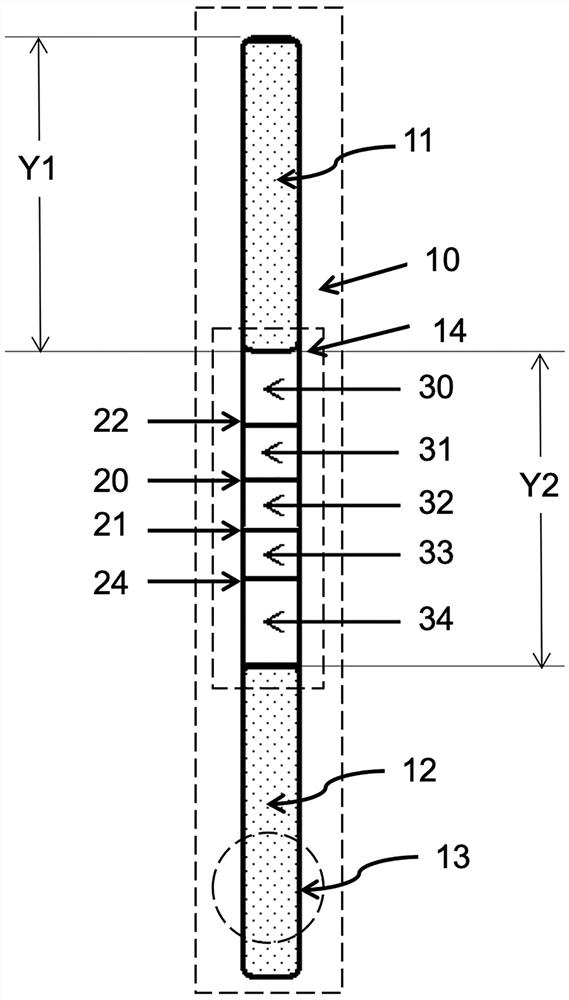
本发明提供的血型检测卡包括本发明所述的红细胞抗原检测试纸条和放置所述红细胞抗原检测试纸条的外壳10。所述外壳10上分别于上端部和下端部设置检测卡安装部I 11和检测卡安装部II 12;所述外壳10的端部还设置有缓冲液孔13,可以理解的是,所述缓冲液孔13可以设置在所述外壳10的上端部,也可以设置在所述外壳10的下端部。
所述外壳10上还设置观察窗口14,用于显示和观察显色线。所述显色线包括A线20、B线21、C线22和D线23。可以理解的是,所述A线20、B线21、C线22和D线23的位置并不是固定的,但A线20和B线21相邻排列。
此外,所述观察窗口14内还设置加样位置,从上到下依次排列,分别是加样位置I30、加样位置II 31、加样位置III 32、加样位置IV 33和加样位置V 34。
本发明所述红细胞抗原检测试纸条包括NC膜和吸水纸基,其中,吸水纸基边缘压在NC膜上下边缘上设置。附图1中的Y1代表吸水纸基纵向长度,Y2代表NC膜纵向长度。
实施例2
本发明的血型检测方法示例。
1)将20μL或30μL待测含红细胞的全血或红细胞悬浮液滴加到红细胞抗原检测试纸条4条显色线正中间;
2)滴加几滴含有质量分数0.5%-0.7% Tween-80和0.1% Proclin 300 和PBS缓冲液的冲洗液到缓冲液孔中;
3)静置5分钟,进行结果判读。
实施例3
抗体包被浓度验证。
方法:将起始浓度为2.0-3.0mg/ml的A、B、D抗体用包被液依次稀释10倍、25倍、50倍、100倍、150倍、200倍后,验证阴阳红细胞,考察线条显色情况,选择合适的包被浓度。
结果:抗体稀释倍数为10倍、25倍、50倍进行包被时,线条会发生聚线,且因包被浓度大易出假阳性,100倍、150倍、200倍线条正常,阴阳性未发现异常,但200倍显色明显较100倍弱,本实验优选最佳包被浓度为抗体稀释100-150倍。
表1 抗体不同稀释倍数检测结果
备注:B-型血为B型Rh阴性血。
其中,C表示检测线颜色深浅(C-:很浅或不显色;C+:较浅;C++:适中;C+++:较深;C++++:过深);D表示扩散程度(D-:清晰不扩散;D+:略微扩散;D++:明显扩散)U表示条带均匀程度(U-:不均匀;U+:较均匀;U++:很均匀)。
实施例4
包被液和冲洗液成分优化。
包被液和冲洗液对结果具有一定影响,下面对包被液成分、冲洗液成分进行了梯度优化,并将4种包被液、6种冲洗液进行了交叉验证。
表2 包被液成分
表3 冲洗液成分
结果:包被液中加入7%-9%的蔗糖,包被液粘稠度增大,在跑样时容易出线假阳性结果;包被液中添加1%-6%的蔗糖,显色差异相差不大,但是进行稳定性考评时,1%-3%的蔗糖不能对包被蛋白起到很好的保护作用;4%-6%的蔗糖添加到包被液中,稳定性考评未发现异常。
冲洗液缓冲液成分为0.05M TBS(pH8.5),显色弱;缓冲液为0.05M MES(pH6.0),阴性有假阳性出现,最佳的缓冲液为0.01M PBS(pH7.4)。
冲洗液中表面活性剂的量影响跑样背景和显色持久度,Tween-80浓度为0-0.4%,跑样背景红,反应10min内线条深浅变化不大;Tween-80浓度为0.5%-0.7%,跑样背景符合要求,且反应10min内线条深浅变化不大;Tween-80浓度为0.8%-1%,跑样背景符合要求,但反应10min内线条明显变浅,表面活性剂浓度大会将NC膜上的反应复合物冲走。
综上所述,包被缓冲液的最佳成分为0.01M PBS(pH7.4),4%-6%蔗糖,0.3%-0.5%BSA,0.1%Proclin 300;冲洗液的最佳成分为0.01M PBS(pH7.4),0.5%-0.7%Tween-80,0.1%Proclin 300。
表4 包被液和冲洗液交叉验证结果
其中,C表示检测线颜色深浅(C-:很浅或不显色;C+:较浅;C++:适中;C+++:较深;C++++:过深)。
实施例5
本发明吸水纸基性能验证。
方法:为验证吸水纸厚度、长度(Y1)对跑样过程及跑样背景的影响,选择以下3种不同厚度、不同品牌的吸水纸进行验证,吸水纸长度优化了10mm、15mm、20mm、25mm、30mm五个条件:
1)吸水纸ABP-S270(厚度0.68mm,吸水量500g/m
2)吸水纸H5072(厚度:0.85mm,克重:270g/m
3)吸水纸ABP-S370(厚度0.95mm,吸水量750g/m
结果:验证3种常用厚度的吸水纸,随吸水纸厚度的增加,跑样背景逐渐变好,且跑样背景的好坏也跟吸水纸长度呈正相关,吸水纸越长,跑样背景越干净。实验中吸水纸厚度应大于等于0.6mm且吸水纸长度最好不小于10mm,以保证显色效果。
表5 不同吸水纸长度验证
其中,C表示检测线颜色深浅(C-:很浅或不显色;C+:较浅;C++:适中;C+++:较深;C++++:过深);D表示扩散程度(D-:清晰不扩散;D+:略微扩散;D++:明显扩散)U表示条带均匀程度(U-:不均匀;U+:较均匀;U++:很均匀)。
实施例6
红细胞样本上样量与包被液间距验证。
方法:红细胞悬液加至NC膜后,会迅速被膜吸附并与NC膜上包被的抗体反应,如果红细胞加入量少,无法完全覆盖包被线条,加入冲洗液后可能会导致假阴性结果出现,所以样本上样量与包被间距相关。
结果:包被间距小于3mm对包被过程要求较高,易发生交叉污染,包被间距大于5mm时卡壳视窗需要同等程度的变大,由于市面上此类型卡壳很少且受NC膜长宽度限制,因此优选包被间距为3-5mm之间。
包被间距为3mm的最佳上样量为20μL;包被间距为4mm时上样量20μL、30μL差异不大,但30μL上样量会导致样本在膜面无法短时间内被吸附,加入冲洗液会发生错误结果,故包被间距为4mm时上样量优选20μL;包被间距为5mm的最佳上样量为30μL。
从美观性及包被操作简便性而言,四条线之间等距离分布,效果较好,但在NC膜宽度限制范围内,优化好上样量,保证加样后样本能够完全覆盖住所有线条,非等距分布也可,为避免包被时交叉污染,线条间间距应不小于3mm。
表6 包被间距3mm不同上样量验证
表7 包被间距4mm不同上样量验证
表8 包被间距5mm不同上样量验证
其中,C表示检测线颜色深浅(C-:很浅或不显色;C+:较浅;C++:适中;C+++:较深;C++++:过深);D表示扩散程度(D-:清晰不扩散;D+:略微扩散;D++:明显扩散)U表示条带均匀程度(U-:不均匀;U+:较均匀;U++:很均匀)。
实施例7
血型检测卡加样位置验证。
如附图1-附图3所示,样本加至加样位置I或加样位置V,样本会大部分被吸水纸基/样品垫吸收,剩余的部分无法流动至其它包被线位置,导致显色弱或无显色;样本加至加样位置II或加样位置IV,也会存在样本不能完全覆盖所有包被线条的风险,造成错误的结果;所以最佳的加样位置为四条线的中心位置即加样位置III。
表9 不同加样位置验证
其中,C表示检测线颜色深浅(C-:很浅或不显色;C+:较浅;C++:适中;C+++:较深;C++++:过深);D表示扩散程度(D-:清晰不扩散;D+:略微扩散;D++:明显扩散)U表示条带均匀程度(U-:不均匀;U+:较均匀;U++:很均匀)。
实施例8
包被膜干燥条件优化验证。
NC膜上包被好抗体后,置于30-37℃鼓风干燥箱中干燥1 h、2 h、4 h、8 h、12h、16h,观察试纸条检测线的颜色、清晰程度等。
表10 不同包被条件的检测结果
其中,C表示检测线颜色深浅(C-:很浅或不显色;C+:较浅;C++:适中;C+++:较深;C++++:过深);D表示扩散程度(D-:清晰不扩散;D+:略微扩散;D++:明显扩散)U表示条带均匀程度(U-:不均匀;U+:较均匀;U++:很均匀)。
结果:包被后选择在37℃干燥8-16小时,条带颜色适中且均匀。进行包被膜干燥的目的是使结合的抗体更加稳定和均一。
实施例9
本发明血型检测卡与传统血型检测卡对比。
表11 不同血型检测卡对比
上面结合附图对本发明的实施例进行了描述,但是本发明并不局限于上述的具体实施方式,上述的具体实施方式仅仅是示意性的,而不是限制性的,本领域的普通技术人员在本发明的启示下,在不脱离本发明宗旨和权利要求所保护的范围情况下,还可做出很多形式,这些均属于本发明的保护之内。
- 一种氨苯胂酸人工抗原、快速检测试纸条及其制备方法
- 一种NSE检测试纸条的制备方法、试纸条、检测卡及NSE检测试剂盒
- 一种快速检测血清中猪附红细胞体抗原的胶体金试纸条
- 一种快速检测牡蛎疱疹病毒抗原的免疫荧光检测试纸条及应用
