丹莪妇康煎膏的特征图谱建立和检测方法
文献发布时间:2023-06-19 19:28:50
技术领域
本发明属于中药质量检测技术领域,具体涉及丹莪妇康煎膏的特征图谱建立和检测方法。
背景技术
丹莪妇康煎膏属于传统中药制剂中的膏滋剂,具有活血化瘀、疏肝理气、调经止痛、软坚化积等功效,是临床上治疗子宫内膜异位症的常用药。丹莪妇康煎膏呈黑褐色粘稠的半流体状态,全方由紫丹参、莪术、滇柴胡、三七、赤芍、当归、三棱、香附、延胡索和甘草10味药组成。
丹莪妇康煎膏包含的处方药材较多,因此成分复杂多样,在“丹莪妇康煎膏”(国家食品药品监督管理局国家药品标准)中采用液相色谱法建立了芍药苷及人参皂苷Rg
但是,丹莪妇康煎膏为复方制剂,含苯丙素类、香豆素类及酚酸类等多种成分,物质基础复杂,单纯通过检测四种指标成分来控制其药品质量显然是不全面的,也不能体现中药复方制剂的整体性特征。因此,开发建立一种简便易行,准确性高,重复性良好且能尽可能多地反映复方制剂所含多种成分的检测方法,对丹莪妇康煎膏的质量控制和评价非常有必要。
发明内容
本发明的第一目的在于提供一种更有利于质量鉴别的丹莪妇康煎膏特征图谱的建立方法。
本发明提供的丹莪妇康煎膏特征图谱的建立方法,包括如下步骤:
a、精密称定绿原酸、阿魏酸、丹酚酸B对照品,混合后加甲醇溶液溶解,即得参照物溶液;
b、精密称取丹莪妇康煎膏,加入水进行超声提取,离心,取上清液过大孔吸附树脂,用水洗脱后再用乙醇溶液洗脱,收集洗脱液,蒸干,加水,滤过,取续滤液,即得供试品溶液;
c、采用超高效液相色谱法对所述对供试品溶液和所述参照物溶液进行测定,即得11个共有特征峰构成的特征图谱。
其中,所述的丹莪妇康煎膏特征图谱的建立方法中,步骤c中,所述超高效液相色谱法采用的流动相为:以体积浓度为0.1%的磷酸溶液为流动相A,以乙腈为流动相B,当采用色谱柱为Acclaim RSLC C120 C18(2.1mm×100mm,2.2μm)时,所述梯度洗脱的程序为:
0~33min,流动相A的体积分数由95%下降至76%,流动相B的体积分数由5%上升至24%;
33~33.1min,流动相A的体积分数由76%下降至50%,流动相B的体积分数由24%上升至50%;
33.1~36min,保持流动相A的体积分数为50%,流动相B的体积分数为50%;
36~36.1min,流动相A的体积分数由50%上升至95%,流动相B的体积分数由50%下降至5%;
36.1~45min,保持流动相A的体积分数为95%,流动相B的体积分数为5%。
当采用色谱柱为Acclaim RSLC C120 C18(2.1mm×150mm,2.2μm)时,所述梯度洗脱程序:
0~60min,流动相A的体积分数由95%下降至70%,流动相B的体积分数由5%上升至30%。
当采用色谱柱为Agilent SB-Aq(2.1mm×100mm,1.9μm)时,所述梯度洗脱程序:
0~60min,流动相A的体积分数由95%下降至70%,流动相B的体积分数由5%上升至30%。
优选地,本发明采用的色谱柱为Acclaim RSLC C120 C18(2.1mm×100mm,2.2μm),以体积浓度为0.1%的磷酸溶液为流动相A,以乙腈为流动相B,梯度洗脱的程序为:
0~33min,流动相A的体积分数由95%下降至76%,流动相B的体积分数由5%上升至24%;
33~33.1min,流动相A的体积分数由76%下降至50%,流动相B的体积分数由24%上升至50%;
33.1~36min,保持流动相A的体积分数为50%,流动相B的体积分数为50%;
36~36.1min,流动相A的体积分数由50%上升至95%,流动相B的体积分数由50%下降至5%;
36.1~45min,保持流动相A的体积分数为95%,流动相B的体积分数为5%。
进一步地,步骤c中,所述超高效液相色谱法还包括如下检测条件:柱温为30~40℃;检测波长为200~400nm;流速为0.3~0.4mL/min。
优选地,柱温为35℃;检测波长为320nm;流速为0.4mL/min。
其中,所述的丹莪妇康煎膏特征图谱的建立方法中,步骤a中,每1mL所述参照物溶液含绿原酸0.1mg、阿魏酸0.1mg、丹酚酸B 0.5mg。
其中,所述的丹莪妇康煎膏特征图谱的建立方法中,步骤b中,精密称取丹莪妇康煎膏5g,加入50mL水进行超声提取。
所述超声提取的功率为50~720W,超声频率为10~60kHz;时间为5~120min。
优选地,所述超声提取的功率为500W;超声频率为40kHz;时间为30min。
所述离心的转速为2000~12000r/min;时间为3~30min。
优选地,所述离心的转速为6000r/min;时间为10min。
所述大孔吸附树脂的内径为10~60mm;柱高为6~72cm。
优选地,所述大孔吸附树脂的内径为24mm;柱高为20-22cm。
所述乙醇溶液的体积浓度为50~95%。
优选地,所述乙醇溶液的体积浓度为70%。
所述收集洗脱液后,蒸干,精密加入25mL的水,滤过。
本发明建立的丹莪妇康煎膏的特征图谱,并确定了11个共有峰,峰的分离度良好,能够充分反映丹莪妇康煎膏的特征峰信息,并且方法稳定,精密度高,重现性好。
本发明的第二目的在于提供一种丹莪妇康煎膏的检测方法,可以快速检测出多个化学成分,能更加全面、科学地评价丹莪妇康煎膏的质量。
本发明提供的丹莪妇康煎膏的检测方法,包括如下步骤:精密吸取丹莪妇康煎膏供试品溶液,采用超高效液相色谱法,测定,并将所得超高效液相色谱图与上述特征图谱建立方法得到的丹莪妇康煎膏的特征图谱进行比较,即可;所述超高效液相色谱法采用的流动相为:以体积浓度为0.1%的磷酸溶液为流动相A,以乙腈为流动相B,当采用色谱柱为Acclaim RSLC C120 C18(2.1mm×100mm,2.2μm)时,所述梯度洗脱的程序为:
0~33min,流动相A的体积分数由95%下降至76%,流动相B的体积分数由5%上升至24%;
33~33.1min,流动相A的体积分数由76%下降至50%,流动相B的体积分数由24%上升至50%;
33.1~36min,保持流动相A的体积分数为50%,流动相B的体积分数为50%;
36~36.1min,流动相A的体积分数由50%上升至95%,流动相B的体积分数由50%下降至5%;
36.1~45min,保持流动相A的体积分数为95%,流动相B的体积分数为5%;
当采用色谱柱为Acclaim RSLC C120 C18(2.1mm×150mm,2.2μm)时,所述梯度洗脱程序:0~60min,流动相A的体积分数由95%下降至70%,流动相B的体积分数由5%上升至30%。
当采用色谱柱为Agilent SB-Aq(2.1mm×100mm,1.9μm)时,所述梯度洗脱程序:0~60min,流动相A的体积分数由95%下降至70%,流动相B的体积分数由5%上升至30%。
优选地,所述超高效液相色谱法采用的流动相为:以体积浓度为0.1%的磷酸溶液为流动相A,以乙腈为流动相B,采用色谱柱为Acclaim RSLC C120 C18(2.1mm×100mm,2.2μm),所述梯度洗脱的程序为:
0~33min,流动相A的体积分数由95%下降至76%,流动相B的体积分数由5%上升至24%;
33~33.1min,流动相A的体积分数由76%下降至50%,流动相B的体积分数由24%上升至50%;
33.1~36min,保持流动相A的体积分数为50%,流动相B的体积分数为50%;
36~36.1min,流动相A的体积分数由50%上升至95%,流动相B的体积分数由50%下降至5%;
36.1~45min,保持流动相A的体积分数为95%,流动相B的体积分数为5%。
进一步地,所述超高效液相色谱法还包括如下检测条件:柱温为30~40℃;检测波长为200~400nm;流速为0.3~0.4mL/min。
优选地,柱温为35℃;检测波长为320nm;流速为0.4mL/min。
进一步地,所述丹莪妇康煎膏供试品溶液的制备方法为:精密称取丹莪妇康煎膏,加入水进行超声提取,离心,取上清液过大孔吸附树脂,用水洗脱后再用乙醇溶液洗脱,收集洗脱液,蒸干,加水,滤过,取续滤液,即得供试品溶液。
进一步地,精密称取丹莪妇康煎膏5g,加入50mL水进行超声提取。
所述超声提取的功率为50~720W,超声频率为10~60kHz;时间为5~120min。
优选地,所述超声提取的功率为500W;超声频率为40kHz;时间为30min。
所述离心的转速为2000~12000r/min;时间为3~30min。
优选地,所述离心的转速为6000r/min;时间为10min。
所述大孔吸附树脂的内径为10~60mm;柱高为6~72cm。
优选地,所述大孔吸附树脂的内径为24mm;柱高为20-22cm。
所述乙醇溶液的体积浓度为50~95%。
优选地,所述乙醇溶液的体积浓度为70%。
所述收集洗脱液后,蒸干,精密加入25mL的水,滤过。
本发明的有益效果是:
本发明采用超高效液相色谱法建立了丹莪妇康煎膏的特征图谱,并确定了新绿原酸、原儿茶醛、绿原酸、隐绿原酸、对香豆酸、阿魏酸、芦丁、迷迭香酸、归属于紫丹参的色谱峰、丹酚酸B、丹酚酸A等11个共有峰,峰的分离度良好,能够充分、全面地反映丹莪妇康煎膏的特征峰信息,并且本发明方法稳定,精密度高,重现性好,为丹莪妇康煎膏的质量控制提供了快速、全面的检测手段,为丹莪妇康煎膏质量评价体系的研究提供了科学的实验依据。
本发明还提供了丹莪妇康煎膏的检测方法,本发明通过对超高效液相色谱检测条件和供试品溶液的制备进行优化,可以同时检测出丹莪妇康煎膏中新绿原酸、原儿茶醛、绿原酸、隐绿原酸、对香豆酸、阿魏酸、芦丁、迷迭香酸、归属于紫丹参的色谱峰、丹酚酸B、丹酚酸A等11个化学成分,避免了因只测定一、两个化学成分而判定制剂整体质量的片面性,本发明检测方法能更加全面、科学地评价丹莪妇康煎膏的质量,从而使产品的质量和疗效得到保证。
附图说明
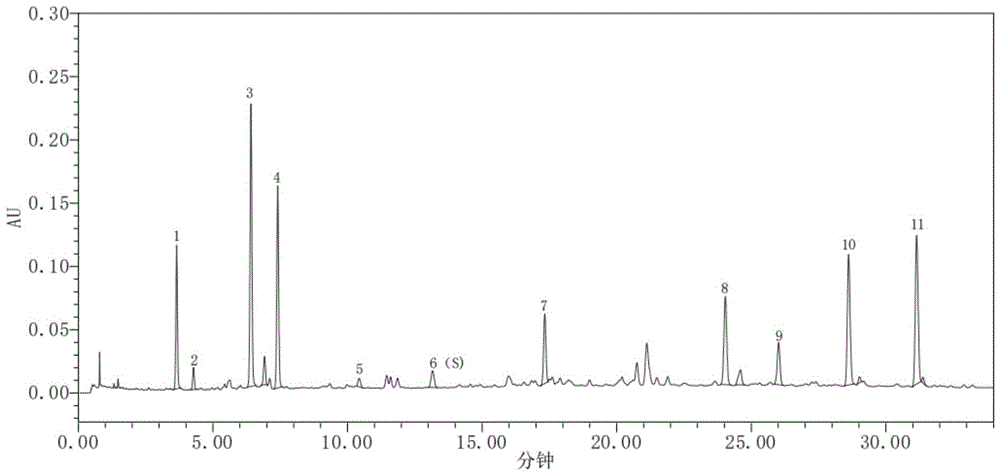
图1为本发明建立的丹莪妇康煎膏的特征图谱(呈现11个特征峰,其中峰1为新绿原酸,峰2为原儿茶醛,峰3为绿原酸,峰4为隐绿原酸,峰5为对香豆酸,峰6为阿魏酸,峰7为芦丁,峰8为迷迭香酸,峰9归属于紫丹参,峰10为丹酚酸B,峰11为丹酚酸A)。
图2为实施例1流动相的考察图谱。
图3为实施例1波长的考察图谱。
图4为实施例1柱温的考察图谱。
图5为实施例1供试品溶液制备方法的考察图谱。
图6为实施例1中丹莪妇康煎膏的特征峰归属图谱。
图7为实施例1中丹莪妇康煎膏的特征峰归属图谱。
图8为实施例1中10批样品的特征图谱(样品批号:200802、200901、201101、201103、201104、210201、210202、210303、210401、210404)。
图9为实施例1中11批样品的特征图谱(样品批号:200801、200902、200903、201102、210301、210302、210304、210305、210306、210402、210403)。
图10为实施例1供试品溶液稳定性考察的图谱。
图11为实施例1精密度考察的图谱。
图12为实施例1重复性考察的图谱。
具体实施方式
下面将通过具体的实施例对本发明作进一步地详细阐述。
实施例1
1.仪器与试药
1.1仪器
ACQUITY H-Class Bio液相色谱仪(沃特世科技(上海)有限公司)、KQ-500DB数控超声波清洗器(昆山市超声仪器有限公司)、梅特勒-托利多XS 105DU分析天平(梅特勒-托利多仪器(上海)有限公司)、TG16-WS型台式高速离心机(长沙高新技术产业开发区湘仪离心机仪器有限公司)、RE-52AA型旋转蒸发器(上海荣亚生化仪器厂)。
1.2试剂
乙腈、磷酸为色谱纯;水为纯化水;无水乙醇为分析纯。
1.3对照品
新绿原酸(批号:N2205002,纯度:99.24%)、隐绿原酸(批号C2205003,纯度:98.39%)、对香豆酸(批号:H2107001,纯度:99.32%)、丹酚酸A(批号:S2108002,纯度:98.81%),均购自成都迈斯克医药科技有限公司。
原儿茶醛(批号:110810-201909,纯度:99.6%)、绿原酸(批号:110753-202119,纯度:96.3%)、阿魏酸(批号:110773-201915,纯度:99.4%)、迷迭香酸(批号:111871-202007,纯度:98.1%)、丹酚酸B(批号:111562-201917,纯度:96.6%)、芦丁(批号:100080-201811,纯度:91.7%);均购自中国食品药品检定研究院。
2.方法与结果
2.1色谱条件
色谱柱:Acclaim RSLC C120 C18(2.1mm×100mm,2.2μm);流动相:以体积浓度为0.1%的磷酸溶液为流动相A,以乙腈为流动相B,按照表1进行梯度洗脱,柱温35℃;流速为0.4mL/min;检测波长为320nm;进样量1μL。理论板数按丹酚酸B峰计算应不低于250000。
表1流动相梯度洗脱条件
2.2供试品溶液的制备:
取丹莪妇康煎膏5g,精密称定,置具塞锥形瓶中,加入水50mL,超声处理(功率500W,频率40kHz)30分钟,取出,放冷,离心,取上清液,通过HPD-100型大孔吸附树脂(内径24mm,柱高20-22cm),用水500mL洗脱,弃去水液,再用体积浓度为70%的乙醇溶液300mL洗脱,收集洗脱液,减压回收乙醇至蒸干,精密加入水25ml,摇匀,滤过,取续滤液,即得。
2.3参照物溶液的制备
取绿原酸对照品、阿魏酸对照品、丹酚酸B对照品适量,精密称定,加入体积浓度为70%的甲醇溶液制成每1mL含绿原酸0.1mg、阿魏酸0.1mg、丹酚酸B 0.5mg的混合溶液,即得。
2.4测定法
分别精密吸取供试品溶液与参照物溶液各1μL,注入超高效液相色谱仪,测定,记录色谱图,即得丹莪妇康煎膏特征图谱,见图1。
2.5色谱条件的筛选
2.5.1流动相的选择
本发明考察了多种不同流动相的分离效果,如下:
(1)0~60min,乙腈的体积分数由5上升至30%,0.1%磷酸溶液的体积分数由95%下降至70%。
(2)0~60min,乙腈的体积分数由5上升至30%,0.5%冰醋酸溶液的体积分数由95%下降至70%。
(3)0~60min,乙腈的体积分数由5上升至30%,0.1%三氟乙酸溶液的体积分数由95%下降至70%。
(4)0~60min,乙腈的体积分数由5上升至30%,0.5%甲酸溶液的体积分数由95%下降至70%。
(5)0~60min,乙腈的体积分数由5上升至30%,0.05M乙酸铵溶液的体积分数由95%下降至70%。
(6)0~60min,乙腈的体积分数由5上升至30%,0.05M磷酸二氢钾溶液的体积分数由95%下降至70%。
(7)0~60min,甲醇的体积分数由5上升至40%,0.1%磷酸溶液的体积分数由95%下降至60%。
(8)本发明方法流动相梯度:0~33min,0.1%磷酸溶液的体积分数由95%下降至76%,乙腈的体积分数由5%上升至24%;33~33.1min,0.1%磷酸溶液的体积分数由76%下降至50%,乙腈的体积分数由24%上升至50%;33.1~36min,保持0.1%磷酸溶液的体积分数为50%,乙腈的体积分数为50%;36~36.1min,0.1%磷酸溶液的体积分数由50%上升至95%,乙腈的体积分数由50%下降至5%;36.1~45min,保持0.1%磷酸溶液的体积分数为95%,乙腈的体积分数为5%。
方法(1)~(7)采用的色谱柱为Acclaim RSLC C120 C18(2.1mm×150mm,2.2μm);方法(8)采用的色谱柱为Acclaim RSLC C120 C18(2.1mm×100mm,2.2μm),方法(1)~(7)结果见图2,方法(8)结果见图1。结果表明,以本发明方法(1)和(8)流动相梯度条件进行洗脱样品的分离效果最好。
2.5.2波长的选择
采用Acclaim RSLC C120 C18(2.1mm×150mm,2.2μm)色谱柱对应的检测条件,采用PDA检测器于200nm~400nm范围对样品进行全波长扫描检测,根据有效信息最大化原则,选取能够最多的体现样品成分信息的波长。结果发现,有多个峰在320nm波长附近有最大吸收,色谱峰较多,吸收较大,信息较丰富,特征性较强,故选择检测波长为320nm,见图3。
2.5.3柱温的选择
采用Acclaim RSLC C120 C18(2.1mm×100mm,2.2μm)色谱柱对应的检测条件考察了30℃、35℃、40℃三种柱温,在35℃时色谱峰分离度较好,故选择柱温为35℃。见图4。
2.6供试品溶液制备方法的考察
采用Agilent SB-Aq(2.1mm×100mm,1.9μm)色谱柱对应的色谱条件考察了五种供试品的制备方法,分别为:
取丹莪妇康煎膏样品5g,加水50mL超声提取,离心,取上清液作为供试品溶液1进样。
取丹莪妇康煎膏样品5g,加水50mL超声提取,离心,取上清液过大孔吸附树脂,用水洗脱,洗脱液弃去。用15%乙醇溶液洗脱,收集15%乙醇溶液洗脱液;再用30%乙醇溶液洗脱,收集30%乙醇洗脱液;再用70%乙醇溶液洗脱,收集70%乙醇洗脱液。分别取15%、30%、70%乙醇洗脱液,减压回收乙醇至蒸干,精密加入水25mL,摇匀,滤过,取续滤液作为供试品溶液2、3、4进样。
取丹莪妇康煎膏样品5g,加水50mL超声提取,离心,取上清液过大孔吸附树脂,用水洗脱,洗脱液弃去,再用70%乙醇溶液洗脱,收集70%乙醇洗脱液,减压回收乙醇至干,精密加入水25mL,摇匀,滤过,取续滤液作为供试品溶液5进样。结果表明,本发明方法制备的供试品溶液5可以有效除去大部分杂质并保留目标成分。见图5。
2.7特征峰的指认
采用Acclaim RSLC C120 C18(2.1mm×100mm,2.2μm)色谱柱对应的检测条件分别取新绿原酸、原儿茶醛、绿原酸、隐绿原酸、对香豆酸、阿魏酸、芦丁、迷迭香酸、丹酚酸B、丹酚酸A对照品溶液及丹莪妇康煎膏供试品溶液进样,记录色谱图,将上述对照品与供试品图谱进行比对,根据保留时间指认样品中化学成分,结果表明:1号峰为新绿原酸、2号峰为原儿茶醛、3号峰为绿原酸、4号峰为隐绿原酸、5号峰为对香豆酸、6号峰为阿魏酸、7号峰为芦丁、8号峰为迷迭香酸、10号峰为丹酚酸B、10号峰为丹酚酸A,结果见图6、图7。
2.8特征图谱共有峰的规定
采用Acclaim RSLC C120 C18(2.1mm×100mm,2.2μm)色谱柱对应的检测条件,取21批丹莪妇康煎膏(批号:200802、200901、201101、201103、201104、210201、210202、210303、210401、210404、200801、200902、200903、201102、210301、210302、210304、210305、210306、210402、210403)按照本发明方法测定各特征峰的保留时间,计算保留时间及相对保留时间的RSD值,结果见表2、表3,图8、图9。保留时间RSD在0.30%~0.86%之间,相对保留时间RSD在0.08%~0.26%之间,21批丹莪妇康煎膏质量的稳定性及批间一致性较好。
表2 21批样品的保留时间(min)
表3 21批样品的相对保留时间(min)
/>
供试品溶液色谱中呈现11个特征峰,其中,峰3、峰6和峰10应与相应参照物绿原酸、阿魏酸、丹酚酸B的保留时间相对应,与阿魏酸对照品相对应的6号峰为S峰,计算其余各特征峰与S峰的相对保留时间,其相对保留时间应在规定值的±10%范围之内。
3方法学考察
3.1进样精密度考察
按Acclaim RSLC C120 C18(2.1mm×100mm,2.2μm)色谱柱对应的检测条件,取绿原酸、阿魏酸、丹酚酸B 3种混合对照品溶液连续进样5针,每针1μL,记录保留时间,峰面积,计算保留时间及峰面积的RSD值,结果见表4、表5。保留时间RSD在0.19%~0.81%之间,峰面积RSD在1.32%~1.44%之间,表明进样精密度较好。
表4进样精密度-保留时间(min)
表5进样精密度-峰面积
3.2供试品溶液稳定性考察
按Acclaim RSLC C120 C18(2.1mm×100mm,2.2μm)色谱柱对应的检测条件,取丹莪妇康煎膏(批号:200901),按本发明供试品溶液制备方法制得供试液,分别在0h、2h、4h、8h、12h、24h、36h、48h测定其保留时间、峰面积,并计算保留时间及峰面积的RSD值,结果见表6、表7,图10。保留时间RSD在0.43%~2.06%之间,稳定性较好;除特征峰5和特征峰11的峰面积RSD稍大外,其余峰面积RSD在0.51%~1.40%之间,表明供试品溶液在48h内较为稳定。
表6稳定性考察-保留时间(min)
表7稳定性考察-峰面积
3.3精密度考察
取丹莪妇康煎膏(批号:200901),按Acclaim RSLC C120 C18(2.1mm×100mm,2.2μm)色谱柱对应的检测条件,连续进样5针,每针1μL,记录保留时间,峰面积,计算保留时间及峰面积的RSD值,结果见表8、表9,图11。保留时间RSD在0.04%~014%之间,峰面积RSD在0.28%~2.07%之间,表明精密度较好。
表8精密度-保留时间(min)
表9精密度-峰面积
3.4重复性考察
取丹莪妇康煎膏(批号:200901),按Acclaim RSLC C120 C18(2.1mm×100mm,2.2μm)色谱柱对应的检测条件,分别制备10份供试品溶液,测定各特征峰的保留时间,计算保留时间及相对保留时间的RSD值,结果见表10、表11,图12。保留时间RSD在0.11%~0.42%之间,相对保留时间RSD在0.08%~0.35%之间,表明该方法重复性较好。
表10重复性考察-保留时间(min)
表11重复性考察-相对保留时间(min)
实施例2丹莪妇康煎膏的检测方法
取丹莪妇康煎膏(批号:200802、200901、201101、201103、201104、210201、210202、210303、210401、210404、200801、200902、200903、201102、210301、210302、210304、210305、210306、210402、210403)共21批样品按照实施例1中“2.2供试品溶液的制备”得到待测样品溶液,精密吸取待测样品溶液,注入超高效液相色谱仪中进行测定,所述超高效液相色谱仪的色谱条件同实施例1“2.1色谱条件”项。待测样品的检测图谱如图8和图9所示。保留时间及相对保留时间的RSD值如表2和表3所示。
- 丹莪妇康煎膏的指纹图谱建立方法及其标准指纹图谱和应用
- 丹莪妇康煎膏的指纹图谱建立方法及其标准指纹图谱和应用
