一种干细胞外泌体浓缩纯化方法及其应用
文献发布时间:2023-06-19 18:29:06
技术领域
本发明属于生物技术领域,具体涉及一种干细胞外泌体浓缩纯化方法及其应用。
背景技术
干细胞外囊泡(EV)是干细胞分泌到细胞外空间的脂质结合囊泡,通常包括微泡、外泌体和凋亡小体。其中,外泌体为直径约40~150nm的脂质双层包裹的小囊泡,含有蛋白质、核酸、氨基酸、代谢物、脂质等多种成分。干细胞外泌体含有母细胞的特异性表面标记,又携带母细胞的遗传信息,在细胞间进行信息的传递和交流,从而发挥相应的生物学效应。越来越多的研究者将其作为替代干细胞治疗的非细胞疗法,在促进关节软骨损伤修复、皮肤损伤修复、抗肿瘤和减少心肌损伤等方面具有重要作用。此外,由于外泌体具有双层磷脂膜结构,免疫原性低,避免了体内应用发生免疫排斥,可提高药物递送效率。因此,干细胞外泌体在载药和药物递送方面也显示出巨大的价值。干细胞外泌体保存方式简单,-80℃保存可以较长时间维持其生物活性。随着未来研究的不断发展,干细胞外泌体应用前景广阔。
为了满足干细胞外泌体在生物医学领域应用的需求,需要从生物样品中分离出高纯度干细胞外泌体,其中,干细胞培养基是用于治疗的干细胞外泌体的常见来源。然而,为了满足治疗应用的需求,需要从大体量的细胞培养基中分离得到外泌体,但大体量的细胞培养基不利于外泌体的浓缩分离操作。因此,对于外泌体的实际应用,有必要建立一种高效的浓缩和纯化分离方法,从培养基中浓缩干细胞外泌体。
对于干细胞外泌体浓缩,目前最常见的是超滤法(UF)。UF方法是目前最广泛用于EV浓缩的方法,但是,UF有一些局限性,例如,它可能导致外泌体与膜的非特异性结合,从而可能导致外泌体产量降低;而且,在超滤过程中,由于外泌体或蛋白质杂质会堵塞膜,超滤管难以重复使用,导致超滤法耗时且成本高;此外,UF方法依赖于台式设备,涉及复杂的非便携式程序,具有耗时、耗能、成本高、设备要求高等缺点,这些问题降低了UF方法在分离干细胞外泌体方面的实际应用效果。因此,迫切需要开发一种高效、低成本、便捷的干细胞外泌体浓缩纯化方法。
发明内容
本发明针对上述现有技术中干细胞外泌体浓缩纯化分离技术的不足,旨在提供一种干细胞外泌体浓缩纯化方法及其应用,实现干细胞外泌体的浓缩与纯化。
本发明的首要目的是提供一种干细胞外泌体浓缩纯化方法。
本发明的另一目的是提供上述浓缩纯化方法在浓缩干细胞外泌体中的应用。
本发明的又一目的是提供一种超吸水性聚合物复合物。
本发明的又一目的是提供上述超吸水性聚合物复合物在浓缩干细胞外泌体中的应用。
本发明通过以下技术手段实现上述发明目的:
本发明提供了一种干细胞外泌体浓缩纯化方法,将超吸水性聚合物复合物(复合SAPs)与含有干细胞外泌体的生物样品混合后放置,然后去除超吸水性聚合物复合物(复合SAPs)吸水后形成的水凝胶,剩余的液体即为外泌体浓缩液;其中,所述复合SAPs由聚丙烯酸、聚丙烯酸酯、聚丙烯酰胺、聚(丙烯酸-共-丙烯酰胺)、聚乙烯马来酸酐中的任意一种和天然生物高分子聚合物共混制备得到。
本发明在制备超吸水性聚合物复合物时,聚丙烯酸、聚丙烯酸酯、聚丙烯酰胺、聚(丙烯酸-共-丙烯酰胺)、聚乙烯马来酸酐由其各自单体在引发剂作用下分别聚合形成。
优选地,所述天然生物高分子聚合物包括多糖类生物高分子聚合物;优选为海藻酸盐,其中,海藻酸盐优选为海藻酸钠。
优选地,所述共混是在聚丙烯酸、聚丙烯酸酯、聚丙烯酰胺、聚(丙烯酸-共-丙烯酰胺)、聚乙烯马来酸酐中的任意一种由其单体在聚合时加入天然生物高分子聚合物(即在天然生物高分子聚合物存在下进行上述聚合物的单体的聚合),从而实现共混。
更优选地,天然生物高分子聚合物预先溶解于水相溶液中。
本发明中聚丙烯酸、聚丙烯酸酯、聚丙烯酰胺、聚(丙烯酸-共-丙烯酰胺)、聚乙烯马来酸酐中的任意一种聚合物均具有网络结构,而天然生物高分子聚合物也具有网络结构(例如,海藻酸钠在Ca
当使用海藻酸钠或海藻酸钾制备超吸水性聚合物复合物时,海藻酸盐形成聚合物网络结构时需要的Ca
作为可选择的优选的方案,所述超吸水性聚合物复合物通过聚(丙烯酸-共-丙烯酰胺)和海藻酸盐共混制备得到。
所述超吸水性聚合物复合物的制备方法为将丙烯酸、丙烯酰胺、海藻酸盐混合,加入交联剂和引发剂,进行反应即得。
更优选地,所述海藻酸盐为海藻酸钠。
优选地,所述生物样品为干细胞培养基。
优选地,超吸水性聚合物复合物与生物样本的质量(g)/体积(mL)比为1:20~200。最优选为1:50。
优选地,所述放置的温度为4~35℃。最优选为4℃。
优选地,所述放置的时间为0.5~5小时。最优选为2小时。
优选地,所述去除超吸水性聚合物复合物吸水后形成的水凝胶通过夹取、细胞筛等物理方式分离中的任意一种方式实现。
作为可选择的优选的方案,所述超吸水性聚合物复合物的制备方法为将丙烯酸、丙烯酰胺、海藻酸盐混合,加入交联剂和引发剂,进行反应即得。
更优选地,所述交联剂为N,N'-亚甲基双酰胺。
更优选地,所述引发剂为过硫酸钾。
更优选地,所述丙烯酸、丙烯酰胺、海藻酸盐的质量比为150~80:60~20:1。最优选为90:30:1。
更优选地,所述交联剂与海藻酸盐的质量比为10~20:15~40。最优选为12:25。
更优选地,所述引发剂与海藻酸盐的质量比为10~20:80~240。最优选为12:125。
更优选地,所述反应为在60~90℃下反应1~5小时。最优选为在75℃下反应3小时。
更优选地,所述丙烯酸使用NaOH中和至中和度为50~90%。最优选为使用NaOH中和至中和度为80%。
更优选地,所述海藻酸盐为海藻酸钠。
使用本发明的浓缩纯化方法浓缩纯化干细胞外泌体,具有处理量大、简便、无需设备、高效、低成本的优点,同时成功降低蛋白质杂质,提高外泌体保留率,基于此,上述浓缩纯化方法在浓缩干细胞外泌体中的应用也应在本发明的保护范围内。
本发明还提供了一种用于干细胞外泌体分离的超吸水性聚合物复合物,由聚丙烯酸、聚丙烯酸酯、聚丙烯酰胺、聚(丙烯酸-共-丙烯酰胺)、聚乙烯马来酸酐中的任意一种和天然生物高分子聚合物共混制备得到。
作为可选择的优选的方案,所述超吸水性聚合物复合物通过聚(丙烯酸-共-丙烯酰胺)和海藻酸盐共混制备得到。
优选地,所述超吸水性聚合物复合物的制备方法为将丙烯酸、丙烯酰胺、海藻酸盐混合,加入交联剂和引发剂,进行反应即得。
更优选地,所述交联剂为N,N'-亚甲基双酰胺。
更优选地,所述引发剂为过硫酸钾。
更优选地,所述丙烯酸、丙烯酰胺、海藻酸盐的质量比为150~80:60~20:1。最优选为90:30:1。
更优选地,所述交联剂与海藻酸盐的质量比为10~20:15~40。最优选为12:25。
更优选地,所述引发剂与海藻酸盐的质量比为10~20:80~240。最优选为12:125。
更优选地,所述反应为在60~90℃下反应1~5小时。最优选为在75℃下反应3小时。
更优选地,所述丙烯酸使用NaOH中和至中和度为50~90%。最优选为使用NaOH中和至中和度为80%。
更优选地,所述海藻酸盐为海藻酸钠。
将本发明提供的超吸水性聚合物复合物用于处理大体积干细胞培养基,实现干细胞外泌体的浓缩,同时成功降低蛋白质杂质,提高外泌体保留率。基于此,上述超吸水性聚合物复合物(SAPs)在浓缩干细胞外泌体中的应用也应在本发明的保护范围内。
本发明具有以下有益效果:
本发明提供的干细胞外泌体浓缩纯化方法可以成功从大体积生物样本中实现干细胞外泌体的浓缩,同时成功降低蛋白质杂质,提高外泌体保留率。该方法具有简便、无需设备、高效、低成本的优点,可广泛用于生产高纯度的干细胞外泌体,满足广泛的临床应用需求。本发明的干细胞外泌体浓缩方法可以替代传统外泌体浓缩方法,适用于大体积细胞培养基中实现干细胞外泌体的浓缩,适于规模生产,对促进干细胞外泌体的应用有明显推动作用,对干细胞外泌体在促进关节软骨损伤修复、皮肤损伤修复、抗肿瘤和减少心肌损伤等方面的临床相关领域应用,具有重要意义。
附图说明
图1为实施例1合成的两种不同SAP的吸水能力。
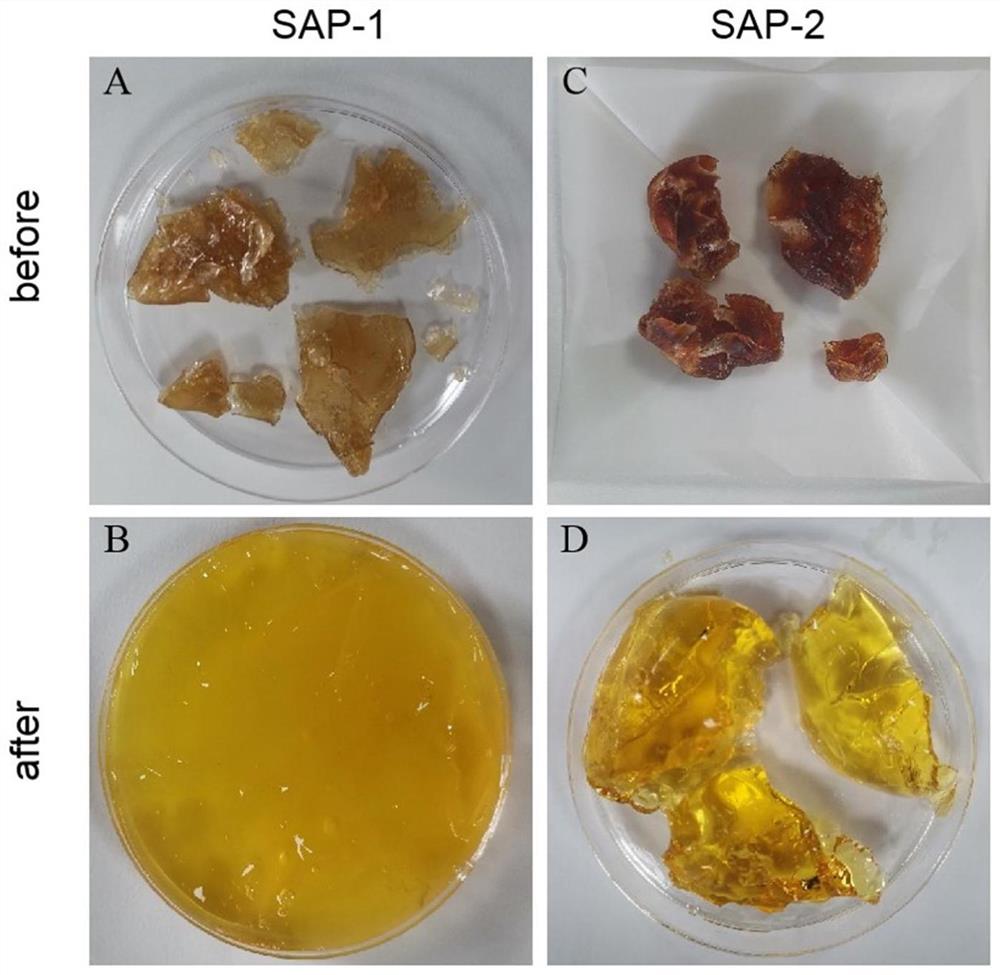
图2为SAP-1和SAP-2吸水前后的比较;其中,图2A和图2B为SAP-1吸水前后的照片;图2C和图2D为SAP-2吸水前后的照片。
图3为掺有海藻酸钠的SAP的合成示意图及其吸水性和用于外泌体的浓缩的示意图。图中Ca
图4为hucMSC形态观察结果。
图5为hucMSC诱导染色结果。
图6为hucMSC流式细胞鉴定结果。
图7为基于SAP和基于UF法对100mL细胞培养基单次浓缩时间比较结果。
图8A为不同浓度BSA溶液浓缩前后的样品体积;图8B为不同浓度BSA溶液浓缩前后的绝对蛋白质量。
图9为SAP在细胞培养基中浓缩外泌体的应用;其中,图9A、9B、9C、9D为240mL培养基浓缩前后的体积变化;图9E为培养基浓缩前后体积变化的统计结果。
图10A为SAP排斥外泌体示意图;图10B为SAP浓缩后外泌体的保留率。
图11为外泌体的表征实验结果;其中图11A和图11B为外泌体的TEM图像,图像比例尺为200nm;图11C为外泌体的大小分布;图11D为外泌体标记蛋白的蛋白质印迹分析。
具体实施方式
以下结合说明书附图和具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
除非特别说明,以下实施例所用试剂和材料均为市购。
以下实施例中使用的试剂及其来源如下所示:
抗CD9多克隆抗体、抗CD63多克隆抗体和山羊抗兔IgG(HRP偶联)来自MultiSciences(Lianke)Biotech(中国)。
MEM改良培养基(α-MEM)、胎牛血清(FBS)和磷酸盐缓冲溶液(PBS),以及Tris缓冲盐水(TBS)和Tris缓冲盐水与Tween-20(TBST)购自Gbico(美国)。
磷钨酸水合物购自Alfa Aesar(美国)。
3,3-二十八烷基氧羰花青高氯酸盐(DiO)、RIPA裂解液、BCA蛋白检测试剂盒、SDS-PAGE凝胶制备试剂盒、PVDF膜、蛋白上样缓冲液和牛血清白蛋白(BSA)均购自BeyotimeBiotechnology(China)。
丙烯酰胺(AM)、过硫酸铵、N,N'-亚甲基双丙烯酰胺、丙烯酸(AA)、过硫酸钾(KPS)、海藻酸钠购自国药化学(中国)。
获得的所有化学试剂至少为分析级,无需进一步纯化即可使用。
实施例1超吸水性聚合物复合物的合成与性能测试
一、不同SAPs的合成
(1)单一超吸水性聚合物(SAP-1):
即聚(丙烯酰胺-共-丙烯酸)超吸水性聚合物,采用水相聚合法合成,以丙烯酸(AA)和丙烯酰胺(AM)为单体,N,N'-亚甲基双酰胺(NMBA)为交联剂,过硫酸钾为引发剂(KPS);其中丙烯酸(AA)使用NaOH中和制成中和度为80%的AA。
SAP-1的具体合成方法:将9g中和度为80%的AA、3g AM在25℃下混合,然后加入48mg KPS和9.6mg NMBA,于75℃下反应3小时。
(2)超吸水性聚合物复合物(SAP-2):
SAP-2的具体合成方法:将9g中和度为80%的AA、3g AM和0.1g海藻酸钠在25℃下混合,然后加入48mg KPS和9.6mg NMBA,于75℃下反应3小时。
反应后,将得到的超吸水性聚合物在70℃下干燥12小时。
二、不同SAPs的吸水能力以及机械强度的比较
1、实验方法
分别将合成的不同SAPs与等体积的超纯水混合,待放置2-3小时后,称量吸水后的SAP的重量,与吸水前SAP的重量进行比较,计算吸水率。
观察吸水前后SAP的形貌特征变化,并拍照记录,评估吸水后SAP的机械强度。
2、实验结果
本实施例合成的两种不同SAPs的吸水能力如图1所示,可见,SAP-1和SAP-2的吸水量分别约为4g/mL和66.9g/mL。可见,SAP-2具有更强的吸水能力。
SAP吸水后形成的水凝胶的机械强度通常较差,难以与目标溶液样品分离。因此,提高溶胀后SAP的机械强度很重要。
SAP-1和SAP-2吸水前后的比较如图2所示;其中,图2A和图2B为SAP-1吸水前后的照片;图2C和图2D为SAP-2吸水前后的照片。从图2A和图2C可以看出,干燥后的SAP表面粗糙,有许多小褶皱和沟壑,反映了水凝胶材料的脱水收缩特征,另外,干燥后的SAP-2比SAP-1的颜色更深、硬度更强。从图2B和图2D可见,吸水溶胀后SAP-2呈独立的块状,SAP-1直观地表现为稀稠的黏土形式,结果表明,SAP-2表现出比SAP-1有更高的机械强度,易于分离。
图3为SAP的合成示意图,及其吸水性和用于外泌体的浓缩的示意图。综合考虑到这两种SAPs的吸水能力和机械强度,选择了SAP-2作为干细胞外泌体浓缩材料,并用于后续实验。
实施例2脐带间充质干细胞的分离培养和鉴定
一、干细胞培养
脐带间充质干细胞(hucMSC)分离自新生儿脐带,脐带来自深圳大学总医院产科,脐带的采集经过医院伦理委员会审批。
将脐带用含有10%双抗的磷酸缓冲溶液(PBS)清洗三次,然后用剪刀剪开脐带,平均约1.5cm一段,用弯头镊子夹取脐静脉和动脉,然后将脐带用剪刀和手术刀切成0.5~1mm大小的组织块,用无菌小勺将切碎的组织块约0.5g放入T75细胞培养瓶中,加入含15%胎牛血清(FBS)和1%青霉素-链霉素的α-MEM培养液9mL,使培养液刚好淹没组织块的一半,使组织块在瓶中的状态既可接触到瓶底又不会被浮起。将细胞培养瓶置于37℃、5% CO
细胞自P1代开始每三天进行传代培养,传至P3代细胞融合度至70%时,用PBS洗涤细胞,换成含10%无外泌体的FBS的α-MEM培养液继续培养48小时。收集细胞培养液置于冰上,3,000×g离心15min,去除细胞沉淀、碎片。离心后将上清吸入烧杯中,收集得到含外泌体的细胞培养基,完成样品前处理。
二、脐带间充质干细胞的鉴定
1、实验方法
(1)形态观察
剪碎的脐带组织培养于T75细胞培养瓶,标记为P0代,待细胞融合度达到80-90%时,可在倒置显微镜下观察细胞形态和生长情况。随后,每传一代均需在显微镜下观察细胞的形态,直至P3代。
(2)诱导染色
P3代细胞计数种6孔板,每孔细胞数为2×10
(3)流式细胞术鉴定
取P3代对数生长期细胞,通过流式细胞术检测hucMSC表面阳性标志物CD90、CD73、CD10及阴性标志物CD34、CD45的表达情况,采用FlowJo软件分析检测结果。
2、实验结果
hucMSC形态观察结果如图4所示,细胞培养14天以后可见长梭形细胞,围绕中央组织块呈集落状贴壁生长,即为P0代(图4a)。P0传两代后,分别为P1,P2代,细胞呈长梭形,生长速度和传代时间较P0代迅速(图4b、4c)。随后传代至P3代后(图4d),细胞为大小均一的长梭形,呈平行或漩涡状排列,细胞形态观察结果表明分离自脐带的原代细胞符合脐带间充质干细胞的形态特征。
细胞成骨诱导后进行茜素红染色,hucMSC染色结果如图5a、图5b显示,与未进行诱导培养的阴性对照组相比,诱导组在显微镜下可见到呈团块状的深红色的钙结节,而对照组并未观察到此现象。成脂诱导后的细胞进行油红染色,染色结果显示,诱导组可观察到典型的棕红色串珠样油脂滴(图5c、图5d)。成骨、成脂诱导染色结果表明,分离自脐带的间充质干细胞具有多能分化潜能。
流式细胞仪检测结果如图6所示,结果检测显示第3代huMSC的CD90、CD73的阳性表达率为99.9%(图6a、图6b),CD10的阳性表达率为73.%(图6c)。CD34和CD45的表达率在0~0.052%(图6e、图6d)。流式结果表明实验室分离培养的细胞符合《临床研究用人脐带来源间充质干细胞制剂规范》,得到了脐带间充质干细胞。
以下实施例3针对实施例2所培养得到的脐带间充质干细胞培养液进行外泌体浓缩。
实施例3基于SAP-2和基于UF的外泌体浓缩方法的比较
超滤是外泌体浓缩的常用方法,但这些方法对设备要求高,操作复杂,并且会导致蛋白质和其他非外泌体污染物的积累,从而限制外泌体的生物医学应用。在本实施例中使用超滤管(Merck Millipore,100kDa)和SAP-2分别对相同体积的干细胞培养基进行外泌体浓缩,并比较两种方法的浓缩效果。
一、超吸水性聚合物复合物(SAP-2)和超滤(UF)浓缩干细胞外泌体样品
1、通过SAP-2浓缩干细胞外泌体样品
将5克的实施例1合成的SAP-2与100mL实施例2收集得到的细胞培养液混合,加入的SAP-2(g)与细胞培养液(mL)的质量/体积比为1:20。将混合物在4℃下放置2小时,然后,使用无菌镊子去除SAP-2吸水形成的凝胶,获得27.5mL浓缩外泌体样品。
2、通过超滤法(UF)浓缩外泌体样品
通过UF法浓缩100mL实施例2收集得到的培养基,使用超滤法离心后收集浓缩液,获得与SAP-2浓缩后等体积的外泌体样品,共用时6.7小时。
二、基于SAP-2和基于UF法的外泌体浓缩方法的比较
基于SAP-2和基于UF法对100mL细胞培养基单次浓缩时间比较结果如图7所示。由此可见,对于处理相同体积的干细胞培养液来获得相同体积的浓缩干细胞外泌体而言,基于UF的方法需要6.7小时,基于SAP-2的方法只需2小时。
这些结果表明,基于SAP的干细胞外泌体浓缩方法在时间成本上具有显著优势,明显优于基于UF的外泌体浓缩方法。而且,该方法不需要专门的设备,综合成本明显低于超滤方法。总体而言,与超滤法相比,基于SAP-2的干细胞外泌体浓缩方法具有成本低、设备要求低、样品处理量容易放大等诸多优势,是一种经济、有效的外泌体浓缩方法。
实施例4SAP-2在干细胞外泌体浓缩过程中减少蛋白质杂质
蛋白质是干细胞外泌体样品的主要杂质,降低了干细胞外泌体溶液纯度,限制了干细胞外泌体的生物医学应用。本实施例测试实施例1合成的SAP-2在干细胞外泌体浓缩过程中减少蛋白质杂质的效果。
1、实验方法
选择BSA作为模型蛋白,将SAP-2与不同浓度BSA标准品溶液混合,4℃孵育2小时,评估添加SAP-2浓缩前后的蛋白质浓度,用分光光度计在562nm波长处测定吸光度,根据剩余体积和蛋白质浓度测定蛋白质的绝对量。以此来评价SAP-2对蛋白质的吸附情况。
二、实验结果
在相同处理时间里,对不同浓度BSA溶液浓缩前后的样品体积如图8A所示。可见,SAP-2在含有不同浓度BSA的溶液中均显示出高的吸水能力,然而,随着BSA浓度的增加,SAP-2的吸水能力呈下降趋势。另外,不同浓度BSA溶液在经SAP-2处理前后的BSA蛋白含量如图8B所示。可见,经过SAP-2处理后,蛋白含量均明显下降,表明干细胞培养液中的蛋白质杂质可以被SAP-2吸收减少。
实施例5基于SAP的干细胞外泌体浓缩方法浓缩后的外泌体浓度及保留率
细胞培养基是外泌体的常见来源之一,但大体积的细胞培养基不利于分离操作。在本实施例中,我们考察了使用SAP-2处理240mL的干细胞培养基的效果,然后测量了所得到的外泌体的浓度及保留率。
一、外泌体浓缩
将12克SAP-2与240mL实施例3收集得到的细胞培养基(图9A)一起孵育0分钟(图9B)和120分钟(图9C)。如图9C所示,SAP-2在细胞培养基中培养2h后完全膨胀。去除SAP-2吸水形成的水凝胶后,样品浓缩后的体积如图9D所示,样品体积从240mL减少到约66mL,体积减少百分比如图9E所示。
二、外泌体保留率
外泌体的保留率是评估干细胞外泌体浓缩方法的最重要指标。在这项工作中,采用荧光标记的外泌体来研究SAP-2对外泌体的吸附能力。
如图10A所示,将1mL外泌体与20μMDio在PBS缓冲液中,黑暗条件下,37℃孵育15min(图10A),然后用荧光光谱仪(日立,F-7000)在激发波长和发射波长分别为465nm和505nm处检测200μL上清的荧光强度。将标记过Dio染料的外泌体溶液中加入40mg SAP-2,在4℃黑暗条件下,孵育2h,再次测定200uL上清中的荧光强度。结果如图10B所示,孵育前后荧光强度基本上没有变化,表明SAP-2不会吸附外泌体。
实践上,这种基于SAP-2的浓缩方法可以处理远超过240mL的干细胞培养液,处理后的培养液中外泌体的保留量接近100%,而且不需要任何浓缩设备,综合成本低,因而与传统浓缩方法相比而言,具有很大的优势。
实施例6干细胞外泌体的表征
使用透射电子显微镜(TEM)、动态光散射(DLS)和蛋白免疫印迹(Western Blot)方法对收集到的干细胞外泌体的大小和形状、外泌体特征标记物进行了表征。其中,典型的外泌体相关蛋白有CD9和CD63。
一、提取外泌体
基于实施例5,通过SAP-2浓缩获得的干细胞外泌体浓缩液,进一步采用市售的外泌体提取试剂盒(辽宁润基生物科技有限公司)提取外泌体。所有操作均按照说明书进行。首先,将浓缩样品与沉淀剂(由试剂盒提供)在4℃下静置30min。然后,将混合溶液在以12,000×g、4℃下离心30min收集沉淀。接下来,将沉淀用适量的PBS重悬,将重悬的外泌体转移至纯化柱(试剂盒提供)并在4℃下以2,000×g离心5min。最后,收集溶液并储存在-80℃以供进一步使用。
二、外泌体表征
1、TEM表征和DLS分析
将得到的外泌体样品(10mL)滴加到铜网上,静置10分钟。之后,用一张滤纸吸收多余的样品溶液,然后将外泌体用2%(w/v)磷钨酸染色3分钟,然后在红外灯下干燥10分钟,最后在120KV的TEM(HITACH HT7700,日本)下观察。
使用DLS设备(ZetasizerNS,Malvern,UK)在25℃下测量外泌体样品的尺寸分布和多分散指数(PDI)。
2、蛋白印迹分析(Western blot analysis,WB analysis)
用细胞组织裂解液(RIPA裂解液)处理分离得到的外泌体样品,用BCA蛋白质检测试剂盒测定外泌体样品的蛋白质浓度,再将蛋白质样品与SDS-PAGE蛋白上样缓冲液混合调整蛋白质浓度到1.7mg/mL,然后在100℃加热5min使蛋白质变性。
通过SDS-PAGE电泳分离蛋白质并通过湿膜转移装置转移到一块聚偏二氟乙烯(PVDF)膜上。PVDF膜用TBST冲洗3次(每次10分钟),然后用5%BSA溶液(溶于TBST)在25℃下封闭2小时。然后,将PVDF膜与不同的抗体孵育(抗CD9或抗CD63)在4℃过夜。第二天用TBST冲洗,将PVDF膜与HRP标记的二抗孵育2h,然后用TBST冲洗。
加入化学发光(ECL)工作液1mL到PVDF膜上,室温孵育2-3分钟,放在化学发光成像仪拍照。
三、实验结果
从TEM图像中可以观察到大小约为125nm的干细胞外泌体的形状(图11A和图11B)。
DLS测量结果显示所得到的外泌体样品大小为130nm(图11C),结果与TEM基本一致。
WB技术成功检测到外泌体的典型标记蛋白CD63和CD9(图11D),表明所得到的是干细胞外泌体。
综上所述,这些结果表明,基于SAP-2的浓缩方法可用于干细胞外泌体的浓缩和纯化。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 一种负载目标miRNA的间充质干细胞外泌体、应用的敷料及其制备方法
- 一种脐带间充质干细胞外泌体培养以及分离方法
- 一种骨髓间充质干细胞外泌体的改造方法
- 一种脐带间充质干细胞复合外泌体及其制备方法
- 人脐带间质干细胞外泌体的分离纯化方法和人脐带间质干细胞外泌体的应用
- 人脐带间质干细胞外泌体的分离纯化方法和人脐带间质干细胞外泌体的应用
