纯化过敏原提取物的方法
文献发布时间:2023-06-19 13:46:35
技术领域
本发明涉及生产用于诊断和治疗过敏症的半纯化和纯化过敏原提取物以及药物组合物和疫苗的方法。
背景技术
过敏症是免疫系统的获得性超敏障碍,并且由暴露于称为过敏原的无害环境物质触发。I型超敏反应是过敏反应的特征,并且导致产生过量的IgE抗体,进而激活嗜碱性粒细胞和肥大细胞,引起炎症反应。效应可能是全身性的,如血管舒张、粘液分泌、神经刺激或平滑肌收缩,从而导致过敏性反应,或者效应可能限于身体的特定区域,例如呼吸系统。
梯牧草(Phleum pratense)
草过敏是在某些季节期间影响敏感人群的最常见和流行的过敏症形式之一。春末夏初空气中存在草的花粉,可引起过敏性鼻炎、过敏性结膜炎和哮喘。坐在草上或修剪草坪时,皮肤与草直接接触会导致皮肤瘙痒、荨麻疹和特应性皮炎。最具代表性的草的物种之一是梯牧草。在梯牧草物种中已鉴定出至少九种不同的过敏原,并且包括:Phl p 1,其为27kDa的β扩展蛋白;Phl p 2,其为10-12kDa的草族II/III;Phl p 4,其为55kDa的蛋白质;32kDa的Phl p 5;11kDa的Phl p 6;Phl p 7,其为6kDa的钙结合蛋白;Phl p 11,其为20kDa的Ole e 1相关蛋白;Phl p 12,其为14kDa的前纤维蛋白;以及Phl p 13,其为55kDa的聚半乳糖醛酸酶。
油橄榄(Olea europaea)
在地中海地区,由于橄榄树的广泛种植,橄榄花粉症是一个重要的健康问题。橄榄树向大气中释放大量花粉。目前,WHO/IUIS过敏原命名小组委员会已经描述了来自油橄榄的12种过敏原;11种来自花粉,1种(奇异果甜蛋白,也称为Ole e 13)来自橄榄果的食物过敏原。Ole e 1是主要过敏原,被超过70%的橄榄花粉致敏患者所识别。其他过敏原包括前纤维蛋白(Ole e 2)、polcalcin(Ole e 3和Ole e 8)、葡聚糖酶(Ole e 4和Ole e 9)、超氧化物歧化酶(Ole e 5)、脂质转移蛋白(Ole e 7)、糖基水解酶(Ole e 10)、果胶甲酯酶(Olee 11)和Ole e 6。
屋尘螨(Dermatophagoides pteronyssinus)
螨是全世界致敏的主要来源,尤其是在湿度和温度有利于其发育的地区。目前,属于尘螨科的屋尘螨(HDM)是室内生境中最丰富的螨,因此是过敏原的主要室内来源。已经由WHO/IUIS过敏原命名小组委员会描述了在屋尘螨中的十九种过敏原,其中的9种是蛋白酶,具有与过敏原性相关的活性。最重要的过敏原是Der p 1(25kDa半胱氨酸蛋白酶)和Der p2(14kDa的NPC2家族蛋白)。
过敏患者可以通过药物治疗以减轻其症状并控制症状高峰,或者可以通过特异性免疫疗法进行治疗。然而,特异性免疫疗法是唯一能够改变疾病进程的治疗。特异性免疫疗法(SIT)涉及施用不断变大的剂量的过敏原提取物,目的是诱导免疫耐受。过敏原免疫疗法调节对过敏原的免疫应答,而不是改善由过敏反应诱发的症状,并且可以减少对药物的需求、减轻症状的严重程度或完全消除超敏性。
免疫疗法的风险之一是向致敏患者注射过敏原会引起过敏反应或过敏性。自20世纪初首次使用以来,为了进一步提高过敏原免疫疗法的安全性和功效,人们做出了许多努力。一种方法是开发类过敏原,这涉及使用过敏原性降低但保留免疫原性的过敏原疫苗。
EP 0 662 080(CBF LETI SA)披露了一种去除物质和其他低分子量材料以纯化过敏原提取物并增加最终过敏原/蛋白质含量的方法。所述方法由以下组成:在一定条件下破坏静电力、疏水力或其他物理力,以使非过敏原性化合物与过敏原性活性蛋白质分离。所述过程可以由以下组成:通过将pH降低到相应过敏原蛋白质的pI之下进行弱酸处理。
降低过敏原性的各种方式之一由以下组成:用醛(主要是甲醛和戊二醛)对天然过敏原提取物进行化学改性,以产生类过敏原。这种醛处理产生失去了部分过敏原性(即展现出IgE反应性B细胞表位的减少)的反应产物(主要是聚合物),从而减少了过敏副作用。同时,保留了过敏原的天然免疫原性。一些过敏原疫苗制造商已选择这种过敏原改性途径,以基于此原理开发市售产品。
然而,对于通过优化过敏原纯化方法以确保消除低分子量蛋白质、刺激物和有毒组分来寻找用于获得用于过敏性障碍免疫疗法中的安全有效药物的其他方法仍然存在兴趣。
发明内容
诸位发明人已经发现,使用碱对过敏原提取物脱色会增加蛋白质含量,并且还可以增加主要过敏原含量和提取物的生物效力。
根据本发明的第一方面,提供了一种生产脱色过敏原提取物的方法,所述方法包括:
a)碱化天然过敏原提取物;并且
b)去除分子大小小于3.5kDa的分子;并且
c)调节pH至中性;
从而产生脱色过敏原提取物。
所述方法还可以包括聚合步骤,所述聚合步骤包括:
d)使脱色过敏原提取物与醛接触;并且
e)去除分子大小小于100kDa的分子;
从而产生脱色聚合过敏原提取物。
根据本发明的第二方面,提供了根据本发明第一方面的方法可获得的脱色过敏原提取物。
根据本发明的第三方面,提供了根据本发明第一方面的方法可获得的脱色聚合过敏原提取物。
根据本发明的另外的方面,提供了在治疗过敏症中用作活性治疗物质的纯化过敏原提取物。
定义
“过敏原”可以定义为能够诱导IgE应答和/或I型过敏反应的分子。
术语“天然过敏原提取物”是指从源材料中提取并经过处理以去除未结合的低分子量组分的过敏原提取物。
本文提及的术语“脱色过敏原提取物”可定义为通过去除与过敏原蛋白结合的过敏原性无关物质(包括吸附的色素)而从天然过敏原提取物获得的半纯化过敏原提取物。
本文提及的术语“脱色聚合过敏原提取物”可定义为经纯化的其中通过非还原性SDS-PAGE不可检测到<100kDa的蛋白质条带的过敏原提取物,并且是通过对脱色过敏原提取物进行聚合获得的。
具体实施方式
本发明的过敏原提取物源自任何包含已知在个体中引发IgE介导的免疫反应的天然过敏原的源材料。此类过敏原可包括空气传播的过敏原(例如来自草、树、草本植物和杂草的花粉,尘螨,真菌和霉菌),食物过敏原(例如花生),昆虫过敏原(例如来自蟑螂和蚤、以及蜜蜂和胡峰毒液)和上皮过敏原(动物毛发和动物皮屑,例如猫和狗的皮屑)。
所述源材料可以是任何过敏原,包括食物过敏原(例如花生)、空气传播的过敏原(例如花粉(如树花粉、杂草花粉、草花粉、和谷类花粉)、尘螨、真菌、和霉菌)、上皮过敏原(动物毛发和动物皮屑,例如猫的毛发和皮屑以及狗的毛发和皮屑)和昆虫过敏原(例如来自蟑螂和蚤、以及蜜蜂和胡蜂毒液)。
来自树、草和杂草的花粉过敏原源自以下的分类学目组:壳斗目(Fagales)(例如桤木属(Alnus)和桦木属(Betula))、唇形目(Lamiales)(例如木樨榄属(Olea)和车前属(Plantago))、禾本目(Poales)(例如梯牧草)、菊目(Asterales)(例如豚草属(Ambrosia)和蒿属(Artemisia))、石竹目(Cayophyllales)(例如藜属(Chenopodium)和猪毛菜属(Salsola))、蔷薇目(Rosales)(例如墙草属(Parietaria))、山龙眼目(Proteales)(例如悬铃木属(Platanus))等。尘螨属于无气门亚目(Astigmata)(例如表皮螨属(Dermatophagoides)和嗜霉螨属(Euroglyphus))组。源自霉菌和真菌的空气传播的过敏原属于格孢腔目(Pleosporales)(例如链格孢属(Alternaria))、煤炱目(Capnodiales)(例如枝孢属(Cladosporium))等。
空气传播的过敏原可以选自:树花粉(欧洲桤木(Alnus glutinosa)、桦树(Betulaalba)、欧榛(Corylus avellana)、绿干柏(Cupressus arizonica)、油橄榄(Oleaeuropaea)、悬铃木属物种(Platanus sp)),草花粉(狗牙根(Cynodon dactylon)、鸭茅(Dactylis glomerata)、苇状羊茅(Festuca elatior)、绒毛草(Holcus lanatus)、黑麦草(Lolium perenne)、梯牧草(Phleum pratense)、芦苇(Phragmites communis)、草地早熟禾(Poa pratensis)),杂草花粉(豚草(Ambrosia elatior)、北艾(Artemisia vulgaris)、藜(Chenopodium album)、犹太墙草(Parietaria judaica)、长叶车前(Plantagolanceolata)、钾猪毛菜(Salsola kali))以及谷类花粉(燕麦(Avena sativa)、大麦(Hordeum vulgare)、黑麦(Secale cereale)、小麦(Triticum aestivum)、玉蜀黍(Zeamays)),尘螨(粉尘螨(Dermatophagoides farinae)、微角尘螨(Dermatophagoidesmicroceras)、屋尘螨(Dermatophagoides pteronyssinus)、梅氏嗜霉螨(Euroglyphusmaynei))、贮藏螨(粗脚粉螨(Acarus siro)、热带无爪螨(Blomia tropicalis)、害鳞嗜螨(Lepidoglyphus destructor)、腐食酪螨(Tyrophagus putrescentiae)、家食甜螨(Glycyphagus domesticus)、拱殖嗜渣螨(Chortoglyphus arcuatus))以及真菌和霉菌(交链格孢菌(Alternaria alternata)、腊叶芽枝霉(Cladosporium herbarum)、烟曲霉(Aspergillus fumigatus))。
上皮过敏原可以选自任何动物,包括猫的毛发和皮屑、狗的毛发和皮屑、马的毛发和皮屑、人的毛发和皮屑、兔的毛发和皮屑、大鼠的毛发和皮屑、小鼠的毛发和皮屑、豚鼠的毛发和皮屑以及羽毛。
节肢动物过敏原可选自昆虫(例如蚂蚁、蚤、蟑螂、胡蜂和蜜蜂毒液),或螨(粗脚粉螨、热带无爪螨、粉尘螨、微角尘螨、屋尘螨、梅氏嗜霉螨、害鳞嗜螨、腐食酪螨和拱殖嗜渣螨)。
花粉过敏原对碱处理反应特别好。花粉过敏原包括树花粉、杂草花粉、草花粉和谷类花粉,并且源自以下的分类学目组:壳斗目(例如桤木属和桦木属)、唇形目(例如木樨榄属和车前属)、禾本目(例如梯牧草)、菊目(例如豚草属和蒿属)、石竹目(例如藜属和猪毛菜属)、蔷薇目(例如墙草属)、山龙眼目(例如悬铃木属)等。
在一个实施方案中,所述过敏原提取物源自为花粉的源材料。所述花粉可选自梯牧草、油橄榄和桦树(垂枝桦)。
更优选地,所述源材料选自花生(落花生(Arachis hypogaea))、花粉(梯牧草、油橄榄和桦树(垂枝桦))、螨(屋尘螨)、和上皮(猫的皮屑)。
在本发明的优选实施方案中,所述源材料选自花粉(梯牧草、油橄榄和桦树(垂枝桦))和螨(屋尘螨)。
更特定地,所述源材料选自梯牧草、油橄榄和桦树(垂枝桦)。
在本发明的更优选实施方案中,所述源材料是梯牧草。
可替代地,所述源材料是油橄榄。
可替代地,所述源材料是屋尘螨。
现在将描述一种制备天然过敏原提取物的方法,但应理解技术人员已知用于获得天然过敏原提取物的其他合适方法,并可将所述天然过敏原提取物用作本发明脱色过程中的起始材料。
从源材料获得天然过敏原提取物的方法可以包括:
i)使源材料或第一源材料残余物与液体过敏原提取剂接触以产生溶解在液相中的过敏原与包含第二源材料残余物的固相的第二混合物;
ii)使所述第二混合物经受第二分离步骤以分离溶解在所述液相中的过敏原,以产生粗过敏原提取物;
iii)使所述粗过敏原提取物经受低分子级分去除步骤,以去除在3-10摄氏度下大小为小于1-10kDa、优选小于3.5kDa的分子;
iv)在3-10摄氏度下进行步骤iii),直到所述过敏原提取物具有在室温下测量的低于900μS/cm的电导率,以获得天然过敏原提取物;
可首先处理源材料以产生用于与液体过敏原提取剂接触的最大表面积。可以将源材料均质化、共混、压碎或粉末化以产生用于液体提取的均质浆料。
在某些情况下,需要初步脱脂步骤,其中可包括:
i)使包含过敏原的源材料与液体脂质提取剂接触以产生第一混合物,所述第一混合物包含溶解在液相中的脂质和由包含过敏原和蛋白质的第一源材料残余物组成的固相;并且
ii)使所述第一混合物经受第一分离步骤以分离所述第一源材料残余物。
在其中所述源材料是花粉、上皮或食物(如坚果,例如花生)的情况下,可能需要初步脱脂步骤。脂质提取或“脱脂”步骤从源材料中去除亲脂性化合物,如脂质和脂肪酸。
所述液体脂质提取剂可以是丙酮、醚或类似的溶剂,它可以是冷的。优选地,所述液体脂质提取剂是丙酮。脂质提取步骤可以以1:1的源材料重量/液体脂质提取剂重量比率,或其中液体脂质提取剂重量超过源材料重量的任何比率例如1:2、1:3、1:5、1:10进行。脂质提取步骤优选以1kg源材料对应2L液体脂质提取剂的比率进行。脂质提取步骤优选进行足够的时间以使源材料中的脂质溶解在液体脂质提取剂中,所述步骤可以持续超过1分钟,优选超过5分钟,更优选超过30分钟,并且最优选为1小时或更长时间。液体提取步骤可以在2至25摄氏度之间的温度下进行,但优选在冷的情况下在2至6摄氏度之间、并且更优选在3至5摄氏度之间进行。在脂质提取步骤期间,优选将源材料与液体脂质提取剂一起搅拌或搅动。
所述第一分离步骤可以是技术人员已知的任何合适的分离步骤,例如所述第一分离步骤可以是过滤或任何其他合适的方法。
在第一分离步骤之后,可以用液体脂质提取剂洗涤源材料残余物。任选地,可以将所述第一源材料残余物进一步用液体脂质提取剂提取,然后分离。优选地,进行一个、两个或更多个进一步的脂质提取步骤。可重复液体提取剂的过滤直至其透明。也可以使用技术人员已知的其他合适的分离方法。
在脂质提取和分离之后,可以干燥源材料残余物。可以将源材料残余物在2至25摄氏度之间,优选在室温下干燥。所述干燥步骤优选持续足够的时间以允许从源材料残余物中去除液体脂质提取剂,所述时间可以在1至24小时、6至18小时之间,但干燥优选持续至少12小时。
过敏原可通过以下方式从(“脱脂的”)第一源材料残余物获得:用液体过敏原提取剂提取以产生包含溶解在液相中的过敏原和由“不需要的”非过敏原残余物组成的固相的粗过敏原提取物。液体过敏原提取剂可以是水溶液,并且优选包含缓冲剂。液体过敏原提取剂可以包括PBS和/或NaCl,例如可以是0.01M PBS/0.15M NaCl的水溶液,或碳酸氢铵((NH
在过敏原提取步骤之后,可以将溶解在液相中的过敏原与第二源材料残余物分离,以产生粗过敏原提取物。所述分离步骤优选是离心,但许多用于从液体中分离固体的技术是适用的,这些技术是本领域技术人员熟知的。优选地,将溶解在液相中的过敏原在2至6摄氏度之间、并且优选在3至5摄氏度之间进行离心,持续足够的时间以将源材料残余物沉淀为沉淀物,所述时间例如在1分钟至1小时之间、或超过1小时。可以将粗过敏原提取物(即含有溶解的过敏原的上清液)储存在2至6摄氏度之间。可以使用与第一过敏原提取步骤相同的条件,进一步用液体过敏原提取剂提取第二源材料残余物沉淀物,并且优选持续更长的提取时间段,如4至8小时之间、8至12小时或超过12小时。在第二过敏原提取步骤之后,可以将溶解在液相中的过敏原与第二源材料残余物分离,以产生粗过敏原提取物。优选将来自第一和第二过敏原提取步骤的粗过敏原提取物合并用于进一步处理。
可以例如使用0.45μm孔径过滤粗过敏原提取物。可以使粗过敏原提取物经受低分子级分去除步骤以去除具有低分子大小的分子,如盐和其他非过敏原性化合物。在步骤iii)中,可以去除分子大小小于1-10kDa、优选小于3.5kDa的分子。优选地,低分子级分去除步骤在3℃-10℃、优选3℃-5℃下继续进行,直到过敏原提取物的电导率小于900μS/cm,或小于800μS/cm,或小于700μS/cm,或小于600μS/cm,或更优选小于500μS/cm(在室温下测量)。
可以例如使用0.45和/或0.22μm孔径过滤所得的天然过敏原提取物。
天然过敏原提取物可用于制备用于标准化、诊断、合成和疫苗接种目的的药物组合物或疫苗。
在本发明中,天然过敏原提取物用作本文所述脱色方法中的起始材料。
本发明提供了一种脱色方法,其包括碱化处理,其中使用破坏静电力、疏水力或其他物理力(这些力是导致非过敏原性化合物粘附到蛋白质上的原因)的手段去除粘附在过敏原/蛋白质上的非过敏原性化合物,以产生脱色提取物。
所述碱化处理包括:
a)碱化所述天然过敏原提取物;
b)去除分子大小小于3.5kDa的分子;并且
c)将pH调节至中性以产生脱色过敏原提取物。
所述碱化处理包括弱碱处理或强碱处理。在碱处理中,可以将过敏原/蛋白质的pH增加到至少pH 7,例如7与11之间的pH值。过敏原蛋白质的优选pH在7与10之间,更优选的是在7与8之间的pH。大于11的pH值可导致脱色过敏原提取物的蛋白质谱不完整,而中性pH,例如pH 6,会导致所得脱色过敏原提取物中的非过敏原性化合物不完全消除。
在一个实施方案中,碱处理包括将过敏原提取物碱化至pH 7、pH 8、pH 9、pH 10或pH 11。
在一个实施方案中,碱处理包括将过敏原提取物碱化至pH 7至11,或pH 7至10,优选pH 7与8之间。
可以使用任何合适的碱提高天然过敏原提取物的pH。所述碱可以是强碱或弱碱。强碱包括氢氧化钠、氢氧化锂和氢氧化钾。弱碱包括尿素、氢氧化铵和甲胺。在一个实施方案中,所述碱选自包括氢氧化钠、氢氧化锂、氢氧化钾、尿素、氢氧化铵或甲胺的列表。特别地,所述碱是氢氧化钠。
可以将碱化提取物在碱性pH下维持1分钟至24小时、1分钟至4小时、1至60分钟,优选5至30分钟,更优选10至20分钟,并且最优选约15分钟。
可以在低分子级分去除步骤中去除分子大小小于3.5kDa的分子。
在碱化处理之后,可以收集所得的脱色过敏原提取物,并使用合适的酸例如HCl调节提取物的pH。可以将pH调节至避免蛋白质沉淀的值,例如pH7.0与7.5之间,更特别地pH7.3与7.4之间。
特别地,所述碱化处理可以包括:
a)将天然过敏原提取物碱化至pH 7至11,并将碱化的提取物维持1分钟至24小时,例如5至30分钟,优选15分钟;
b)使所述提取物经受低分子级分去除步骤以去除分子大小小于3.5kDa的分子;并且
c)将pH调节至7.0与7.5之间,特别是7.3至7.4,以产生脱色过敏原提取物。
碱化处理可包括将天然过敏原提取物碱化至pH 7至10。
低分子级分去除步骤可以是透析步骤,其中将提取物针对透析液如纯化水或缓冲液进行透析。低分子级分去除步骤可以在2-25摄氏度之间进行,但优选在冷的情况下在2-6摄氏度之间、并且最优选在3-5摄氏度之间进行。低分子级分去除步骤可进行12-24小时,其中定期更换溶剂或在透析情况下的透析液以维持反应。
可以将所得的脱色过敏原提取物例如使用0.45μm和/或0.22μm孔径进行过滤,并且可以冷冻或冷冻干燥以用于储存。
可以进一步处理使用本发明的方法产生的提取物。所述方法还可以包括聚合步骤,所述聚合步骤包括:
d)使脱色过敏原提取物与醛接触,并且在聚合后,
e)去除分子大小小于100kDa的分子。
所述醛可以是任何合适的醛,例如戊二醛或甲醛。
所述聚合步骤可以包括:
d)使脱色过敏原提取物与戊二醛或甲醛接触,
e)使所述提取物经受分子级分去除步骤以去除分子大小小于100kDa的分子,并且
f)在3-15摄氏度,优选3-5摄氏度下进行步骤e),直到所述过敏原提取物具有低于210μS/cm的电导率(在室温下测量),和/或直到所述提取物中不存在醛,以获得脱色聚合过敏原提取物。
在对用于聚合的提取物进行冷冻干燥的情况下,可以将所述提取物重构于缓冲液例如0.01M PBS/0.15M NaCl中,至终浓度为0.1-500mg/ml,优选1-100mg/ml,并且最优选10-50mg/ml。
聚合反应优选进行至完成,使得通过非还原性SDS-PAGE不可检测到在脱色聚合过敏原提取物中<100kDa(例如14-25kDa)的蛋白质条带。
增加戊二醛的浓度会降低聚合物产量并增加透析前通过任何离心步骤获得的残余物产量。与使用约5mg/ml戊二醛浓度(即0.009ml戊二醛/ml过敏原提取物)的先前已知聚合条件相比,实验确定针对一些过敏原(花生、猫的上皮和豚草属)的最佳戊二醛浓度大约是已知量的两倍,即10mg/ml(0.02ml戊二醛/ml过敏原提取物)。可以以1-20mg/ml的范围添加醛。虽然使用先前已知量的戊二醛终浓度可导致过敏原的一些聚合,但优选以5-10mg/ml的终浓度或0.01-0.02ml戊二醛/ml提取物的比率添加醛,以实现最佳聚合。
降低戊二醛的添加速率也可降低聚合物产率并增加残余物产率。可以将醛以恒定速度例如0.001-0.5ml/分钟之间(1-500μl/min或60-3000μl/小时)添加至提取物中。
可以将聚合反应在室温或更高温度下维持1-12小时之间,优选7小时。可以40mg/ml脱色聚合过敏原提取物溶液的比例使用甘氨酸终止聚合反应。可以将终止的反应在3℃-5℃下维持过夜,优选在搅拌下。可以将液相中的脱色聚合过敏原与不溶性残余物分离以产生脱色聚合过敏原提取物。所述分离步骤优选为离心,但许多分离技术是适用的,这些技术是本领域技术人员熟知的。优选地,将提取物在2-6摄氏度之间、并且优选在3-5摄氏度之间离心足够的时间以将不溶性残余物沉淀为沉淀物,所述时间例如在1分钟至1小时之间、或超过1小时。可以收集上清液(含有可溶性脱色聚合过敏原)并进行分子级分去除步骤e)。
在步骤e)中,去除分子大小小于100kDa的分子。
优选地,分子级分去除步骤是透析步骤,其中在3-15摄氏度、优选3-5摄氏度下将提取物针对透析液如纯化水或缓冲液进行透析。分子级分去除步骤可以在3-15摄氏度、优选3-5摄氏度下继续进行,直到在室温下测量的电导率小于300μS/cm,更优选小于250μS/cm,最优选小于210μS/cm。
可以将所得的脱色聚合过敏原提取物例如使用0.45μm和/或0.22μm孔径进行过滤,并且可以冷冻或冷冻干燥以用于储存。
本文所述的任何低分子级分去除步骤,例如步骤b)或e),可包括超滤步骤、渗滤步骤、透析步骤或过滤。
在最简单的形式中,本发明的方法可包括制备或获得天然过敏原提取物,并且碱化所述提取物(例如通过弱碱或强碱处理)以去除具有低分子大小的非过敏原性化合物。然后可以使用醛使提取物聚合。天然过敏原提取物可以是花生、花粉、草、上皮、霉菌、真菌、昆虫或螨过敏原,特别是草、花粉或螨,更特别是花粉过敏原。本发明的方法产生展现出降低的IgE结合能力但保留其免疫原性能力的过敏原提取物。
本发明还包括过敏症治疗剂和过敏症诊断药物,两者均包含通过本发明的方法产生的过敏原提取物作为活性成分。过敏症可能与暴露于各种过敏原有关,这些过敏原引发如本文所讨论的IgE介导的过敏反应。
根据本发明的第二方面,提供了根据本发明第一方面的方法可获得的脱色过敏原提取物。
根据本发明的第三方面,提供了根据本发明第一方面的方法可获得的脱色聚合过敏原提取物。提供了用作活性治疗物质的纯化过敏原提取物。
所述过敏原提取物可以选自花生(落花生)、花粉(梯牧草、桦树、油橄榄、犹太墙草和绿干柏)、螨(屋尘螨)和上皮(猫的皮屑)。特别地,所述过敏原提取物是选自油橄榄和梯牧草的花粉。
所述过敏原提取物可用于治疗过敏症。在优选的实施方案中,油橄榄或梯牧草的过敏原提取物可用于治疗花粉过敏。
脱色聚合过敏原提取物的特征可以在于以下物理化学和生物特性:
i.溶于水,
ii.不存在分子量低于100kDa的非聚合过敏原/蛋白质(在非还原条件下通过SDS-PAGE鉴定为条带)
iii.不存在分子量低于100kDa的IgE识别条带(通过非还原条件下的免疫印迹鉴定)
iv.不存在分子量低于100kDa的聚合分子(通过SDS PAGE确定)
v.相对于天然过敏原提取物的生物效力降低(95%)(使用来自致敏个体的特定血清池通过IgE ELISA抑制实验确定),以及
vi.在小鼠和豚鼠中不存在异常毒性。
特别地,脱色聚合过敏原提取物的特征在于相对于天然过敏原提取物的生物效力降低(95%)(使用来自致敏个体的特定血清池通过IgE ELISA竞争实验确定)。
本发明的过敏原提取物可用作治疗过敏个体的药物的活性组分,目的是诱导对某些过敏原的耐受性。
提供了根据本发明的过敏原提取物在诊断免疫障碍,优选检测过敏性疾病中的用途。提供了根据本发明的过敏原提取物用于治疗过敏症或在制备用于治疗过敏症例如花粉过敏的药物中的用途。所述用途可以是用于免疫疗法。所述用途可以是用于标准化、诊断、合成和疫苗接种目的。所述用途可以是在患者的治疗性治疗,优选免疫疗法中。所述用途可以是在免疫疗法期间监测患者中。
可替代地,提供了一种用于治疗有需要的人的过敏症如花粉过敏的方法,其包括向有需要的人施用本发明的过敏原提取物的步骤。
根据本发明的另外的方面,提供了包含根据本发明的过敏原提取物的药物组合物。提供了一种用于治疗过敏症的药物组合物,其包含作为活性成分的药学有效量的根据本发明的过敏原提取物和至少一种药学上可接受的载体或稀释剂。提供了一种用于过敏症的诊断组合物,其包含作为活性成分的诊断有效量的根据本发明的过敏原提取物。
根据本发明的另外的方面,提供了一种包含根据本发明的过敏原提取物的疫苗。所述药物组合物和疫苗还可包含一种或多种佐剂、稀释剂、防腐剂或其混合物。所述药物组合物或疫苗可包含生理学上可接受的载体。如本文所用,短语“药学上可接受的”优选意指经政府监管机构批准或在欧洲或美国列出的。药典或其他公认的用于人类的药典。
此类药学上可接受的载体可以是无菌液体,如水和油,所述油包括石油、动物、植物或合成来源的那些油,如花生油、大豆油、矿物油、芝麻油等。盐水溶液和水性右旋糖和甘油溶液也可以用作液体载体,特别是用于可注射溶液。合适的药物赋形剂包括甘露醇、人血清白蛋白(HSA)、淀粉、葡萄糖、乳糖、蔗糖、明胶、麦芽、稻米、面粉、白垩、硅胶、碳酸镁、硬脂酸镁、硬脂酸钠、单硬脂酸甘油酯、滑石、氯化钠、脱脂乳粉、甘油、丙烯、二醇、水、乙醇等。
提供了根据本发明第一方面的方法可获得的疫苗。所述疫苗可以用于皮下或舌下使用或表皮使用。
提供了根据本发明的疫苗在治疗过敏症或制造用于治疗过敏症的药物中的用途。
根据本发明的另外的方面,提供了一种预防过敏原致敏的方法,所述方法包括以下步骤:将个体暴露于有效量的本发明的过敏原提取物、药物组合物或疫苗。
根据本发明的另外的方面,提供了治疗致敏个体的过敏症的方法,所述方法包括向所述个体施用有效量的本发明的过敏原提取物、药物组合物或疫苗。可以皮下或舌下施用过敏原提取物、药物组合物或疫苗,并且可以以渐增或恒定的剂量施用。
所述个体可以是人或动物,优选人。
附图说明
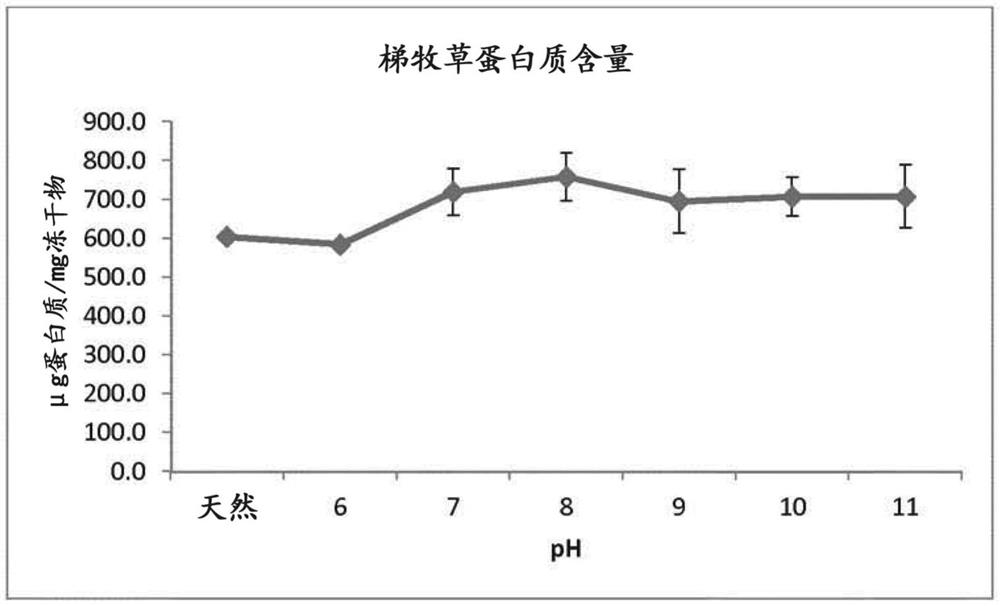
图1示出了在不同pH处理后获得的冻干样品中的梯牧草提取物的蛋白质含量(使用Lowry-Biuret法测定)。误差棒是指不同样品平均值的标准差。
图2示出了在用不同的碱处理后获得的冻干样品中的梯牧草提取物的蛋白质含量(使用Lowry-Biuret法测定)。误差棒是指不同样品平均值的标准差。
图3示出了在不同pH处理后获得的冻干样品中的Phl p 5(梯牧草主要过敏原)含量。误差棒是指不同样品平均值的标准差。
图4示出了用不同的碱处理后获得的冻干样品中的Phl p 5(梯牧草主要过敏原)含量。误差棒是指不同样品平均值的标准差。
图5示出了在不同pH处理后获得的冻干样品中的梯牧草提取物的生物效力(ELISA竞争)。误差棒是指不同样品平均值的标准差。
图6示出了在用不同的碱处理后获得的冻干样品中的梯牧草提取物的生物效力(ELISA竞争)。误差棒是指不同样品平均值的标准差。
图7示出了获得IgE与梯牧草提取物天然提取物结合的50%抑制所需的在不同pH处理后获得的冻干样品中的梯牧草提取物的μg。误差棒是指不同样品平均值的标准差。
图8示出了获得IgE与梯牧草提取物天然提取物结合的50%抑制所需的在用不同的碱处理后获得的冻干样品中的梯牧草提取物的μg。误差棒是指不同样品平均值的标准差。
图9示出了用不同的碱处理的梯牧草提取物的SDS。
图10示出了用不同的碱处理的梯牧草提取物的蛋白质印迹。
图11示出了在用不同的pH处理后获得的冻干样品中,使用Lowry-Biuret法测定的油橄榄提取物的蛋白质含量。误差棒是指不同样品平均值的标准差。
图12示出了在用不同的碱处理后获得的冻干样品中,使用Lowry-Biuret法测定的油橄榄提取物的蛋白质含量。误差棒是指不同样品平均值的标准差。
图13示出了在用不同的pH处理后获得的冻干样品中,使用ELISA竞争方法测定的油橄榄提取物的生物效力。误差棒是指不同样品平均值的标准差。
图14示出了在用不同的碱处理后获得的冻干样品中,使用ELISA竞争方法测定的油橄榄提取物的生物效力。误差棒是指不同样品平均值的标准差。
图15示出了获得IgE与天然油橄榄提取物结合的50%抑制所需的在用不同的pH处理后获得的冻干样品中的天然油橄榄提取物的μg。误差棒是指不同样品平均值的标准差。
图16示出了获得IgE与天然油橄榄提取物结合的50%抑制所需的在用不同的碱处理后获得的冻干样品中的天然油橄榄提取物的μg。误差棒是指不同样品平均值的标准差。
图17示出了用不同的碱处理的油橄榄提取物的SDS。
图18示出了用不同的碱处理的油橄榄提取物的蛋白质印迹。
图19示出了油橄榄的薄层色谱。A,用氢氧化钠和氢氧化锂处理的样品;B,用氢氧化铵、氢氧化钠和尿素处理;C,用甲胺处理。所有测定均与天然提取物进行比较。标准品是:1,绿原酸;2,槲皮素;3,芦丁三水合物;4,异槲皮苷;5,槲皮苷;6,山奈酚3-葡萄糖苷;7,芹菜素7-葡萄糖苷。
图20示出了在用不同的pH处理后获得的冻干样品中,使用Lowry-Biuret法测定的屋尘螨提取物的蛋白质含量。误差棒是指不同样品平均值的标准差。
图21示出了在用不同的碱处理后获得的冻干样品中,使用Lowry-Biuret法测定的屋尘螨提取物的蛋白质含量。误差棒是指不同样品平均值的标准差。
图22示出了针对在用不同的pH处理后获得的冻干样品中的Der p 1和Der p 2,使用特定ELISA夹心试剂盒(Indoor)测定的屋尘螨提取物的主要过敏原含量。误差棒是指不同样品平均值的标准差。
图23示出了针对在用不同的酸或碱处理后获得的冻干样品中的Der p 1和Der p2,使用特定ELISA夹心试剂盒(Indoor)测定的屋尘螨提取物的主要过敏原含量。误差棒是指不同样品平均值的标准差。
图24示出了在用不同的pH处理后获得的冻干样品中,使用ELISA竞争方法测定的屋尘螨提取物的生物效力。误差棒是指不同样品平均值的标准差。
图25示出了在用不同的pH处理后获得的冻干样品中,使用ELISA竞争方法测定的屋尘螨提取物的生物效力。误差棒是指不同样品平均值的标准差。
图26示出了在用不同的pH处理后获得的冻干样品中,使用ELISA抑制方法测定的屋尘螨提取物的生物效力(获得IgE与天然提取物的结合的50%抑制所需的μg)。误差棒是指不同样品平均值的标准差。
图27示出了在用不同的碱处理后获得的冻干样品中,使用ELISA抑制方法测定的屋尘螨提取物的生物效力(获得IgE与天然提取物结合的50%抑制所需的μg)。误差棒是指不同样品平均值的标准差。
图28示出了用不同的碱处理的屋尘螨提取物的SDS。
图29示出了用不同的碱处理的屋尘螨提取物的蛋白质印迹。
本发明通过以下实施例进行说明,这些实施例详细说明了包含过敏原的提取物的制备、纯化和碱化方法。
方法A-C详细说明了用于制作过敏原提取物的方法。
方法
A.任选的过敏原原料脱脂方法
获得脱脂提取物。通常,将均质材料在丙酮中在3℃-5℃下脱脂,并过滤。重复该步骤直至丙酮透明。将脱脂材料回收并在室温下干燥,直至除去所有丙酮。
B.天然过敏原提取物的制备
将干燥的脱脂材料称重并在0.01M PBS/0.15M NaCl中以1:10的比例在磁力搅拌下在3℃-5℃下提取4小时。之后,将溶液在4℃下以10.000r.p.m离心30分钟。将所得上清液收集并储存在3℃-5℃下,并将沉淀重构于0.01M/NaCl 0.15M(1:10)中,并在磁力搅拌下在3℃-5℃下提取过夜。将溶液在3℃-5℃下以10.000r.p.m离心30分钟,并将上清液收集且与先前获得的级分混合。使用0.45μm孔径过滤合并的提取物,并在3kDa截止透析膜中广泛透析,直到电导率低于500μS/cm。然后使用0.22μm孔径对提取物进行过滤除菌。
C.脱色过敏原提取物的制备
使用以下程序进一步处理在水溶液中并维持在3℃-5℃的天然提取物。在磁力搅拌下,通过添加氢氧化钠、氢氧化锂、氢氧化钾、尿素、氢氧化铵或甲胺将溶液的pH调节至pH7-11,并在这些条件下维持15分钟。之后,将提取物在3.5kDa截止透析膜中针对10倍体积的纯化水在3℃-5℃下用纯化水透析大约17小时。在此时间段期间更换了4次纯化水。碱处理后,收集提取物并使用0.1M HCl将pH调节至7.3-7.4。最后将提取物无菌过滤至0.22μm,冷冻并冻干。
免疫学表征
蛋白质含量
按照制造商的说明,通过Lowry Biuret法测量天然和脱色提取物的蛋白质含量。
十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)
在还原条件下(样品与β-巯基乙醇孵育并在95℃下加热10分钟)在2.67%C、15%T丙烯酰胺-丙烯酰胺凝胶中通过SDS-PAGE鉴定蛋白质谱。样品和低分子量标准品(BioRadLaboratories,Hercules,加利福尼亚州,美国)在相同的凝胶中运行。将凝胶用0.1%考马斯亮蓝R-250(BioRad)染色。
免疫印迹
将电泳分离的蛋白质(通过SDS-PAGE)转移到PVDF膜(
主要过敏原定量
使用ELISA夹心法使用酶联免疫吸附测定试剂盒(Indoor Biotechnologies,弗吉尼亚州,美国)对主要过敏原进行定量。简而言之,将Nunc Maxisorp板(ThermoScientific,Waltham,马塞诸塞州,美国)用在碳酸盐/碳酸氢盐缓冲液(pH=9.6)中稀释的特异性单克隆抗体包被,并在4℃下孵育过夜。之后,用在PBS 0.01M-吐温0.05%中的BSA1%封闭板。然后,将样品和标准品以连续二分之一稀释度与在PBS 0.01M-吐温0.05%中的BSA 1%一起添加。添加特异性二级单克隆抗体(生物素化),并最终使用链霉亲和素。用硫酸终止后,在OD 450nm处测量与显色溶液(chromogen)的反应。通过最小二乘法使用4参数逻辑斯谛拟合获得标准曲线,其中将样品浓度内插以获得结果。
ELISA竞争(IgE)
比较了天然和脱色提取物抑制IgE与生物学标准化的每种内部参考制剂(IHRP)结合的能力。将Nunc板(Thermo Scientific)用抗IgE包被。将来自对过敏原敏感的患者的血清池在板中孵育。将样品和IHRP的稀释物与用过氧化物酶标记的过敏原一起孵育。将混合物添加至包被的板中并孵育。之后,添加显色溶液(chromogen),用硫酸终止,并测量在450nm处的光密度(OD)。
ELISA抑制(IgE)
使用天然提取物作为参考,通过ELISA抑制来测试提取物(天然脱色的)的体外过敏原活性,确立50%抑制点。将塑料微量滴定板(Immulon 4HBX;Thermo Scientific)用天然提取物(10μg蛋白质/ml)包被过夜。在Nunc F板(Thermo Scientific)中从天然脱色提取物制成1:2的连续稀释物。将每个稀释物在室温下与血清池一起孵育2小时。之后,将提取物的稀释物转移到天然包被的板上并孵育2小时。洗涤后添加100μl抗人IgE过氧化物酶,并在室温静置30分钟。洗涤后,将板显色(chromogen)30分钟并用硫酸(1N)终止。
薄层色谱(TLC)
植物类黄酮用作阳性对照。将对照和标准品施加在TLC铝片硅胶60F(Merck,达姆施塔特,德国)上。乙酸乙酯:甲酸:乙酸:水(100:11:11:27)用作洗脱液,并使用1%甲醇二苯硼酸-β-乙基氨基酯溶液、然后使用5%乙醇聚(乙二醇)-4000展开。
实施例
实施例1:梯牧草
根据方法步骤A至C获得脱色梯牧草提取物。
蛋白质含量
使用甲基铵pH 8处理后获得最大蛋白质含量(865μg蛋白质/mg冻干提取物),而最低含量对应于氢氧化钾pH 11处理(579μg蛋白质/mg冻干提取物)(表1)。跨所有pH的平均值为718μg蛋白质/mg冻干提取物。
最高的蛋白质含量对应于pH 8处理(平均值758μg蛋白质/mg冻干物),而最低的对应于pH 9(694μg蛋白质/mg冻干物)(表2)(图2)。在7至11之间的所有pH下,蛋白质含量高于天然提取物和在pH 6(这是样品的原始pH)下的样品(样品处理与脱色样品相同,但没有碱化pH变化)。
关于使用的不同碱,使用氢氧化锂获得最高的蛋白质含量(739μg蛋白质/mg冻干物),而使用尿素的情况下最低(668μg蛋白质/mg冻干物)(表3,图2)。
主要过敏原定量
最低水平对应于在pH 10下的氢氧化铵处理(13.0μg Phl p 5/mg冻干提取物)(表1)。最高水平对应于在pH 8下的氢氧化锂处理,其次是在pH 11下的氢氧化铵处理(分别为41.0和38.0μg Phl p 5/mg冻干提取物)。脱色样品的平均值为26.6μg Phl p 5/mg冻干提取物。
在pH 8下的处理中获得最高的主要过敏原含量(31.5μg Phl p 5/mg冻干提取物),而在pH 10下最低(23.2μg Phl p 5/mg冻干提取物)(图3,表2)。然而,所有用碱处理产生的主要过敏原含量均比天然提取物和在pH 6下的样品(未经处理)高。
在使用氢氧化钠处理中获得的主要过敏原含量最低(24.1μg Phl p 5/mg冻干提取物),而使用氢氧化钾最高(29.1μg Phl p 5/mg冻干提取物)(图4,表3)。
ELISA竞争(IgE)–生物效力
最高生物效力对应于用甲基铵pH 7和9处理的样品(分别为3052和2909HEPL/mg冻干提取物)(图5和6,表1)。最低值对应于用氢氧化钾的处理(平均值为984HEPL/mg冻干提取物),类似于天然提取物(952HEPL/mg)(表3)。可以检测到氢氧化铵与其他组(氢氧化钾P=0.010,图基检验(Tukey Test);尿素P=0.005,氢氧化钠P=0.012,以及氢氧化锂P=0.049,Mann-Whitney)之间的差异,但甲胺除外。甲胺与氢氧化钾之间也存在差异。脱色样品的平均值为1685HEPL/mg冻干提取物,高于用天然提取物和在pH 6下的样品(未经处理)获得的结果(分别为952和1262HEPL/mg冻干提取物)。
ELISA抑制(IgE)
达到50%抑制所需的冻干μg微克数显示与HEPL/mg值没有相关性(皮尔逊积差相关,P>0.050)。
与在pH 11和10下的处理相比,在pH 8下的50%抑制值显著高(分别为P=0.030和P=0.017,Mann-Whitney秩和检验)(图7,表2)。最低值对应于在pH11下的氢氧化钾(0.007μg),其次是在pH 11下的氢氧化铵(分别为0.020μg)(表1)。平均值为0.102μg,与天然提取物和在pH 6下的样品(分别为0.105和0.097μg)相似。
关于所用的碱,最高的50%抑制值对应于用尿素的处理(平均值为0.195μg)(图8,表3)。在甲胺处理中观察到最低值(平均值为0.066μg)。在尿素处理与甲胺、氢氧化铵、氢氧化锂、氢氧化钾和氢氧化钠之间检测到差异。
单项结果表格
按组分析的结果汇总
天然样品和未经处理的样品不存在标准差,因为只分析了一个样品。
SDS和蛋白质印迹
与天然提取物(梯牧草)相比,对所有脱色样品进行了SDS和蛋白质印迹。
所有电泳均在还原条件下,在15%T的丙烯酰胺凝胶中进行。所有泳道都加载有相同μg的冻干样品(25μg)。凝胶用考马斯R-250染色。将膜与呈递IgE至梯牧草(使用ELISA测定)的稀释1/5的患者血清池一起孵育。之后,将膜与α-IgE-PO一起孵育并使用化学发光显色。SDS结果示于图9中。蛋白质印迹示于图10中。
在11、37和31kDa(按强度顺序)处观察到天然提取物的最强条带。在脱色样品的SDS中观察到的最重要差异是随着pH的增加,高分子条带的强度降低,但这种影响只会导致条带强度降低,并且没有完全去除条带。
注意:已对梯牧草IHRP中的一些条带进行了测序。Phl p 5在37kDa条带中得到鉴定,Phl p 1在31kDa条带中得到鉴定,以及Phl p 2(或3)和6在12kDa条带中得到鉴定。这些过敏原在IUIS中报道的分子量略有不同:Phl p 5为32kDa,Phl p 1为27kDa,Phl p 2为10-12kDa,以及Phl p 6为11kDa。IUIS中描述的其他过敏原是Phl p 4和13,为55kDa;Phl p 7(钙结合蛋白),为6kDa;Phl p 11(Ole e 1相关),为20kDa;以及Phl p 12(前纤维蛋白),为14kDa。
此外,还进行了蛋白质印迹(图10)。天然提取物中最强的条带对应于37、31、59、15和12kDa(按强度顺序),这可分别对应于Phl p 5、Phl p 1、Phl p 4、Phl p 12和Phl p 2和6(最后两个在同一条带中)。没有观察到随着pH变化条带强度的重要差异。
总结
与天然和未处理的样品相比,在大多数碱性处理中(28个中的26个)蛋白质含量更高,证实了碱性处理对结果的影响。
关于主要过敏原含量,pH 8处理中Phl p 5水平更高。
关于ELISA竞争(REINA),虽然使用氢氧化铵处理呈现出更高的效力,但没有明显的取决于所用pH或碱处理的趋势。
关于ELISA抑制(IgE),最高值(50%抑制的μg)对应于pH 10和11。
蛋白质谱和过敏原谱未受不同pH处理或不同碱的显著影响。
总体结论
总体来说,用碱处理在蛋白质浓度和主要过敏原含量方面产生更好的结果。SDSPAGE中的蛋白质和主要过敏原谱不受碱性处理的影响。
根据方法步骤A至C获得脱色油橄榄提取物。
蛋白质含量
使用甲胺pH 9处理后获得最大蛋白质含量(862μg蛋白质/mg冻干提取物),而最低含量对应于氢氧化钠pH 10处理(441μg蛋白质/mg冻干提取物)。平均值为696μg蛋白质/mg冻干提取物(表4,图11和12)。
ELISA竞争(IgE)–生物效力
中值为302HEPL/mg冻干提取物。最高值对应于用氢氧化钠pH 8处理的样品(582HEPL/mg),而最低值对应于用甲胺pH 7处理的样品(128HEPL/mg)(表4)。
在pH 8的处理中观察到最高的生物效力(347HEPL/mg),而在pH 9的处理中观察到最低的生物效力(236HEPL/mg)(表5,图13)。
ELISA抑制(IgE)
达到50%抑制所需的冻干提取物的量与该提取物的效力成反比。达到50%抑制所需的冻干微克数与HEPL/mg值没有显著相关性(斯皮尔曼等级次序相关(Spearman RankOrder Correlation))。最低值对应于在pH 9下的尿素(0.043μg),而最高值是氢氧化锂pH10(0.132μg)(表4)。脱色样品的平均值为0.088μg。
在不同pH下获得的值非常相似(表5,图15)。使用不同的碱获得更大的差异。用氢氧化锂获得最高值(平均值0.108μg),而用尿素获得最低值(0.057μg)(表4,图16)。
单项结果表格
按组分析的结果汇总
天然样品和未经处理的样品不存在标准差,因为只获得了一个样品。
免疫印迹和SDS-PAGE
与天然提取物相比,对所有脱色样品进行了SDS和蛋白质印迹。
所有电泳均在还原条件下,在15%T的丙烯酰胺凝胶中进行。所有泳道都加载有相同量的冻干提取物(25μg)。凝胶用考马斯R-250染色。此外,将蛋白质印迹膜与呈递IgE至油橄榄(使用ELISA测定)的稀释1/5的患者血清池一起孵育。之后,将膜与α-IgE-PO一起孵育并使用化学发光显色。
在20和18kDa处观察到天然提取物的SDS中最强的条带(按强度顺序,图22)。在IHRP中,这两个条带都被鉴定为Ole e 1,即油橄榄的主要过敏原。还有10.5、42、48、73和89kDa的条带。IUIS中报告的其他过敏原是Ole e 2(前纤维蛋白,15kDa)、Ole e 3(polcalcin,9kDa)、Ole e 4(32kDa)、Ole e 5(16kDa)、Ole e 6(10kDa)、Ole e 7(nsLTP,9-10kDa)、Ole e 8(21kDa)、Ole e 9(46kDa)、Ole e 10(11kDa)和Ole e 11(39.4kDa)。
在脱色样品的SDS中观察到的最重要差异是在pH更碱性,尤其是在pH 11时高分子条带减少。然而,在用尿素处理的情况下,在pH为9时观察到。
此外,还进行了蛋白质印迹(图18)。天然提取物中最强的条带对应于19和17kDa(Ole e 1)。观察到的其他条带位于13、34、38、48和74kDa处。在用碱的处理中没有明显差异。然而,34和13kDa的条带在高pH下丢失(用尿素时为pH 9,用其他碱时为pH 10和11)。
薄层色谱
对所有样品进行薄层色谱,并将结果与天然样品进行比较。参考标准品(植物来源)也被用作技术对照。
结果示于图19中。在油橄榄样品中可以观察到多达五种不同的类黄酮。与脱色样品相比,在天然提取物中的信号强度更高。
总结
关于
总体上,在pH升高(pH 9-10),尤其是在用尿素处理时,
总体结论
1.总体来说,与天然的相比,用碱处理油橄榄提取物在蛋白质含量方面产生了更好的结果。
2.在高pH处理下,高分子量蛋白质(和过敏原)丢失,这意味着主要过敏原(具有更低的分子量)的富集。
实施例3:屋尘螨
根据方法步骤A至C获得脱色屋尘螨提取物。
蛋白质含量
用氢氧化铵pH 7处理后获得最大蛋白质含量(710μg蛋白质/mg冻干提取物),而最低含量对应于CH
与天然提取物相比,所有处理中的蛋白质含量均更高。
关于特定碱的使用,用氢氧化铵获得最高的蛋白质含量值,而NaOH处理呈现最低浓度(表9,图21)。
主要过敏原含量
Der p 1的最高水平对应于天然提取物(20.3μg Der p 1/mg冻干提取物),其次是pH 7和9(平均值分别为17.6和17.1μg Der p 1/mg冻干提取物)。脱色提取物的平均值为16.1μg Der p 1/mg冻干提取物(图22,表7和8)。
关于用不同碱的处理,用氢氧化铵和甲胺处理的样品的Der p 1水平最高(平均值分别为18.6和18.4μg Der p 1/mg冻干提取物)(图23,表9)。
ELISA竞争(IgE)
最高生物效力对应于在pH 7下用氢氧化铵处理的样品(707HEPL/mg冻干提取物)。最低值对应于用NaOH的处理(在pH 10和11下,分别为185.5和168.3HEPL/mg冻干提取物)(表7)。脱色样品的中值为356HEPL/mg冻干提取物(图29和30)。
ELISA抑制(IgE)
达到50%抑制所需的冻干微克数与HEPL/mg值成反比。
最低的50%抑制值对应于甲基铵pH 9,其次是天然提取物(分别为0.024和0.030μg,表7)。
在pH组之间没有观察到明显的差异(图26,表8)。关于所用的碱,最高的50%抑制值对应于用LiOH的处理(平均值为0.043μg)。在天然提取物、用氢氧化铵处理和在pH 6下的样品(未经处理)中观察到最低值(平均值分别为0.030、0.39和0.04)(图27,表9)。
单项结果表格
按组分析的结果汇总
天然样品和未经处理的样品不存在标准差,因为只获得了一个样品。
免疫印迹和SDS-PAGE
与天然提取物相比,对所有脱色样品进行了SDS和蛋白质印迹。
所有电泳均在还原条件下,在15%T的丙烯酰胺凝胶中进行。所有泳道都加载有相同μg的冻干物(35μg)。凝胶用考马斯R-250染色。进行免疫印迹,将蛋白质转移到膜上,之后将膜与呈递IgE至屋尘螨(使用ELISA测定)的稀释1/10的患者血清池一起孵育。之后,将膜与α-IgE-PO一起孵育并使用化学发光显色。
在31、28和15kDa处观察到天然提取物SDS中最强的条带(图35)。脱色样品的SDS中的蛋白质谱没有重要差异。
注意:对屋尘螨IHRP中的一些条带进行了测序。Der p 1和Der p 3在31kDa条带中得到鉴定,以及Der p 10和Der p 8在28kDa条带中得到鉴定。使用单克隆抗体α-Der p 2鉴定在15kDa处的Der p 2。
此外,进行了蛋白质印迹(图29)。天然提取物中最强的条带对应于15、28、37、46和60kDa。46kDa条带在脱色提取物中较弱。在一些情况下,60kDa的条带消失(碱性处理),而与天然提取物相比,80kDa的条带显现更强。
总结
关
关于
总体结论
1.与天然提取物相比,“脱色”提取物中的蛋白质含量更高。
2.高pH处理降低了免疫印迹中高分子量蛋白质的识别。
