类姜黄色素组合物
文献发布时间:2023-06-19 10:22:47
发明领域
本发明涉及包含类姜黄色素(curcuminoids)的组合物;特别地,本发明涉及高度水溶性的包含类姜黄色素的组合物。本发明还涉及用于提供这类组合物的方法和这类组合物的用途。
发明背景
在本说明书中对显然是先前出版的文件的列出或讨论不必一定认为是该对比文件是现有技术的组成部分或是公知常识。
姜黄和从姜黄中分离出的化合物,例如类姜黄色素,包括姜黄素,长期以来已被用于治疗多种疾病和病症。类姜黄色素是天然的黄-橙色色素和疏水性多酚,其来源于草药姜黄(Curcuma longa)的根茎。它们通常分离自香料和食用色素姜黄。
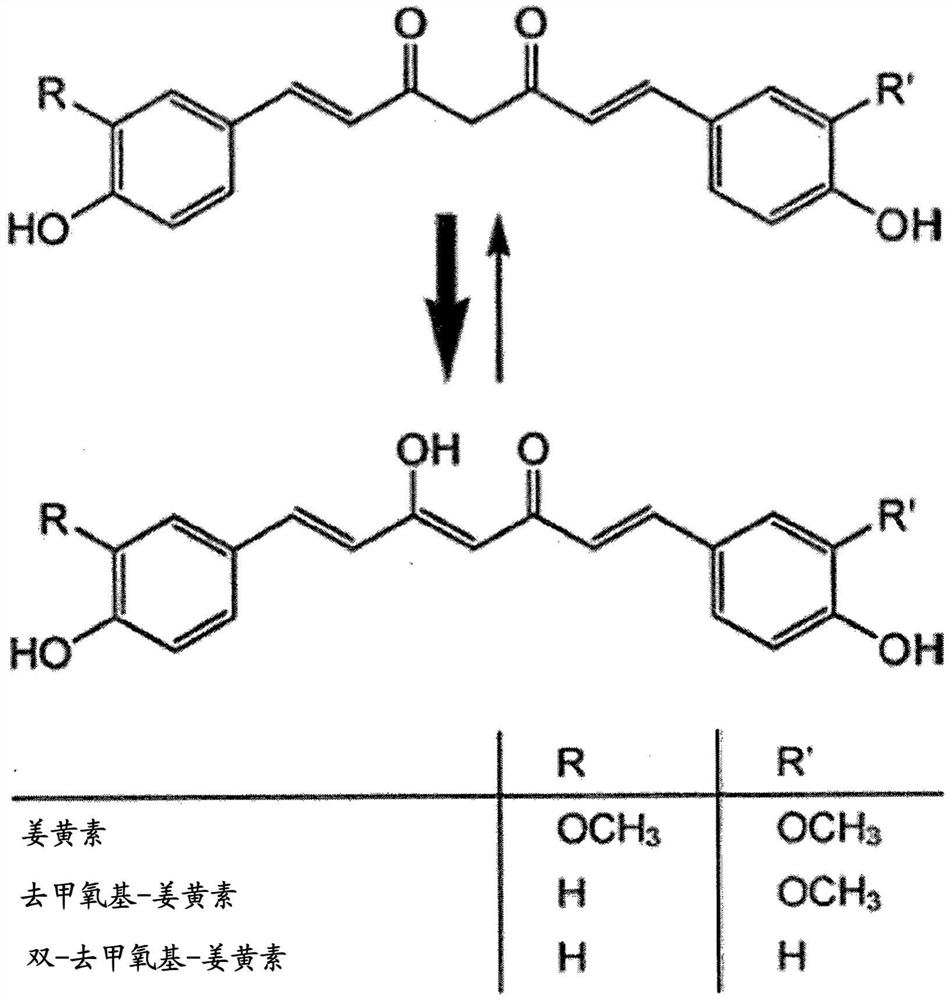
姜黄提取物包含约75-80%姜黄素、15-20%去甲氧基姜黄素(DMC)和0-10%双去甲氧基姜黄素(BDMC)(参见图1)。类姜黄色素具有独特的共轭结构,即双-α,β-不饱和β-二酮(通常称作双阿魏酰基甲烷),其显示出在酸性和中性溶液中具有主要的酮基形式并且在碱性介质中具有稳定的烯醇形式的酮-烯醇互变异构现象(Hoehle SI,Pfeiffer E,SólyomAM,Metzler M.Metabolism of curcuminoids in tissue slices and subcellularfractions from rat liver.J Agric Food Chem.2006年2月8日;54(3):756-64)。
虽然姜黄素能够赋予有价值的健康益处的确切机制尚不清楚,但在某些情况下,总体积极作用是相当明显的。
姜黄素是一种高度多效性分子,它于1949年首次被证明具有抗菌活性。从那时起,该多酚已被证明具有抗炎、降血糖、抗氧化、伤口愈合和抗微生物活性。在过去的三十年中,广泛的前期临床研究和临床试验表明,姜黄素对广泛的人体疾病具有治疗潜能(Gupta SC,Sung B,Kim JH,Prasad S,Li S,Aggarwal BB.Multitargeting by turmeric,thegoldenspice:From kitchen to clinic.Mol Nutr Food Res.2013年9月;57(9):1510-28)。
尽管姜黄素已显示出对多种人体疾病的功效,但由于吸收不良、代谢迅速和全身快速消除,因此,其生物利用度有限。
据报道,口服施用姜黄素时,血清水平低且组织分布有限和代谢迅速。例如,已证明即使口服剂量高达12g,姜黄素的血清水平也不会超过低微摩尔水平。在一项使用4-8g姜黄素的临床研究中,观察到的最大血清浓度为1.3μg/mL,而其他几种临床和动物研究则报道血清水平在更低的每毫升纳克范围内(Anand P,Kunnumakkara AB,Newman RA,AggarwalBB.Bioavailability of curcumin:problems and promises.Mol Pharm.2007年11月-12月;4(6):807-18)。
已发现姜黄素难溶于水。例如,据报道姜黄素在水性缓冲液(pH5.0)中的最大溶解度低至11ng/ml(
姜黄素在酸性pH值下相对稳定,但在中性pH值以上会迅速分解,并且形成阿魏酸和阿魏酰基甲烷(ferulloymethane),最后一个随后得到香草醛(FAO 2004.CURCUMINChemical and Technical Assessment(CTA)First draft prepared by IvanStankovic.Chemical and Technical Assessment 61st JECFA)。
姜黄素也表现出非常低的肠道吸收。在体外人肠道细胞模型中发现姜黄素的表观渗透系数极低(Papp值:0.1x 10
一旦被吸收,则姜黄素同时经历I期和II期代谢(参见图2)。
在I期代谢中,姜黄素及其两个去甲氧基同源物在肝脏以及肠粘膜中依次还原为二氢-、四氢-、六氢-和八氢-代谢物。在II期代谢中,姜黄素及其还原代谢物都与葡糖醛酸和硫酸酯结合,并且形成II期代谢物。
还原和结合显然是类姜黄色素的一般代谢途径,其发生在大鼠和人的肝和肠组织中。因此,几位作者认为,姜黄素在胃肠道以外的组织中引起的生物学效应更有可能是由于姜黄素代谢物引起的。
还证实姜黄素由肠微生物代谢(参见图3)。
发现姜黄素的微生物代谢包含两步还原,其中姜黄素依次通过NADPH-依赖性姜黄素/二氢姜黄素还原酶(CurA)被转化成二氢姜黄素,且然后转化成四氢姜黄素(Hassaninasab等人,2011)。
近期研究还报道,四羟基姜黄素、而非姜黄素可在大鼠组织中蓄积,这启示微生物群也可被视为姜黄素代谢和生物利用度的潜在作用物(Neyrinck AM,Alligier M,Memvanga PB,Névraumont E,Larondelle Y,Préat V,Cani PD,Delzenne NM.Curcumalonga extract associated with white pepper lessens high fat diet-inducedinflammation in subcutaneous adipose tissue.PLoS One.2013年11月19日;8(11):e81252)。
快速的代谢、差的水溶性、在中性pH下以及在暴露于光和/或氧气后的不稳定性和组织吸收差显著地限制了类姜黄色素的潜在用途,包括类姜黄色素、例如姜黄素在治疗病症例如癌症中的潜在用途。
几项I期和II期临床试验已证明,在具有结肠直肠瘤形成、晚期胰腺癌和乳腺癌的患者(无论是否接受进一步化疗)的患者中口服施用姜黄素的富有希望的疗效。更具体地,姜黄素在体外和体内均显示出抗黑素瘤的功效。
尽管姜黄素在多种癌症(包括黑色素瘤)中具有巨大的治疗潜能,但由于许多局限性特征,姜黄素的临床应用受到严重阻碍,这些特征包括:快速的代谢、差的水溶性、在中性pH下以及在暴露于光和/或氧气后的不稳定性和组织吸收差。上述特征极大地限制了姜黄素在治疗例如癌症中的潜在用途。
由于差的水溶性和吸收特性,典型地使用有机溶剂溶解类姜黄色素,例如姜黄素。例如,溶剂为例如二甲亚砜(DMSO)。然而,尽管使用这种溶剂有助于溶解姜黄素并改善其利用度,但是使用有机溶剂作为媒介物存在争议,并且是不期望的,特别是在消费者对天然成分的需求不断增加的时代。
辅助姜黄素的水溶性的另一种可能性通过乳化进行。然而,天然有机级乳化剂很少,而合成乳化剂、例如聚山梨醇酯80和天然乳化剂、例如基于淀粉的乳化剂典型地仅能够将低含量(<7%)的姜黄素分散在水中。
为解决上述缺点并改善姜黄素的治疗功效而探索的其他策略包括使用聚合物纳米颗粒、聚合物胶束和包括将姜黄素接枝到亲水聚合物上的方法。
本发明旨在解决上述与类姜黄色素在水中的溶解性差有关的问题,并提供一种包含类姜黄色素的组合物,该组合物既在水中是高度可溶性的,又在生理pH下是稳定的。
本发明的公开内容
组合物
本发明人惊奇地发现,包含占组合物重量至少约20%的类姜黄色素、阿拉伯胶和得自或可得自皂皮树属(quillaja)的提取物的组合物在水中是高度可溶性的并且在生理pH下是稳定的,其中该组合物包含具有平均直径为约100nm至约10000nm的颗粒。
本发明提供了组合物,其包含:
(i)占该组合物重量至少约20%的类姜黄色素;
(ii)阿拉伯胶;和
(iii)得自或可得自皂皮树属的提取物,
其中该组合物包含具有平均直径为约100nm至约10000nm的颗粒,例如约100nm至约700nm或约1000nm至约6000nm。
本发明还提供了组合物,其包含:
(iv)占该组合物重量至少约20%的类姜黄色素;
(v)阿拉伯胶;和
(vi)得自或可得自皂皮树属的提取物,
其中该组合物包含具有平均直径为约100nm至约700nm的颗粒。
这类组合物在下文中可以称作“本发明的组合物”。
本发明的组合物可以为乳液的形式,或本发明的组合物可以为固体形式,例如粉末形式。
如本文所用,术语“乳液”是指通过将两种通常不混合的液体混合而形成的一类胶体。典型地,液体之一包含另一种液体的分散液。
有时术语“胶体”和“乳液”可互换使用,但是当混合物的两相均为液体时,如本文所用,术语适用乳液。胶体中的颗粒可以为任何物质相。因此,乳液为一类胶体,但并非所有胶体均为乳液。
胶体溶液(有时称作胶体悬浮液)是一种混合物,其中物质均匀地悬浮在流体中。
一些本发明的组合物不含胡芦巴,例如,一些本发明的组合物不包含胡芦巴纤维(即得自或可得自胡芦巴的纤维)。
本发明的组合物可包含少量的多元醇和/或具有优选1或2个单糖单元的低分子量糖,例如小于组合物重量的5%或小于组合物重量的2.5%。或者,本发明的组合物可以不含多元醇和/或低分子量糖,例如具有1或2个单糖单元的那些,即一些组合物不包含任何多元醇和/或低分子量糖,例如具有1或2的单糖单元的那些。
在本发明的组合物中,所述颗粒可以具有约200nm、300nm、400nm、500nm、600nm、700nm、800nm、900nm、1000nm、1100nm、1200nm、1300nm、1400nm或1500nm至约9000nm、8000nm、7000nm、6000nm、5000nm、4000nm、3000nm或2000nm的平均直径,例如约1000nm至约6000nm的平均直径。这些颗粒还可以具有约200nm至约600nm或约300nm至约500nm或约400nm的平均直径。
例如,如果所述组合物为乳液形式,则该组合物可以例如包含具有约550nm至约700nm的平均直径的颗粒和具有约100nm至约250nm的平均直径的颗粒,得到约400nm的平均直径。
如果所述组合物为固体形式,例如粉末,则该组合物可以例如包含具有约1000nm至约6000nm、例如约2000nm至约4000nm的平均直径的颗粒。
本发明的组合物中的颗粒可以为胶束形式。
在本发明的组合物中,例如,如果组合物为固体形式,则可以使用这类本领域公知的技术形成颗粒,例如喷雾干燥。
形成颗粒后(例如,干燥后,例如喷雾干燥后后)。可以研磨和/或碾碎(例如球磨),得到更均匀的大小。
加载的姜黄素胶束的大小和形态通过动态光散射(DLS)、ζ-电位(Z-电位)和扫描电子显微镜(SEM)分析。对于DLS和ζ-电位分析,在(25±0.1℃)温度下,使用He/Ne激光(λ=633nm)在90°的固定散射角下,使用Zetasizer Nano ZS(NanoZS90,Malvern InstrumentLtd.,UK)。例如,可以通过以下实施例中定义的方法CQ-MO-304来测量颗粒的大小。
在本发明的组合物中,类姜黄色素可以得自任何来源。然而,优选类姜黄色素得自天然来源,即类姜黄色素不为合成的,而是基于植物的。
本发明的组合物可以包含占该组合物重量至少约25%的类姜黄色素或至少约30%的类姜黄色素。
例如,在本发明的组合物中,类姜黄色素可以以占组合物重量约20%至约60%、例如约25%至约50%或约28%至约48%的量存在。
可以通过从姜黄(Curcuma longa)的根(根茎)、含油树脂姜黄根、脱脂的含油树脂姜黄根及其混合物中提取和任选地纯化得到类姜黄色素,即(i)类姜黄色素可以为姜黄提取物或纯化的提取物的形式,其包含约30%至约100%类姜黄色素,例如约35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%或90%至约95%、90%、85%、80%、75%、70%、65%、60%、55%、50%或45%类姜黄色素,以提取物中总类姜黄色素的百分比为基准。
如果将类姜黄色素作为姜黄提取物提供,则可以使用基于醇的提取溶剂例如水/醇混合物或醇提取姜黄。例如,基于醇的提取溶剂可以为水/甲醇(即水和甲醇的混合物)或水/乙醇(即水和乙醇的混合物)或甲醇或乙醇。
如果提取溶剂包含水/醇混合物,则水与醇之比可以为约25:75至约1:99,例如约20:80至约5:95或约10:90。例如,提取溶剂可以为水/乙醇,两者之比为约25:75至约1:99,例如约20:80至约5:95或约10:90。
然后可以进一步纯化姜黄提取物,得到类姜黄色素的提取物,其包含约30%至约100%类姜黄色素,例如约35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%或90%至约95%、90%、85%、80%、75%、70%、65%、60%、55%、50%或45%类姜黄色素,以提取物中总类姜黄色素的百分比为基准。
可以使用本领域公知的这类技术进行提取物纯化。典型地,使用基于醇的溶剂例如100%甲醇或100%乙醇纯化提取物。
可以任选地干燥姜黄提取物,以除去任何过量的溶剂。
如果以如上述所定义的姜黄提取物的形式提供类姜黄色素,则所述组合物可以包含占该组合物重量约30%至约50%的姜黄提取物,例如约35%至约45%。例如,所述组合物可以包含占该组合物重量约35%(即35%)至约45%的姜黄提取物,其中所述姜黄提取物包含占该姜黄提取物重量约85%至约95%的类姜黄色素,提供的组合物包含占该组合物重量约30%(即30%)至约43%的类姜黄色素。
可以将类姜黄色素作为液体或粉末提供,例如粉末。例如,粉状姜黄提取物。
如本文所用,术语“类姜黄色素”包括姜黄素、去甲氧基姜黄素(DMC)和双去甲氧基姜黄素(BDMC)。例如,姜黄提取物可以包含约70%至约85%姜黄素(例如约75%至约80%)、约10%至约25%DMC(例如约15%至约20%)和约0%至约10%BDMC。
本发明的组合物中的阿拉伯胶可以以占组合物重量约40%至约65%的量存在,例如占组合物重量约50至约60%或占组合物重量约58%。
本发明的组合物中得自或可得自皂皮树属的提取物可以以占组合物重量约0.1%至约5%、例如占组合物重量约0.5%至约3%或约2%的量存在。
正如本领域技术人员可以理解的,如本文所用,术语“可得自”是指皂皮树属提取物可以得自皂皮树属(例如皂皮树(Quillaja Saponaria Molina))或可以从皂皮树属植物中分离,或者可以从其他来源获得,例如通过化学合成或酶促生产。而本文所用的术语“得自”是指提取物直接来源于皂皮树属植物。
本发明的组合物中得自或可得自皂皮树属的提取物可以包含占皂皮树属提取物重量至少50%的皂苷、例如至少60%的皂苷或至少65%的皂苷。例如,本发明的组合物中使用的皂皮树属可以包含占皂皮树属提取物重量约50%至约80%或约60%至约75%的皂苷。
本发明的方法中使用的得自或可得自皂皮树属的提取物可以为任意形式,例如液体或固体。例如,皂皮树属提取物可以为固体形式,例如粉末。
当存在于本发明的组合物中时,可以将皂皮树属水和/或其他溶剂,例如醇,添加到固体或液体皂皮树属中。例如,皂皮树属可以作为水溶液存在于本发明的组合物中。
本发明的组合物可以任选地包含植物和/或蔬菜油。例如,本发明的组合物可以包含选自椰子油,玉米油,棉籽油,橄榄油,棕榈油,花生油(花生油),菜籽油(包括低芥酸菜籽油),红花油,芝麻油,大豆油,向日葵油及其混合物的植物和/或蔬菜油。
本发明的组合物中存在的植物和/或蔬菜油可以以占组合物重量约1%至约20%植物和/或蔬菜油、例如约2.5%至约10%或约5%的量存在。
除非本文另有说明,否则所列的重量百分比基于得到的(干)组合物的总重。
为避免疑问,除非上下文另有指示,否则本发明的给定方面、特征或参数指示的偏好、选项、特定特征等应视为已经公开与本发明的相同或其他方面、特征和参数所指示的任何其他偏好、特定特征等结合使用。
如本文所用,术语“约”在指可测量值(例如反应混合物中特定成分的量或重量)时是指相对于指定量±20%、±10%、±5%、±1%、±0.5%或特别地为±0.1%的变化形式。例如,在本发明的组合物中有关成分百分比的±0.5%变化形式是指相对于给定的百分比0.5%的变化形式,即10%的±0.5%可以指9.5%至10.5%的变化。
本发明的组合物可以以固体或液体形式提供,优选固体形式,例如粉末。作为固体形式,应包括该化合物可以作为无定形固体或结晶或部分结晶固体形式提供。
本发明的组合物典型地为高度水溶性的和/或在pH为4或以上例如pH约4至约7下是稳定的。
所谓术语水溶性我们是指组合物的至少约50%、例如至少约60%、70%、80%、90%或95%在室温下、即在约25℃的温度下溶于水。
组合物和施用
根据本发明,本发明的组合物可以以如下形式提供:营养保健品(nutraceutical)制剂、用于人或动物的膳食或食品产品(例如功能性食品制剂,即食品、饮料、饲料或宠物食品或者食品、饮料、饲料或宠物食品补剂)、除草剂、营养补剂、香料或调味品、药物或兽药制剂、酿酒或化妆品制剂,或可以形成营养保健品制剂、用于人或动物的膳食或食品产品(例如功能性食品制剂,即食品、饮料、饲料或宠物食品或者食品、饮料、饲料或宠物食品补剂)、营养补剂、香料或调味品、药物或兽药制剂、酿酒或化妆品制剂的一部分。
例如,本发明提供了营养保健品制剂、用于人或动物的膳食或食品产品(例如功能性食品制剂,即食品、饮料、饲料或宠物食品或者食品、饮料、饲料或宠物食品补剂)、营养补剂、香料或调味品、药物或兽药制剂、酿酒或化妆品制剂,其由本发明的组合物组成,主要由本发明的组合物组成(即至少90%w/w的营养保健品制剂、用于人或动物的膳食或食品产品(例如功能性食品制剂,即食品、饮料、饲料或宠物食品或者食品、饮料、饲料或宠物食品补剂)、营养补剂、香料或调味品、药物或兽药制剂、酿酒或化妆品制剂为本发明的组合物,例如至少95%或99%或99.5%)或包含本发明的组合物。
本发明还提供了本发明的组合物在营养保健品制剂、用于人或动物的膳食或食品产品(例如功能性食品制剂,即食品、饮料、饲料或宠物食品或者食品、饮料、饲料或宠物食品补剂)、营养补剂、香料或调味品、药物或兽药制剂、酿酒或化妆品制剂中的用途。
如果本发明的组合物为如下形式:营养保健品制剂、用于人或动物的膳食或食品产品(例如功能性食品制剂,即食品、饮料、饲料或宠物食品或者食品、饮料、饲料或宠物食品补剂)、除草剂、营养补剂、香料或调味品、药物或兽药制剂、酿酒或化妆品制剂,或可以形成营养保健品制剂、用于人或动物的膳食或食品产品(例如功能性食品制剂,即食品、饮料、饲料或宠物食品或者食品、饮料、饲料或宠物食品补剂)、营养补剂、香料或调味品、药物或兽药制剂、酿酒或化妆品制剂的一部分,则可以任选地进一步包含药物/兽药成分,例如赋形剂或载体或(功能)食品可接受的成分及其混合物(如果适合)。
为了避免疑问,在本说明书中,当使用术语“包含”或“含有”时,我们是指所描述的提取物或组合物必须包含所列成分,但可以任选地包含其他成分。当我们使用术语“基本上由……组成”或“主要由……组成”时,我们是指所描述的提取物或组合物必须含有所列成分,并且还可以含有少量(例如,至多5%重量,或至多1%或0.1%重量)的其他成分,前提是任何其他成分均不影响该提取物或组合物的主要特性。当我们使用术语“由……组成”或“由……构成”时,我们是指所描述的提取物或组合物必须仅包含所列成分。
还旨在根据需要在整个申请中将术语“包含”或“含有”或“包括”替换为“由……组成”或“在于”或“主要由……组成”。
如本文所用,涉及的药学上可接受的赋形剂可以指本领域技术人员所公知的药学上可接受的佐剂、稀释剂和/或载体。
食品可接受的成分包括本领域公知的那些成分(包括本文中也称作药学上可接受的赋形剂的那些),并且可以为天然的或非天然的,即其结构可以天然存在或不存在。在某些情况下,它们可以来源于天然化合物或随后被修饰(例如麦芽糖糊精)。
所谓“药学上/营养保健上(nutraceutically)可接受的”,我们是指组合物的其他成分为无菌的且无热原的。从与本发明的组合物相容的意义上讲,这样的成分也必须是“可接受的”,并且对其接受者无害。因此,“药学上可接受的”包括用于形成制剂的一部分的任何化合物,其仅旨在仅充当赋形剂,即预期本身不具有生物活性。因此,药学上可接受的赋形剂通常是安全的,无毒的,并且在生物学和其他方面都不是不期望的。
如果本发明的组合物形成营养保健品制剂、用于人或动物的膳食或食品产品(例如功能性食品制剂,即食品、饮料、饲料或宠物食品或者食品、饮料、饲料或宠物食品补剂)、营养补剂、香料或调味品、药物或兽药制剂、酿酒或化妆品制剂的一部分,则本发明的组合物以占营养保健品制剂、用于人或动物的膳食或食品产品(例如功能性食品制剂,即食品、饮料、饲料或宠物食品或者食品、饮料、饲料或宠物食品补剂)、营养补剂、香料或调味品、药物或兽药制剂、酿酒或化妆品制剂重量约1至约99%的量存在于营养保健品制剂、用于人或动物的膳食或食品产品(例如功能性食品制剂,即食品、饮料、饲料或宠物食品或者食品、饮料、饲料或宠物食品补剂)、营养补剂、香料或调味品、药物或兽药制剂、酿酒或化妆品制剂中,例如占营养保健品制剂、用于人或动物的膳食或食品产品(例如功能性食品制剂,即食品、饮料、饲料或宠物食品或者食品、饮料、饲料或宠物食品补剂)、营养补剂、香料或调味品、药物或兽药制剂、酿酒或化妆品制剂重量的约10%、20%、30%、40%、50%、60%、70%、80%或90%至约90%、80%、70%、60%、50%、40%、30%或20%。
施用
本领域技术人员将要理解,本发明的组合物,其中该组合物为营养保健品制剂、用于人或动物的膳食或食品产品(例如功能性食品制剂,即食品、饮料、饲料或宠物食品或者食品、饮料、饲料或宠物食品补剂)、营养补剂、香料或调味品、药物或兽药制剂、酿酒或化妆品制剂的形式,或其中营养保健品制剂、用于人或动物的膳食或食品产品(例如功能性食品制剂,即食品、饮料、饲料或宠物食品或者食品、饮料、饲料或宠物食品补剂)、营养补剂、香料或调味品、药物或兽药制剂、酿酒或化妆品制剂包含本发明的组合物,营养保健品制剂、用于人或动物的膳食或食品产品(例如功能性食品制剂,即食品、饮料、饲料或宠物食品或者食品、饮料、饲料或宠物食品补剂)、营养补剂、香料或调味品、药物或兽药制剂、酿酒或化妆品制剂可以通过任意适合的途径施用于患者或受试者(例如人或动物患者或受试者),所述任意适合的途径例如通过口服、直肠、鼻部、肺、口含、舌下、透皮、颅内、腹膜内和肠胃外(包括皮下、肌内、鞘内、静脉内和皮内)途径。
特别地,本发明的组合物和营养保健品制剂、用于人或动物的膳食或食品产品(例如功能性食品制剂,即食品、饮料、饲料或宠物食品或者食品、饮料、饲料或宠物食品补剂)、营养补剂、香料或调味品、药物或兽药制剂、酿酒或化妆品制剂可以通过口服施用。在这类情况中,可以将本发明的药物组合物专门配制成用于通过口服途径施用。
用于口服施用的药物制剂包括固体剂型,例如硬或软胶囊,片剂,药片,糖锭剂,丸剂,锭剂,粉末和颗粒。如果适合,则可以用包衣衣料例如肠溶衣制备它们,或可以根据本领域众所周知的方法配制它们,以便得到活性成分的控释,例如缓释或延长释放。
用于口服施用的液体剂型包括溶液,乳液,基于水或油状/油的悬浮液,糖浆剂和酏剂。
本文所述的营养保健品制剂、用于人或动物的膳食或食品产品(例如功能性食品制剂,即食品、饮料、饲料或宠物食品或者食品、饮料、饲料或宠物食品补剂)、营养补剂、香料或调味品、药物或兽药制剂、酿酒或化妆品制剂,例如预期用于口服施用的那些可以根据本领域技术人员公知的方法制备,例如通过将组合物的成分制成混合物。
这类如本文所述的营养保健品制剂、用于人或动物的膳食或食品产品(例如功能性食品制剂,即食品、饮料、饲料或宠物食品或者食品、饮料、饲料或宠物食品补剂)、营养补剂、香料或调味品、药物或兽药制剂、酿酒或化妆品制剂可以包含一种或多种另外的成分,其选自食品成分,例如甜味剂、矫味剂、着色剂和防腐剂。片剂可以包含活性成分与适合于制备片剂的无毒性药学上可接受的赋形剂(或成分)的混合物。这些赋形剂(或成分)可以为,例如:惰性稀释剂,例如碳酸钙、碳酸钠、乳糖、磷酸钙或磷酸钠;制粒剂和崩解剂,例如玉米淀粉、麦芽糖糊精或藻酸;粘合剂,例如,淀粉、明胶或阿拉伯胶;和润滑剂,例如硬脂酸镁、硬脂酸或滑石粉。片剂可以为未包衣的或可以通过公知技术给它们包衣以延迟在胃肠道中崩解和吸收,且由此在延长期限内提供持续作用。例如,可以使用延时材料,例如单硬脂酸甘油酯或二硬脂酸甘油酯。
适合的药用载体包括惰性固体稀释剂或填充剂,无菌水溶液和各种有机溶剂。固体载体的实例为乳糖,白陶土,蔗糖,环糊精,麦芽糖糊精,滑石粉,明胶,琼脂,果胶,阿拉伯胶,硬脂酸镁,硬脂酸,阿拉伯胶,改性淀粉和纤维素的低级烷基醚。液体载体的实例为糖浆,花生油,橄榄油,磷脂,脂肪酸,脂肪酰胺,聚氧乙烯和水。此外,载体或稀释剂可以包括本领域已知的任何缓释材料,例如单硬脂酸甘油酯或二硬脂酸甘油酯,其单独地或与蜡混合。
根据疾病和待治疗的患者以及施用途径的不同,本发明的组合物可以以不同的剂量施用(即治疗有效剂量,对有此需要的患者施用)。在这方面,本领域技术人员将理解,在本发明的上下文中,施用于哺乳动物、特别是人的剂量应足以在合理的时间期限内在哺乳动物中产生治疗反应。本领域技术人员将认识到,确切剂量和制剂以及最适合的递送方案的选择还将特别地受到制剂的药理特性,所治疗病症的性质和严重程度以及物理病症,接受者的精神敏度,以及特定化合物的功效,待治疗患者的年龄,病情,体重,性别和反应以及疾病的阶段/严重程度的影响。
典型地,施用本发明的组合物或营养保健品制剂、用于人或动物的膳食或食品产品(例如功能性食品制剂,即食品、饮料、饲料或宠物食品或者食品、饮料、饲料或宠物食品补剂)、营养补剂、香料或调味品、药物或兽药制剂、酿酒或化妆品制剂,以提供约100mg/天至约2000mg/天、或约500mg/天至约1500mg/天或约1000mg/天、例如约300mg/天至约1000mg/天的量的类姜黄色素。例如,该组合物或营养保健品制剂、用于人或动物的膳食或食品产品(例如功能性食品制剂,即食品、饮料、饲料或宠物食品或者食品、饮料、饲料或宠物食品补剂)、营养补剂、香料或调味品、药物或兽药制剂、酿酒或化妆品制剂可以提供约1至约10mg/kg体重、例如约2.5至约7.5mg/kg体重或约5mg/kg的量的类姜黄色素。
在任何情况下,医务工作者或其他技术人员将能够例行确定对于个体患者而言最适合的实际剂量。上述剂量是一般情况的示例;当然,在个别情况下,应使用更高或更低的剂量范围,且这也在本发明的范围内。
用于制备本发明的组合物的方法
本发明提供了用于制备如上述所定义的本发明的组合物的方法,其中该方法包括下列步骤:
(i)制备类姜黄色素的水溶液;
(ii)混合来自(i)的水溶液与阿拉伯胶水溶液和得自或可得自皂皮树属的提取物和任选的植物和/或蔬菜油,得到乳液;和任选地
(iii)干燥(ii)的产物,得到包含颗粒的组合物,所述颗粒具有约100nm至约10000nm、例如约100nm至约700nm或约1000nm至约6000nm的平均直径。
例如,本发明提供了用于制备如上述所定义的本发明的组合物的方法,其中该方法包括下列步骤:
(i)制备类姜黄色素的水溶液;
(ii)混合来自(i)的水溶液与阿拉伯胶水溶液和得自或可得自皂皮树属的提取物和任选的植物和/或蔬菜油,得到乳液;和
(iii)干燥(ii)的产物,得到包含颗粒的组合物,所述颗粒具有约100nm至约10000nm、例如约100nm至约700nm或约1000nm至约6000nm的平均直径。
这类方法在下文中称作本发明的方法。
在本发明的方法中,可以将阿拉伯胶的水溶液与类姜黄色素的水溶液混合,然后与得自或可得自皂皮树属的提取物和任选的植物和/或蔬菜油混合,即本发明的方法可以包括:
(i)制备类姜黄色素的水溶液;
(ii)混合来自(i)的水溶液与阿拉伯胶水溶液;
(iii)混合得自或可得自皂皮树属的提取物和任选的植物和/或蔬菜油与(ii)的产物,得到乳液;和任选地
(iv)干燥(iii)的产物(例如通过喷雾干燥),得到包含颗粒的组合物,所述颗粒具有约100nm至约10000nm、例如约100nm至约700nm或约1000nm至约6000nm的平均直径。
干燥(例如喷雾干燥)后,可以研磨和/磨碎(例如球磨)颗粒,得到更均匀的大小。
在本发明的方法中,所述颗粒具有约200nm、300nm、400nm、500nm、600nm、700nm、800nm、900nm、1000nm、1100nm、1200nm、1300nm、1400nm或1500nm至约9000nm、8000nm、7000nm、6000nm、5000nm、4000nm、3000nm或2000nm的平均直径,例如约1000nm至约6000nm的平均直径。所述颗粒还可以具有约200nm至约600nm或约300nm至约500nm或约400nm的平均直径。
例如,如果本发明的组合物为乳液形式(即干燥步骤前),则该组合物可以包含具有约550nm至约700nm平均直径的颗粒和具有约100nm至约250nm平均直径的颗粒,得到约400nm的平均直径。
如果所述组合物为固体形式,例如粉末(即干燥步骤后),该组合物可以包含具有约1000nm至约6000nm、例如约2000nm至约4000nm平均直径的颗粒。
本发明中的颗粒可以为胶束形式。
在本发明的方法中,存在于类姜黄色素水溶液中的类姜黄色素相对于本发明的组合物可以为如上述所定义的任何来源。
典型地,在本发明的方法中,类姜黄色素可以具有占类姜黄色素来源重量约5%至约100%的纯度(基于总类姜黄色素),即姜黄或类姜黄色素提取物可以包含约30%至约100%类姜黄色素,例如约35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%或90%至约95%、90%、85%、80%、75%、70%、65%、60%、55%、50%或45%类姜黄色素,以提取物中总类姜黄色素的百分比为基准。
在本发明的方法中,类姜黄色素可以以约2:1(类姜黄色素:水)至约4:1、例如约3:1的重量比与水混合,得到类姜黄色素的水溶液。
典型地,在本发明的方法中,水溶液中类姜黄色素的重量浓度可以为约1%至约95%、例如约5%至约80%或约7%至约40%。
在本发明的方法中,可以通过以约2:1至约4:1、例如约3:1的阿拉伯胶:水之比混合阿拉伯胶与水制备阿拉伯胶水溶液。
阿拉伯胶水溶液可以具有约30%至约70%、例如约40%至约60%的阿拉伯胶重量浓度。
典型地,可以使用搅拌混合类姜黄色素水溶液和拉伯胶水溶液。
在本发明的方法中,植物和/或蔬菜油可以来自任何植物和/蔬菜来源。例如,植物和/或蔬菜油可以为向日葵油。
典型地,在本发明的方法中,植物和/或蔬菜油可以以约1%至约10%植物和/或蔬菜油、例如约2.5%至约7.5%或约5%的量存在。
在本发明的方法中,得自或可得自皂皮树属的提取物可以如上述有关本发明的组合物的方面所定义。
用于本发明的方法的得自或可得自皂皮树属的提取物可以为任意形式,例如液体或固体。例如,皂皮树属提取物可以以固体形式使用,例如粉末。
典型地,在本发明的方法中,皂皮树属可以以约0.5%至约5%皂皮树属、例如约1%至约3%或约2%的量存在。
在本发明的方法中,可以使用搅拌混合植物和/或蔬菜油和皂皮树属提取物。
如上述所定义混合类姜黄色素水溶液、阿拉伯胶水溶液、植物和/或蔬菜油和皂皮树属得到乳液。
可以使用本领域公知的这类技术干燥得到的乳液,得到包含颗粒(例如胶束)的组合物,所述颗粒具有约200nm、300nm、400nm、500nm、600nm、700nm、800nm、900nm、1000nm、1100nm、1200nm、1300nm、1400nm或1500nm至约9000nm、8000nm、7000nm、6000nm、5000nm、4000nm、3000nm或2000nm的平均直径,例如约1000nm至约6000nm的平均直径。所述颗粒还可以具有约100nm至约700nm或约200nm至约600nm、例如约300nm至约500nm或约400nm的平均直径。典型地,喷雾干燥所述乳液。
本发明的方法可以任选地包括根据需要除去额外的溶剂的步骤,以便得到基本上干燥的产品,即可以除去至少90%、例如至少95%或99%的存在的水的产品。
方法和用途
本发明的组合物的高水溶性和稳定性意味着本发明的组合物可用于改善类姜黄色素在哺乳动物中的生物可给性(bioaccessibility)、生物利用度、生物功效和/或生物活性。
类姜黄色素在哺乳动物中的生物可给性、生物利用度、生物功效和/或生物活性能够使得本发明的组合物用于预防和/或治疗其中在过去类姜黄色素的水溶性和稳定性差成为问题的疾病。
因此,本发明提供了一种用于改善哺乳动物中类姜黄色素的生物可给性、生物利用度、生物功效和/或生物活性的方法,其包括以如前定义的本发明的组合物的形式施用所述类姜黄色素。
该方法在下文中可以称作“本发明的方法”。
本发明还提供了如上述所定义的本发明的组合物在改善哺乳动物中类姜黄色素的生物可给性、生物利用度、生物功效和/或生物活性中的用途。
该用途在下文中可以称作“本发明的用途”。
在本文所述的方法或用途中,类姜黄色素在哺乳动物中的生物可给性、生物利用度、生物功效和/或生物活性的改善可以归因于该组合物提供了改善的类姜黄色素的胃肠道抵抗性和/或改善的肠细胞对类姜黄色素的吸收性和/或改善的血液循环。
在本文所述的方法或用途中,类姜黄色素在哺乳动物中的生物可给性、生物利用度、生物功效和/或生物活性的改善可以归因于该组合物提供了改善的水溶性和/或在pH约4至约7下改善的稳定性。
因此,本发明提供了一种用于改善类姜黄色素的水溶性和/或pH稳定性的方法,其中该方法包括以如前定义的本发明的组合物的形式施用所述类姜黄色素。
本发明还提供了如前定义的组合物在改善类姜黄色素的水溶性和/或pH稳定性中的用途。
在本文所述的方法或用途中,类姜黄色素可以选自姜黄素及其I期或II期代谢物,去甲氧基姜黄素及其I期或II期代谢物,双去甲氧基姜黄素及其I期或II期代谢物及其混合物。例如,I期和/或II期代谢物可以选自姜黄素葡糖苷酸、硫酸姜黄素、DMC葡糖苷酸、硫酸DMC、BDMC葡糖苷酸、硫酸BDMC、四氢姜黄素(THC)、THC葡糖苷酸、硫酸THC、六氢姜黄素(HHC)、HHC葡糖苷酸、硫酸HHC及其混合物。
在本文所述的组合物、方法或用途中,类姜黄色素可以为未代谢的形式,例如未经过葡糖苷酸或硫酸酯加成的姜黄素、DMC和BDMC的形式。
在本文所述的方法和用途中,所述哺乳动物可以为人。
如本文所用,术语“生物利用度”可以定义为在作用位点处可用于正常生理功能的摄入成分的百分比,并通过体内测定法测定(Guerra A,Etienne-Mesmin L,Livrelli V等人(2012)Relevance and challenges in modeling humangastric and smallintestinal digestion.Trends Biotechnol 30:591-600)。生物利用度是三个主要步骤的结果:成分在胃肠道中的消化率和溶解度;成分被肠细胞吸收并转运到循环中;以及从循环中结合到功能实体或靶标中(Wienk KJH,Marx JJM,Beynen AC(1999)The concept ofiron bioavailability and its assessment.Eur J Nutr 38:51-75;Etcheverry P,Grusak MA,Fleige LE(2012)Application of in vitro bioaccessibility andbioavailability methods for calcium,carotenoids,folate,iron,magnesium,polyphenols,zinc,and vitamins B6,B12,D,and E.Front Physiol 3:1-21)。
如本文所用,术语“生物可给性”可以定义为在胃肠道内从其食物基质释放并因此可用于肠吸收的化合物的分数(典型地由体外方法确定)。它包括食品消化过程中发生的一系列事件,以转化为潜在的生物可利用材料,但不包括通过上皮组织的吸收/同化和系统前代谢(肠和肝)。(Alegría A.,Garcia-Llatas G.,Cilla A.(2015)Static DigestionModels:General Introduction.In:Verhoeckx K.等人(eds)The Impact of FoodBioactives on Health.Springer,Cham)
如本文所用,术语“生物活性”可以定义为营养物或生物活性化合物如何运输并到达靶组织,其如何与生物分子相互作用,其可能经历的代谢或生物转化以及生物标志物的产生和诱发的生理反应(Alegría A.,Garcia-Llatas G.,Cilla A.(2015)StaticDigestion Models:General Introduction.:Verhoeckx K.等人(eds)The Impact ofFood Bioactives on Health.Springer,Cham)。
附图简述
图1-来自姜黄的类姜黄色素的化学结构。
图2-姜黄素的I期和II期代谢物。
图3-姜黄素的细菌代谢物。
图4-pH对溶于去离子水(0.4%)的本发明的组合物颜色的影响。
图5-加载的本发明的组合物的DLS分布图。
图6-不同pH下的本发明的组合物的Z-电位和组合物的各个成分。
图7-本发明的组合物在x300下的扫描电子显微镜(SEM)图像。
图8-本发明的组合物在x1300下的扫描电子显微镜(SEM)图像。
图9-本发明的组合物在x9200下的扫描电子显微镜(SEM)图像。
图10-温育4h后,对从用来源于不同胃肠道隔室的样品处理的Caco-2细胞中采集的顶端上清液测定的LDH活性,数据来自标准姜黄素提取物。条形图表示平均值±SEM。PP:纯产品;SI:小肠;ST:胃;TB:运输缓冲液。(*)、(**)和(***)分别相当于与TB+结肠48h相比p<0.05、p<0.01和p<0.001的显著性。
图11-温育4h后,对从用来源于不同胃肠道隔室的样品处理的Caco-2细胞中采集的顶端上清液测定的LDH活性,其中数据对TB+结肠48h样品(100%)校准。条形图表示平均值±SEM。PP:纯产品;SI:小肠;ST:胃;TB:运输缓冲液。(*)、(**)和(***)分别相当于与TB+结肠48h相比p<0.05、p<0.01和p<0.001的显著性。
图12-温育4h后,对从用来源于不同胃肠道隔室的样品处理的Caco-2细胞中采集的顶端上清液测定的LDH活性,数据来自姜黄磷脂复合物(phytosome)制剂。条形图表示平均值±SEM。PP:纯产品;SI:小肠;ST:胃;TB:运输缓冲液。(*)、(**)和(***)分别相当于与TB+结肠48h相比p<0.05、p<0.01和p<0.001的显著性。
图13-温育4h后,对从用来源于不同胃肠道隔室的样品处理的Caco-2细胞中采集的顶端上清液测定的LDH活性,数据来自姜黄磷脂复合物制剂,其中数据对TB+结肠48h样品(100%)校准。条形图表示平均值±SEM。PP:纯产品;SI:小肠;ST:胃;TB:运输缓冲液。(*)、(**)和(***)分别相当于与TB+结肠48h相比p<0.05、p<0.01和p<0.001的显著性。
图14-温育4h后,对从用来源于不同胃肠道隔室的样品处理的Caco-2细胞中采集的顶端上清液测定的LDH活性,数据来自基于皂皮树属的制剂。条形图表示平均值±SEM。PP:纯产品;SI:小肠;ST:胃;TB:运输缓冲液。(*)、(**)和(***)分别相当于与TB+结肠48h相比p<0.05、p<0.01和p<0.001的显著性。
图15-温育4h后,对从用来源于不同胃肠道隔室的样品处理的Caco-2细胞中采集的顶端上清液测定的LDH活性,数据来自基于皂皮树属的制剂,其中数据对TB+结肠48h样品(100%)校准。条形图表示平均值±SEM。PP:纯产品;SI:小肠;ST:胃;TB:运输缓冲液。(*)、(**)和(***)分别相当于与TB+结肠48h相比p<0.05、p<0.01和p<0.001的显著性。
图16-在相同时间点处死的小鼠组在适应期和习惯期的食物摄入量的演变。在适应期(J0-J7)和习惯期(J8-J14)期间,不同实验组的平均每日食物摄入量(g)。
图17-在相同时间点处死的小鼠组在适应期和习惯期的体重演变。在相同时期内不同实验组的平均体重(g)。数据表示为平均值±SEM。
图18-单次口服剂量的姜黄磷脂复合物制剂后相对于包含300mg/kg类姜黄色素的标准姜黄提取物在小鼠血浆中的总类姜黄色素水平(姜黄素、DMC、BDMC及其相应代谢物姜黄素葡糖苷酸和硫酸姜黄素、DMC葡糖苷酸和硫酸DMC、BDMC葡糖苷酸和硫酸BDMC、THC、THC葡糖苷酸和硫酸THC、HHC、HHC葡糖苷酸和硫酸HHC的总和)的时程。*、**、***:姜黄磷脂复合物制剂在每个时间点均与标准姜黄提取物存在显著性差异(因果t-检验)(分别为p<0.05,p<0.01,p<0.001)。
图19-单次口服剂量的本发明的方法/用途中使用的组合物后相对于包含300mg/kg类姜黄色素的标准姜黄提取物在小鼠血浆中的总类姜黄色素水平(姜黄素、DMC、BDMC及其相应代谢物姜黄素葡糖苷酸和硫酸姜黄素、DMC葡糖苷酸和硫酸DMC、BDMC葡糖苷酸和硫酸BDMC、THC、THC葡糖苷酸和硫酸THC、HHC、HHC葡糖苷酸和硫酸HHC的总和)的时程。*、**、***:作为在本发明的方法/用途中使用的组合物在每个时间点均与标准姜黄提取物存在显著性差异(因果t-检验)(分别为p<0.05,p<0.01,p<0.001)。
图20:作为消耗不同制剂(n=72/制剂)后时间(h)函数的总类姜黄色素和代谢物(姜黄素、DMC、BDMC及其相应代谢物姜黄素葡糖苷酸和硫酸姜黄素、DMC葡糖苷酸和硫酸DMC、BDMC葡糖苷酸和硫酸BDMC、THC、THC葡糖苷酸和硫酸THC、HHC、HHC葡糖苷酸和硫酸HHC的总和)浓度(ppm)。
图21-不同制剂的曲线AUC(0-8h)下的相应面积。
图22-不同制剂的曲线AUC(0-∞)下的相应面积。
图23-不同制剂的Cmax(在Tmax下的浓度)。
图24-对ITT人群的AUC
图25-对ITT人群的AUC
图26-对ITT人群的AUC
图27-ITT人群的AUC
图28-ITT人群的AUC
图29-ITT人群的AUC
图30-对ITT人群的标准化的Cmax的图形表示。
图31-ITT人群的Cmax的图形表示。
图32-对ITT人群的0-24小时的生物利用度的图形表示。
图33-对ITT人群的0-8小时的生物利用度的图形表示。
图34-对ITT人群的0至无穷大的相对生物利用度的图形表示。
图35-ITT人群的半衰期的图形表示。
图36-对ITT人群的末端消除速率的图形表示。
图37-ITT人群的Tmax的图形表示。
实施例
通过参考以下非限制性实施例将进一步描述本发明。
实施例1-姜黄素碱性有机溶液的制备
使用有机纯化的类姜黄色素提取物(至少10%、但优选95%纯度(总类姜黄色素))在蒸馏水(3个体积的粉末重量/水)制备类姜黄色素在水中的混合物。
实施例2-本发明的组合物的制备
使用蒸馏水(3个体积的粉末重量/水)制备58%阿拉伯胶混合物(底物)。在搅拌下(5000rpm)向500ml阿拉伯胶水溶液中加入如实施例1中制备的500ml类姜黄色素溶液,向其中加入5%有机向日葵油和以皂苷标准化的2%有机皂皮树属。
将得到的混合物在5000rpm下搅拌10分钟。然后将得到的乳液喷雾干燥。
实施例3-本发明的组合物的表征
通过动态光散射(DLS)、ζ电位(Z-电位)和扫描电子显微镜(SEM)分析本发明的组合物的大小和形态。对于DLS和ζ电位分析,在(25±0.1℃)温度下,使用He/Ne激光(λ=633nm)在90°的固定散射角下,使用Zetasizer Nano ZS(NanoZS90,Malvern InstrumentLtd.,UK)。
所用样品为液体乳液形式(干燥前的最后一步)。将样品以0.4%的体积浓度悬浮在软化水中,并施加1分钟的超声。立即对这些样品进行DLS分析(测量时间=60秒)。在大的pH范围(2-11)内进行ζ-电位分析。
通过使用0.1M HCl和0.1M NaOH溶液如下制备样品并在不同的pH下进行分析。将获得的10个样品(pH=2、3、4、5、6、7、8、9、10和11)保存在室温(23℃)下(图4)。
如图4中所示,本发明的组合物在水中的颜色由pH值驱动。当pH范围从酸到中性(从2到7)变化时,酮基形式(黄色)是溶液中的主要形式。在pH 8和9时,溶液颜色变成橙色,而在pH 10和11时,半透明的淡红色为主。颜色变化归因于pH值增加驱动的姜黄素分子的羟基的依次去质子化,从而使姜黄素具有更高的溶解度和不稳定性。
DLS分析结果如图5中所示。存在两组粒径大小的个体。其中一个集中在616±160nm(占总个数的20.8%),且最有意义的一个集中在188±42nm(占总个数的79.2%)。
水溶液(pH 5.4)中负载的姜黄素的平均流体动力学粒径为476.5nm,其中PDI(多分散性指数)为0.337。
图6显示了在不同pH(2至11)下本发明的组合物的Z-电位。Z-电位越高,则混合物越不稳定。本发明的组合物在pH 2至pH 11之间具有负Z-电位。颗粒在水相中带负电。在pH值为2时,Z-电位接近0(等电点:pH值为零)时,在此处我们有一个乳液的不稳定性区。在pH2至pH 4之间,Z-电位相对较低(<25mV),并且在pH大于或等于4时,样品进入稳定区。在pH值为5时,这种稳定性得到了强有力的证实。在pH值8.0中观察到了等电点的快速变化,在2至7的pH值范围内,负载的姜黄素的ζ电位令人惊讶地更高。在pH值<4.0的水相中,负载的姜黄素通常处于最低的表面能状态。在pH 8.0时,负载的姜黄素很可能使低电荷的一面朝向阿拉伯胶,并使高电荷的一面暴露于与水相互作用,从而导致ζ-电位升高。
图6清楚地显示当将所要求保护的组合物分散在pH大于4的水溶液中时,该组合物为稳定的。
实施例4-使用CQ-MO-304的本发明的组合物的粒度分布(PSD)
材料和试剂
材料-来自Malvern Instrument的Mastersizer 3000或等效物;
-Hydro 2000SM样品分散单元或等效物(用于液相),
-Malvern AERO S样品分散单元或等效物(用于固相)。
试剂-水
方法
分析参数
-背景时间:10秒
-测量时间@10秒
-蒸馏水的折射率:1.33
-结果计算:一般用途
-泵/搅拌速度:1800rpm
-液体分散剂:水
-固体分散剂:环境空气
特定参数
-100705(折射率:1,吸收:1)
-100019(折射率:1,吸收:2)
-3CAA0075和3CAA0076(本发明的组合物)
将本发明的组合物的样品与蒸馏水混合,并使用Hydro 2000SM单元或Mastersizer 3000(使用Scirocco 2000单元)测试样品。
结果
根据上述方法测试干燥和研磨后获得的几批本发明的组合物。结果如下表1中所示。
表1:本发明的组合物的粒度分布(其中(D90)相当于粒度总体的90%,而(D4:3)相当于粒度总体的体积矩平均值)。
实施例5-本发明的组合物的形态(通过扫描电子显微镜,SEM)
为了进行SEM分析,如下制备样品:通过简单的撒粉将粉末形式的本发明的组合物沉积在样品架上。随后进行铂/钯沉积物的金属化,然后通过配备有能量色散的X-射线检测器的扫描电子显微镜进行观察和拍摄。
图7、8和9所示的SEM图像提供了本发明的组合物的可视化。
本发明的组合物显示出自组装成尺寸为+/-170nm的球形胶束的缀合物。SEM分析中的大致球形形态证实了通过动态光散射技术进行的尺寸测量分析。
从SEM可以看出,本发明的组合物中的颗粒已清楚地显示出未涂覆的卵磷脂纳米颗粒中不存在的壳聚糖的外涂层。发现姜黄素良好地分散在纳米颗粒的卵磷脂核中。SEM测量也证实了大致球形几何形状的证据,并且表面粗糙度表明表面吸收。这启示这种类型的吸附的驱动力是直接静电相互作用或离子-离子相互作用。
实施例6-在人类胃肠道和肠道吸收细胞的体内模型中测试本发明的组合物增强类姜黄色素的生物利用度的作用
人体胃肠道(GIT)是进入人体的主要入口之一。口服摄入食物、饮料或药品后,肠道是所摄入产品与宿主之间的第一个接触部位。为了发挥其生物学活性,化合物必须先通过胃,其中酸性环境和消化酶的存在可能导致化学或酶促修饰。离开胃后,摄入的化合物到达小肠,其中大部分宿主代谢酶被分泌出来,可能导致进一步的酶促修饰。该化合物以其原始或修饰形式随后可被吸收并进入循环,或可进一步穿过肠。本文中,食物化合物可能会通过与回肠末端(小肠的最后一部分)和结肠中存在的复杂微生物群落接触从而具有局部生物活性(Alegria等人,2015)。
人体研究无疑是研究不同肠道过程的最具代表性的方法之一。但是,它们非常费时费力,非常昂贵,并且不允许进行机械研究。
在人体中,可以将肠道视为一个黑箱,它可以量化摄入量和输出量,但是由于采样问题,很难研究其不同隔室中潜在的肠道过程。此外,道德约束限制了人体试验的普遍应用。
因此,精心设计的体外模拟技术为人类和动物研究提供了非常有用的替代方法。作为特定方法的代表,这样的模型可以对这些方法进行可重复的深入研究,而没有道德约束。设置和采样更容易可以以较低的成本进行中等至高通量的研究。但是,缺乏生理宿主环境是这些模型的最重要限制。然而,使用人源细胞系的标准化体外细胞培养的使用提供了一种快速且可重现的方式来研究化合物对肠粘膜的最终作用。此外,广泛的体外研究允许仔细设计后续的动物或人体研究,从而节省时间和金钱。
精心设计的模拟GIT的体外方法可提供出色的高通量筛选设置,以评估不同浓度的所选食品成分的假定代谢结果。这样的成分可以被修饰或改变肠道中的细菌群落,因此可以完整地或以修饰的副产物的形式到达肠道粘膜。将膳食化合物的口服生物利用度定义为能够被肠细胞吸收并且可用于使用或储存的施用剂量的分数。
膳食化合物的生物利用度取决于许多因素,即取决于个体的营养和生理状况,取决于化合物与其他营养素和/或胆汁盐的结合,取决于化合物通过消化酶的酶促降解以及肠道相关细菌代谢它的能力。体外胃肠道模型提供了在短期实验中以快速且经济高效的方式筛选大量分子组的可能性。
以下方法可以在消化和结肠发酵后快速评估膳食化合物的肠道命运。这与模拟人肠上皮的体外细胞模型有关,可以研究完整化合物和修饰化合物的生物利用度,从而增加科学产出和商业相关性。
首先,进行了短期筛选试验,以评估具有不同溶解度特性的基于姜黄素的制剂的消化命运。
然后将这些实验的结果应用于体外Caco-2细胞,以研究与未改性/未消化形式相比不同制剂的生物利用度部分。
另外,测量细胞毒性以比较不同消化部分的推定细胞毒性作用。
短期筛选试验由在针对大肠的模拟条件下,将代表性剂量的代表性先导化合物与代表性细菌接种物连续温育(胃,小肠,结肠)组成。
使用从人肠道微生物生态系统模拟器(SHIME)模拟器的升结肠隔室采集的肠道悬浮液(Van de Wiele等人,2015)。
该接种物由稳定的微生物群组成,该微生物群在结构和活性上都适应于近端结肠中存在的环境条件。
评价下列基于姜黄素的制剂/组合物:
1.标准姜黄素提取物(姜黄)-包含3种类姜黄色素的混合物(姜黄素-75%、去甲氧基姜黄素(DMC)-15-20%和双去甲氧基姜黄素(BDMC)-5-10%)。
2.对照制剂(姜黄磷脂复合物Thorne产品,具有
3.作为本发明的方法/用途中使用的组合物包含8.6%姜黄提取物(具有超过6%的类姜黄色素)、15.9%向日葵油、2%皂皮树属提取物和73.5%改性淀粉)(本文也称作形式I)。
短期筛选试验在于在胃、小肠和结肠条件下依次温育这三种制剂。
对这些制剂/组合物进行测试,以使其在胃隔室中的类姜黄色素浓度达到0.5g/L(实际含量(mg)基于每种产品中类姜黄色素的%计算-如表2所示)。
然后在胃蛋白酶存在下,将不同的制剂/组合物在37℃,pH 2.0下温育1小时(h)。
然后通过添加胰酶和胆汁盐模拟小肠,并将样品在37℃下温育总计3h期限。
最终,在第三个温育阶段,通过添加从SHIME采集的代表性粪便接种物和丰富的营养培养基模拟结肠。结肠温育在37℃与摇动和厌氧条件下进行,总计历时48h期限。
每种制剂/组合物进行三次重复测试以控制生物学变异性。
注意,设计这些实验是为了遵守食品成分在胃肠道中的特定停留时间。考虑到每个隔室中的体积,所测试的类姜黄色素的浓度为:胃中0.5g/L,小肠中0.35g/L,结肠中0.1g/L。对于细胞转运实验,将这些样品稀释10倍以上。
表2:测试的基于姜黄素的制剂/组合物以及相应的类姜黄色素在制剂/组合物中的百分比。考虑类姜黄色素的百分比,以便计算要添加到胃隔室的mg量。粗体字表示天然形式。
在如下时间点采集每种制剂/组合物的样品:
-胃:30min和60min
-小肠:60、120和180min
-结肠:2、4、6、24和48小时
然后使用与质谱偶联的高压液相色谱(HPLC)的分析样品的类姜黄色素含量(姜黄素、DMC和BDMC)。
对于每种3种类姜黄色素(Phytolab,Vestenbergsgreuth,Germany)在2-1000ng/mL范围内制备校准曲线,并添加54ppb姜黄素-d6(TLC pharmachem,Ontario,Canada)作为内标,以确保保留时间稳定性和仪器校正偏差。乙腈用作每种溶液的稀释剂。对于游离类姜黄色素测定,将准确的450μL内标溶液(60ng/mL)和50μL血浆样品上样至Captiva 96孔板(来自Agilent的ND脂质)。混合并过滤后,可将洗脱液注入LC/MS系统。Captiva ND脂质板旨在有效去除血浆中的磷脂。为了测定总缀合类姜黄色素代谢物(葡糖苷酸和硫酸酯代谢物),将100μL血浆样品与100μL酶溶液(葡糖醛酸糖苷酶1000单位/mL,Sigma#G7017;或硫酸酯酶,Sigma#S9626,100单位/mL)在37℃下混合2小时。水解步骤之后,将50μL溶液与450μL乙腈混合到Captiva 96孔板上。进样步骤与游离类姜黄色素相同,在进样前混合并过滤。
然后LC/MS条件如下。使用的自动进样器(5℃)和LC系统为Agilent Infinity1290集成系统。在本研究过程中使用了Agilent 6420三重四极杆质谱仪与电喷雾电离。将代谢物从BEH Shield RP 18柱(100x2.1,1.7μm;Waters)中洗脱,流动相由HPLC级0.1%甲酸水溶液(溶剂A)和0.1%甲酸的乙腈水溶液(溶剂B)组成,流速为0.5mL/min。在0-6min以40-80%B的梯度洗脱。标准品和样品的进样量为2μL。对于每种参比化合物,利用多种反应监测(MRM)模式检测到前体离子到产物离子的相关跃迁。对于在MS1全扫描测试中测定了3种分析物的每一种,在MS/MS实验中测定了产物离子。使用直接输注和Optimizer B.08.00工作站软件解决方案(Agilent technologies,Santa Clara,CA,USA)对每种分析物的MRM跃迁进行了优化。最佳选择条件请参见表2a。质谱仪参数设置如下:ESI源为正负两种模式;干燥气体(N2)流速为10L/min;气体温度为350℃;雾化器为40psi;毛细管为4.0kV。在按照制造商的指南运行之前,将MS系统已完全校准。数据分析使用Agilent MassHunter定量/定性分析B.07.00(Agilent technologies,Santa Clara,CA,USA)进行。
表2a:3种类姜黄色素和内标的保留时间(Tr)、多种反应监测(MRM)转换以及优化的串联质谱(MS/MS)检测参数。
表3描述在消化期间在胃肠道隔室中得到的类姜黄色素浓度。
令人惊讶地,作为用于本发明的方法/用途中的组合物在60min后在胃中消化后的浓度以及在120min和180min后在小肠中的浓度优于对标准姜黄粉末提取物所获得的浓度,这表明与标准提取物相比,作为本发明的方法/用途中使用的组合物对消化的抵抗性更优。同样,作为用于本发明的方法/用途中的组合物在60min后在胃中消化后的浓度以及在120min和180min后在小肠中的浓度高于比较物姜黄磷脂复合物制剂的浓度,这表明作为本发明的方法/用途中使用的组合物对消化的抵抗性优于姜黄磷脂复合物比较物。
表4显示了根据初始浓度(实验开始时胃腔中0.5g/l或500mg/l的类姜黄色素)在消化后保留在肠腔中的类姜黄色素的百分比。结果清楚地表明,令人惊讶地,来自作为本发明的方法/用途中使用的组合物的类姜黄色素对胃和小肠的消化的抵抗性远优于来自标准姜黄提取物的类姜黄色素,并且与类姜黄色素标准提取物或姜黄磷脂复合物制剂中的类姜黄色素相比,作为本发明的方法/用途中使用的组合物在口服消耗后具有更好的防止在消化过程中降解的作用,并且与标准提取物或姜黄磷脂复合物制剂的口服消耗相比,作为本发明的方法/用途中使用的组合物口服消耗后存在更多种类的类姜黄色素可在小肠隔室中吸收。
表4:对胃肠道(GIT)消化的抵抗性:根据初始浓度,消化后保留在肠隔室中的类姜黄色素的百分比
数据显示与初始浓度相比,消化后不同隔室和不同时间内类姜黄色素浓度百分比的平均值±SD。
还采集了以下样品用于对Caco-2细胞的转运实验:
-小肠:120和180min
在使用前将施用于细胞的样品的pH调节至6.5。
Caco-2细胞被广泛用作肠道功能的细胞模型,因为它们能够自发分化为培养中的肠细胞。当在半透性支持物中培养时,这些细胞会发育成功能性的存在顶端刷状缘酶和微绒毛的极化单层,类似于肠道上皮。因此,由于它们在培养中获得了成熟肠细胞的形态和功能特征,因此被视为转运实验的“金标准”模型(Sambuy等人,2002)。
将Caco-2细胞(ATCC)以0.9x105细胞/cm
采集了如下样品:
1.用于刺激细胞的稀释样品(500μL)。它们相当于0h的时间点,因为在运送到细胞之前,样品中还包含稀释的样品,未经处理的制剂也要以TB浓度0.025mg/mL稀释运输。
2.温育2h和4h后(分别为250μL)从顶端采集样品。
3.温育2h(800μL)和4h(1000μL)后,从基底外侧采集的样品。
4.温育4h后从细胞中取得的样品。这些相当于已经在细胞内部摄取的部分。简言之,将冰冷的PBS 1X加入细胞以终止运输。然后,将细胞再次用PBS 1X洗涤一次,以去除痕量尚未内摄入的产物,并用含20%乙醇和0.1%Tween-20(600μL)的PBS 1X溶液渗透细胞;在该溶液中搅拌20分钟后,将细胞收集到1.5mL试管中,并借助注射器和21G针头破碎并匀化。离心试管,并将上清液转移至新试管(450μL)中。
将全部样品储存在-20℃直至HPLC分析。
为了评估施用于Caco-2细胞的不同样品的细胞毒性,使用LDH-活性试剂盒评估了由Caco-2细胞在顶端侧释放的乳酸脱氢酶(LDH)(温育4h后)。LDH在膜损伤时被细胞释放到上清液中,因此是细胞死亡的标志。
使用一种方式方差分析进行统计分析,然后进行Dunnett的因果多重比较检验。(*)、(**)和(***)分别相当于在p<0.05、p<0.01和p<0.001的显著性。
如图10至15所示,对照孔(TB+结肠48h)显示LDH活性为约1.0。能够观察到,对于所有产品,与对照相比,未消化的形式以及60min后采集的胃样品均显示出最高的LDH活性。
相反,小肠和结肠样品均显示与对照相差无几或更低的水平。这些结果表明,除了来自胃的样品以外,所有样品均对Caco-2细胞无毒性,并且可以利用来自测试Caco-2细胞中样品的类姜黄色素的转运和生物利用度的测定结果并且判断作为有效样品。因为是对活细胞得到的。
对来自与未消化产物或来自小肠的样品(120min或180min)一起温育的Caco-2细胞的顶端、基底外侧和细胞内隔室的样品进一步分析其类姜黄色素含量(姜黄素、DMC和BDMC)及其相应代谢物的含量(硫酸姜黄素、姜黄素葡糖苷酸、硫酸DMC和DMC葡糖苷酸、硫酸BDMC和BDMC葡糖苷酸),因为已知Caco-2细胞表达UDP-葡萄糖醛酸基转移酶和磺基转移酶(Siissalo S,Zhang H,Stilgenbauer E,Kaukonen AM,Hirvonen J,Finel M.Theexpression of most UDP-glucuronosyltransferases(UGTs)is increasedsignificantly during Caco-2cell differentiation,whereas UGT1A6 is highlyexpressed also in undifferentiated cells.Drug Metab Dispos.2008年11月;36(11):2331-6),因此能够将姜黄素、DMC和BDMC在其葡糖苷酸或硫酸酯代谢物中代谢(Dempe JS,Scheerle RK,Pfeiffer E,Metzler M.Metabolism and permeability of curcumin incultured Caco-2cells.Mol Nutr Food Res.2013年9月;57(9):1543-9)。
根据Artursson和Karlsson使用以下公式计算出从顶端到基底外侧跃迁的表观渗透系数(P
P
其中Vapi是顶端室的体积(0.6mL),A是单层的表面积(1.131cm
表5描述在将Caco-2细胞顶端暴露于标准提取物或2种不同制剂(姜黄磷脂复合物或作为本发明的方法/用途中使用的组合物)之后不同时间间隔的P
表5:将Caco-2细胞顶端暴露于标准提取物或2种不同制剂后针对不同时间间隔计算出的总类姜黄色素及其代谢物的P
数据显示平均值±SD。相对于标准提取物,P
如表5所示,本发明的方法/用途中使用的组合物的顶端至基底外侧跃迁的表观渗透系数(P
姜黄磷脂复合物制剂的顶端到基底外侧转变的表观渗透系数(P
表6描述使用小肠隔室中120min或180min的类姜黄色素的定量浓度作为Capi将Caco-2细胞顶端暴露于标准提取物或2种不同制剂(姜黄磷脂复合物或作为本发明的方法/用途中使用的本发明的组合物)的小肠消化样品(120或180min)后的P
表7描述使用小肠隔室中类姜黄色素的理论浓度作为Capi将Caco-2细胞顶端暴露于标准提取物或2种不同制剂(姜黄磷脂复合物或作为本发明的方法/用途中使用的本发明的组合物)的小肠消化样品(120或180min)后的P
表6:将Caco-2细胞顶端暴露于标准提取物或2种不同制剂的小肠消化样品(120或180min)后的总类姜黄色素及其代谢物的P
数据显示平均值±SD。相对于姜黄磷脂复合物制剂,P
表7:将Caco-2细胞顶端暴露于标准提取物或2种不同制剂的小肠消化样品(120或180min)后的总类姜黄色素及其代谢物的P
数据显示平均值±SD。相对于标准提取物,P
实施例6-通过小鼠体内比较性药物动力学研究测试本发明的组合物增强类姜黄色素的生物利用度的作用
鉴于在体外模型中获得的结果表明,作为本发明的方法/用途中使用的组合物显示出对胃肠道消化的更好的抵抗性以及通过肠细胞的更好的吸收,因此推定作为本发明的方法/用途中使用的组合物(即包含8.6%的姜黄提取物(包含6%以上的类姜黄色素)、15.9%的向日葵油、2%的皂皮树属提取物和73.5%的变性淀粉的组合物)与标准姜黄提取物相比将改善类姜黄色素在小鼠中的生物利用度。
因此,在小鼠中进行对比药代动力学研究。
将来自Janvier Labs(St-Berthevin,France)的在收到时5周龄的成年雄性C57Bl/6J Rj小鼠集中饲养在标准塑料笼中(n=4/笼)。所有动物均可随意获得水和标准颗粒食物(小丸AO4;SAFE,Villemoisson-sur-Orge,France),并维持在温度-(24.0-26.0℃)和湿度-(40.0-50.0%)下在12-h光照(07:00AM-07:00PM)/12-h黑暗周期内受控室内。
收到后,所有动物都要适应新环境1周。为了确保正确的适应环境和标准的生长曲线,每周2次评估动物的总体食物摄入量和体重。在该适应期之后,使小鼠习惯于每天1次口服施用媒介物(在室温溶于蒸馏水的1%羧甲基纤维素钠盐(w/v),CMC;Ref#C4888,批号:SLBB5612V,SIGMA ALDRICH,St Quentin Fallavier,FRANCE)6天,然后治疗。在此习惯期中,每天测量动物的总体食物摄入量和体重。这些措施可以确保动物对注射程序和实验人员操作的最佳习惯适应。
在适应和习惯期间,允许小鼠随意进食预先称重的新鲜食物颗粒(小丸AO4;SAFE,Villemoisson-sur-Orge,France)。第二天称重剩余的食物。使用精密秤(THB-600G,PMCMillot;精密度±0.01g),通过将对预先称重的食物中扣除剩余食物,来确定每个笼子的总食物摄入量(08:40-09:20AM)。平均每日食物摄入量通过将该值除以间隔两个测量值的天数以及每个笼子中的动物数量而得到。在每次体重测量中,在早晨(08:40-09:20AM)称重小鼠。
治疗前1天(适应期的最后1天),晚上(17:40-18:20PM)禁食120只小鼠。次日,小鼠(n=40只/制剂)在早晨(08:00-09:50AM)通过管饲法(30ml/kg)接受标准姜黄粉末提取物、姜黄磷脂复合物制剂作为对比物或作为本发明的方法/用途中使用的组合物(即包含8.6%姜黄提取物(含超过6%类姜黄色素)、15.9%向日葵油、2%皂皮树属提取物和73.5%的变性淀粉的组合物)急性治疗。
在搅拌下在适当的接受者中加入适量的媒介物(溶于蒸馏水的CMC 1%),并将pH调节至5.5。在恒定搅拌下,将适量的预称重制剂逐渐添加到媒介物中。一旦均匀,则测量获得的悬浮液的pH,并且如果需要将其调节为5.5。为了避免类姜黄色素的任何降解,在制备后的1h内全身施用最终的悬浮液。计算给动物喂食的总类姜黄色素剂量为300mg/kg(参见表8)。在小鼠中,该剂量相当于在人体中的21.37mg/kg,假定为60kg人用配方,则相当于1282mg(来自(U.S.Department of Health and Human Services,Food and DrugAdministration,Center for Drug Evaluation and Research(CDER).Guidance forIndustry Estimating the Maximum Safe Starting Dose in Initial Clinical Trialsfor Therapeutics in Adult Healthy Volunteers.2005);人当量剂量(mg/kg)=动物剂量(mg/kg x)(以kg计的动物体重/以kg计的人体重)
表8:在首次体内研究中标准姜黄提取物和2种制剂的类姜黄色素含量以及用于以相应浓度的300mg/kg体重的类姜黄色素对小鼠产品施用悬浮液的类姜黄色素含量
对麻醉的小鼠通过心脏穿刺在给药后0.5-、1h-、2h-、4h-、6h-、8h-、12h-或24h-取血样(n=5/时间点/制剂)。通过腹膜内注射氯胺酮/赛拉嗪(分别为100mg/kg和15mg/kg)的混合物进行麻醉。对于心脏穿刺,将26G注射器插入到第八与第十胸骨之间,与动物体形成的纵轴成45°角,以便直接穿透左心室。然后适度地抽血以获得0.6-1ml的终体积。为了生物分析方法的利益,随后将血液转移到Eppendorf管中,与硫酸肝素混合(200U.I/ml血液)并适度搅拌。采血后30分钟内在3000g和4℃下在15分钟期间离心所有样品以分离血浆。在新的0.5ml Eppendorf中等分血浆(上清液)。血浆的等分试样在离心后1小时内在-80℃冷冻。
母体类姜黄色素(姜黄素、DMC或BDMC)及其相应代谢物(姜黄素葡糖苷酸和硫酸姜黄素、DMC葡糖苷酸和硫酸DMC、BDMC葡糖苷酸和硫酸BDMC、THC、THC葡糖苷酸和硫酸THC、HHC、HHC葡糖苷酸和硫酸HHC)的血浆剂量通过LC-MS-MS方法得到。对于每种5种类姜黄色素(Phytolab,Vestenbergsgreuth,Germany)的每一种,制备在2-1000ng/mL范围内的校准曲线,加入54ppb姜黄素-d6(TLC pharmachem,Ontario,Canada)作为内标,以确保保留时间稳定性和仪器校正偏差。乙腈用作每种溶液的稀释剂。对于游离类姜黄色素的测定,将准确的450μL内标溶液(60ng/mL)和50μL血浆样品上样至Captiva 96孔板(来自的Agilent ND脂质)。混合并过滤后,可将洗脱液注入LC/MS系统。Captiva ND脂质板旨在有效去除血浆中的磷脂。为了测定总缀合的类姜黄色素代谢物(葡糖苷酸和硫酸酯代谢物),将100μL血浆样品与100μL酶溶液(葡糖醛酸糖苷酶1000单位/mL,Sigma#G7017;或硫酸酯酶,Sigma#S9626,100单位/ml)在37℃下混合2小时。水解步骤之后,还将50μL该溶液与450μL乙腈混合到Captiva 96孔板上。进样步骤与游离类姜黄色素相同,在进样前混合并过滤。
随后LC/MS条件如下。使用的自动进样器(5℃)和LC系统是Agilent Infinity1290集成系统。在本研究过程中使用Agilent 6420三重四极杆质谱仪与电喷雾电离。将代谢物从BEH Shield RP 18柱(100x2.1,1.7μm;Waters)上洗脱,其中流动相由HPLC级0.1%甲酸水溶液(溶剂A)和0.1%甲酸的乙腈溶液(溶剂B)组成,流速为0.5mL/min。在0-6min以40-80%B的梯度洗脱。标准品和样品的进样量为2μL。对于每种参比化合物,利用多种反应监测(MRM)模式检测到前体离子到产物离子的相关跃迁。在MS1全扫描测试中测定5种分析物的每一种,在MS/MS实验中测定产物离子。使用直接输注和Optimizer B.08.00工作站软件解决方案(Agilent technologies,Santa Clara,CA,USA)对每种分析物的MRM跃迁进行了优化。最佳选择条件参见表9。质谱仪参数设置如下:ESI源为正负模式两种;干燥气体(N2)流速为10L/min;气体温度为350℃;雾化器为40psi;毛细管为4.0kV。在按照制造商的指南运行之前,MS系统已完全校准。使用Agilent MassHunter定量/定性分析B.07.00(Agilent technologies,Santa Clara,CA,USA)进行数据分析。
对于所测试的三种制剂/组合物,通过在血液采集的每个时间点计算平均值±SEM血浆浓度,可以测定在治疗后0.5-12h之间的每种类姜黄色素化合物的血浆浓度的动力学。药代动力学参数T1/2(半衰期),Cmax,Tmax,AUC(0-12h)和AUC(0-∞)根据0-12h动力学通过使用PKSolver的非区室分析测定。PKSolver是用于Visual Studio应用程序(VBA)编写的Microsoft Excel菜单驱动的外接程序,用于解决药代动力学问题(Zhang等人,2010)。
将整个数据表示为平均值±SEM。使用Statview 5.0.1(Statview软件,Cary,NC,USA)和Excel 2013程序进行统计学分析。在每个时间点通过斯氏t检验分析数据。风险α固定在0.05。
表9:类姜黄色素、四氢姜黄素和六氢姜黄素及内标的保留时间(Tr)、多种反应监测(MRM)跃迁以及优化的串联质谱(MS/MS)检测参数。
在两个连续的适应期(J1-J7)和习惯期(J8-J14)期间,定期测量小鼠的24h食物摄入量和体重,以确保治疗前正确的适应环境和标准生长曲线。对于本研究,每个笼子中饲养4只小鼠,每只小鼠在用三种制剂之一治疗后在同一时间点进行采血样。因此,首先对每组15只在相同时间点处死的小鼠(8组;5只小鼠/时间点/制剂)的食物摄入量和体重数据进行分析。图16和图17分别显示了在施用前适应和习惯期间小鼠的摄食量和体重;不同组显示了治疗前的经典体重曲线和摄食量。应当注意,所有组在J15(图17)观察到的体重大幅下降是由于治疗前一夜进行的禁食所致。这些结果证实了该实验中使用的所有小鼠都具有相同的行为,并且可以按预期进行比较。
图18描述在口服施用姜黄磷脂复合物制剂和标准提取物制剂的(300mg/kg bw类姜黄色素)后小鼠的每个时间点得到的总类姜黄色素(姜黄素、DMC、BDMC及其相应代谢物姜黄素葡糖苷酸和硫酸姜黄素、DMC葡糖苷酸和硫酸DMC、BDMC葡糖苷酸和硫酸BDMC、THC、THC葡糖苷酸和硫酸THC、HHC、HHC葡糖苷酸和硫酸HHC的总和)浓度的药代动力学曲线。标准姜黄提取物的总类姜黄色素的血浆浓度仅在1h时最高达到12.9ppm,而在所有其他时间点均低于10ppm,不过,姜黄磷脂复合物制剂可使总类姜黄色素的血浆浓度达到41.5ppm(μg/ml)(30min后),并显著优于除24h以外的每个时间点得到的血浆浓度。姜黄磷脂复合物显示与标准姜黄提取物相比,总类姜黄色素Cmax增加了3.2-倍,AUC增加了3.9-倍。这些结果验证了使用姜黄磷脂复合物制剂增强类姜黄色素的生物利用度并作为阳性对照,并验证了我们体内模型与测试不同制剂相对于姜黄提取物增强类姜黄色素生物利用度标准的能力的相关性。
如表10所示包含每个时间点平均值±SEM的表。这些值旁边的括号中的数字表示样品总数,其对于样品总数为正值。统计学比较的结果也显示在同一表中。表11包含使用PKSolver软件得自非隔室分析的PK参数。也表示出了组间的变化百分比((%Var°)。数据表示为平均值±SEM。
表10和11:图18中显示的每个时间点使用PKSolver软件通过非隔室分析获得的平均值±SEM和PK参数。
图19描述口服施用包含姜黄素、皂皮树属、油和改性淀粉的混合物(实施例2形式1)和标准提取物制剂的(300mg/kg bw类姜黄色素)后在每个时间点穴位小鼠得到的总类姜黄色素(姜黄素、DMC、BDMC及其相应代谢物姜黄素葡糖苷酸和硫酸姜黄素、DMC葡糖苷酸和硫酸DMC、BDMC葡糖苷酸和硫酸BDMC、THC、THC葡糖苷酸和硫酸THC、HHC、HHC葡糖苷酸和硫酸HHC的总和)浓度的药代动力学曲线。结果表明,与标准姜黄提取物相比,作为本发明的方法/用途的组合物可将总类姜黄色素的浓度0.5h至24h显著增加。作为本发明的方法/用途中使用的组合物显示总类姜黄色素Cmax增加1.8-倍,且AUC增加2.2-倍。
包含每个时间点平均值±SEM的表如表12所示。这些值旁边的括号中的数字表示样品数,其对于样品总数为正值。统计学比较的结果也显示在同一表中。表13显示包含使用PKSolver得自非隔室分析的PK参数的表。也表示出组间的变化百分比(%Var°)。数据表示为平均值±SEM。
表12和13:图19中显示的每个时间点使用PKSolver软件通过非隔室分析获得的平均值±SEM和PK参数。
如表14所示,当特定地查看母体化合物(姜黄素,DMC和BDMC的天然形式,即未代谢)时,得到来自标准姜黄提取物、姜黄磷脂复合物或作为本发明的方法/用途中使用的组合物的300mg/kg类姜黄色素消耗后的每个时间点的母体类姜黄色素的血浆浓度,作为本发明的方法/用途中使用的组合物是我们能够定量给药后前4h期间可检测量的母体类姜黄色素的唯一一种,且由此计算AUC(0-12h)和AUC(0-∞)(表15)。与标准姜黄提取物相比,作为本发明的方法/用途中使用的组合物得到的母体类姜黄色素的C max增加了10.9-倍。
如表16所示,当特定地查看姜黄素(姜黄素的天然形式,即未代谢)时,得到来自标准姜黄提取物、姜黄磷脂复合物或作为本发明的方法/用途中使用的组合物的300mg/kg消耗后的每个时间点的母体类姜黄色素的血浆浓度,在本发明的方法/用途中使用的组合物,在本发明的方法/用途中使用的组合物是唯一能够在检测后第一个4h内定量检测母体姜黄素的检测量的组合物。计量并因此计算AUC(0-12h)和AUC(0-∞)(表16)。与标准姜黄提取物相比,作为本发明的方法/用途中使用的组合物的母体姜黄素的Cmax增加了521.8-倍。此外,作为本发明的方法/用途中使用的组合物诱导的母体姜黄素的血浆水平高于姜黄磷脂复合物(C max增加1.8-倍)。
从首次体内实验可以得出结论,具有超过6%的类姜黄色素,由8.6%的姜黄提取物、15.9%的葵花油、2%的皂皮树属提取物和73.5%的改性淀粉得到的根据形式1制备的作为本发明的方法/用途中使用的组合物与标准形式的姜黄提取物相比,能够提高总类姜黄色素及其代谢物的生物利用度,而且还能提高母体化合物的生物利用度。
还可以得出结论,作为本发明的方法/用途中使用的组合物比姜黄磷脂复合物制剂可以更好地改善天然姜黄素的生物利用度。
因此,作为本发明的方法/用途中使用的组合物代表了一种有吸引力的方式,与姜黄磷脂复合物相反,其在制剂中不使用大豆衍生的卵磷脂来增强母体姜黄素的生物利用度。此外,与DMC和BDMC及其相关还原的葡糖苷酸或硫酸酯代谢物相比,姜黄素被认为是最强的姜黄活性物质之一(Ireson C,Orr S,Jones DJ,Verschoyle R,Lim CK,Luo JL,Howells L,Plummer S,Jukes R,Williams M,Steward WP,Gescher A.Characterizationof metabolites of the chemopreventive agent curcumin in human and rathepatocytes and in the rat in vivo,and evaluation of their ability to inhibitphorbol ester-induced prostaglandin E2 production.Cancer Res.2001年2月1日;61(3):1058-64;Anand P,Thomas SG,Kunnumakkara AB,Sundaram C,Harikumar KB,Sung B,Tharakan ST,Misra K,Priyadarsini IK,Rajasekharan KN,Aggarwal BB.Biologicalactivities of curcumin and its analogues(Congeners)made by man and MotherNature.Biochem Pharmacol.2008年12月1日;76(11):1590-611;Pal A,Sung B,BhanuPrasad BA,Schuber PT Jr,Prasad S,Aggarwal BB,BornmannWG.Curcuminglucuronides:assessing the proliferative activity against humancell lines.Bioorg Med Chem.2014年1月1日;22(1):435-9),作为本发明的方法/用途中使用的组合物代表改善姜黄素对不同健康状况如关节健康,炎症,关节炎,动脉粥样硬化,肝脂肪变性,肝纤维化,糖尿病,认知,轻度认知障碍,肠易激综合征的生物学功效的良好解决方案。
表14:首次体内研究中从标准姜黄提取物、姜黄磷脂复合物或作为本发明的方法/用途中使用的组合物中消耗300mg/kg类姜黄色素后的每个时间点的母体类姜黄色素(姜黄素、DMC和BDMC之和)的浓度。
紧邻这些值的括号中的数字表示样品数量,该数量在样品总数上为正值。
表15:首次体内研究中使用PKSolver软件得自从标准姜黄提取物、姜黄磷脂复合物或作为本发明的方法/用途中使用的组合物中消耗300mg/kg类姜黄色素后母体类姜黄色素的非区室分析的PK参数
表16:首次体内研究中从标准姜黄提取物、姜黄磷脂复合物或作为本发明的方法/用途中使用的组合物中消耗300mg/kg类姜黄色素后每个时间点的母体姜黄素的浓度。
位于紧邻这些值的括号中的数字表示样品数量,该数量在样品总数上为正值。
表17:首次体内研究中从标准姜黄提取物、姜黄磷脂复合物或作为本发明的方法/用途中使用的组合物中消耗300mg/kg类姜黄色素后使用PKSolver软件得自非区室分析的PK参数
鉴于在小鼠中进行的首次体内研究获得的结果表明,总类姜黄色素和母体类姜黄色素和姜黄素具有更好的生物利用度,因此我们决定测试更高类姜黄色素含量(12%类姜黄色素)的优化制剂,该制剂按照形式2制备,该形式2具有14.4%的姜黄提取物,26.8%的葵花籽油,2%的皂皮树属提取物和56.8%的变性淀粉,与标准姜黄提取物相比,其在小鼠的二次对比药代动力学研究中具有改善类姜黄色素生物利用度的能力。
如本实施例之前所述,使用相同的方法(小鼠收容,适应期,习惯期,使用LC/MS方法的类姜黄色素及其代谢物定量),但每组和每个时间的动物数量更高(n=12/时间点/制剂),并在给药后0.25-、0.5-、0.75-、1h-,2h-或8h取血样,以便明确口服消耗(300mg/kgbw)的来自标准姜黄提取物(分别为79.5、15.0和3.0g/100g姜黄素、DMC和BDMC,总计97.5g类姜黄色素/100g)的类姜黄色素、姜黄磷脂复合物制剂(分别具有18.6、2.6和0.2g/100g的姜黄素、DMC和BDMC和总计21.5g类姜黄色素/100g)或根据形式2(分别具有9.8、1.6和0.2g/100g的姜黄素、DMC和BDMC和总计11.6g类姜黄色素/100g)制备的作为本发明的方法/用途中使用的组合物后最早期间的动力学特性。
图20描述食用不同制剂后作为时间函数的总类姜黄色素和代谢物浓度(每种制剂n=72)。结果清楚地表明,与标准姜黄提取物相比,姜黄磷脂复合物和作为本发明的方法/用途中使用的组合物的类姜黄色素和代谢物浓度显著增加。与姜黄磷脂复合物制剂相比,食用作为本发明的方法/用途中使用的组合物后0.5h和0.75h,总类姜黄色素的浓度更高,这令人惊讶地显示出作为本发明的方法/用途中使用的组合物在改善总类姜黄色素和代谢物生物利用度方面比姜黄磷脂复合物制剂更好的性能。
这在计算曲线AUC(0-8h)、AUC(0-∞)和Cmax(分别为图21、22和23)下的相应面积的同时得到了证实,与标准提取物相比分别高280%,高300%和高337%,作为本发明的方法/用途中使用的组合物与姜黄磷脂复合物相比分别高6.5%,30%和63%(表18)。我们还证实,与标准提取物相比,来自作为本发明的方法/用途中使用的组合物的类姜黄色素和代谢物的吸收更迅速(0.5h与0.75h),Tmax降低1.5-倍,并且相应地与姜黄磷脂复合物制剂相比,Tmax降低了2-倍(0.5h与1h)(表18)。结果也令人惊讶地表明,与姜黄磷脂复合物制剂相比,来自作为本发明的方法/用途中使用的组合物的类姜黄色素和代谢物排泄较不快捷,其中半衰期更长(3.8h与2.8h)。
如表19所示,当专门查看母体化合物(姜黄素,DMC和BDMC的天然形式,即未代谢)时,得到来自标准姜黄提取物、姜黄磷脂复合物或作为本发明的方法/用途中使用的组合物的300mg/kg类姜黄色素消耗后的母体类姜黄色素的PK参数,如表19所示。提取物,姜黄磷脂复合物或作为本发明的方法/用途中使用的组合物,作为本发明的方法/用途中使用的组合物是令人惊讶的,其中唯一的在于我们可以为母体姜黄素计算AUC(0-8h)。与标准姜黄提取物相比,得到作为本发明的方法/用途中使用的组合物的母体姜黄素的Cmax增加3.2-倍。消耗姜黄磷脂复合物制剂后,血浆样品中未发现母体姜黄素,因此无法计算出姜黄素的Cmax。
从该第二次体内实验中可以得出结论,根据形式2使用14.4%姜黄提取物、26.8%向日葵油、2%皂皮树属提取物和56.8%改性淀粉制备的具有较高类姜黄色素含量(12%类姜黄色素)含量的作为本发明的方法/用途中使用的组合物标准姜黄提取物和姜黄磷脂复合物制剂相比出乎意料地能够提高总类姜黄色素及其代谢物的生物利用度。
因此,与姜黄磷脂复合物制剂相反,作为本发明的方法/用途中使用的组合物代表在不使用大豆衍生的卵磷脂的制剂增强类姜黄色素生物利用度的有吸引力的方式。
表18:首次体内研究中从标准姜黄提取物、姜黄磷脂复合物或作为本发明的方法/用途中使用的组合物中消耗300mg/kg类姜黄色素后使用PKSolver软件得自总类姜黄色素和代谢物的非区室分析的PK参数
相对于标准提取物,AUC或Cmax的增加倍数显示在括号()中。相对于姜黄磷脂复合物制剂,AUC或Cmax的增加倍数显示在方括号[]中。
表19:首次体内研究中从标准姜黄提取物、姜黄磷脂复合物或作为本发明的方法/用途中使用的组合物中消耗300mg/kg类姜黄色素后使用PKSolver软件得自母体类姜黄色素的非区室分析的PK参数
实施例7-在健康志愿者中的用于评估本发明的组合物增强类姜黄色素生物利用度的能力的对比药代动力学研究
本研究具有两个目的:
1.主要目的
评估与1500mg标准姜黄粉末提取物95%类姜黄色素相比单剂量消耗300mg本发明的组合物(Turmipure GOLD
2.次要目的
为了评估单剂量消耗五种研究产品后以下参数的血浆浓度分布,所述产品包含1425mg(标准姜黄粉末提取物95%类姜黄色素(curcumindoid),姜黄素C3复合物California Gold Nutrition)、200mg(Curcuma Platinum MannaVital)、90mg(本发明的组合物(Turmipure GOLD
■总类姜黄色素;
■母体化合物(姜黄素,DMC,BDMC)及其代谢物:姜黄素、葡糖苷酸和硫酸酯;DMC葡糖苷酸和硫酸DMC;BDMC葡糖苷酸和硫酸BDMC;天然四氢姜黄素(THC),葡糖苷酸和硫酸酯;天然六氢姜黄素(HHC),葡糖苷酸和硫酸酯。
该研究为一项单中心,随机,交叉和开放的临床试验。
本研究始于筛选/纳入拜访(V0),然后是5个实验阶段(V1-V5),在此期间受试者食用了研究产品(每个阶段每个随机分组的受试者使用一种不同的产品)。V1访视发生在V0之后最多3周,并且也可以构成随机访视。
每个实验阶段(V1-V5)至少间隔1周,最长间隔2周。在每个实验阶段中,受试者在8小时内接受动力血采样。在每次实验阶段后的第二天,即动力学开始后24小时,采集最后的动力学血样。在这些随访期间还进行尿液采集以进行生物库存。
在每次实验随访的早晨早上采集受试者的第一次排尿(第一次排尿的总量),在现场进行动力采血样期间的0至8小时以及回家后的8至24小时进行额外的采集。最后一次尿液采集在实验随访后的第二天带回(当他们返回以动力采血样的最后一次血样T24H时)。
在每个实验阶段之前和每个动力学过程的所有持续时间(早餐,午餐和下午整理)中,向志愿者提供标准餐食。
本研究结束是最后一次期间V5(V5-24H)后的当天。
■根据以下主要纳入和排除标准招募了30名受试者参加本研究:
■I1:年龄在18-45岁(包括端点);
■I2:BMI为19-25kg/m2(包括端点);
■I3:体重稳定,最近3个月在±3kg;
■I4:常规血液化学值在正常范围内;
■I5:对于女性:非绝经期,自研究开始前至少3个周期以来,使用相同的可靠避孕方法,并同意在整个研究过程中保持(接受含杀精子凝胶和雌激素/孕激素联合避孕的避孕套)或不使用或使用激素替代疗法的停经(排除开始不超过3个月的雌激素替代疗法);
■I6:禁止吸烟或每天吸烟量≤5支,并同意在所有实验期间(V1-V5)均不吸烟;
■I7:同意在整个研究期间不食用含姜黄素或其他类姜黄色素(DMC、BDMC)的食物,饮料和调味品;
■I8:研究者认为,身体和心理健康状况良好:没有病史或身体检查的临床意义和相关异常;
■E1:患有代谢或内分泌疾病,例如糖尿病,不受控制或受到控制的甲状腺疾病或代谢障碍;
■E2:患有严重的慢性疾病(例如,癌症,HIV,肾衰竭,进行性肝或胆道疾病,慢性炎性消化系统疾病,关节炎或其他慢性呼吸系统疾病等)或研究者的研究行为不一致的胃肠道疾病(例如乳糜泻);
■E3:患有肝病;
■E4:具有膳食补充禁忌的受试者的当前疾病状态:慢性腹泻,便秘或腹痛,炎性肠病(克罗恩病或溃疡性结肠炎),肝硬化,长期使用轻泻药……;
■E5:患有由医生诊断并用长期药物治疗的肠易激综合征(IBS);
■E6:根据研究者的描述,存在可能会影响研究结果或使受试者面临其他风险的病史;
■E7:最近的肠胃炎或食源性疾病例如证实的食物中毒(少于1个月);
■E8:谁在V0随访之前的3个月内献血或打算在前3个月献血;
■E9:根据研究者的意见,下静脉的关键在于不允许进行血样的动力学分析;
■E10:对研究产品的任何成分和/或标准餐食(谷蛋白不耐受,乳糜泻等)有已知或怀疑的食物过敏或不耐受或超敏反应);
■E11:妊娠或哺乳期女性或打算在前三个月内妊娠的妇女;
■E12:显示出酒精或药物依赖;
■E13:除口服和局部避孕药外,使用任何长期药物治疗(例如抗凝药,抗高血压药治疗,甲状腺治疗,哮喘治疗,抗焦虑药,抗抑郁药,降脂药治疗,皮质类固醇,phlebotonic,血管紧张性药物,影响血液循环的药物……);
■E14:目前(和在过去的3个月期间)服用从植物来源的任何补品;
■E15:食用含姜黄素的食品补剂(姜黄素,姜黄和咖喱食品)或食品(姜黄素,姜黄,E100和咖喱食品),确定为每周至少3次,并在测试前食用2周;
■E27:根据研究者,具有临床显著性异常的处置制记录(血糖,GGT,ASAT,ALAT,脲,肌酸酐和全血细胞计数)。
作为本研究的组成部分,对五种产品进行测试,它们是胶囊形状的膳食补剂:
1.标准姜黄粉末提取物95%类姜黄色素,作为胶囊消耗1500mg(4粒胶囊;375mg粉末/胶囊)(STE),
2.C3
3.
4.
5.如本文所定义的组合物,包含姜黄提取物、向日葵油、皂皮树属提取物和阿拉伯胶,作为胶囊消耗(1粒胶囊;300mg粉末/胶囊)(TURMIPURE GOLD)。
为了确保受试者的健康状况并检查合格标准,在V0随访期间抽取了血样用于非绝经妇女的对照记录分析和妊娠试验(βhCG剂量)。
在对身体进行检查并确认合格标准后,再抽取样品。最多采集10mL。
在体检过程中的每次就诊时,都使用电子血压监测仪(Carescape
所有参与的受试者禁食12小时。
为准备V1至V5的就诊,在临床检查后,将静脉导管放在受试者的肘部折痕上。该导管允许对血流进行动力学采样,而无任何其他穿刺。
动力学样品持续约8个小时,所有受试者均留在临床研究中心。根据以下时间表进行十(10)次采血样:
-T-10(基线),
-T15>T30>T45>T60>T90>T120>T240>T360>T480,
对T15的边界审定为±30s,T30和T45为±1min,T60和T90为±2min,T120至T480为±5min。
T0时间点相当于研究产品消耗。
志愿者被允许在食用研究产品后约4小时(仅在T240时间点之后)食用标准午餐,并在食用研究产品后约8小时食用标准下午餐。午餐消耗最多30分钟。产品施用前1h和施用后1h禁止饮水。在最后一个时间点T480之后拔出导管。
然后,要求志愿者在随访后的第二天以禁食12-小时的状态再次来到临床研究现场,以获取动力学的最后一次采血样T24H。使用经典静脉血样材料(单刺)。通过在血浆中分析这些样品来评估生物学参数;因此仅使用EDTA管(每次采样5mL)。
制备5种类姜黄色素(Phytolab,Vestenbergsgreuth,Germany)的每一种校准曲线,均在10-600ng/mL范围内,并添加50ppb标记的姜黄素(TLC pharmachem,Ontario,Canada)作为内标,以确保保留时间稳定性和仪器校正偏差。乙腈用作每种溶液的稀释剂。对于游离类姜黄色素测定,将含内标溶液(50ng/mL)的精确500μL的冷甲醇:乙腈(15:85)混合物上样至100μL血浆样品中,装入Captiva 96孔板中(来自Agilent的EMR脂质,参见图18)。混合并过滤后,将姜黄素用冷水:乙腈(1:4)混合物洗脱,并将洗脱液注入LC/MS系统。Captiva EMR脂质板经设计可有效去除血浆中的磷脂。为了测定总缀合的类姜黄色素代谢物(葡糖苷酸和硫酸酯代谢物),将60μL血浆样品与60μL酶溶液(1mg/mL的葡糖醛酸糖苷酶,pH 6.8的100mM磷酸盐缓冲液或10mg/mL的硫酸酯酶,100mM乙酸盐缓冲液pH5.0)在37℃通过恒定搅拌(Eppendorf,Thermomixer C,400rpm)混合1小时。在该水解步骤之后,该方案与使用Captiva 96孔板EMR脂质的游离类姜黄色素的方案相同。
注射前用于人血浆处理的EMR-Lipid方案如下所示。
LC/MS条件如下。自动进样器(5℃)和LC系统是Agilent Infinity II 1290集成系统。在本研究过程中使用Agilent 6420三重四极杆质谱仪与电喷雾电离。代谢物从BEH C18柱(100x2.1mm,1.7μm;Waters)中洗脱,其中流动相由HPLC级的0.1%甲酸水溶液(溶剂A)和0.1%的甲酸乙腈溶液(溶剂B)组成,流速为0.4mL/min,柱温为35℃。在0-3min从40-60%B梯度洗脱。对于标准品和样品,进样量为2μL。对于每种参比化合物,利用多种反应监测(MRM)模式检测到前体离子到产物离子的相关跃迁。在MS1全扫描测试中确定了5种分析物的每种,在MS/MS实验中确定了产物离子。使用直接输注和Optimizer B.08.00工作站软件解决方案(Agilent technologies,Santa Clara,CA,USA)对每种分析物的MRM跃迁进行了优化。最佳选择条件请参见表20。质谱仪参数设置如下:ESI源为正负两种模式;干燥气体(N2)流速为10L/min;气体温度为350℃;雾化器为40psi;毛细管为4.0kV。在按照制造商的指南运行之前,对MS系统进行完全校准。数据分析使用Agilent MassHunter定量/定性分析B.07.00(Agilent technologies,Santa Clara,CA,USA)进行。
表20:5种类姜黄色素和内标的保留时间(Tr)、多种反应监测(MRM)跃迁以及优化的串联质谱(MS/MS)检测参数。
分析人群
■ITT人群:本研究中随机分组的所有受试者食用了至少一剂量的产品(n=30)
■PP人群:ITT人群中完成本研究的受试者没有出现严重的方案偏差(n=30)。以下受试者被排除在PP人群之外:
■对于全部参数,受试者SN01-040-V5
■SAFETY人群:本研究中随机分组的所有受试者食用了至少一剂量的产品(n=30)
■
表21:显示平均值和标准偏差的基线处的研究人群的描述
软件环境
■使用
■显著性水平
■对于全部统计学检验(双尾),0.05的显著性水平用于证明具有统计学显著性效果的主张。
■处理丢失的动力学数据的方法
■如果动力学丢失了两个以上的值或两个连续的值,则无法进行AUC计算,并且在统计分析中将动力学视为丢失(未进行丢失数据替换);
■如果数据在T-10时间点丢失,则无法进行AUC计算,并且动力学在统计分析中被视为丢失(未进行丢失数据替换);
■如果动力学中某个值(基线值和最后一个时间点的值除外)丢失,则将其替换为使用Genolini开发的CopyMean方法获得的值(Genolini,2013);
■如果动力学的最后一个时间点(T1440=T24h)的值丢失,则不会进行丢失数据替换。
■如果丢失数据处理后动力学不完全,则无法计算AUC。
→该方法适用于ITT和PP人群。
衍生变量
■总类姜黄色素=姜黄素+DMC+BDMC+THC+HHC+姜黄素葡糖苷酸+DMC葡糖苷酸+BDMC葡糖苷酸+THC葡糖苷酸+HHC葡糖苷酸+硫酸姜黄素+硫酸DMC+硫酸BDMC+硫酸THC+硫酸HHC
如果这15个要素全部丢失,则无法计算总类姜黄色素。如果对这15个要素中的至少一个进行了量化,则会计算出总类姜黄色素。
■总母体化合物=姜黄素+DMC+BDMC之和
■总母体化合物及其相关硫酸酯和葡糖苷酸代谢物=姜黄素+姜黄素葡糖苷酸+硫酸姜黄素+DMC+DMC葡糖苷酸+硫酸DMC+BDMC+BDMC葡糖苷酸+硫酸BDMC
■姜黄素及其相关硫酸酯和葡糖苷酸代谢物=姜黄素+姜黄素葡糖苷酸+硫酸姜黄素
■DMC及其相关硫酸酯和葡糖苷酸代谢物=DMC+DMC葡糖苷酸+硫酸DMC
■BDMC及其相关硫酸酯和葡糖苷酸代谢物=BDMC+BDMC葡糖苷酸+硫酸BDMC
■姜黄素及其相关代谢物=姜黄素+姜黄素葡糖苷酸+硫酸姜黄素+THC+THC葡糖苷酸+硫酸THC+HHC+HHC葡糖苷酸+硫酸HHC
■0至24小时之间的相对生物利用度=不同测试制剂的剂量标准化AUC0-24h与对参比产品(姜黄提取物95%类姜黄色素)获得的剂量标准化AUC0-24h之比
■0至8小时之间的相对生物利用度=不同测试制剂的剂量标准化AUC0-8h与对参比产品(姜黄提取物95%类姜黄色素)获得的剂量标准化AUC0-8h之比
■0至无穷大之间的相对生物利用度=不同测试制剂的剂量标准化AUC0-∞与对参比产品(姜黄提取物95%类姜黄色素)获得的剂量标准化AUC0-∞之比
低于检测限(LOD)的值的数据处理
■在数据库中鉴定了姜黄素(天然,葡糖苷酸和硫酸酯)的某些低于检测限(LOD)的值,表示为《0.62》。
→在LOD下为每个参数和随访给出值的数量和百分比。
图形表示的产生
■有关测定值的定量变量:AUC参数的箱线图(如下图示例)
统计学检验假定的检查
■通过统计模型产生的残差的图形表示来研究正态性和均方差性的假设。如果与正态性和/或均方差有很大偏差,则考虑研究终点的对数变换(log10)。
注意结果的产生:
■STE=标准姜黄粉末提取物95%类姜黄色素1500mg
■TEP=姜黄素C3复合物California Gold Nutrition(1500mg C3
■NOV=Curcumin Cell’Innov(1000mg
■PHYT=Curcuma Platinum MannaVital(1000mg
■Turmipure GOLD
统计学方法
■主要终点:使用以下用于重复测量的混合模型分析0至24小时之间的剂量标准化AUC(
Y=产品+随访+基线+受试者
其中:
■Y:分析物血浆浓度的0-24形式的剂量标准化的AUC;
■产品:Turmipure Gold
■随访:随访V1-V5;
■基线:T-10时间点的参数值(用于AUC计算的T0);
■受试者
■如果具有显著的随访效果(p<0.05):则在第一阶段(随访)进行二次分析以评估产品效果。
■关注产品之间的比较→Turmipure Gold
额外的分析:性别作用的研究
■本研究使用以下混合模型对性别作用进行了重复测量(
Y=产品+随访+性别+产品*性别+基线+受试者
其中:
■Y:终点;
■产品:Turmipure Gold
■随访:随访V1-V5;
■性别:女性或男性;
■产品*性别:产品与相比之间的相互关系;
■基线:T-10时间点的参数值(用于AUC计算的T0);
■受试者
■关注产品之间的比较;
■Turmipure GOLD
■TEP与STE比较;
■NOV与STE比较;
■PHYT与STE比较;
■TEP与Turmipure GOLD
■NOV与Turmipure GOLD
■PHYT与Turmipure GOLD
■如果具有显著的随访效果(p<0.05):则在第一阶段(随访)进行二次分析以评估产品效果。
■如果具有显著的产品*性别相互作用效果(p<0.05):则分别研究了男性和女性的治疗效果(产生描述性统计数据和图形表示)
■如果具有显著的产品*性别相互作用效果(p>0.05):则全面研究治疗效果(男女在一起)
次要终点的统计方法(相对生物利用度除外)
■使用以下用于重复测量的混合模型分析次要终点(
Y=产品+随访+基线+受试者
■如果具有显著性随访效果(p<0.05):则在第一阶段(随访)进行二次分析以评估产品效果。
■关注的产品之间的比较:
■Turmipure GOLD
■TEP与STE比较;
■NOV与STE比较;
■PHYT与STE比较;
■TEP与Turmipure GOLD
■NOV与Turmipure GOLD
■PHYT与Turmipure GOLD
■相对生物利用度的统计方法
■使用以下用于重复测量的混合模型分析次要终点(
Y=产品+随访+受试者
■如果具有显著性随访效果(p<0.05):则在第一阶段(随访)进行二次分析以评估产品效果。
■关注的产品之间的比较:
■TEP与Turmipure GOLD
■NOV与Turmipure GOLD
■PHYT与Turmipure GOLD
主要终点结果概述
表22和23:ITT和PP人群的初步分析■ITT人群
■PP人群
表24和25:ITT和PP人群的附加分析(性别作用的研究)■ITT人群
■PP人群
●p-值<0.05(统计学显著性);○p-值>0.05(无统计学显著性)
从上述分析中,可以得出结论,对于ITT人群:
组间分析(共同考量全部性别)
■未鉴定随访显著性(p=0.2245)→因此,对全部随访进行分析。
■显著的产品效果(p<0.0001):
■主要终点:Turmipure GOLD
■其他比较:
■TEP与STE(调节的p=0.6948)
■NOV与STE(调节的p<0.0001;diff[调节的CI95%]=1.62[1.48;1.76])→NOV>STE
■PHYT与STE(调节的p<0.0001;diff[调节的CI95%]=0.48[0.34;0.62])→PHYT>STE
■TEP与Turmipure GOLD
■NOV与Turmipure GOLD
■PHYT与Turmipure GOLD
■附加分析:性别作用的研究
■无显著随访(p=0.2456)和产品*性别相互关系(p=0.3804)效果:对全部性别和所有随访共同进行分析。
■显著产品效果(p<0.0001):
■TEP与STE(调节的p=0.7091)
■NOV与STE(调节的p<0.0001;diff[调节的CI95%]=1.61[1.47;1.75])→NOV>STE
■PHYT与STE(调节的p<0.0001;diff[调节的CI95%]=0.48[0.34;0.62])→PHYT>STE
■Turmipure GOLD
■TEP与Turmipure GOLD
■NOV与Turmipure GOLD
■PHYT与Turmipure GOLD
对于PP人群:
■组间分析(共同考量全部性别)
■结果与对ITT人群观察到的结果类似。
■附加分析:性别作用的研究
■结果与对ITT人群观察到的结果类似。
次要终点的结果概述
有关ITT(表27-43)和PP(表44-60)人群的次要终点结果分别显示在下表中。在图24-37中提供了数据的图形表示。
以下关键字适用于每个表,指示每个结果的统计学显著性。
*仅对V1随访进行的分析(n=30)
严重不良反应:
■受试者SN01-009:V0和V1随访之间的宫颈疼痛/道路交通事故(无研究产品)(运动/风湿性人体系统,与病史无关的事件,中等强度,对研究产品无作用,与对于研究和研究产品无关的事件,与纠正治疗无关的事件,无后遗症的恢复)。
■重度治疗突发性AE:
■受试者SN01-007:V2与V3随访之间的腰痛(使用Turmipure GOLD
■与研究产品相关的AE:
■受试者SN01-008:V3随访当天的头痛(使用Turmipure GOLD
■受试者SN01-030:V1随访当天的头痛(使用Turmipure GOLD
■受试者SN01-032:V2随访当天的头痛(使用NOV产品)(神经/精神系统系统,与病史无关的事件,强度轻度,对研究产品无作用,可能与研究和研究产品有关的事件,与纠正治疗无关的事件,无后遗症的恢复)。
对PP人群观察到的结果与对ITT人群上观察到的结果相似。
总类姜黄色素(ITT人群)的平均值±SD如下所示。
结论
结果表明,TEP和STE中发现的化合物的生物利用度之间几乎没有差异(只有5个差异)。
发现本发明范围内的组合物(Turmipure GOLD
更具体地,使用Novasol为1000mg,而本发明的组合物(Turmipure GOLD
- 类姜黄色素组合物的用途
- 包含类姜黄色素的营养组合物及制造方法
