一种基于切离酶基因编辑技术的定向修复系统
文献发布时间:2023-06-19 10:33:45
技术领域
本申请涉及生物基因技术领域,尤其涉及一种基于切离酶基因编辑技术的定向修复系统。
背景技术
基因编辑技术指能够让微生物、动物和人类的细胞目标基因进行“编辑”,实现对靶点DNA片段的敲除和加入等的一项技术。自CRISPR/Cas9技术自问世以来,就有着其它基因编辑技术无可比拟的优势,技术不断改进后,更被认为能够在活细胞中最有效、最便捷地“编辑”任何基因。如果想使某个基因的功能丧失,可以在这个基因上产生位点切割,非同源末端连接修复的过程中往往会产生DNA的插入或删除,造成移码突变,从而实现基因敲除。
切除酶(又称切除酶;切割酶或切离酶)是由XIS基因编码的噬菌体蛋白,可以切除噬菌体插入细菌基因组的基因。采用了一种不寻常的翼状螺旋结构,其中两个α螺旋被包装在两个延伸的链上。结构中还存在一个双链反平行β-折叠片,其股线通过四残余翼连接。在与DNA相互作用期间,螺旋α被认为插入主沟中,而翼接触相邻的小沟或磷酸二酯骨干。切除酶的C末端区域参与与噬菌体编码的整合酶的相互作用。
现有CRISPR/Cas9酶切技术进行定向的基因编辑,CRISPR/Cas9酶切技术只能敲除靶向目的基因位点基因序列切割,如果去除基因组中的长片段,单独CRISPR/Cas9技术是无法实现,需要设计两个指导RNA序列;而且CRISPR/Cas9技术切除基因片段之后,其修复是依赖于细胞内的随机修复系统。
发明内容
本申请实施例提供了一种基于切离酶基因编辑技术的定向修复系统,用以解决现有的CRISPR/Cas9酶切技术进行定向的基因编辑,CRISPR/Cas9酶切技术只能敲除靶向目的基因位点基因序列切割,如果去除基因组中的长片段,单独CRISPR/Cas9技术是无法实现,需要设计两个指导RNA序列;而且CRISPR/Cas9技术切除基因片段之后,其修复是依赖于细胞内的随机修复系统的技术问题。
有鉴于此,本申请提供了一种基于切离酶基因编辑技术的定向修复系统,所述基因编辑定向修复系统建立在质粒的基础上,包括质粒载体;
所述质粒载体包括:编辑器和指导RNA,所述编辑器与所述指导RNA为非共价结合;
所述编辑器包括用于定向的核酸酶失活的Cas9结构域和XIS切离酶复合体;
所述指导RNA包含编码靶向区域的crRNA和特异性靶向基因;
所述核酸酶失活的Cas9结构域用于与所述指导RNA定向结合定位特异性位点,所述XIS切离酶复合体用于定向切除特异性靶向基因片段。
可选地,所述XIS切离酶复合体包括:Mycobacterium phage D29切离酶、Mycobacterium phage L5切离酶、Staphylococcus phage L54a切离酶、Streptomycesambofaciens切离酶、Bacillus subtilis切离酶、Enterobacteria phage phi80切离酶、Salmonella phage HK620切离酶、Shigella phage Sf6切离酶、Streptococcuspneumoniae切离酶、Streptococcus agalactiae serotype V切离酶、Escherichia phageHK022切离酶、Escherichia phage lambda切离酶、Enterobacteria phage 434切离酶、Enterobacteria phage P21切离酶、Saccharopolyspora erythraea切离酶、Salmonellaphage P22切离酶、Acyrthosiphon pisum secondary endosymbiont phage 1切离酶、Shigella phage SfV切离酶和丝状噬菌体切离酶XIS5。
可选地,所述核酸酶失活的Cas9结构域包括D10A、D10N、H840A、H840N、H840Y、G1104、L1111、S1136、G1218、N1317、T1337、D1135、S1109、G1104、S1136、R1335、T1337G、1104K、S1109T、L1111、S1136N、G1218R、N1317K、R1335E、T1337R、D1135V、D1135E、R1335Q中的一个或两个以上组合。
可选地,所述质粒载体包括:Pllp-OmpA、pllp-STII、pMBP-P、pMBP-C、pET-GST、pET-Trx、pET-His、pET-CKS、pET-DsbA、pTZ19R DNA、pUC57 DNA、PMD18T、PQE30、pUC18、pUC19、pTrcHisA、pTrxFus、pRSET-A和pRSET-B。
可选地,所述质粒载体还包括:pVAX1、PBR322、pbv220、pBluescript II KS(+)、L4440、pCAMBIA-1301、pMAL-p2X、pGD926、pGEX-2T、pGEX-2TK、pGEX-3X、pGEX-4T-1、pGEX-4T-2、pGEX-4T-3、pGEX-5X-1、pGEX-5X-2、pGEX-5X-3、pGEX-6P-1、pGEX-6P-2、pGEX-6P-3、PTYB1、PTYB2、PTYB11、PTYB12、pCDNA3.1(-)、pCDNA3.1(+)、pPICZ alpha A、pGAPZαA、PYES2.0、pBI121、pEGFP-N1、pEGFP-C1、pPIC9K、pPIC3.5K、PX459、PX458、pAAV、PX462、pUCori vector、plenti、pFUGW、pAAV、EF1a-lenti、Ai9、pX330-U6-Chimeric_BB-CBh-hSpCas9、pCAGEN、pcDNA3.1和pHKO_23。
可选地,所述指导RNA包括:crRNA和trRNA。
可选地,所述指导RNA还包括单一嵌合gRNA。
可选地,所述靶向目的基因为原核基因或真核基因。
可选地,所述原核基因为荧光蛋白基因或抗性基因和致病基因。
可选地,所述真核基因为HIV插入人源细胞基因或猪瘟病毒插入猪细胞基因。
从以上技术方案可以看出,本申请实施例具有以下优点:
本申请中提供了一种基于切离酶基因编辑技术的定向修复系统,包括质粒载体;质粒载体包括:编辑器和指导RNA,编辑器与指导RNA为非共价结合;编辑器包括用于定向的核酸酶失活的Cas9结构域和XIS切离酶复合体;指导RNA包含编码靶向区域的crRNA和特异性靶向基因;核酸酶失活的Cas9结构域用于与指导RNA定向结合定位特异性位点,XIS切离酶复合体用于定向切除特异性靶向基因片段。
本申请提供的一种基于切离酶基因编辑技术的定向修复系统,其利用核酸酶失活的Cas9结构域和指导RNA来定向基因位点,再利用切离酶来删除靶向目的基因的基因靶点进行定向修复,能够避免随机修复,为长距离定向基因删除提供了特异性定向修复能力。解决了现有的CRISPR/Cas9酶切技术进行定向的基因编辑,CRISPR/Cas9酶切技术只能敲除靶向目的基因位点基因序列切割,如果去除基因组中的长片段,单独CRISPR/Cas9技术是无法实现,需要设计两个指导RNA序列;而且CRISPR/Cas9技术切除基因片段之后,其修复是依赖于细胞内的随机修复系统的技术问题。
附图说明
为了更清楚地说明本申请实施例中的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本申请中记载的一些实施例,对于本领域普通技术人员来讲,还可以根据这些附图获得其他的附图。
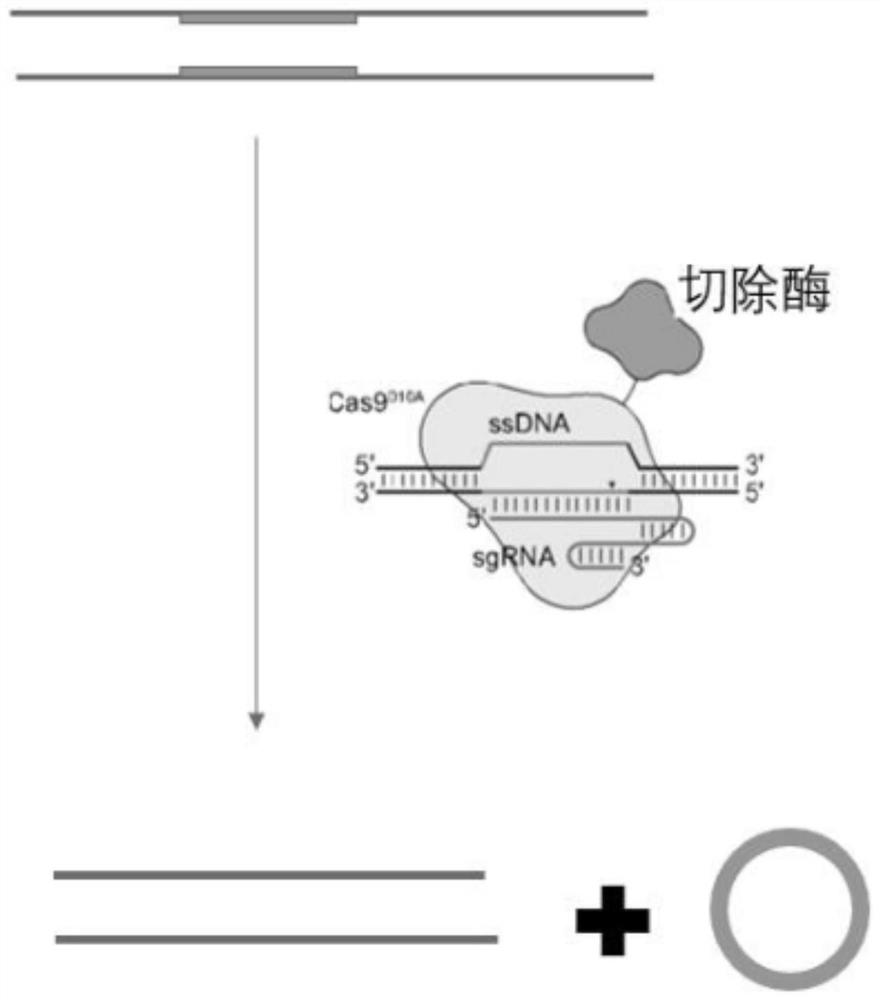
图1为本申请实施例中提供的一种基于切离酶基因编辑技术的定向修复系统的dCas9介导的Excisionase切除示意图;
图2为本申请实施例中提供的一种基于切离酶基因编辑技术的定向修复系统的dCas9-Excisionase HIV切除示意图。
具体实施方式
为了使本技术领域的人员更好地理解本申请方案,下面将结合本申请实施例中的附图,对本申请实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅是本申请一部分实施例,而不是全部的实施例。基于本申请中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本申请保护的范围。
实施例1
为了便于理解,请参阅图1,本申请提供的一种基于切离酶基因编辑技术的定向修复系统的一个实施例,包括质粒载体;质粒载体包括:编辑器和指导RNA,编辑器与指导RNA为非共价结合;编辑器包括用于定向的核酸酶失活的Cas9结构域和XIS切离酶复合体;指导RNA包含编码靶向区域的crRNA和特异性靶向基因;核酸酶失活的Cas9结构域用于与指导RNA定向结合定位特异性位点,XIS切离酶复合体用于定向切除特异性靶向基因片段。
需要说明的是,指导RNA包含编码靶向区域的crRNA和特异性靶向基因,特异性靶向基因的sgRNA双链寡核苷酸序列,Cas9首先与crRNA及tracrRNA结合成复合物,将其连接在一起得到sgRNA。将切离酶和非活性Cas9及序列特异性指导RNA的质粒引入细菌和细胞中,使用非活性Cas9和指导RNA定向结合特异性位点,再用切离酶可以定向切除特异性基因片段。核酸酶失活的Cas9结构域和指导RNA用于定向基因位点,将指导RNA包含编码靶向区域的crRNA进行定点编辑的靶向sgRNA克隆到包含ssDNA剪切的Cas9基因的质粒中,得到进行编辑的质粒。
本申请提供的一种基于切离酶基因编辑技术的定向修复系统,其利用核酸酶失活的Cas9结构域和指导RNA来定向基因位点,再利用切离酶来删除靶向目的基因的基因靶点进行定向修复,能够避免随机修复,为长距离定向基因删除提供了特异性定向修复能力。用以解决现有的CRISPR/Cas9酶切技术进行定向的基因编辑,CRISPR/Cas9酶切技术只能敲除靶向目的基因位点基因序列切割,如果去除基因组中的长片段,单独CRISPR/Cas9技术是无法实现,需要设计两个指导RNA序列;而且CRISPR/Cas9技术切除基因片段之后,其修复是依赖于细胞内的随机修复系统的技术问题。
实施例2
作为实施例1的进一步改进,质粒载体包括:Pllp-OmpA、pllp-STII、pMBP-P、pMBP-C、pET-GST、pET-Trx、pET-His、pET-CKS、pET-DsbA、pTZ19R DNA、pUC57 DNA、PMD18T、PQE30、pUC18、pUC19、pTrcHisA、pTrxFus、pRSET-A和pRSET-B。质粒载体还包括:pVAX1、PBR322、pbv220、pBluescript II KS(+)、L4440、pCAMBIA-1301、pMAL-p2X、pGD926、pGEX-2T、pGEX-2TK、pGEX-3X、pGEX-4T-1、pGEX-4T-2、pGEX-4T-3、pGEX-5X-1、pGEX-5X-2、pGEX-5X-3、pGEX-6P-1、pGEX-6P-2、pGEX-6P-3、PTYB1、PTYB2、PTYB11、PTYB12、pCDNA3.1(-)、pCDNA3.1(+)、pPICZ alpha A、pGAPZαA、PYES2.0、pBI121、pEGFP-N1、pEGFP-C1、pPIC9K、pPIC3.5K、PX459、PX458、pAAV、PX462、pUC ori vector、plenti、pFUGW、pAAV、EF1a-lenti、Ai9、pX330-U6-Chimeric_BB-CBh-hSpCas9、pCAGEN、pcDNA3.1和pHKO_23。
需要说明的是,质粒载体包含编码可操作地链接至该最小的人类免疫缺陷病毒(HIV)长末端重复序列(LTR)启动子的CRISPR相关的切离酶的分离核酸序列以及至少一个编码至少一个指导RNA的分离核酸,其中,至少一个指导RNA与HIV基因组中的靶点核酸序列互补。
实施例3
作为对以上实施例的进一步改进,核酸酶失活的Cas9结构域包括D10A、D10N、H840A、H840N、H840Y、G1104、L1111、S1136、G1218、N1317、T1337、D1135、S1109、G1104、S1136、R1335、T1337G、1104K、S1109T、L1111、S1136N、G1218R、N1317K、R1335E、T1337R、D1135V、D1135E、R1335Q中的一个或两个以上组合,XIS切离酶复合体包括:Mycobacteriumphage D29切离酶、Mycobacterium phage L5切离酶、Staphylococcus phage L54a切离酶、Streptomyces ambofaciens切离酶、Bacillus subtilis切离酶、Enterobacteria phagephi80切离酶、Salmonella phage HK620切离酶、Shigella phage Sf6切离酶、Streptococcus pneumoniae切离酶、Streptococcus agalactiae serotype V切离酶、Escherichia phage HK022切离酶、Escherichia phage lambda切离酶、Enterobacteriaphage 434切离酶、Enterobacteria phage P21切离酶、Saccharopolyspora erythraea切离酶、Salmonella phage P22切离酶、Acyrthosiphon pisum secondary endosymbiontphage 1切离酶、Shigella phage SfV切离酶和丝状噬菌体切离酶XIS5。
需要说明的是,在指导RNA存在下,核酸酶能够对靶向DNA序列包括哺乳动物的基因组的任意位点进行切割,造成ssDNA断链从而达到编辑目的如图1和图2所示。编辑手段包括内切、删除、引入突变、外源序列插入、片段置换等。本申请实施例采用的编辑手段是引入突变,突变可由一个或者两个以上组成,编辑效果包括基因灭活、基因突变、导入外源基因等。几乎任何基因组位点都能被核酸酶有效靶向和切割。利用本技术,实现特异性定向修复基因组靶向编辑。
实施例4
为了便于理解,请参阅图2,作为对以上实施例的进一步改进,靶向目的基因为原核基因或真核基因;原核基因可以为荧光蛋白基因,抗性基因和致病基因;真核基因可以为HIV插入人源细胞基因,猪瘟病毒插入猪细胞基因;所述指导RNA包括:crRNA和trRNA;所述指导RNA还包括单一嵌合gRNA,原核基因为荧光蛋白基因或抗性基因和致病基因,真核基因为HIV插入人源细胞基因或猪瘟病毒插入猪细胞基因。
需要说明的是,Cas9首先与crRNA及tracrRNA结合成复合物,将其连接在一起得到sgRNA,指导RNA还包括单一嵌合的gRNA;CRISPR相关的切离酶是Cas9,CRISPR相关的切离酶经优化用于在人类细胞中表达;用于被切离酶裂解的特异性病毒序列为靶向的指导RNA,该组合物诱导被该gRNA识别的ssDNA中的断裂。将基因编码Cas9置于最小启动子例如横跨该5'-LTR的HIV的控制之下,导致由HIV-1反式激活蛋白Tat造成的激活。例如HIV特异性的RNA的多倍体和切离酶如Cas9在细胞中的共表达,导致病毒DNA片段的修饰及/或切除,从而在体外和体内根除该病毒。编码反式激活小RNA(tracrRNA)的序列,其中,该tracrRNA融合至编码指导RNA的序列。
以上所述,以上实施例仅用以说明本申请的技术方案,而非对其限制;尽管参照前述实施例对本申请进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本申请各实施例技术方案的精神和范围。
- 一种基于切离酶基因编辑技术的定向修复系统
- 一种利用基因编辑技术敲除烟草二氢黄酮醇-4-还原酶基因提升芸香苷含量的方法及应用
