一种碳酸锂的提取方法
文献发布时间:2023-06-19 19:27:02
技术领域
本发明具体涉及一种碳酸锂的提取方法。
背景技术
随着科技发展,我国新能源汽车的产量和销量呈直线上升。而随着新能源的迅速发展,报废/退役的大量动力锂离子电池也引起了广泛关注。当新能源汽车动力电池容量衰减至低于80%时,动力电池就不能达到电动汽车的动力需求,就需要进行报废或退役处理。这些报废或退役的动力电池未来必定会成为我国主要的城市固体废弃物之一。废旧动力电池中的镍、钴、锰、锂等金属元素具有十分重要的价值,据美国地质调查局公布数据显示,2017年澳大利亚和智利锂产量分别为18700吨、12000吨,位居第一、第二位,两国产量合计占全球产量的76.2%,这说明全球锂生产集中度较高,中国产量约为3000吨,占总产量的7%,表明我国的锂资源相对匮乏,近年来锂矿作为战略资源而被禁止出口,锂价不断走高,许多企业开始对废旧锂电池中的锂元素回收开展研究。
现有技术方案中,发明专利CN110817907A公开了一种高纯碳酸锂纯化的处理系统及方法,主要应用于油田勘探过程中油田水、煤层气田产出水、盐湖卤水、盐湖晶间卤水、地热水、地下卤水、海水、温泉水中锂资源综合化利用。通过沉淀除杂,蒸发浓缩,离子交换,纯化精制,沉锂反应等工序,可得到高纯碳酸锂。但该法针对的为含镁,钙,锰离子的富锂溶液,并没考虑废旧锂电池回收过程中可能存在的其他杂质离子(铁,锌,铜,镍,钴等)对高纯碳酸锂提取的影响。
发明专利CN102502720B公开了一种环保、能耗低、成本低、产品质量高的深度碳化法处理碳酸盐型锂精矿生产电池级碳酸锂工艺,通过将锂精矿经过磨矿,两次洗矿,调浆,深度碳化,过滤及除钙,树脂交换除钙、镁、硼,加热分解,离心分离,洗涤,烘干与粉碎等步骤得到电池级碳酸锂,但此方法同样只针对于锂精矿原料,不一定适用于从废旧锂电池中提取电池级碳酸锂。相对以前的石灰苛化法,该法无需消耗石灰,产生的锂渣也较少,无需蒸发浓缩,解决了石灰苛化法工艺流程长、能耗高、渣量大及成本高等问题。
发明专利CN111994925A针对现有技术中“含钴、镍、锰、锂的混合溶液中含有大量的铁、镁、钙、铝、铜等杂质离子,造成钴、镍、锰、锂元素分离难度大且所得产品的品质低”的技术问题,目的在于提供一种成本低、工艺简单的废旧锂电池中有价资源的综合利用方法,利用该方法可提取纯净的三元前驱体和电池级碳酸锂。通过预处理,除铁铝,除铜,除钙镁锂,沉锂,闪蒸等步骤,得到电池级碳酸锂,解决了使用离子膜分离溶液离子存在的机械性能差、分离效率低、膜污染等问题。但该方法采用的是后端提锂的方式,所得锂溶液纯度较低,杂质含量较多,造成提取工艺复杂,能耗高等问题。
发明内容
本发明所要解决的技术问题是克服现有的利用废旧锂电池提取碳酸锂的方法所得的碳酸锂杂质含量较多、纯度低的问题,而提供一种碳酸锂的提取方法。采用本发明的碳酸锂的提取方法,提高了Li元素的回收率和纯度,提取得到的碳酸锂的纯度较高,利于实际应用。
本发明通过以下技术方案解决上述技术问题。
本发明还提供了一种碳酸锂的提取方法,其包括如下步骤:将锂电池正极材料进行酸处理、焙烧、浸出得富锂溶液、除杂、沉锂,即得所述碳酸锂;
所述除杂包括一次除杂和二次除杂;所述一次除杂调节所述富锂溶液的pH值为5-7;所述二次除杂调节所述富锂溶液的pH为9-10。
本发明中,所述除杂即通过向富锂溶液中加入碱性物质,使杂质元素生成不溶的氢氧化物而达到除杂的目的。
本发明中,所述一次除杂调节所述富锂溶液的pH值优选为5或7。
本发明中,所述二次除杂调节所述富锂溶液的pH值优选为9或10。
本发明中,所述一次除杂采用的碱性物质优选为氢氧化钙。
本发明中,所述二次除杂采用的碱性物质可为本领域常规可溶性碱,例如Na
本发明中,所述二次除杂后还包括将所述二次除杂后的溶液加热、搅拌、过滤。所述加热的温度可为50-60℃。
本发明中,所述酸处理采用的酸可为本领域常规的酸性物质,例如硫酸。
当所述酸处理采用的酸为硫酸时,所述硫酸优选为浓硫酸,即质量分数大于或等于70%的硫酸水溶液。
本发明中,进行所述酸处理时,所述锂电池正极材料与所述酸处理采用的酸的固液比可为10:(1-5),优选为10:(2-5),例如10:2或10:5。
本发明中,所述焙烧的温度可为600-700℃。
本发明中,所述焙烧的时间可为80-120min,优选为90-120min,例如95min、100min或110min。
本发明中,所述浸出的浸出液可为本领域常规浸出液,例如去离子水。
本发明中,进行所述浸出时,所述焙烧后得到的焙烧料与浸出液的液固比可为(5-10)∶1,优选为(7-10)∶1,例如7∶1、8∶1、9∶1或10∶1。
本发明中,所述浸出一般在常温下进行。所述常温是指室温25-28℃。
本发明中,所述浸出的时间可为90-120min。
本发明中,所述浸出一般在搅拌条件下进行。
本发明中,所述沉锂一般在碱性溶液中进行。所述碱性溶液可为本领域常规的碱性物质的溶液,优选为饱和Na
本发明中,所述沉锂的温度可为70-90℃,优选为80-90℃。
本发明中,所述沉锂后一般还包括将所述沉锂后所得的溶液过滤、洗涤滤渣和重结晶。
其中,所述重结晶的温度可为本领域常规温度,例如100℃。进行所述重结晶前时,优选地,先将所述沉锂后得到的粗制碳酸锂加水浆化后与CO
本发明一些优选实施方案中,所述碳酸锂的提取方法,包括如下步骤:将锂电池正极材料进行酸处理、焙烧、浸出得富锂溶液、除杂、沉锂,即得所述碳酸锂;所述一次除杂调节所述富锂溶液的pH值为5-7;所述二次除杂调节所述富锂溶液的pH为9-10;所述一次除杂采用的碱性物质为氢氧化钙;所述焙烧的时间为90-120min;进行所述酸处理时,所述锂电池正极材料与所述酸处理采用的酸的固液比为10:(2-5)。
本发明一些优选实施方案中,所述碳酸锂的提取方法,包括如下步骤:将锂电池正极材料进行酸处理、焙烧、浸出得富锂溶液、除杂、沉锂,即得所述碳酸锂;所述一次除杂调节所述富锂溶液的pH值为5-7;所述二次除杂调节所述富锂溶液的pH为9-10;所述一次除杂采用的碱性物质为氢氧化钙;所述焙烧的时间为90-120min;进行所述酸处理时,所述锂电池正极材料与所述酸处理采用的酸的固液比为10∶(2-5);进行所述浸出时,所述焙烧后得到的焙烧料与浸出液的液固比为(7-10)∶1。
本发明一些优选实施方案中,所述碳酸锂的提取方法,包括如下步骤:将锂电池正极材料进行酸处理、焙烧、浸出得富锂溶液、除杂、沉锂,即得所述碳酸锂;所述一次除杂调节所述富锂溶液的pH值为5-7;所述二次除杂调节所述富锂溶液的pH为9-10;所述一次除杂采用的碱性物质为氢氧化钙;所述焙烧的时间为90-120min;进行所述酸处理时,所述锂电池正极材料与所述酸处理采用的酸的固液比为10∶(2-5);进行所述浸出时,所述焙烧后得到的焙烧料与浸出液的液固比为(7-10)∶1;所述沉锂的温度为80-90℃。
本发明一些优选实施方案中,所述碳酸锂的提取方法,包括如下步骤:
S1、焙烧:将废旧锂电池正极粉料与浓硫酸按照固液比10∶(2-5)混合后,经过管式炉氮气气氛下600-700℃焙烧90-120min,以破坏正极材料结构;
S2、浸出:将S1中得到的焙烧料,加入一定比例的去离子水,液固比(7-10)∶1,常温搅拌90-120min,将溶液过滤后得到富锂溶液;
S3、除杂:向S2中得到的富锂溶液中加入氢氧化钙至溶液pH为5-7,搅拌、过滤后,在得到的滤液中加入30%Na
S4、沉锂:将S3所得滤液加至饱和Na
S5、重结晶:将S4所得粗制碳酸锂加水浆化,并通入CO
本发明一优选实施方案中,所述碳酸锂的提取方法,包括如下步骤:
S1、焙烧:将废旧锂电池正极粉料与浓硫酸按照固液比10:5混合后,经过管式炉氮气气氛下700℃焙烧120min,以破坏正极材料结构;
S2、浸出:将S1中得到的焙烧料,加入一定比例的去离子水,液固比10:1,常温搅拌120min,将溶液过滤后得到富锂溶液;
S3、除杂:向S2中得到的富锂溶液中加入氢氧化钙至溶液pH为7,搅拌、过滤后,在得到的滤液中加入30%Na
S4、沉锂:将S3所得滤液加至饱和Na
S5、重结晶:将S4所得粗制碳酸锂加水浆化,并通入CO
在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
本发明所用试剂和原料均市售可得。
本发明的积极进步效果在于:
(1)采用本发明的碳酸锂的提取方法,提高了Li元素的回收率和纯度,提取得到的碳酸锂的纯度较高,利于实际应用。
(2)本发明的碳酸锂的提取方法提取得到的碳酸锂中的杂质含量较低,在一些实施方案中,碳酸锂的纯度可达电池级标准。
附图说明
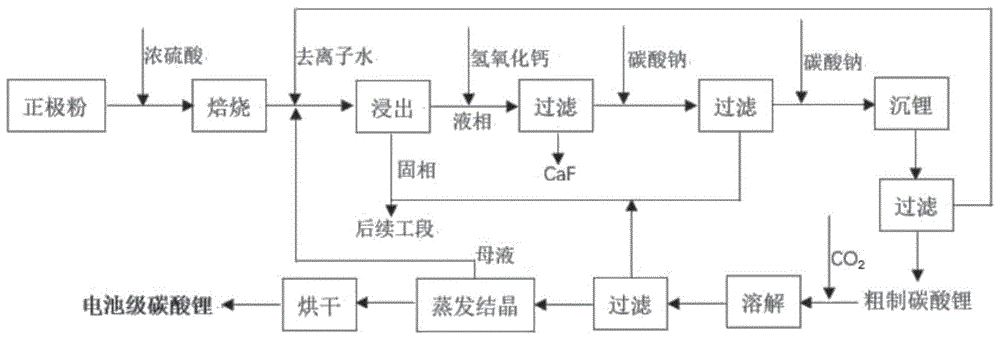
图1为本发明的碳酸锂提取工艺流程示意图。
具体实施方式
下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
下述实施例中的废旧锂电池正极粉料与浓硫酸混合前,无需预处理。
下述实施例中的废旧锂电池正极粉料来自江苏省苏州市某废旧锂电池拆解厂,利用手工拆除三元动力锂电池包外壳,再通过机械拆解、破碎、分选、焙烧的方式获得的正极粉料。
除特别说明外,下述实施例中采用的实验试剂均市售可得。
本发明的碳酸锂提取工艺流程示意图如图1所示,具体实施例及对比例如下:
实施例1
步骤(1),将废旧锂电池正极粉料与浓硫酸按照固液比(10∶2)混合后,经过管式炉氮气气氛下600℃焙烧90min,以破坏正极材料结构。
步骤(2),将步骤(1)中得到的焙烧料,加入一定比例的去离子水(液固比7∶1),常温搅拌90min,将溶液过滤后得到富锂溶液。
步骤(3),向步骤(2)中得到的富锂溶液中加入氢氧化钙至溶液pH为5,搅拌、过滤后,在得到的滤液中加入30%Na
步骤(4),将步骤(3)所得滤液加至饱和Na
步骤(5),将步骤(4)所得粗制碳酸锂加水浆化,并通入CO
经检测,所得碳酸锂纯度为99.5%,达到电池级标准。
实施例2
步骤(1),将废旧锂电池正极粉料与浓硫酸按照固液比(10∶5)混合后,经过管式炉氮气气氛下700℃焙烧120min,以破坏正极材料结构。
步骤(2),将步骤(1)中得到的焙烧料,加入一定比例的去离子水(液固比10∶1),常温搅拌120min,将溶液过滤后得到富锂溶液。
步骤(3),向步骤(2)中得到的富锂溶液中加入氢氧化钙至溶液pH为7,搅拌、过滤后,在得到的滤液中加入30%Na
步骤(4),将步骤(3)所得滤液加至饱和Na
步骤(5),将步骤(4)所得粗制碳酸锂加水浆化,并通入CO
经检测,所得碳酸锂纯度为99.6%,达到电池级标准。
实施例3步骤(1),将废旧锂电池正极粉料与浓硫酸按照固液比10∶2混合后,经过管式炉氮气气氛下600℃焙烧80min,以破坏正极材料结构。
步骤(2),将步骤(1)中得到的焙烧料,加入一定比例的去离子水(液固比7∶1),常温搅拌90min,将溶液过滤后得到富锂溶液。
步骤(3),向步骤(2)中得到的富锂溶液中加入氢氧化钙至溶液pH为5,搅拌、过滤后,在得到的滤液中加入30%Na
步骤(4),将步骤(3)所得滤液加至饱和Na
步骤(5),将步骤(4)所得粗制碳酸锂加水浆化,并通入CO
经检测,所得碳酸锂纯度为99.2%,达到工业级标准。
实施例4
步骤(1),将废旧锂电池正极粉料与浓硫酸按照固液比10∶2混合后,经过管式炉氮气气氛下600℃焙烧90min,以破坏正极材料结构。
步骤(2),将步骤(1)中得到的焙烧料,加入一定比例的去离子水(液固比7∶1),常温搅拌90min,将溶液过滤后得到富锂溶液。
步骤(3),向步骤(2)中得到的富锂溶液中加入氢氧化钙至溶液pH为5,搅拌、过滤后,在得到的滤液中加入30%Na
步骤(4),将步骤(3)所得滤液加至饱和Na
步骤(5),将步骤(4)所得粗制碳酸锂加水浆化,并通入CO
经检测,所得碳酸锂纯度为99.1%,达到工业级标准。
实施例5
步骤(1),将废旧锂电池正极粉料与浓硫酸按照固液比10∶2混合后,经过管式炉氮气气氛下600℃焙烧90min,以破坏正极材料结构。
步骤(2),将步骤(1)中得到的焙烧料,加入一定比例的去离子水(液固比5∶1),常温搅拌90min,将溶液过滤后得到富锂溶液。
步骤(3),向步骤(2)中得到的富锂溶液中加入氢氧化钙至溶液pH为5,搅拌、过滤后,在得到的滤液中加入30%Na
步骤(4),将步骤(3)所得滤液加至饱和Na
步骤(5),将步骤(4)所得粗制碳酸锂加水浆化,并通入CO
经检测,所得碳酸锂纯度为99.3%,达到工业级标准。
实施例6
步骤(1),将废旧锂电池正极粉料与浓硫酸按照固液比(10∶1)混合后,经过管式炉氮气气氛下600℃焙烧90min,以破坏正极材料结构。
步骤(2),将步骤(1)中得到的焙烧料,加入一定比例的去离子水(液固比7∶1),常温搅拌90min,将溶液过滤后得到富锂溶液。
步骤(3),向步骤(2)中得到的富锂溶液中加入氢氧化钙至溶液pH为5,搅拌、过滤后,在得到的滤液中加入30%Na
步骤(4),将步骤(3)所得滤液加至饱和Na
步骤(5),将步骤(4)所得粗制碳酸锂加水浆化,并通入CO
经检测,所得碳酸锂纯度为99.1%,达到工业级标准。
实施例7
步骤(1),将废旧锂电池正极粉料与浓硫酸按照固液比(10∶2)混合后,经过管式炉氮气气氛下600℃焙烧90min,以破坏正极材料结构。
步骤(2),将步骤(1)中得到的焙烧料,加入一定比例的去离子水(液固比7∶1),常温搅拌90min,将溶液过滤后得到富锂溶液。
步骤(3),向步骤(2)中得到的富锂溶液中加入氢氧化钠至溶液pH为5,搅拌、过滤后,在得到的滤液中加入30%Na
步骤(4),将步骤(3)所得滤液加至饱和Na
步骤(5),将步骤(4)所得粗制碳酸锂加水浆化,并通入CO
经检测,所得碳酸锂纯度为99.0%,达到工业级标准。
实施例及对比例中涉及的关键条件参数如下表1所示:
表1
效果实施例1
测试对象:实施例1-7制得的碳酸锂。
测试方法:
碳酸锂纯度测定:测定方法《GB/T11064.1-2013碳酸锂、单水氢氧化锂、氯化锂化学分析方法第1部分:碳酸锂量的测定酸碱滴定法》。
Li浸出率测定:测定方法《YST-二次电池废料化学分析方法第4部分:锂量的测定(2)》,设备型号:AA-6880G型原子吸收分光光度计(日本产)。
测试结果:如下表2所示。
表2
/>
由上表2中的数据可得,采用本发明的碳酸锂提取方法得到的碳酸锂的纯度较高,可达99.6%,Li浸出率也较高,可达96.5%。具体地,发明人通过实验探究发现:
不同的焙烧时间一定程度上影响碳酸锂提取效果,例如,与实施例1相比,实施例3中焙烧时间较低,提取得到的碳酸锂纯度较低,Li浸出率也较低。
不同的沉锂温度一定程度上影响碳酸锂提取效果,例如,与实施例1相比,实施例4中除杂后的富锂溶液加热温度(即沉锂温度)较低,溶液中的碳酸锂沉淀不完全,提取得到的碳酸锂纯度较低,Li浸出率也较低。
不同的焙烧料与浸出液的液固比一定程度上影响碳酸锂提取效果,例如,例如,与实施例1相比,实施例5中焙烧料与去离子水的液固比较低,焙烧料不能充分被较好浸没,且焙烧料中的可溶性锂不能被较好溶出,提取得到的碳酸锂纯度较低,Li浸出率也较低。
此外,通过比较实施例1与实施例6,可得,废旧锂电池正极粉料与酸的固液比等条件也在一定程度上影响碳酸锂提取效果;通过比较实施例1与实施例7,可得,一次除杂时采用不同种类的碱,对碳酸锂提取效果影响较大。
综上,采用本发明的碳酸锂提取方法,可优先使Li元素浸出,而Ni,Co,Mn元素仍在固相中,提高了后续Li元素的回收率和纯度;本发明的提取方法可较好去除提锂过程中存在于废旧锂电池中的主要杂质元素,如F,Al,Ni,Co,Mn等元素,最终得到的碳酸锂的纯度较高。
