一种抗肿瘤血管生成药物增效剂、抗肿瘤药物组合物及应用
文献发布时间:2024-04-18 19:58:21
本申请要求申请日为2023年03月31日,申请号为CN2023103403499,发明名称为“一种抗肿瘤血管生成药物增效剂、抗肿瘤药物组合物及应用”的在先申请的优先权,该在先申请的全部内容均已在本申请中体现。
技术领域
本发明属于医疗领域,具体涉及一种抗肿瘤血管生成药物增效剂、抗肿瘤药物组合物及应用。
背景技术
异常的血管系统及免疫抑制是实体肿瘤的两大特点,由于肿瘤细胞的恶性增殖,其血管系统难以维持高负荷的代谢供氧,因此肿瘤会分泌过量的促血管生长因子,一方面会促进血管内皮细胞的快速增殖,导致其无序堆积;另一方面会破坏内皮细胞基膜,抑制周细胞与平滑肌细胞在新生血管的覆盖,造成肿瘤血管膜和管腔结构的异常。此外,不受控制的肿瘤细胞生长扩张会受到周围宿主组织的限制而产生机械力,进而压缩瘤内血管致管腔塌陷。因此肿瘤血管在宏观上表现为血管不完整,渗透性增强,组织间隙液压增高,血管灌注不足等特点,而运输氧气不足和代谢产物不能及时运出又会进一步导致促血管生成因子和炎性因子的释放,不仅会引起更多异常的血管生成,也会形成高压、低PH、免疫抑制的肿瘤微环境。
大量研究发现,相较于单纯抑制血管生成和使血管衰退,如何有效诱导肿瘤血管正常化,促进免疫细胞浸润和化疗药物的递送才是治疗的重要目的和机制。目前利用抗血管形成药物调节血管正常化,进而联合免疫治疗表现出极佳抗肿瘤疗效,被美国FDA批准用于肺癌和肝癌等的治疗。然而,抗血管药物诱导血管正常化程度不足或血管正常化窗口期短,窗口期外的治疗会恶性抑制血管生成并产生耐药,引起新的免疫抑制,导致血管和免疫循环耐药,给抗血管联合免疫治疗带来巨大挑战。
因此,本领域仍然需要开发新的抗血管联合免疫治疗方法。
发明内容
针对上述技术问题,本发明的目的在于提供一种抗肿瘤血管生成药物增效剂、抗肿瘤药物组合物及应用,具体包括以下内容:
第一方面,本发明提供了一种SHCBP1抑制剂在制备抗肿瘤血管生成药物增效剂中的应用;所述SHCBP1抑制剂干扰/抑制SHCBP1表达。
优选地,所述SHCBP1抑制剂包括RNA干扰试剂或小分子抑制剂。
优选地,所述SHCBP1抑制剂为小分子抑制剂为shRNA及小分子抑制剂MS1943;所述shRNA的序列SEQ ID NO.1-2所示;所述MS1943的结构式如下式(Ⅰ)所示:
优选地,所述抗肿瘤血管生成药物为VEGFR2抑制剂。
优选地,所述VEGFR2抑制剂包括抗VEGFR2抗体或VEGFR2酪氨酸激酶抑制剂。
优选地,所述VEGFR2抑制剂为阿帕替尼。
第二方面,本发明提供了一种用于抗肿瘤的药物组合物,所述药物组合物包括SHCBP1抑制剂和抗肿瘤血管生成药物。
优选地,所述SHCBP1抑制剂包括RNA干扰试剂或小分子抑制剂。
优选地,所述SHCBP1抑制剂为小分子抑制剂为shRNA及小分子抑制剂MS1943;所述shRNA的序列SEQ ID NO.1-2所示;所述MS1943的结构式如下式(Ⅰ)所示:
优选地,所述抗肿瘤血管生成药物为VEGFR2抑制剂。
优选地,所述VEGFR2抑制剂包括抗VEGFR2抗体或VEGFR2酪氨酸激酶抑制剂。
优选地,所述VEGFR2抑制剂为阿帕替尼。
优选地,所述药物组合物还包括免疫治疗药物。
优选地,所述免疫治疗药物包括PD-1抑制剂。
优选地,所述PD-1抑制剂为PD-1抗体。
第三方面,本发明提供了上述第二方面所述的药物组合物在制备抗肿瘤药物中的应用。
优选地,所述癌症包括胃癌和乳腺癌。
本发明的有益效果是:
本发明发现:①敲除SHCBP1可显著增敏抗肿瘤血管生成药物(阿帕替尼)抑制肿瘤血管形成,通过影响α-SMA、PDGFR2及血管黏附因子VCAM-1在新生血管的聚集和黏附促进血管正常化,表明抑制SHCBP1表达能够增强抗肿瘤血管生成药物的敏感性,即SHCBP1抑制剂可作为抗肿瘤血管生成药物的增效剂;②敲除SHCBP1后联合抗肿瘤血管生成药物(阿帕替尼)可促进肿瘤血管正常化并改善免疫微环境,抑制乳腺癌生长并延长生存预后,即SHCBP1的敲除联合抗肿瘤血管生成药物(例如阿帕替尼)可有效抑制肿瘤生长,改善肿瘤局部缺氧和血管灌注,促进免疫细胞浸润,因此SHCBP1抑制剂与抗肿瘤血管生成药物联合具有显著的抗肿瘤活性;③敲除SHCBP1后联合抗肿瘤血管生成药物(阿帕替尼)和免疫治疗药物(PD1抗体)可以显著抑制肿瘤细胞的生长,提高抗肿瘤血管治疗效果;④进一步地,SHCBP1抑制剂MS1943联合抗肿瘤血管生成药物(阿帕替尼)和免疫治疗药物(PD1抗体)可显著抑制肿瘤细胞的生长,提高抗肿瘤血管治疗效果,表明SHCBP1抑制剂与抗肿瘤血管生成药物以及免疫治疗药物联合进一步提高的抗肿瘤活性,具有广泛的应用价值。
附图说明
图1SHCBP1在阿帕替尼抑制血管生成中的增敏作用结果;
图2SHCBP1-KO联合阿帕替尼抑制肿瘤生成(A-C所示),促进肿瘤血管正常化(D-F所示);
图3SHCBP1-KO联合阿帕替尼改善肿瘤血管渗漏(A所示)和肿瘤缺氧(B所示);
图4:SHCBP1敲除联合阿帕替尼诱导肿瘤PD-L1的表达(A所示)和促进免疫细胞CD4
图5SHCBP1敲除联合阿帕替尼和PD1抗体抑制乳腺癌细胞的生长。
图6SHCBP1抑制剂MS1943联合阿帕替尼和PD1抗体抑制乳腺癌细胞的生长。
具体实施方式
下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于举例说明本发明,而不应视为限定本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过商购获得的常规产品。除非另外指明,否则本发明的实施将采用在本领域技术人员范围内的分子生物学(包括重组技术)、微生物学、细胞生物学、生物化学和免疫学等的常规技术,在诸如以下的文献中充分解释:Molecular Cloning:A Laboratory Manual,second edition(Sambrook等人,1989)Cold Spring Harbor Press;OligonucleotideSynthesis(M.J.Gait编辑,1984);Methods in Molecular Biology,Humana Press;CellBiology:A Laboratory Notebook(J.E.Cellis编辑,1998)Academic Press;Animal CellCulture(R.I.Freshney编辑,1987);Introduction to Cell and Tissue Culture(J.P.Mather and P.E.Roberts,1998)Plenum Press;Cell and Tissue Culture:Laboratory Procedures(A.Doyle,J.B.Griffiths,and D.G.Newell编辑,1993-1998)J.Wiley and Sons;Methods in Enzymology(Academic Press,Inc.);Handbook ofExperimental Immunology(D.M.Weir and C.C.Blackwell编辑);Gene Transfer Vectorsfor Mammalian Cells(J.M.Miller and M.P.Calos编辑,1987);Current Protocols inMolecular Biology(F.M.Ausubel等人编辑,1987);PCR:The Polymerase ChainReaction,(Mullis等人编辑,1994);Current Protocols in Immunology(J.E.Coligan等人编辑,1991);Sambrook and Russell,Molecular Cloning:ALaboratory Manual,3rd.ed.,Cold Spring Harbor Laboratory Press,Cold Spring Harbor,NY(2001);Ausubel等人,Current Protocols in Molecular Biology,John Wiley&Sons,NY(2002);Harlow and Lane Using Antibodies:A Laboratory Manual,Cold Spring HarborLaboratory Press,Cold Spring Harbor,NY(1998);Coligan等人,Short Protocols inProtein Science,John Wiley&Sons,NY(2003);Short Protocols in Molecular Biology(Wiley and Sons,1999);Immunobiology(C.A.Janeway and P.Travers,1997);Antibodies(P.Finch,1997);Antibodies:a practical approach(D.Catty.编辑,IRLPress,1988-1989);Monoclonal antibodies:a practical approach(P.Shepherd andC.Dean编辑,Oxford University Press,2000);Using antibodies:a laboratory manual(E.Harlow and D.Lane(Cold Spring Harbor Laboratory Press,1999);The Antibodies(M.Zanetti and J.D.Capra编辑,Harwood Academic Publishers,1995)。
本申请所述抗肿瘤血管生成药物以阿帕替尼(医用江苏恒瑞医药股份有限公司)为例;胎牛血清和ECM培养基(Sciencell),MTT细胞增殖检测试剂盒(Promega),SHCBP1抗体(sigma),VEGFR2抗体(Cell Signaling Technology),免疫组织化学染色试剂盒(武汉博士德生物),Alexa Fluor 488荧光二抗和Alexa Fluor 647荧光二抗(Abcam),Biacor CM5芯片(GE Healthcare),Flag抗体凝胶珠(Sigma),Matrige基质胶(Corning)。
细胞系:人脐静脉内皮细胞HUVEC提取自新生儿脐带,并已通过兰州大学第二临床医学院伦理审查。
实验动物:SHCBP1敲除鼠及MMTV-PyMT乳腺癌自发瘤模型鼠购自上海南方模式生物科技发展有限公司。
人胃癌临床组织样本:所有人胃癌临床组织样本由兰州大学第二医院提供,所有患者签署知情同意书,实验过程经过兰州大学第二医院人体伦理委员会批准。
研究方法如下:
(1)胃癌肿瘤类器官与血管内皮细胞(HUEVCs)共培养模型建立:①HUEVC分离培养:取15cm新生儿脐带,无菌PBS冲洗后灌入0.1%的Ⅰ型胶原酶,37℃孵育15min。收集消化液1000rpm离心后至于ECM完全培养基培养;②胃癌类器官构建:取1cm
分离了8例来源于不同人体的HUEVC,并建立2例胃癌患者肿瘤类器官,建立了HUEVC和类器官缺氧共培养模型。
(2)SHCBP1敲减HUEVCs细胞系的构建:①根据人SHCBP1基因设计并合成2种靶向SHCBP1的shRNA(如表1所示);②细胞感染:将HUVEC细胞以2×10
表1两种靶向SHCBP1的shRNA序列
(3)SHCBP1血管内皮条件性敲除鼠模型的建立:采用SHCBP1flox鼠和血管内皮Cdh5-2A-Cre鼠杂交获得。SHCBP1flox鼠全名为C57BL/6J-SHCBP1em1(flox)Smoc(南方模式动物),采用CRISPR/Cas9技术进行SHCBP1基因编辑。经过gRNA及donor载体构建、显微注射、F0代、F1代和纯合子繁育及基因型鉴定等过程获得SHCBP1flox纯合子鼠。Cdh5-2A-Cre鼠品名为C57BL/6-Cdh5em1(2A-CreERT2-WPRE-polyA)Smoc(Jackson Laboratory),一种特异性表达于血管内皮的Cre工具鼠,SHCBP1flox鼠与血管内皮Cdh5-2A-Cre鼠交配,获得SHCBP1条件性敲除小鼠Cdh5-Cre SHCBP1flox。
(4)SHCBP1小分子抑制剂的筛选:利用Alpha Fold 2对SHCBP1进行建模获得蛋白质三维结构,使用MOE软件的Site Finder检索查找潜在的小分子结合口袋。其次利用药明康德公司DELopen技术,即利用蛋白质药物垂钓法从四亿个DNA编码的小分子中进行初步筛选,获得潜在可与SHCBP1结合的小分子抑制剂,再使用MOE软件的Dock模块对潜在的小分子抑制剂进行虚拟对接筛选,最后结合SPR亲和筛选,最终获得SHCBP1抑制剂。目前已获得SHCBP1小分子结合口袋模型,并利用DELopen试剂盒完成SHCBP1潜在抑制剂的垂钓,正在进行结果解析。
(5)胃癌人源化肿瘤异种移植模型(PDX)建立:取1cm
实施例1 SHCBP1调节阿帕替尼抑制血管形成的敏感性
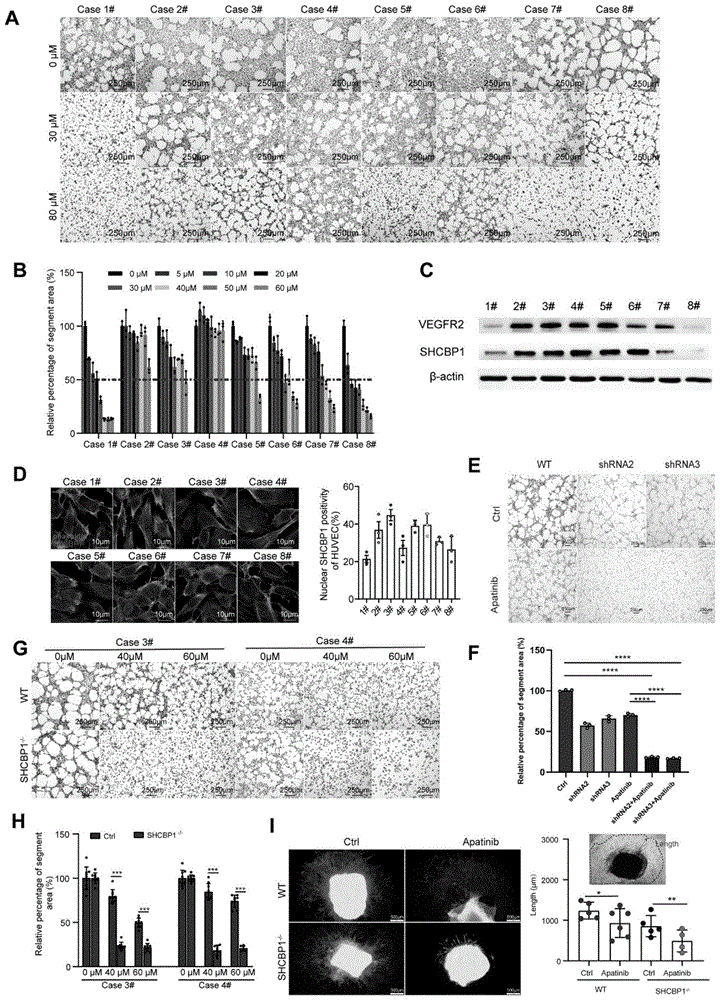
申请人分离了8例不同供体的HUEVC,利用成环实验检测其对阿帕替尼的敏感性,发现阿帕替尼耐药细胞具有SHCBP1高表达(图1中A-B所示)、且核转位增加的现象(图1中C-D所示);而敲减或敲除SHCBP1均可增敏阿帕替尼抑制血管生成(图1中E-H所示);通过体外培养SHCBP1敲除鼠颈动脉发现,SHCBP1敲除鼠动脉内皮细胞对阿帕替尼具有更高的敏感性(图1中I所示)。上述结果表明,抑制SHCBP1表达可以增强抗肿瘤血管生成药物的敏感性,即SHCBP1的表达抑制剂可作为抗肿瘤血管生成药物的增敏剂,增强血管内皮细胞对抗肿瘤血管生成药物的敏感性。
实施例2 SHCBP1敲除增敏阿帕替尼改善小鼠肿瘤血管正常化
利用SHCBP1敲除鼠与PyMT乳腺癌自发瘤模式鼠杂交形成SHCBP1敲除的乳腺癌自发瘤模型,并给与小鼠60mg/kg阿帕替尼处理(图2中A所示),结果显示,SHCBP1敲除鼠联合阿帕替尼可显著抑制乳腺癌生长并延长小鼠生存预后(图2中B和C所示);此外,小鼠组织免疫荧光染色显示,SHCBP1敲除可显著增敏阿帕替尼抑制肿瘤血管形成,促进血管正常化,影响α-SMA、PDGFR2及血管黏附因子VCAM-1在新生血管的聚集和黏附(分别如图2中D-F所示)。上述结果表明,抑制SHCBP1表达可以增强抗肿瘤血管生成药物的敏感性,促进肿瘤血管正常化,即SHCBP1的表达抑制剂可作为抗肿瘤血管生成药物的增敏剂,与抗肿瘤血管生成药物联合可促进肿瘤血管正常化,增强抗肿瘤活性。
实施例3 SHCBP1敲除改善肿瘤血管渗漏和肿瘤缺氧
申请人检测了肿瘤血管渗漏及肿瘤缺氧情况,结果显示SHCBP1敲除联合阿帕替尼可显著改善肿瘤渗漏(图3中A所示)及肿瘤缺氧(图3中B所示)。上述结果表明,抑制SHCBP1表达可以改善肿瘤血管渗漏和肿瘤缺氧情况,即SHCBP1抑制剂与抗肿瘤血管生成药物联合能够进一步改善肿瘤血管渗漏和肿瘤缺氧活性,增强抗肿瘤活性。
实施例4 SHCBP1敲除可增敏阿帕替尼改善小鼠肿瘤微环境
随后,申请人检测了肿瘤细胞中PD-L1的表达和免疫细胞浸润情况,结果如图4所示,发现SHCBP1敲除可显著诱导肿瘤中PD-L1表达升高(图4中A所示),促进免疫细胞CD4
实施例5 SHCBP1敲除联合阿帕替尼与PD1抗体可显著抑制小鼠肿瘤生长
申请人利用SHCBP1敲除鼠与PyMT乳腺癌自发瘤模式鼠杂交形成SHCBP1敲除的乳腺癌自发瘤模型,并给与模型小鼠阿帕替尼(60mg/kg,口服,3天一次)或PD-1抗体(200μg/只,3天一次)处理(图5中A所示),结果显示,SHCBP1-KO联合阿帕替尼与PD1抗体可显著延长小鼠生存预后并抑制乳腺癌生长(图5中B-C)。上述结果表明,抑制SHCBP1表达后,联合抗肿瘤血管生成药物和PD1抗体可显著抑制肿瘤细胞增殖,表明SHCBP1抑制剂与抗肿瘤血管生成药物和免疫治疗药物联合可显著抑制肿瘤细胞增殖,增强抗肿瘤活性。
实施例6 SHCBP1抑制剂MS1943联合阿帕替尼与PD1抗体可显著抑制小鼠肿瘤生长
申请人利用微量热涌动筛选到可直接靶向SHCBP1的小分子化合物MS1943,其亲和力达128.32nM(图6中A所示)。该抑制剂联合阿帕替尼可显著抑制血管内皮细胞的成环能力(图6中B-C所示)。此外,利用PyMT乳腺癌自发瘤模式鼠,并给与小鼠MS1943(50mg/kg,腹腔注射,2天一次)或60mg/kg的阿帕替尼或PD-1抗体200μg/只处理,结果显示,SHCBP1抑制剂MS1943联合阿帕替尼与PD1抗体可显著抑制乳腺癌生长(图6中D-G)。上述结果表明,SHCBP1的抑制剂与抗肿瘤血管生成药物和免疫治疗药物联合可显著抑制肿瘤细胞增殖,增强抗肿瘤活性。
- 一种提高抗肿瘤药物敏感性的药物组合物及其在制备抗肿瘤药物中的应用
- 黄精花在制备抗肿瘤药物中的应用以及基于黄精花的抗肿瘤药物组合物
