一种含Fe3O4纳米颗粒的去核细胞及其制备与在抗衰老中的应用
文献发布时间:2024-04-18 20:01:23
技术领域
本发明属于合成生物学技术,具体涉及一种含Fe
背景技术
线粒体属于半自主细胞器,细胞生物化学反应所需的绝大部分能量由线粒体提供。线粒体还参与了细胞众多的基本活动。线粒体DNA(mtDNA)易于发生突变,这些突变可能发生孟德尔型遗传,也可能是母性遗传、散发性、或在发育的某个阶段爆发,导致线粒体功能障碍,其在衰老、代谢疾病、神经退行性疾病、神经肌肉病和癌症等都发挥重要作用。因此,线粒体现在越发成为研究的热点和生物医药公司关注的靶点。
线粒体移植在体内能自然地发生,在体外细胞培养过程中也可以通过一种被成为隧道纳米管的结构进行转移。另外,细胞还可以释放包含线粒体的小泡并转移给周围的细胞。上述线粒体移植据报道可导致自由基(ROS)和细胞凋亡的减少,然而,这些途径移植线粒体的效率地下,限制了他们的生物医药价值。
目前有许多报道纯化线粒体移植的研究,据说线粒体移植在各种研究模型甚至临床研究中都能有效对抗线粒体共功能障碍。McCully及其同事报道了线粒体移植可降低心肌梗死面积,减少心肌细胞损失,并改善缺血后心肌功能。Zhang等报道了线粒体移植可减少卒中大鼠模型的脑梗死容积并逆转神经功能缺陷。然而,以上研究的生物学机制并未阐明,导致纯化线粒体的应用受到质疑。
去核细胞是著名的生物载体,可用于递送正常线粒体或含突变DNA的患者线粒体至缺失线粒体的细胞(Rho0细胞)。在上述情形里,线粒体被质膜包被,可避免严峻环境的伤害从而保持完整状态。一种小型去核细胞即质膜囊泡(PMV),通过机械挤压细胞获得,可被用于移植有功能的线粒体。Rho0细胞及对乙酰氨基酚伤害的HepG2肝脏细胞移植线粒体后得到很好的保护,细胞免于死亡并获得增殖活性。然而,这种方法严重依赖细胞膜融合,但细胞膜融合是众所周知地困难,而且经常导致细胞死亡。
膜融合是生物细胞的一个基本过程,参与膜的生物发生、细胞内运输、激素分泌和病毒感染。膜融合经历了一系列的明确的中间步骤,即所谓的半融合模型。这些步骤受能量壁垒控制,而各类促融合试剂,如蛋白、多肽、脂肪和离子据报道可以克服融合过程的能量壁垒。能量壁垒还可以通过机械或化学的技术得以解除,如PEG诱导和电刺激,但这类方法效率低且导致严重的细胞毒性。
发明内容
本发明的目的在于提供含Fe
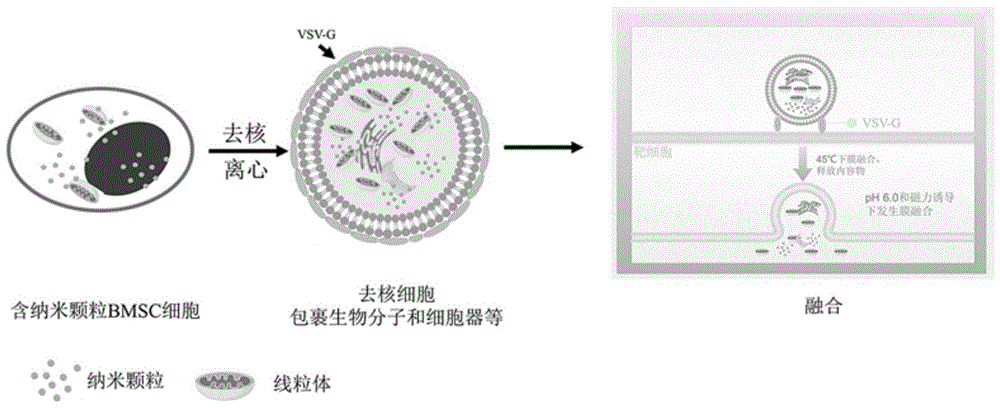
一种含Fe
(1)将BMSC细胞铺板于孔板中;优选24孔板,细胞密度约为50-70%左右(约1x10
(2)再加入0.5-2mg/mL的Fe
(3)倒置于离心管中,加入离心液;将离心管置于预热离心机中,于30-35℃,5000-10000rpm下,离心40-60min;
(4)再加入细胞培养液并放入细胞培养箱中恢复30-60min得到含Fe
进一步的,所述离心液包含10%蔗糖,1mg/mL细胞松弛素B,100μM氯化钙,500mMNAC抗氧化剂及10mg/mL秋水仙素。
上述制备方法制备的含Fe
一种含Fe
纳米级颗粒可以包裹蛋白质和一些小分子药物易于进入细胞,但是纳米颗粒尺寸越大,传递的效率会有所下降,而且纳米颗粒不能包裹更大的物质,例如直径为微米级的线粒体。本发明的含Fe
氧化铁纳米颗粒作为一种新型的纳米材料,其具有良好的靶向性、生物兼容性、生物降解性和生物安全性;其在生物分布、代谢速度及热稳定等理化性质方面展现出优异的稳定性。本发明通过在外加磁场的作用下,细胞之间膜张力发生变化,胞内钙离子瞬变及细胞骨架形成增加,从而有效促进膜融合效率。
选择BMSC骨髓间充质干细胞,且细胞含有Fe
含Fe
一种含Fe
一种含Fe
(1)将含Fe
(2)收集后的含Fe
(3)将孔板置于磁铁上在细胞培养箱中孵育2-4小时;
(4)将上清液吸弃,加入37-55℃的柠檬酸缓冲液1min;
(5)吸弃上清液,加入含10%血清的DMEM细胞培养液置入细胞培养箱中孵育。
本发明的含Fe
本发明优选Accutase
VSV-G浓缩液通过收集VSV-G条件培养液,然后通过超速离心浓缩而获得。VSV-G条件培养液收集自转染VSV-G表达质粒48小时后的Ad293细胞。
进一步的,VSV-G条件培养液制备包括如下:
(1)将0.8μg的表达水疱性口炎病毒蛋白质粒加入离心管中,加入50μL无血清培养液将混匀;
(2)将3μL Polyjet转染试剂和50μL的无血清培养液加入另一离心管中,轻轻摇匀;然后加入步骤(1)所得溶液中;得到转染混合液,室温静置15min;
(3)15min后吸去培养液,并补加1mL新鲜无血清培养液,把转染混合液马上加入到Ad293细胞,轻轻摇匀;
(4)12小时后更换新的培养液。
进一步的,VSV-G浓缩液的制备方法如下:
(1)用表达0.8 μg水疱性口炎病毒蛋白质粒对Ad293细胞进行瞬时转染;
(2)48小时后将收集上清并将细胞用胰酶消化之后收集;
(3)收集后的细胞经细胞培养液重悬之后,反复冻融5次后离心收集上清;
(4)将(2)和(3)的上清收集在一起之后,经300g、10min,2000g、10min及10000rpm,30min离心之后收集上清;
(5)将(4)置入6mL超速离心管中,47000rpm,4℃,2h超速离心,每管收集沉淀1mL,即为浓缩后的VSV-G蛋白条件培养液。
进一步的,所述线粒体缺陷细胞包括Rho0细胞和衰老细胞。
进一步的,所述含Fe
进一步的,所述柠檬酸浓度为 所述柠檬酸浓度为0.8-1mM,pH为4.5-6.0。将柠檬酸溶液加入细胞培养液中并占总体积的1/10,即为柠檬酸缓冲液。所述磁铁的磁力为1500Gs-5000Gs。
上述含Fe
含Fe
靶细胞可以为线粒体缺失细胞Rho0。Rho0细胞是C2C12细胞经双脱氧胞嘧啶(10 μM)和溴化乙啶(5 μM)连续处理7天后所获得。
靶细胞也可为衰老细胞。衰老细胞可以是C2C12细胞经诱导所得。诱导条件为:在含D-gal(40 g/L)的2% FBS血清培养液中一周,然后在含R6G(5 μg/mL)的培养液孵育1天后获得。
上述含Fe
本发明引入一个磁力使去核的骨髓间充质干细胞(BMSCs)与靶细胞紧密接触。在45ºC进行pH诱导的膜融合,较高的温度有利于打破细胞膜的液晶状态。融合导致去核BMSCs的完整线粒体被移植的靶细胞,如Rho0细胞和衰老细胞。类似地,线粒体也被成功地移植到腓肠肌细胞。
与现有技术相比,本发明通过磁力与较高融合温度,极大提高细胞融合效率,融合导致线粒体移植,所移植线粒体维持正常网状结构与膜电位,从而提高线粒体的生物学活性。本发明的含Fe
附图说明
图1为本发明含Fe
图2为不同浓度的Fe
图3中(A)为不同浓度的融膜蛋白下细胞融合图,1x代表浓度为:0.5mg/mL,其中一组293细胞装载纳米颗粒并标记为绿色,靶细胞293标记为红色;最右边一列图为细胞拼合图,其它三列从左到右依次为细胞DiI荧光、明场、Calcein和细胞核;(B)是细胞融合后直径统计图;(C)是细胞融合率统计图;
图4中(A)为不同浓度Fe
图5中(A)为不同磁力下对细胞融合的图片;其中一组293细胞装载2mg/mL的纳米颗粒并标记为绿色,靶细胞293标记为红色;在1x浓度的VSV-G浓度0.5mg/mL下进行膜融合;最右边一列图为细胞拼合图,其它三列从左到右依次为细胞DiI荧光、明场、Calcein和细胞核;(B)是细胞融合后直径统计图;(C)是细胞融合率统计图;
图6中(A)为不同温度的柠檬酸缓冲液以及孵育温度条件下细胞融合效率图;(B)为将融合的细胞进行Calcein以及PI染色标记活死细胞;(C)为统计不同条件下的细胞融合效率做成柱状统计图;
图7为添加溴化乙锭(EB)、双脱氧胞嘧啶(Zalcitabine, ddC)、尿苷(uridine)后,所构建的线粒体缺陷型细胞C2C12 Rho0(线粒体缺陷型),从左到右依次为线粒体染色试剂、明场和拼合图;
图8为去除溴化乙锭(EB)、扎西他滨(Zalcitabine, ddC)、尿苷(uridine)后,线粒体缺陷型细胞C2C12 Rho0(线粒体缺陷型)与去核后含纳米颗粒的BMSC细胞(线粒体带有红色荧光)融合,并在融合30min后进行线粒体形态荧光染色鉴定图,从左到右依次为CFSE、线粒体染色试剂、明场、细胞核和拼合图;
图9为去除溴化乙锭(EB)、扎西他滨(Zalcitabine, ddC)、尿苷(uridine)后,线粒体缺陷型细胞C2C12 Rho0与去核后含纳米颗粒的BMSC细胞融合,其中(A)为融合两到三天后分别进行细胞形态观察、(B)为细胞数量统计、(C)为PCR分析、(D)为定量PCR分析线粒体DNA。
图10为衰老细胞C2C12及衰老细胞与去核BMSC细胞融合30min后分析图;
图11为正常C2C12细胞,衰老细胞C2C12及衰老细胞与去核BMSC细胞融合3天后进行细胞衰老β-半乳糖甘酶染色图。
具体实施方式
为使本发明的目的、技术方案和优点更加清楚,下面将结合附图对本发明作进一步地详细描述。
实施例1
1、一种含Fe
(1)将BMSC细胞铺板于24孔中,细胞密度约为70%左右(细胞个数2x10
(2)向(1)中加入Fe
(3)倒置于50mL离心管中;离心管中含有10mL的离心液,其中包含10%蔗糖,1mg/mL细胞松弛素B,100μM氯化钙,500mM NAC抗氧化剂及10mg/mL秋水仙素;
(4)将离心管置于预热离心机中,30-35℃,5000-10000rpm下,离心40-60min;
(5)再加入细胞培养液并放入细胞培养箱中恢复30-60min,得到含Fe
2、含Fe
(1)将含Fe
(2)收集后的细胞使用VSV-G浓缩液重悬(浓度0.5mg/ml),并加入前一天铺好板的Rho0细胞或衰老细胞中(细胞密度约为20%左右,即大约个数为5x10
(3)将孔板置于磁铁上在细胞培养箱中孵育2-4小时;
(4)将上清液吸弃,加入45℃的柠檬酸缓冲液1min;
(5)吸弃上清液,加入含10%血清的DMEM细胞培养液置入细胞培养箱中孵育,此为融合细胞。
其中,VSV-G条件培养液制备,包括以下步骤:
(1)将0.8μg的表达水疱性口炎病毒蛋白质粒加入离心管中,加入50μL无血清培养液将混匀;
(2)将3μL Polyjet转染试剂和50μL的无血清培养液加入另一离心管中,轻轻摇匀;然后加入步骤(1)所得溶液中;得到转染混合液,室温静置15min;
(3)15min后吸去培养液,并补加1mL新鲜无血清培养液,把转染混合液马上加入到Ad293细胞,轻轻摇匀;
(4)12小时后更换新的培养液。
VSV-G浓缩液的制备方法,包括以下步骤:
(1)用表达0.8 μg水疱性口炎病毒蛋白质粒对Ad293细胞进行瞬时转染;
(2)48小时后将收集上清并将细胞用Accutase
(3)收集后的细胞经细胞培养液重悬之后,反复冻融5次后离心收集上清;
(4)将(2)和(3)的上清收集在一起之后,经300g,10min、2000g,10min及10000rpm,30min离心之后收集上清;
(5)将(4)置入6mL超速离心管中,47000rpm,4℃,2h超速离心,每管收集沉淀1mL,即为浓缩后的VSV-G蛋白条件培养液,浓度为:0.5-5mg/mL。
实施例2
对装载纳米颗粒的细胞的监测
对融合度50%左右的Ad293细胞(个数约为1x10
实施例3
一种含Fe
Ad293细胞铺板在24孔板中,细胞融合度约为50%(个数约为1x10
上述两种不同染料标记的细胞在外加磁力及VSV-G的作用下,最后通过调低pH值5.5诱导膜融合,融合后的细胞有两种不同颜色的荧光。通过统计细胞的直径尺寸以及细胞面积进行分析,在20μm以下的细胞为未发生融合的细胞,20μm以上的细胞直径为融合细胞。
从图3到图6可见,细胞在装载纳米颗粒后,与靶细胞在VSV-G条件培养液孵育下,融合效率上升,且VSV-G浓度越高,融合效率越高;当提高柠檬酸缓冲液的温度及孵育温度时,细胞融合效率得到一定的升高;根据实验结果可知在细胞装载2mg/ml的纳米颗粒之后,在1x的VSV-G(浓度为0.5mg/mL)的条件培养液下孵育30min,并使用45℃柠檬酸缓冲液酸化1min后再培养箱中孵育,其融合效果最优。
选取最优实验条件制备去核纳米细胞,制备得到的去核细胞大小为10µm-15µm,里面包含大量的线粒体,在外加磁力和VSV-G下,通过调低pH值至5.5诱导膜融合,释放去核细胞中的物质至靶细胞中。将目的生物大分子和细胞器传递到生物大分子和细胞器缺陷的细胞中。
实施例4
BMSC细胞传递线粒体至Rho0细胞验证
对C2C12细胞使用溴化乙锭(EB)、双脱氧胞嘧啶(Zalcitabine, ddC)、尿苷(uridine)处理后,得到Rho0细胞。将正常细胞及Rho0细胞用1μM MitoTracker(线粒体绿色染色试剂)进行染色,并在共聚焦显微镜下进行观察;另外,为了检测细胞膜电位,用500nMTMRE(线粒体膜电位染色试剂)进行染色,如图7所示在共聚焦显微镜下分析得知获得到的Rho0细胞线粒体形态明显受损。
将装载纳米颗粒的BMSC细胞去核与Rho0细胞融合;简言之细胞去核之后用VSV-G重悬加入标记CSFE的Rho0细胞置于磁铁上在培养箱中孵育2小时,然后后使用45℃柠檬酸缓冲液酸化1min,之后加入细胞培养液放在培养箱中孵育30min,30min之后对融合后的细胞及Rho0细胞进行线粒体荧光染色及细胞核染色。从图8可以看出Rho0细胞里面含有大量正常形态的线粒体,上述结果证明本发明的BMSC细胞能够有效的将线粒体递送至Rho0细胞中。
实施例 5
BMSC细胞传递线粒体至Rho0细胞功能验证。
对装载纳米颗粒的BMSC细胞去核后与Rho0细胞融合;通过上述实施例4采用融合方法得到的融合细胞,三天后在显微镜下进行观察检测。另外还通过细胞计数手段,real-time PCR技术和凝胶电泳等技术进行表征。从图9中可以看出Rho0细胞在融合3天后细胞形态明显变为正常,而未发生融合的细胞在有无尿嘧啶的添加下,细胞形态不饱满,出现拉丝及死亡的情况。图9中(B)可以看出在细胞融合第二天融合细胞的数量显著比另外两组高,而在第三天后融合组的细胞比其它多两倍左右,以上结果进一步的证明细胞融合后细胞恢复生长;图9中(C)结果中定量PCR检测显示,以细胞核β-2M为标准,移植后,Rho0细胞线粒体DNA拷贝数显著增加;进一步对PCR电泳条带分析得知融合后的细胞内线粒体含量明显上升。以上结果证明去核细胞BMSC能有效的将线粒体递送至Rho0细胞中并发挥生物功能,使其在无尿嘧啶添加的正常细胞培养液中恢复Rho0细胞生长增殖。
实施例6
BMSC细胞传递线粒体至衰老C2C12细胞的监测和验证。
对C2C12细胞使用2%FBS及D-gal处理七天后继续使用R6G处理细胞一天得到衰老C2C12细胞。R6G是一种膜渗透性的阳离子荧光染料,进入细胞后,其可自由穿过线粒体外膜并定位于线粒体内膜上。另外其是一种有效的氧化磷酸化抑制剂,通过抑制ATP合成酶,阻塞氢离子通道,从而抑制ATP合成。细胞经R6G处理之后可消除内源性线粒体及mtDNA。通过实施例3的融合方法将衰老细胞和去核含纳米颗粒的BMSC细胞进行融合;在图10中可以看出细胞经R6G处理之后,内源性线粒体基本消失;而衰老细胞与去核BMSC细胞融合之后,衰老细胞里面出现了正常形态结构的线粒体;上述表现再一次证明了去核BMSC细胞在磁力、VSVG及高温的条件下能有效的将线粒体递送到衰老细胞中。细胞融合三天后分别与正常细胞及衰老细胞进行细胞衰老β-半乳糖甘酶染色,从图11中可以看出,融合后细胞染色程度变浅,证明了去核细胞有效传递线粒体至衰老细胞后,线粒体能在衰老细胞中发生复制并发挥生物学功能。
- 一种果蔬水冷预冷车
- 一种果蔬产地预冷车
